96孔板法筛选抗黑曲霉性乳酸菌及抑菌机理研究
, ,,,,*,,
(1.渤海大学食品科学与工程学院,辽宁省食品安全重点实验室, 生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心,辽宁锦州 121013; 2.北京林业大学生物科学与技术学院,北京 100083; 3.大连东霖食品股份有限公司,辽宁大连 116101)
96孔板法筛选抗黑曲霉性乳酸菌及抑菌机理研究
马欢欢1,林洋1,吕欣然2,孙梦桐1,白凤翎1,*,励建荣1,宋强3
(1.渤海大学食品科学与工程学院,辽宁省食品安全重点实验室, 生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心,辽宁锦州 121013; 2.北京林业大学生物科学与技术学院,北京 100083; 3.大连东霖食品股份有限公司,辽宁大连 116101)
目的:筛选对黑曲霉具有良好拮抗作用的乳酸菌菌株。方法:采用96孔板法进行乳酸菌优良菌株的筛选。研究pH和温度等因素对抗菌特性的影响,利用气相测定菌株DL3无细胞上清液(CFS)中有机酸含量,研究抑菌活性物质;利用扫描电镜分析孢子细胞的完整性,研究抑菌机理。结果:从传统东北酸菜分离的乳酸菌中筛选对黑曲霉具有较强抑制作用的植物乳杆菌DL3,其抑菌率为92.28%。在pH2.5~6.5对黑曲霉具有抑菌活性,并具有良好的热稳定性,121 ℃处理30 min后抑菌率仅降低5.71%。经气相色谱分析表明菌株DL3 CFS中乳酸、乙酸、丙酸和苯乳酸含量分别为5.743、1.635、0.033、0.085 μg/mL,乳酸和乙酸对黑曲霉的抑菌率分别为91.69%和92.04%,丙酸和苯乳酸均无抑菌作用,初步判断菌株DL3的抑菌活性物质为有机酸类。扫描电镜观察表明菌株DL3 CFS破坏了黑曲霉孢子的完整性,导致细胞膜溶解,胞内物质外泄。结论:菌株DL3 CFS中对黑曲霉的抑菌活性主要来自于乙酸和乳酸,可作为米面制品的乳酸菌生物防霉剂的出发菌株。
乳酸菌,抑制,黑曲霉,96孔板法,筛选,有机酸
黑曲霉(Aspergillusniger)广泛分布于土壤、空气等自然环境中,可引起米粉、面包、蛋糕等米面制品的霉腐变质[1-2]。乳酸菌作为益生菌可通过生态位和营养物竞争、产生抗真菌肽和酸性物质等方式有效控制真菌的生长繁殖[3-4]。目前,应用乳酸菌控制食品中由霉菌引起的霉腐变质的研究已有相关报道。Varsha等[5]研究发现,LactobacilluscaseiDY2和PediococcuspentosaceusTG2等对FusariumoxysporumKACC 42109、A.nigerKACC42589和FusariummoniliformeKACC08141等霉菌的抑菌直径均大于10 mm,经ESI-MS和HPLC分析表明,抑菌成分主要为硬脂酸和水杨酸。Valerio等[6]从发酵面包中分离出Lactobacillusfermentum18B和Lactobacillusbrevis18F对A.nigerITM5132抑菌率分别高达82.7%和100%,经LC-MS/MS分析发现其抑菌物质为苯乳酸。

表1 乳酸菌菌株来源Table 1 The sources of lactic acid bacteria strains
针对抗真菌性乳酸菌筛选方法主要有短琼脂划线法、牛津杯琼脂扩散法、纸片法和96孔板法等[7-8]。而96孔板法对抗真菌性天然产物的筛选具有方便、快速、费用低等特点[9],饶瑜等[10]应用96孔板法对抗食品腐败酵母的乳酸菌进行筛选,从57株乳酸菌中筛选出一株来自发酵泡菜的WeissellacibariaAT6,其发酵上清液对腐败酵母的抑菌率可高达73.04%。Gerez等[11]通过96孔板法从不同源的91株乳酸菌中获得一株产抗菌肽的乳酸菌Lb.fermentumCRL251,其无细胞上清液对A.nigerCH 101和FusariumgraminearumCH 103的抑菌率均大于80%,其抗菌肽分子量小于10 kDa。目前,应用96孔板法对抗黑曲霉乳酸菌的筛选及抑制作用研究的相关报道较少。
本文应用从传统发酵食品和海产动物肠道中分离的8株乳杆菌属的乳酸菌为出发菌株,以黑曲霉为目标菌,采用96孔板法筛选抗黑曲霉效果最好的乳酸菌菌株,并对其抑菌活性物质和对霉菌孢子的影响进行分析,为研发乳酸菌生物防腐剂控制米面制品中黑曲霉污染导致的腐败提供理论和应用依据。
1 材料和方法
1.1材料与仪器
黑曲霉(AspergillusnigerCMCC 98003) 上海北诺生物科技有限公司;乳酸菌菌株 本实验室前期分离获得的已知菌株,见表1;马铃薯葡萄糖琼脂培养基(PDA)、MRS液体培养基 北京奥博星生物技术有限责任公司;戊二醛 上海生工生物工程有限公司;乳酸、乙酸、丙酸、苯乳酸标品 Sigma公司。
SPX-250智能生化培养箱 宁波海曙赛福实验仪器厂;GI54DS高压灭菌锅 致微仪器有限公司;MJ-250霉菌培养箱 上海苏达实验仪器有限公司;DL-CJ-2N超级洁净工作台 北京市东联哈尔仪器制造有限公司;KA Vortex GENIUS3振荡器 德国IKA公司;ZD-85气浴恒温振荡器 金坛市科析仪器有限公司;I5804R冷冻高速离心机 德国Eppendorf公司;安捷伦6890N气相色谱仪 安捷伦公司;GC2010气相色谱仪 日本岛津公司;E-1045镀金仪、S-4800扫描电镜 日本日立公司。
1.2实验方法
1.2.1 乳酸菌无细胞上清液(cell-free supernatant,CFS)的制备 参照Varsha等[5]方法稍加修改,将8株保藏于-20 ℃的乳酸菌以0.5%的接种量于10 mL MRS液体培养基中37 ℃培养12 h,连续培养2代至正常代谢水平。然后按2%的接种量接种于100 mL MRS培养基,置于37 ℃条件下培养24 h,其发酵液经10000×g、4 ℃离心5 min,取离心后的上清液经0.45 μm过滤膜获得乳酸菌CFS,4 ℃保存备用。
1.2.3 抗黑曲霉乳酸菌的筛选 参照Gerez方法[11]并稍作修改,96孔板法测定乳酸菌CFS对黑曲霉的抑制作用。取10 μL 104孢子/mL黑曲霉孢子悬液添加到含190 μL乳酸菌CFS的无菌96孔细菌培养板中,28 ℃培养48 h后应用酶标仪测定OD580 nm值,以接种孢子悬液于MRS培养基为对照组。乳酸菌CFS发酵液的抑菌率按公式(1)计算。
抑菌率(%)=100-(ODLAB×100/ODcontrol)
式(1)
式中:ODLAB表示黑曲霉在乳酸菌CFS中培养48 h的OD580 nm;ODcontrol表示黑曲霉在MRS培养基中培养48 h后的OD580 nm。
1.2.4 影响乳酸菌CFS抑制黑曲霉的因素分析 pH对菌株DL3抗黑曲霉的影响:以乳酸菌CFS为对照组,取乳酸菌CFS用1.0 mol/L HCl和1.0 mol/L NaOH分别调至pH2.5、3.5、4.5、5.5、6.0、6.5、7.0和7.5,按1.2.3方法进行抑菌活性测定。
温度对菌株DL3抗黑曲霉的影响:以乳酸菌CFS为对照组,取乳酸菌CFS分别经50、80、100和121 ℃处理30 min,同时按1.2.3方法进行抑菌活性测定。

表2 乳酸菌CFS对黑曲霉的抑菌率Table 2 Inhibitory rates of CFS of lactic acid bacteria against A. niger
注:不同字母表示差异显著(p<0.05)。1.2.5 有机酸的测定 乳酸、乙酸和丙酸:参照Yuan等[15]方法稍作修改,采用安捷伦6890N气相色谱仪,色谱柱:CNW CD-ACIDWAX毛细管柱(30 m×0.25 mm×25 μm);FID检测器温度为300 ℃;进样口温度为280 ℃;升温程序:初温110 ℃,以10 ℃/min升至150 ℃,保持5 min,再以10 ℃/min升至230 ℃,保持15 min;空气流速300 mL/min;N2流速30 mL/min;H2流速30 mL/min;进样量为1 μL;分流比为15∶1。在线性范围内,用外标法峰面积进行定量。
苯乳酸:参照Zhang等[16]方法稍作修改,移取待测样品及标样至带塞玻璃管中,加入适量吡啶振荡溶解,再加入50 μL BSTFA硅烷化试剂,置于100 ℃保持30 min,待测GC;采用岛津GC2010气相色谱仪。色谱柱:Rtx-5石英毛细柱(30 m×0.25 mm×25 μm);FID检测器温度为300 ℃;进样口温度为280 ℃;升温程序:初温180 ℃,保持20 min,以20 ℃/min升至280 ℃,保持10 min;空气流速300 mL/min;N2流速30 mL/min;H2流速30 mL/min;进样量1 μL;分流比为20∶1。在线性范围内,用外标法峰面积进行定量。
1.2.6 有机酸抑菌活性分析 根据上述有机酸测定结果,应用MRS液体培养基配制与乳酸菌CFS中相同浓度的乳酸、乙酸、丙酸、苯乳酸和四种混合酸分别按1.2.3方法进行抑菌活性测定,同时,以乳酸菌CFS作为对照。
1.2.7 扫描电镜观察乳酸菌CFS对霉菌孢子的作用 参照Akocak方法[17]并稍作修改,分别取1.0 mL 1.0×105孢子/mL黑曲霉的孢子悬液于1.5 mL灭菌的EP管中,4 ℃条件下12000×g离心10 min,去上清液。以添加1.0 mL MRS液体培养基为对照组,添加1.0 mL的菌株DL3 CFS为实验组,4 ℃静置培养7 d。4 ℃条件下12000×g离心10 min,用0.1 mol/L PBS(pH7.2)洗涤孢子3次,后加入1.0 mL 2.5%戊二醛4 ℃固定13 h。再用pH5.6 PBS冲洗2次以除去孢子中戊二醛,每次5 min,4 ℃条件下12000×g离心10 min,去上清液并用0.5 mL无菌水将洗涤后孢子悬浮,胶头滴管吸取1滴于洁净盖玻片上,置于空气中干燥,真空喷金并镜检。
1.2.8 数据处理 所有实验均重复测定3次,数据采用平均值±标准差表示。采用SPSS 18.0软件对实验数据进行统计和显著性分析,采用Origin 8.0软件进行绘图。
2 结果与讨论
2.1抗黑曲霉乳酸菌的筛选
图1是应用96孔板法测定8株不同源乳酸菌对黑曲霉抑菌效果,从中可看出,未添加乳酸菌CFS的对照组3个孔井均被黑曲霉覆盖,添加菌株JY-22、DL3和LY-19的CFS孔井均无浑浊现象,其余菌株的孔井均出现不同程度的浑浊现象。表2是8株乳酸菌CFS对黑曲霉的抑菌结果,可看出Lb.plantarumDL3抑菌效果最好,抑菌率为92.28%;Lb.sakeLY-19和Lb.plantarumJY-22次之,抑菌率分别为86.85%和88.14%;其余乳酸菌菌株相对较弱,抑菌率均低于85%。因此,选取Lb.plantarumDL3进行下一步的实验。
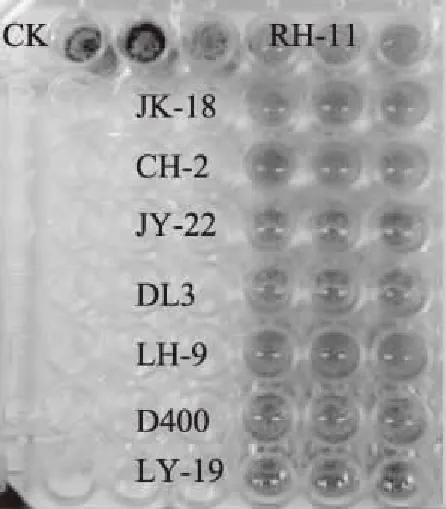
图1 乳酸菌CFS对黑曲霉的抑菌效果Fig.1 Antibacterial effects of CFS of lactic acid bacteria against A. niger
2.2影响乳酸菌CFS抑制黑曲霉因素分析
2.2.1 pH对菌株DL3抗黑曲霉的影响 乳酸菌生长代谢过程中形成的酸性环境或产生的酸性物质对真菌均具有抑制作用[18]。因此,pH因素对菌株DL3 CFS抗黑曲霉具有重要的影响。图2是不同pH条件下菌株DL3 CFS对黑曲霉抑制结果,从中可看出,pH2.5~4.5范围内,抑菌率均为90%左右,抑菌活性稳定;随着pH的升高抑菌率逐渐降低,pH5.5~6.5范围内抑菌率下降显著,当pH6.5时,对黑曲霉仍具有抑制作用,抑菌率为23.17%(pH7.0~7.5抑菌率为0,未给出)。结果表明,菌株DL3的抑菌活性物质在pH2.5~6.5范围内对黑曲霉具有抑制作用,抑菌作用可能来源于酸性物质。Muhialdin等[19]研究发现,Lb.fermentumTe007和Lb.pentosusG004代谢产生的抗A.niger的抑菌活性物质在pH3.0~7.0范围内具有抗菌活性;当pH7.0时,2株乳酸菌对A.niger的抑菌率分别为29.90%和33.50%,经HPLC分析表明抑菌活性物质为有机酸类。本文与文献[19]的研究结果相似。
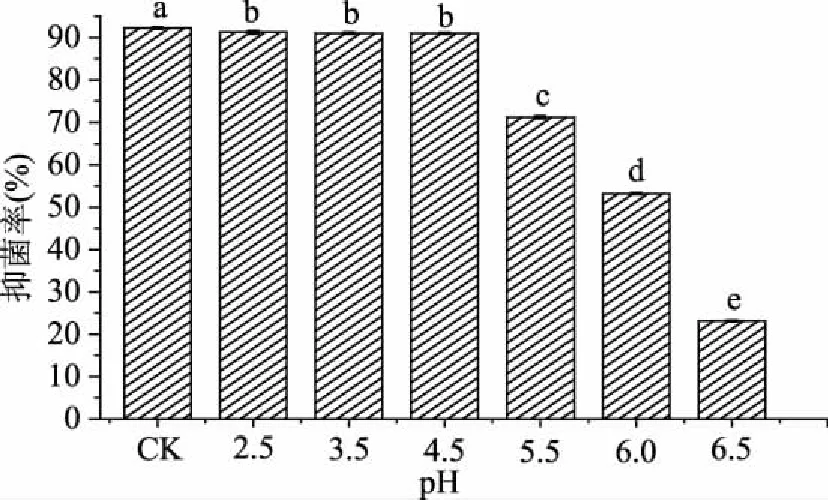
图2 不同pH对植物乳杆菌DL3 CFS抑制黑曲霉活性的影响Fig.2 Effects of pH on the antifungal activity of Lb. plantarum DL3 CFS against A. niger注:不同字母表示差异显著(p<0.05),图3同。
2.2.2 温度对菌株DL3抗黑曲霉的影响 温度也是影响菌株DL3 CFS对黑曲霉抑菌活性的因素。图3是菌株DL3 CFS经不同温度处理30 min后对黑曲霉抑菌作用的变化,从中可看出,随温度的升高抑菌率呈下降趋势,与对照组相比50、80和100 ℃处理后的菌株DL3抑菌率均无明显变化,121 ℃处理后抑菌率仅下降了5.71%,其原因可能是乳酸菌CFS中一些热敏感性的抑菌物质失活。如此说明菌株DL3 CFS中抑菌活性物质具有良好的热稳定性。Muhialdin等[19]研究发现Lb.fermentumTe007和Lb.pentosusG004 CFS经90 ℃和121 ℃处理30 min对A.nigei和A.oryzae仍具有较强的抑制作用,与本文结果相似。
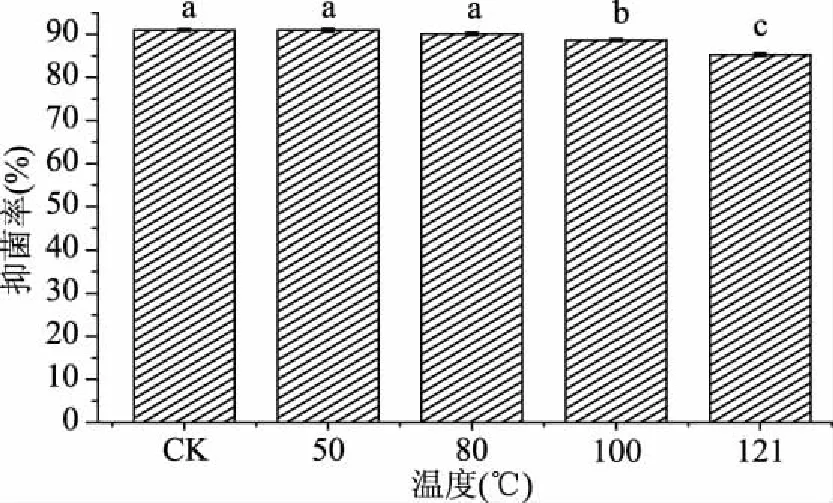
图3 热处理植物乳杆菌DL3 CFS对抑菌活性的影响Fig.3 Effects of heat treatment on the antifungal activity of Lb. plantarum DL3 CFS against A. niger
2.3有机酸对抑菌活性的影响
乳酸菌代谢产物中抗真菌物质主要包括有机酸、过氧化氢、羟基脂肪酸和抗菌肽等活性成分[20]。表3是菌株DL3 CFS中乙酸、乳酸、丙酸和苯乳酸含量及其对黑曲霉的抑菌结果。从中可看出,乳酸和乙酸含量相对较高分别为5.743 μg/mL和1.635 μg/mL,苯乳酸次之为0.085 μg/mL,丙酸含量较低为0.033 μg/mL。乳酸和乙酸对黑曲霉均具有较强抑制作用,抑菌率分别为91.69%和92.04%,其余两种酸可能是由于含量较低对黑曲霉不呈现抑制效果。按照DL3 CFS中有机酸含量进行复配后的酸对黑曲霉抑菌率略高于对照组,为92.31%(p>0.05)。可以得出乙酸和乳酸为菌株DL3 CFS中抗黑曲霉的主要抑菌活性物质。

表3 植物乳杆菌DL3 CFS有机酸及抑菌率分析结果Table 3 The results of Lb. plantarum DL3 CFS organic acid contents and the inhibitory rate
注:“-”表示无抑菌效果,不同字母表示差异显著(p<0.05)。
2.4扫描电镜分析乳酸菌CFS对黑曲霉孢子的影响

图4 植物乳杆菌DL3 CFS对黑曲霉孢子的影响Fig.4 Effects of Lb. plantarum DL3 CFS on the spores of A. niger注:A:对照组,B:DL3;A、B放大倍数均为5000×。
图4是黑曲霉孢子经MRS培养基(对照)和菌株DL3CFS处理7 d后的扫描电镜观察的结果,从中可看出,经MRS处理后黑曲霉孢子(见图4A)结构完整,表面光滑;经菌株DL3 CFS处理的黑曲霉孢子(见图4B)出现溶解现象,孢子内容物外泄,表面出现较深的褶皱式裂痕,孢子完整性被破坏。可能是有机酸中H+与黑曲霉孢子细胞膜上的一些分子间存在相互作用导致磷脂双分子层被损坏孢子细胞出现崩塌现象,同时,孢子细胞内部混合物出现泄露[21-23]。结果表明,菌株DL3 CFS对黑曲霉孢子具有破坏作用。Da等[21]研究发现,青霉的孢子经2.5 mmol/L水杨酸处理5 min后,部分青霉孢子的细胞膜被损坏,孢内蛋白质泄露;未经处理的孢子细胞膜完整无损无泄露。本文与文献[21]的研究结果相似。
3 结论
传统发酵食品和海产动物肠道是拮抗性乳酸菌的主要来源,本文从8株不同源的乳酸菌中筛选到对黑曲霉具有较强抑菌作用的Lb.plantarumDL3,其抑菌率高达92.28%。通过pH和温度处理,表明菌株DL3 CFS中抑菌活性物质在pH2.5~6.5具有抗黑曲霉活性,其抑菌物质对热稳定。经气相色谱仪分析菌株DL3 CFS中的抑菌活性物质主要为乳酸和乙酸,其含量分别为5.743 μg/mL和1.635 μg/mL。扫描电镜结果表明菌株DL3 CFS对黑曲霉抑菌作用机制主要通过破坏黑曲霉孢子的完整性,从而抑制其生长和繁殖。因此,菌株DL3可作为控制黑曲霉的生物防霉剂的出发菌株,应用于米面加工制品的防霉保鲜。
[1]Muhialdin B J,Hassan Z,Bakar F A,et al. Novel antifungal peptides produced byLeuconostocmesenteroidesDU15 effectively inhibit growth ofAspergillusniger[J]. Journal of Food Science,2015,80(5):M1026-M1030.
[2]张宽朝,魏练平,沈浩,等. 肉桂醛、柠檬醛抑制黑曲霉生长的比较研究[J]. 中国微生态学杂志,2011,23(2):141-143.
[3]Cortés Z O,López M A,Hernández M A,et al. Antifungal activity ofLactobacilliand its relationship with 3-phenyllactic acid production[J]. International Journal of Food Microbiology,2014,173(3):30-35.
[4]Li D,Ni K,Pang H,et al. Identification and antimicrobial activity detection of lactic acid bacteria isolated from corn Stover silage[J]. Asian Australasian Journal of Animal Sciences,2015,28(5):620-631.
[5]Varsha K K,Peiya S,Devendra L,et al. Control of spoilage fungi by protective lactic acid bacteria displaying probiotic properties[J]. Applied Biochemistry & Biotechnology,2014,172(7):3402-3413.
[6]Valerio F,Biase M D,Lattanzio V M T,et al. Improvement of the antifungal activity of lactic acid bacteria by addition to the growth medium of phenylpyruvic acid,a precursor of phenyllactic acid[J]. International Journal of Food Microbiology,2016,222:1-7.
[7]Adedokun E O,Rather I A,Baipai V K,et al. Biocontrol efficacy ofLactobacillusfermentumYML014 against food spoilage moulds using the tomato puree model[J]. Frontiers in Life Science,2015,9(1):64-68.
[8]Bian X,Evivie S E,Muhammad Z,et al.Invitroassessment of the antimicrobial potentials ofLactobacillushelveticusstrains isolated from traditional cheese in Sinkiang China against food-borne pathogens[J]. Food and Function,2015,7(2):789-797.
[9]宋志刚,许强芝,鲁心安,等. 利用真菌分生孢子筛选抗真菌活性的海洋微生物[J]. 第二军医大学学报,2005,26(11):1300-1301.
[10]饶瑜,常伟,向文良,等. 抗食品腐败酵母的乳酸菌的筛选与鉴定[J]. 现代食品科技,2013(8):1943-1947.
[11]Gerez C L,Torres M J,Valdez G F D,et al. Control of spoilage fungi by lactic acid bacteria[J]. Biological Control,2013,64(3):231-237.
[12]马欢欢,吕欣然,缪璐欢,等. 鼠李糖乳杆菌对互隔交链孢的抑制作用研究[J]. 食品工业科技,2016,37(17):180-184.
[13]吕欣然,李莹,马欢欢,等. 辽西传统发酵食品中抗单增李斯特菌乳酸菌的筛选与鉴定[J]. 食品工业科技,2016,37(3):143-148.
[15]Yuan,Kong,Guan,et al. A GC-based metabonomics investigation of type 2 diabetes by organic acids metabolic profile[J]. Journal of Chromatography B,2007,850(1-2):236-240.
[16]Zhang K,Zuo Y. GC-MS determination of flavonoids and phenolic and benzoic acids in human plasma after consumption of cranberry juice[J]. Journal of Agricultural and Food Chemistry,2004,52(2):222-227.
[17]Akocak P B,Churey J J,Woeobo R W. Antagonistic effect of chitinolyticPseudomonasandBacilluson growth of fungal hyphae and spores of aflatoxigenicAspergillusflavus[J]. Food Bioscience,2015,10:48-58.
[18]李院,蔻莉萍,王静,等. 抑制青霉菌乳酸菌的分离,鉴定及抑菌物质初步分析[J]. 食品科学,2015,36(21):150-155.
[19]Muhialdin B J,Hassan Z,Sadon S K,et al. Effect of pH and heat treatment on antifungal activity ofLactobacillusfermentumTe007,LactobacilluspentosusG004 andPediococcuspentosaceusTe010[J]. Innovative Romanian Food Biotechnology,2011(8):41-53.
[20]成妮妮. 乳酸菌抗真菌生物防腐剂作用机理和前景展望[J]. 食品工业科技,2012,33(4):430-433.
[21]Da R N A,Maraschin M,Di P R. Antifungal activity of salicylic acid againstPenicilliumexpansumand its possible mechanisms of action[J]. International Journal of Food Microbiology,2015,215:64-70.
[22]马欢欢,吕欣然,缪璐欢,等. 鼠李糖乳杆菌对互隔交链孢的抑制作用研究[J]. 食品工业科技,2016,37(17):180-184.
[23]Chen A,Zing G,Chen G,et al. Plasma membrane behavior,oxidative damage,and defense mechanism inPhanerochaetechrysosporiumunder cadmium stress[J]. Process Biochemistry,2014,49(4):589-598.
ScreeningandinhibitionmechanismoflacticacidbacteriaagainstAspergillusnigerusing96-wellmicrotiterplates
MAHuan-huan1,LINYang1,LVXin-ran2,SUNMeng-tong1,BAIFeng-ling1,*,LIJian-rong1,SONGQiang3
(1.College of Food Science and Technology,Bohai University,Food Safety Key Laboratory of Liaoning Province, National & Local Joint Engineering Research Center of Storage,Processing and Safety Control Technology for Fresh Agricultural and Aquatic Products,Jinzhou 121013,China; 2.College of Biology Science and Technology,Beijing Forest University,Beijing 100083,China; 3.Dalian Donglin Food Co.,Ltd.,Dalian 116101,China)
Objective:To isolate lactic acid bacteria(LAB)with outstanding inhibitory activity againstAspergillusniger. Methods:LAB with inhibitory activity againstA.nigerwas screened using 96-well microtiter plates.Research on effect factors of antibacterial was analyzed by pH test,heat-treated test. Research on the antimicrobial substances of the contents of organic acids were analyzed by the gas chromatography. Research on the antibacterial mechanism of the integrity of cellular of spores was observed by scanning electron microscope. Results:LactobacillusplantarumDL3 isolated from traditional northeast Suancai had strong anti-fungal activity againstA.niger,and its inhibitory rate reached 92.28%. Antimicrobial substances were effective within pH2.5~6.5 and heat stable,which was declined by 5.71% after incubation at 121 ℃ for 30 min. The contents of lactic acid,acetic acid,propionic acid and phenyl lactic acid in CFS of strain DL3 were 5.743,1.635,0.033 and 0.085 μg/mL using gas chromatography analysis,respectively. In addition,the inhibition rate of lactic acid and acetic acid toA.nigerwere 91.69% and 92.04%,respectively. Therefore,antimicrobial substances produced by strain DL3 were preliminary determined as organic acids. The propionic acid and phenyl lactic had no inhibition againstA.niger. The scanning electron microscope images revealed that the membrane of the spores ofA.nigertreated with CFS of strain DL3 was damaged and dissolved,resulting in the leakage of intracellular material from spores. Conclusion:Lactic acid and acetic acid were the main inhibitory substances produced by strain DL3,which could be used as starting strain of biological fungicide in rice and flour products.
lactic acid bacteria;inhibition;Aspergillusniger;96-well microtiter plates;screening;organic acid
2016-11-30
马欢欢(1991-),女,硕士研究生,研究方向:食品安全与质量控制,E-mail:mahuanhuan14@163.com。
*通讯作者:白凤翎(1964-)男,博士,教授,研究方向:食品安全与质量控制和食品微生物学,E-mail:baifling@163.com。
辽宁省科技厅攻关项目(2015103020);泰山学者蓝色产业领军人才团队支撑计划项目(鲁政办字(2015)19号)。
TS201.1
:A
:1002-0306(2017)12-0171-05
10.13386/j.issn1002-0306.2017.12.031

