柑橘属果实中过敏原几丁质酶的表达和B细胞抗原表位的预测
,,
(贵州师范大学生命科学学院,贵州贵阳 550001)
柑橘属果实中过敏原几丁质酶的表达和B细胞抗原表位的预测
闫慧清,罗庆华,黄小龙*
(贵州师范大学生命科学学院,贵州贵阳 550001)
I类植物的几丁质酶(chitinase)是许多植物性食品中一种非常重要的过敏原,与乳胶-水果综合症有着密切的关系。大部分致敏性植物中的几丁质酶对人体的健康有着潜在的危害。本文以柑橘属中的过敏原几丁质酶为研究对象,通过比较柑橘属中不同来源的果实,如琯溪蜜柚、甜橙和温州蜜柑中的几丁质酶基因表达含量,得到温州蜜柑果实的表达量最高。通过Genebank搜索得到几丁质酶的氨基酸序列,采用同源比对说明在不同的物种中可能会导致交叉过敏的现象。最后利用DNAStar软件预测得到几丁质酶的二级结构,当氨基酸的二级结构是β-转角和无规则卷曲,同时抗原指数>0、柔韧性>0、表面可及性>1和亲水性>0的氨基酸区域时,形成B细胞抗原表位的可能性较大。综合这些参数结果表明几丁质酶的B细胞抗原表位结合氨基酸序列的可能区域是在62~69、96~100、126~133、145~149、155~159、169~172、179~182、189~190、256~262,通过预测氨基酸的区域,为制备相应的抗体、培育低过敏品种等后续研究提供一定的理论依据。
柑橘过敏,几丁质酶,细胞表位
几丁质酶是植物体内防御真菌和虫害病原菌的重要蛋白质[1],其中I类植物几丁质酶是大部分植物,如猕猴桃(Actinidiamelliana)[2]、鳄梨(PerseaamericanaMill)[3]、柿子(DiospyrosKaki L.)[4]等果实中重要的一种过敏原,能够与乳胶过敏原发生交叉反应,有研究表明几丁质酶(chitinase)与儿童的哮喘病等过敏性疾病有着密切的关系。几丁质酶的含量能够作为真菌感染血清学的指标,在观察布朗克斯儿童(Bronx children)哮喘人群中起着重要作用[5]。它提供了真菌感染、重症哮喘和过敏之间的关联。利用酵母重组表达系统产生几丁质酶蛋白,能够与IgE发生特异性结合[1]。B细胞抗原表位是抗原分子与体内产生抗体能够结合的氨基酸序列。大部分导致食物过敏现象产生的原因就是过敏原表位。决定几丁质酶抗原表位形成的因素有很多。通过根据其氨基酸序列及亲水性、抗原性等不同参数综合预测的方法[6],能够了解几丁质酶的表位特征。
除了能够诱发过敏发生之外,温州蜜柑中的几丁质酶可以增加小鼠巨噬细胞RAW264.7细胞系的炎症因子前列腺素PGE2的含量,导致炎症的发生[7]。本文首先以柑橘属果实为材料,比较得到不同品种中几丁质酶基因的表达。通过不同物种之间氨基酸序列的比对,得到不同果实间存在交叉过敏。最后对几丁质酶进行B细胞抗原表位的预测,得到过敏原几丁质酶的相关特性,为柑橘几丁质酶过敏的进一步研究提供相应的理论依据。
1 材料与方法
1.1材料与仪器
温州蜜柑、甜橙和琯溪蜜柚的果实 购自本地市场;Trizol试剂盒、cDNA反转录试剂盒 均购自大连宝生物有限公司;引物合成 由上海生工生物股份有限公司完成。
lightCycler 480Ⅱ荧光定量仪器分析 购自罗氏。
1.2实验方法
1.2.1 RNA的提取和定量PCR 取成熟温州蜜柑、甜橙和琯溪蜜柚的果实,利用Trizol试剂盒提取总RNA,并进行qRT-PCR。反转录利用first-strand cDNA synthesis kit试剂盒合成,几丁质酶基因引物及反应体系具体如表1所示。
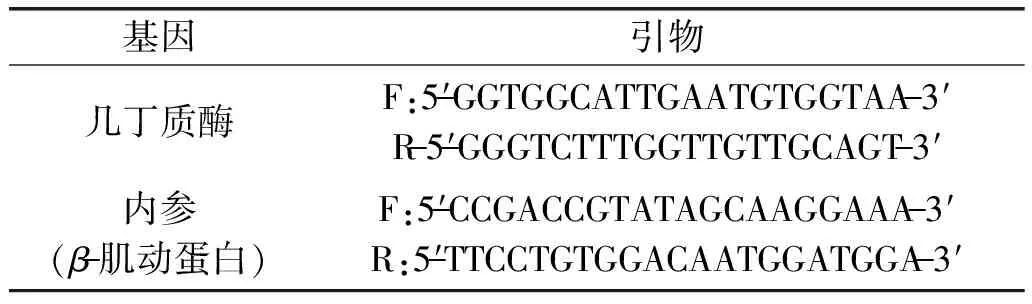
表1 定量RT-PCR所用几丁质酶基因引物序列Table 1 Sequences of chitinaseprimers used for RT-PCR tests
基因的表达分析采用了real-time RT-PCR的方法。PCR反应程序如下:50 ℃ 2 min,95 ℃ 10 min;95 ℃ 15 s,60 ℃ 1 min(45个循环)。每个样品的cDNA扩增反应进行3个独立重复。通过计算2-ΔΔCt值比较各个产物得出基因的表达量。
1.2.2 柑橘中炎症蛋白氨基酸序列 通过NCBI(http://www.ncbi.nlm.nih.gov/)中搜索柑橘几丁质酶的蛋白质序列登录号,得到几丁质酶多肽链中氨基酸的排列顺序为一级结构,并利用ClustalX 8软件对不同种间的一级结构进行同源比对。
1.2.3 几丁质酶的二级结构预测 将推导出的几丁质酶氨基酸序列,利用DNAStar生物软件中Gamier-Robson方法对蛋白质螺旋、折叠、转角和无规则卷曲的氨基酸区域进行预测。
1.2.4 几丁质酶蛋白抗原指数、柔韧性、亲水性及蛋白表面可及性预测 利用DNAStar生物软件中Jameson-Wolf方法分析蛋白的蛋白抗原指数[8]、Karplus-Schulz分析柔韧性[9]、Kyte-Doolittle法分析蛋白亲水性[10]和Emini[11]法获得蛋白表面可及性的氨基酸序列。
1.2.5 B细胞抗原表位预测 蛋白质二级结构中的螺旋、折叠区段因有大量的氢键维持结构,起结构稳定的作用不与抗原发生作用,而转角、无规则卷曲区域多位于分子表面,空间结构利于与抗体结合。同时当亲水性>0,抗原指数>0,柔韧性>0,表面可及性>1时,形成抗原表位的可能性大。因此通过DNAStar软件,综合其上各参数可推导出该蛋白的抗原区,得出几丁质酶蛋白的B细胞抗原表位[11-12]。
1.2.6 数据处理 采用SPSS 19.0中Duncan进行多重比较(p<0.05为显著性),分析柑橘不同品种之间几丁质酶的差异性表达。B细胞抗原表位预测利用DNAstar软件(http://www.dnastar.com/)分析。
2 结果与讨论
2.1定量PCR检测不同物种中几丁质酶的表达
通过测定琯溪蜜柚、甜橙和温州蜜柑果实中几丁质酶基因的相对表达量,表明在不同的种类中几丁质酶的含量存在着显著性的差异。由图1得到,琯溪蜜柚(pummelo)和甜橙(orange)果实中几丁质酶的含量基本相同,而温州蜜柑(satsuma)果实中的含量最高,并显著性的高于甜橙和琯溪蜜柚,表达量分别是琯溪蜜柚的25.65倍,甜橙的13.05倍。
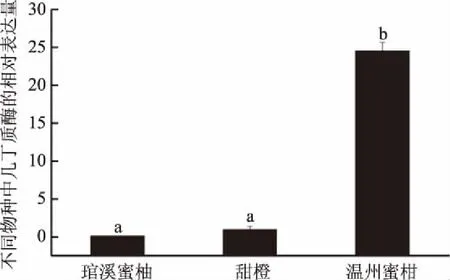
图1 几丁质酶在琯溪蜜柚、甜橙和温州蜜柑果实中的表达Fig.1 The relative expression level of chitinase in pummelo,orange and satsuma注:不同小写字母表示差异显著(p<0.05)。

图2 柑橘中几丁质酶与其他物种的同源比较Fig.2 Amino acid sequence alignments of chitinase in citrus with other plants注:黑色和灰色分别表明序列的相同和相似性,相对保守的区域ChtBD1和Glyco_hydro_19显示在序列上方。
从几丁质酶在温州蜜柑果实中的高表达,可以得到温州蜜柑是一种过敏食物,温州蜜柑是柑橘中最常见的食用品种。柑橘在国际上也被列为过敏(Allergy)食品之一,有研究表明在欧洲,如意大利、西班牙等国家,食用柑橘后诱发的过敏人群达到17%,部分幼童在食用柑橘后也会产生过敏现象[13]。过敏可以是体液(抗体)或者是细胞免疫机制介导的,并导致炎症的发生[14]。在大多数情况下,在过敏反应中的大部分过敏原都属于IgE类,与血清蛋白的调控密切相关,如几丁质酶。这些个体可以归类于患有IgE-介导的过敏反应[15-17]。利用过敏病人血清中特异性IgE检测柑橘,发现柑橘中还存在其它过敏原,如萌发素类蛋白和抑制蛋白(profilin)等[18-19],可见通过过敏血清中的IgE抗体筛选得到柑橘中更多的过敏原。有研究表明,在对195个过量食用温州蜜柑果实的志愿者调查中,有41%的人群出现明显的体温升高、嘴唇干裂、咳嗽和口腔综合症等“上火”的症状,而这些人群的血清中IgE的含量从66.82 kU/L增加到69.87 kU/L,嗜酸性粒细胞、红细胞的数量、嗜碱性粒细胞、血小板的含量和血红蛋白的浓度同时都发生了改变[20]。这些因素都可以通过产生细胞因子进而在炎症中起着重要的作用。例如嗜酸性粒细胞通过表达受体识别信号将病原体或宿主源性危险信号放大,引发免疫反应并诱导释放的促炎细胞因子和趋化因子,发生炎症反应[21]。
2.2几丁质酶对应的氨基酸序列
通过NCBI(http://www.ncbi.nlm.nih.gov/)中搜索,得到柑橘几丁质酶的蛋白质序列登录号为CAA93847.1。几丁质酶共编码的283个氨基酸,所对应的氨基酸序列为

2.3几丁质酶的同源比较
用BLAST对柑橘中几丁质酶的蛋白质序列与其他物种,如大麦(Hordeumvulgare)、小麦(Triticumaestivum)、玉米(Zeamays)、苜蓿(Medicago)和茄属植物(SolanumL.)进行同源性比对搜索后的结果如图2,氨基酸序列的相似度分别是78%、76%、82%、84%和73%,表明其在氨基酸序列上有较高的相似性,说明这些物种之间可能会导致交叉过敏的现象。通过SMART(http://smart.embl-heidelberg.de)对几丁质酶的结构域预测,得到包含两个结构域,分别是几丁质酶结构域(ChtBD1)和甲壳素结合结构域(Glyco_hydro_19),其中这两个保守序列在对应氨基酸的序列上方用黑色标明指出。相似的表位结构域具有相同免疫原性的活性,从而决定了与IgE相互作用的反应。柑橘果实中的几丁质酶和其他物种具有氨基酸序列的较高同源性,因此在食用或者接触同类食物中要注意防止发生交叉过敏反应或者可能会出现休克等严重的症状。
2.4几丁质酶的空间结构
利用DNAStar生物软件中Gamier-Robson方法对蛋白质α-螺旋、β-折叠、β-转角和无规则卷曲的氨基酸区域进行预测,得到的结果如图3所示。将每一个二级结构相对应的氨基酸序列分别列出,得到几丁质酶的序列如表2所示。
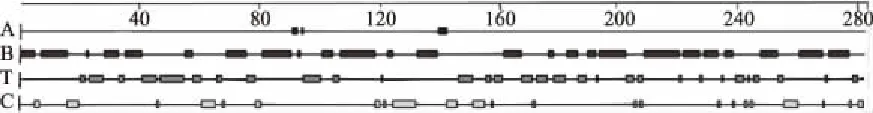
图3 几丁质酶的α-螺旋、β-折叠、β-转角和无规则卷曲相对应的氨基酸序列Fig.3 The corresponding A(α-helix),B(β-helix), T(turn)and C(coil)amino acid sequences of chitinase

表2 预测几丁质酶的二级结构氨基酸序列Table 2 Prediction secondary amino acid sequences of chitinase
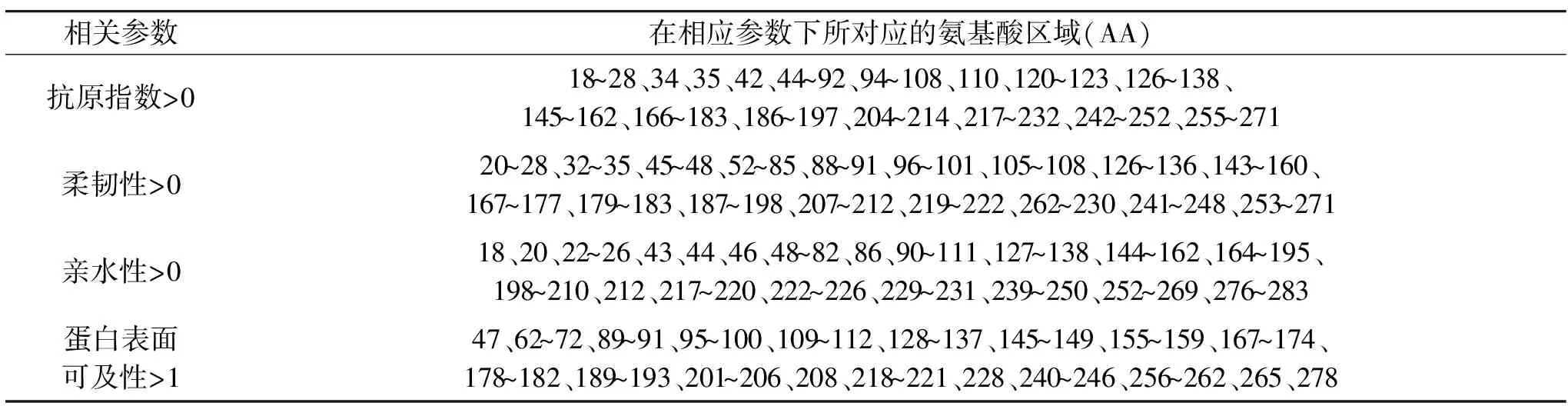
表3 几丁质酶抗原指数、柔韧性、亲水性及蛋白表面可及性的氨基酸序列Table 3 Prediction amino acid sequences of chitinase antigenic index,flexible regions,hydrophilicity and surface probability
2.5几丁质酶蛋白的B细胞表位预测
蛋白质中的表面可及性、柔韧性等特征在与抗原结合与形成的方面发挥着重要的作用。利用DNAStar生物软件中Jameson-Wolf方法分析得到几丁质酶的抗原指数、Karplus-Schulz得到几丁质酶的柔韧性、Kyte-Doolittle法和Emini法分别获得几丁质酶的亲水性和表面可及性的氨基酸序列,其具体的序列分布如图4所示。
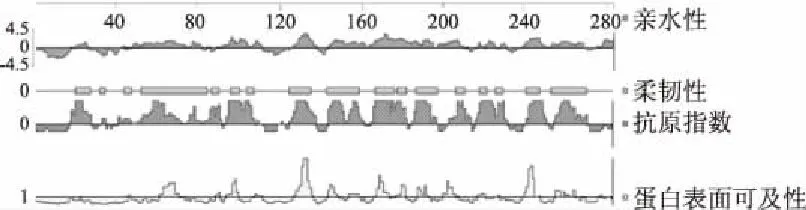
图4 几丁质酶的亲水性、柔韧性、抗原指数及蛋白表面可及性相对应的氨基酸序列Fig.4 The hydrophilicity,flexible regions,antigenic index and surface probabilityamino acid sequences of chitinase
当蛋白质的亲水性>0、柔韧性>0、蛋白表面可及性>1和抗原指数>0时,形成与抗原结合表位的可能性增大,因此根据图4中,所显示的区域和DNAstar软件中每个氨基酸所对应的数值,提取几丁质酶在亲水性>0、柔韧性>0、蛋白表面可及性>1和抗原指数>0时,所对应的氨基酸区域进行列表,如表3所示。
因此综合以上所有参数,即表面可及性>1、柔韧性>0、亲水性>0、抗原指数>0和氨基酸二级结构的氨基酸序列,将其在表3中共同拥有的区域,取交集从小到大进行罗列,分别为62~69、96~100、126~133、145~149、155~159、169~172、179~182、189~190、208、256~262。由于蛋白质二级结构中的α-螺旋和β-折叠有较稳定的氢键作用,因此不易与其他物质相作用,而β-转角和无规则卷曲多位于蛋白质的表面区域,则更易于与抗体结合,形成抗原表位的可能性也越大[11]。以上列出氨基酸区域的二级结构都属于β-转角和无规则卷曲,因此可以得出几丁质酶蛋白的抗原结合区氨基酸的区域分别可能为62~69、96~100、126~133、145~149、155~159、169~172、179~182、189~190、256~262。通过对几丁质酶B细胞抗原表位的预测分析,利用对该片段进行基因功能和生物技术的方法改造,为后续研究培育低过敏的柑橘品种提供了一定的理论依据。但是本文中对于抗原性的预测均为二级结构,对于依赖于三级结构的构象抗原表位有局限性,因此还需要结合具体的实验鉴定。
3 结论
柑橘不同的品种中,几丁质酶基因的表达量存在显著不同,其中在温州蜜柑果实中的表达量显著的高于琯溪蜜柚和甜橙的果实。相对于其他两者,温州蜜柑较容易引起过敏。
通过与大麦、小麦、玉米、苜蓿和茄属植物进行同源性比对搜索后的结果,得到其在氨基酸序列上有较高的相似性,相似的氨基酸序列具有相同免疫原性的活性,决定了与IgE相同作用的反应,说明这些物种之间可能会导致交叉过敏的现象。因此在食用或者接触同类食物中要注意防止此类反应。
B细胞抗原表位是抗原分子与体内产生抗体能够结合的氨基酸序列。通过对几丁质酶B细胞抗原表位的预测,得到氨基酸序列在62~69、96~100、126~133、145~149、155~159、169~172、179~182、189~190和256~262时,这些区域可能结合抗体。可以对该氨基酸片段进行改造,对研究培育低过敏的柑橘品种或者有针对性的治疗过敏人群提供了一定的理论依据。
[1]相启森,时国庆,马云芳,等. 致命性植物几丁质酶研究进展[J]. 食品工业科技,2015,36(10):389-394.
[2]Bublin M,Mari A,Ebner C,et al. IgE sensitization profiles toward green and gold kiwifruits differ among patients allergic to kiwifruit from 3 European countries[J]. Journal of Allergy and ClincialImmunology,2004,114(5):1169-1175.
[3]Sowka S,Hsieh LS,Krebitz M,et al. Identification and cloning of prs a1,a 32-kua endochitinase and major allergen of avocado,and its expression in the yeast[J]. Journal of Biological Chemistry,1998,273(43):28091-28097.
[4]Zhang J,Kopparapu NK,Yan Q,et al. Purification and characterisation of a novel chitinase from persimmon(Diospyroskaki)with antifungal activity[J]. Food Chemistry,2013,138(2-3):1225-1232.
[5]Goldman DL,Li X,Tsirilakis K,et al. Increased chitinase expression and fungal-specific antibodies in the bronchoalveolar lavage fluid of asthmatic children[J]. Clinical and Experimental Allergy,2012,42(4):523-530.
[6]胡纯秋,高金燕,罗春萍,等.花生过敏原Ara h 2.02二级结构和B细胞抗原表位预测[J].食品科学,2009,30(21):13-15.
[7]Jameson BA,Wolf H. The antigenic index-a novel algorithm forpredicting antigenic determinants[J]. Computer Applications in the Biosciences Cabios,1988,4(1):181-186.
[8]Karplus PA,Schulz GE. Prediction of chain flexibility in proteins[J].Naturwissenschaften,1985,72(4):212-213.
[9]Kyte J,Doolittle RF. A simple method for displaying the hydropathic character of a protein[J]. Journal of Molecular Biology,1982,157(1):105-132.
[10]Emmini EA,Hughes JV,Perlow DS,et al. Induction ofhepatitis a virus-neutralizing antibody by a virus-specific synthetic peptide[J]. Journal of Viorology,1985,55(3):836-839.
[11]Yan H,Ji Q,Chen D,et al. A novel macromolecular extract screened from Satsuma with pro-inflammatory effect[J]. Food and Function,2014,5(2):295-302.
[12]Adler BR,Assadullahi T,Warner JA,et al. Evaluation of a multiple food specific IgE antibodytest compared to parental perception,allergy skin tests and RAST[J]. Clinical Experimental Allergy,1991,21(6):683-688.
[13]刘一璇,林洪,吴丽莎,等. 加工方式对刀额新对虾主要过敏原免疫原性的影响[J]. 水产学报,2011,35(6):948-952.
[14]Mattila L,Kilpelainen M,Terho EO,et al. Food hypersensitivity among Finnish university students-association with atopic diseases[J]. Clinical and Experimental Allergy,2003,33(33):600-606.
[15]Millichap JG,Yee MM. The diet factor in pediatric and adolescent migraine[J]. Pediatric Neurology,2003,28(1):9-15.
[16]Vanden BJ,Cahill J,Emmanuel AV,et al. Gut mucosal response to food antigens in Crohn’s disease[J]. Alimentary Pharmacology and Therapeutics,2002,16(11):1903-1915.
[17]Park HS,Jee YK,Kim YK,et al. Identification of immunoglobulin E binding components of the two-spotted spider miteTetranychusurticae-Allergenic relationships with the citrus red mite and house-dust mite[J]. Allergy and Asthma Proceedings,2002,23(3):199-204.
[18]Iraneta SG,Seoane MA,Laucella SA,et al. Antigenicity and immunecross-reactivity of orange tree pollen and orange fruit allergenic extracts[J]. Int Arch Allergy Immunol,2005,137(4):265-272.
[19]Crespo JF,Retzek M,Foetisch K,et al. Germin-like protein Cit s 1 and profilingCit s 2 are majorallergens in orange(Citrussinensis)fruits[J]. Molecular Nutrition and Food Research,2006,50(3):282-290.
[20]Ji,Q,Ma ZC,Deng XX. Volunteer study and serum protein profiling to understand inflammatory response induced by Satsuma mandarin[J]. Food Research International,2015,75(1):367-373.
[21]Stengel A,Tache Y. Yin and Yang-the Gastric X/A-like Cell as Possible Dual Regulator of Food Intake[J]. Journal of Neurogastroenterology and Motility,2012,18(2):138-149.
TheexpressionofallergenchitinaseincitrusfruitandthepredictionofBcellepitopes
YANHui-qing,LUOQing-hua,HUANGXiao-long*
(College of Life Science,Guizhou Normal University,Guiyang 550001,China)
Class I chitinase plays an important part inallergy of lots of plant food. This allergen has a relationship with and responsible for latex-fruit syndrome. Chitinase was harmful to human health on some conditions. In our study chitinase was isolated from citrus fruits. Compared with fruits of orange and pummelo,the relative expression level of chitinase in satsuma fruits was significant higher than the others. Cross-reactivity of allergen was also found,for the reason that high similarity of the amino acid sequences with many other varieties. The secondary structure with DNAStar was obtained. Meanwhile the corresponding amino acid sequences of antigen index>0,surface probability>1,hydrophilicity>0,flexible regions>0 were all obtained. When the sequences of amino acid were corresponding to these conditions,as well as that the secondary structures wereβ-turn and irregular corners,the chance of B-cell epitopes was higher. Based on the comprehensive prediction analysis,we could infer that B-cell epitopes of chitinase had the high probability in regions of 62~69,96~100,126~133,145~149,155~159,169~172,179~182,189~190,256~262.These results could provide theoretical basements for antibody preparation and many other researches.
citrus allergen;chitinase;cell epitopes
2016-11-23
闫慧清(1987-),女,博士,讲师,主要从事园艺植物功能成分方面的研究,E-mail:qingyanhui@sohu.com。
*通讯作者:黄小龙(1986-),男,博士,副教授,主要从事园艺植物功能成分方面的研究,E-mail:huangxiaolong@gznu.edu.cn。
博士科研启动项目(11904-0514156,11904-0514157);贵州省自然科学基金(黔科合J字[2015]2117号);“通识教育基础课程-营养与健康”课程团队项目和品牌团队(KT2014014H;KT2016015B)。
TS201.2+5
:A
:1002-0306(2017)12-0135-05
10.13386/j.issn1002-0306.2017.12.025

