多效生长因子在骨髓间充质干细胞向神经元样细胞分化中的表达变化
连 霞,李光来,李东芳,薛国芳,裴宇恒
多效生长因子在骨髓间充质干细胞向神经元样细胞分化中的表达变化
连 霞,李光来,李东芳,薛国芳,裴宇恒
目的 探讨多效生长因子(PTN)在体外诱导成人骨髓间充质干细胞(BMSCs)向神经元样细胞分化中过程不同时间的表达变化,了解多效生长因子是否参与BMSCs向神经元样细胞分化的机制。方法 以密度梯度离心加贴壁培养法分离成人BMSCs,进行原代和传代培养,以流式细胞仪鉴定纯度。对照组和实验组对传代第6代的BMSCs进行诱导分化,诱导后30 min至3 d,观察细胞形态并计数。将分化后细胞采用免疫细胞化学法测定神经细胞特异性表面标志神经元特异性烯醇化酶(NSE)、微管相关蛋白-2(MAP-2)、胶质纤维酸性蛋白(GFAP)表达。对诱导前和诱导后3 h、6 h、12 h、24 h、3 d细胞以RT-PCR法测定PTN mRNA表达。结果 BMSCs在接种1 d后黏附贴壁,呈椭圆形或圆形,3 d~5 d后呈梭状细胞成簇生长,7 d~12 d融合。传代至第5代~6代可见较为均一的成纤维细胞样形态。流式细胞仪检测结果显示:细胞表达CD44、CD105,不表达造血干细胞的特异标记CD45,证实其纯度。诱导后细胞胞体开始向细胞胞核收缩,出现双极或多极细胞。12 h变形细胞增多,细长突起相互连接。24 h后细胞变化不明显。诱导后细胞经免疫化学染色显示:多数表达NSE(64.79±0.06)%、MAP-2(60.05±0.09)%,而未检测到GFAP。实验组诱导后细胞不同时间点PTN mRNA的表达不同(P<0.01)。 诱导后12 h~24 h PTN mRNA表达最高。结论 建立成人BMSCs培养增殖体系基础上诱导BMSCs向神经元样细胞分化,诱导过程细胞有外观形态变化,同时表达神经细胞特异性标志物NSE和MAP-2。诱导后BMSCs与形态改变相似,向神经元样细胞分化的不同时间点,有PTN mRNA表达变化,提示PTN可能参与BMSCs向神经元样细胞的分化。
多效生长因子;骨髓间充质干细胞;神经元样细胞;神经元特异性烯醇化酶;微管相关蛋白-2;胶质纤维酸性蛋白
骨髓间充质干细胞(mesenchymal stem cells,BMSCs)是具有多向分化潜能的一类干细胞,在组织工程、细胞移植、基因治疗等领域有广阔的应用前景,其向神经细胞的分化为治疗神经系统疾病带来新思路,成为干细胞的研究热点之一[1]。目前经诱导分化后的细胞与正常神经细胞功能有较大差别。目前对其向神经细胞分化的机制仍不明确,故不能确立稳定的诱导方法。本实验研究BMSCs向神经元样细胞分化中不同时间点多效生长因子(pleiotrophin,PTN)mRNA的表达变化,以了解其是否参与影响BMSCs向神经元样细胞的分化。
1 材料与方法
1.1 实验材料 骨髓采集于健康成年志愿捐髓者;DMEM培养基(Gibicol公司);胎牛血清(FBS)(杭州四季青公司);BHA(中国药物试剂公司);BME、二甲基亚砜(DMSO)、胰酶(AMRESCO公司);淋巴细胞分离液(上海试剂二厂)、兔抗人神经元特异性烯醇化酶(NSE)、微管相关蛋白-2(MAP-2)、胶质纤维酸性蛋白(GFAP)、羊抗兔二抗、链霉素和素-生物素复合物(SABC)试剂盒(博士德公司);寡核苷酸引物序列(大连宝生物有限公司合成);RNA PCR Kit(AMV)Ver.2.1(TKaRa公司);CO2培养箱、倒置荧光显微镜、超静工作台、流式细胞仪(Kurtz公司);Kodark凝胶数字扫描分析系统等;PTC-100型PCR仪。
1.2 BMSCs分离培养 以髂后上棘行骨髓穿刺术抽取4 mL肝素化骨髓,加胎牛血清制成悬液,离心弃上清去除脂肪,以1.073×103g/mL淋巴细胞分离液梯度分离,吸取单个核细胞层,以磷酸盐缓冲液(PBS)洗涤2次~3次后接种于25 mL培养瓶中培养,培养液为加20%胎牛血清的DMEM,含有100 mg/mL链霉素、100 U/mL青霉素、2 mmol/L L-谷胺酰胺。接种细密度为5×106/L;温度37 ℃、饱和湿度为5%CO2。接种后3 d~4 d第一次换培养液,之后每3 d~4 d换液1次。应用倒置显微镜下观察细胞形态和生长。
1.3 BMSCs的传代培养 细胞生长至90%以上融合后弃区上清液,以无钙镁的PBS液洗涤2次~3次,加入1 mL~2 mL消化液[0.25%胰酶/0.02%乙二胺四乙酸(EDTA)],37 ℃温度下消化3 min~5 min,以吸管缓慢捶打至细胞完全脱落,离心弃去上清液后用培养液重悬细胞,捶打均匀,按1∶3比例分瓶进行培养。继续观察细胞形态和其生长的速度。
1.4 流式细胞仪检测BMSCs纯度 选取第5代细胞进行纯度鉴定,弃培养液,以PBS液洗涤1次~2次,加入37 ℃温度的消化液1 mL~2 mL 1 min~2 min,加入完全培养基终止消化,用吸管捶打成单细胞悬液,弃上清液后将细胞沉淀用PBS液再洗涤一遍后,制成单细胞PBS悬液300 μL。将细胞悬液平均分至5支Ep管中,每支标本计数10×105个细胞,取四管分别加入CD44、CD45、CD105,一管为空白对照。给予4 ℃,避光培育30 min后以PBS冲洗1次,置入冰盒,进行流式细胞仪检测,测试3次,结果取平均值。打印结果。
1.5 BMSCs体外诱导分化 取第6代细胞以4×105/mL的密度接种于放置消毒盖玻片的6孔板内培养成单层细胞。实验组用完全DMEM(含1 mmo lBME)预诱导24 h[2],对照组为无诱导剂的完全DMEM。1 d后去除培养液,PBS洗涤2次~3次。实验组以含200 μmol/L BHA+2%DMSO的无血清DMEM作为培养液进行诱导,对照组不加诱导剂。诱导后30 min至4 d,观察细胞的形态变化并计数目。分组详见表1。

表1 BMSCs诱导分组及诱导剂
1.6 诱导后神经元样细胞的鉴定
1.6.1 免疫细胞化学法鉴定及分化细胞计数 诱导后12 h,以4%的多聚甲醛固定附着于盖玻片上细胞,封闭内源性过氧化物酶,正常羊血清封闭,之后分组加入抗NSE、MAP-2和GFAP抗体(1∶200),4 ℃过夜。以PBS洗涤后加入生物素化羊抗兔二抗,室温20 min后加SABC,室温下20 min后以新配制的3,3-二氨基联苯胺(DAB)液反应5 min~30 min,显微镜下观测细胞的颜色。以5个方位分别取2个不重复的视野计算总细胞数及抗原表达率(NSE或MAP-2染色阳性细胞率)。
1.6.2 RT-PCR法检测PTN mRNA的表达 分别在诱导前和诱导后3 h、6 h、12 h、24 h、3 d检测PTN mRNA的表达。提取总RNA,以甲醛变性凝胶电泳,纯度检测后进行RT-PCR检测,按试剂盒说明进行,内参照为GADPH,总体积50 μL,反转录之后进行PTN的扩增,扩增片段长238 bp,扩增条件:94 ℃变性2 min,94 ℃ 30 s,57.5 ℃ 30 s,72 ℃ 1 min,共30个循环。扩增好的产物进行电泳,最后分析结果。

2 结 果
2.1 BMSCs的分离和原代培养 细胞接种1 d后开始少量黏附贴壁,呈圆或椭圆形,折光性好。3 d后开始出现变形细胞,呈多边形或梭形,并向不同方向伸出突起。之后贴壁细胞呈集落样生长增殖,类似成纤维细胞,突起粗细不等、长短不一。8 d~10 d细胞呈集簇状,中心放射状融合,周边细胞相对分散,轮廓清晰,形态不完全一致。至15 d~20 d可铺满瓶底,集落中心细胞增殖明显,周围细胞完全融合,轮廓不清,似毛玻璃样。详见图1。

图1 第16天原代培养(200×)
2.2 BMSCs的扩增培养 传代中,消化细胞1 min后近一半细胞变圆,待80%变形时终止消化。传代后第2天细胞逐渐恢复生长,潜伏期缩短,贴壁生长速度增快,给予换液去除悬浮死亡的细胞。第4天~第6天再次长满瓶底,分布较原代均匀,仍呈集落状生长,大小形态同原代细胞一致(详见图1)。1代、2代时可见少量圆形细胞,至4代~6代细胞纯化度高,形态比较均一,融合后细胞折光均匀,高倍镜下可见胞体内微小颗粒。传至15代以上,细胞生长速度减慢,呈逐渐衰老状态,胞体大,不透亮。高倍镜下可见胞体颗粒增多,空泡出现至悬浮死亡。详见图2。

图2 第5天BMSCs原代培养(200×)
2.3 流式细胞仪鉴定结果 经流式细胞仪检测,骨髓间充质干细胞表面标记结果为CD44(+)、CD105(+)、CD45(-),表明BMSCs的纯度相对较高。详见图3。
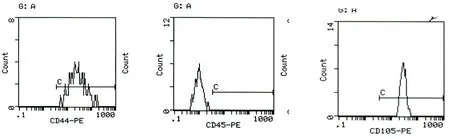
BMSCs CD44(+) BMSCs CD45(-) BMSCs CD105(+)
2.4 BMSCs诱导分化后的形态变化 诱导后的细胞形态逐渐发生改变,胞体开始向细胞核收缩;诱导3 h后细胞胞体成圆形,出现双极或多极细胞,折光性增强。12 h后变形细胞增多,细胞突起增长,细胞间细长突起可相互交织,形成网络。诱导后1 d,部分细胞呈现似神经元的细胞形态,之后变形趋势逐渐缓慢,至诱导后3 d悬浮死亡细胞开始增多。对照组仍为呈纤维样细胞形态,未见细胞形态改变。详见图4、图5。

图4 实验组诱导12 h BMSCs(300×)
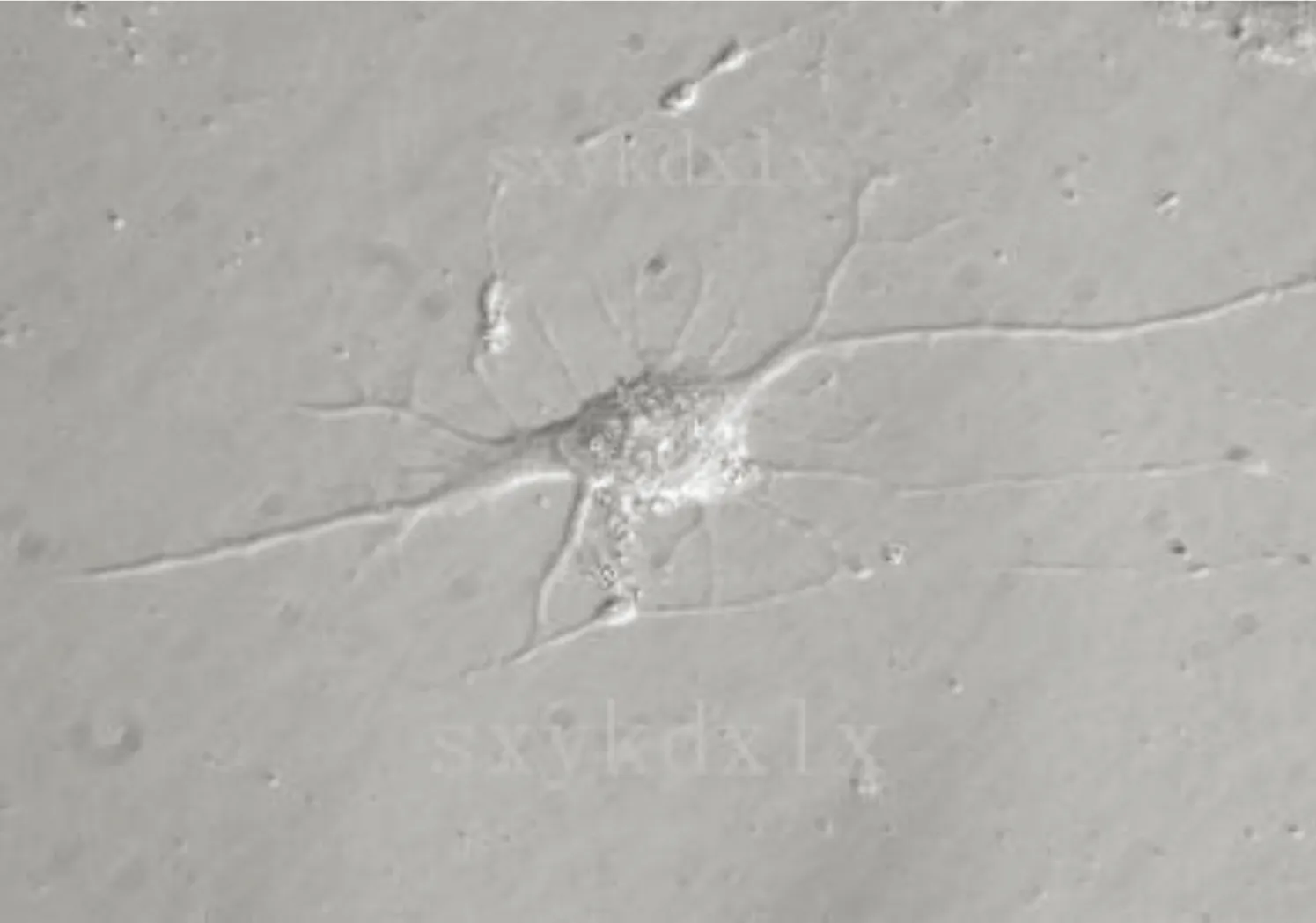
图5 实验组诱导24 h BMSCs(600×)
2.5 两组BMSCs诱导后12 h神经细胞特异性抗原表达率 显微镜下观察两组NSE、MAP-2及GFAP染色阳性细胞数,实验组诱导后12 h细胞免疫化学染色显示,大部分绝大多数形态改变的细胞均表达神经元特异性标志NSE、MAP-2,与对照组比较,差异有统计学意义(P<0.01),而未检测到GFAP表达,与对照组比较,差异无统计学意义。详见表2、图6、图7。

表2 两组BMSCs诱导后12 h神经细胞特异性抗原表达率比较(±s) %

图7 实验组诱导12 h免疫细胞化学检测MMP-2表达
2.6 两组BMSCs诱导后不同时间点PTN mRNA表达比较 实验组PTN和GADPH mRNA RT-PCR产物电泳结果,详见图8、图9。实验组PTN mRNA的表达与对照组比较,差异有统计学意义(P<0.01)。实验组BMSCs向神经元样细胞分化过程中的不同时点PTN mRNA的表达不同,诱导后12 h表达基本达高峰,持续至24 h表达仍较强。至诱导后3 d表达下降。详见表3。PTN mRNA的表达变化与细胞形态的改变是一致的。
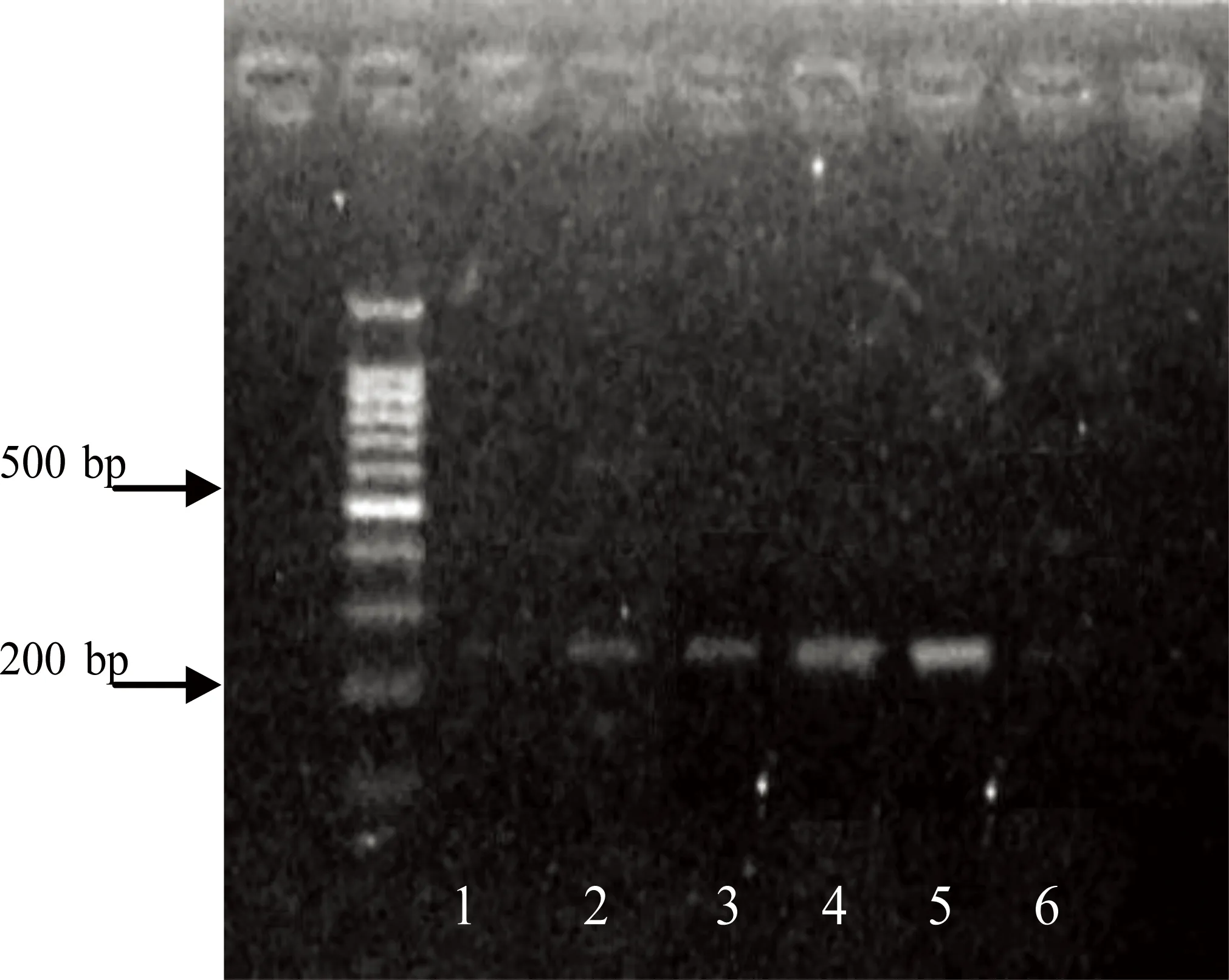
注:1为诱导前;2为诱导后3 h;3为诱导后6 h;4为诱导后12 h;5为诱导后24 h;6为诱导后3 d。
图8 实验组PTN RT-PCR电泳图
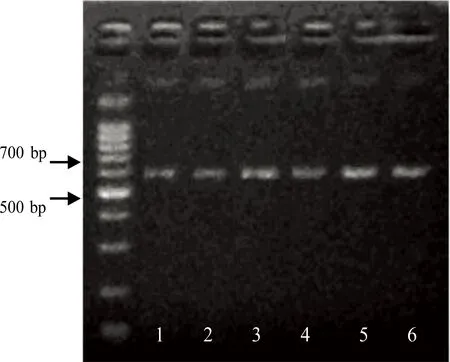
图9 实验组GADPH RT-PCR电泳图

表3 两组BMSCs诱导后不同时间点PTN mRNA表达比较(±s)
3 讨 论
BMSCs的多向分化潜能使其在组织工程、细胞移植、基因治疗等领域有较为广阔的应用前景。Woodbury[2]在一定条件下将BMSCs诱导为神经元样细胞,之后尝试不同的诱导方法,但至今诱导分化后的细胞在功能上与正常神经细胞有较大差距,对其分化机制未充分了解,故而不能建立明确稳定的诱导方法。
目前认为BMSCs的跨系分化基础有可能为转分化[3]现象,在分子水平上,表现为关键发育基因表达的改变。因此确定其转分化的关键基因至关重要。Jori等[4]发现RB和RB2/P130基因对BMSCs向神经系细胞分化中起一定作用。RB2/P130影响细胞的一般特性,而RB则促进BMSCs向胆碱能神经元分化。Woodbury等[5]研究发现BMSCs分化为的神经元样细胞可以表达TOAD-64、触突素,微管蛋白(β-tubulinIII),一种微管相关蛋白(tau),神经丝-M(neurofilament-M)等基因[5]。有研究也发现,在成人BMSCs向神经元样细胞分化中有褪黑素受体MT1亚型的表达[6]。
1990年Li等[7]从牛子宫分离出一种肝素结合蛋白,有促进成纤维细胞有丝分裂的作用。 这种蛋白以前称为肝素结合样生长因子-8,因其具有多种功能而被重新命名为多效生长因子 。研究认为PTN属高度保守的基因家族,其表达产物 PTN可启动培养的胎鼠脑细胞轴突生长发育,在神经组织的发育和/或维持中起一定作用[8]。 研究显示PTN在癫痫发作、脑损伤、脑退行性变如帕金森、亨廷顿病、多发性硬化和中风表达均有增高,有神经保护作用[9-10]。在神经发育中,PTN表现为时空分布的表达并与神经上皮源性的神经元和胶质祖细胞的发育迁移相关联,在胚胎时期表达开始增高,直至在脑架构形成时即出生时达到高峰,此后便逐渐下降,直到成体时仅能在海马、嗅球、垂体和参与皮质之间连接的新皮质以及Schwann细胞中发现[11]。PTN在发育过程中的这种表达模式反映它对生长发育和分化的重要作用。体外培养发现,PTN可促进胚胎神经元的分化和神经突的生长,并可促进成纤维细胞的分裂增殖[8]。Li等[12]研究认为PTN基因在脑中和间充质来源的组织中是高表达,并是受发育调控的。它和MK及RI-HB基因基本类似,这两种基因也是发育调节的并能被维A酸(RA)所诱导。Raulais等[13]以RA作用P19细胞后,发现PTN表达明显增高。而Li等[12]以血小板衍生生长因子(PDGF)刺激NIH3T3细胞后PTN mRNA表达比以RA刺激后增高更为明显,以此认为PTN是PDGF诱导的细胞因子家族的新成员。体外培养发现,PTN可促进胚胎神经元的分化和神经突的生长[14]。故PTN也被称为轴突生长刺激因子(neurite outgrowth- promoting factor)。
Furuta等[15]检测神经干细胞表达PTN及其受体N-syndecan、PTP和ALK的mRNA,表明在神经干细胞上存在PTN信号传导系统,并对神经干细胞的分化有重要作用。那么作为间充质细胞的MSCs,在其向神经系细胞分化中是否有PTN表达和PTN信号传导的发生。
因此本课题在Woodbury体外诱导体系的基础上,观察BMSCs向神经元样细胞诱导分化过程中不同时间点PTN mRNA的表达变化,结果显示其与细胞形态的变化相呼应,与对照组比较差异有统计学意义(P<0.01)。诱导后12 h PTN mRNA表达已达峰值并持续至24 h,均高于其他组,但差异无统计学意义。而细胞形态的改变也是在12 h~24 h最明显,故BMSCs在其向神经系细胞分化中PTN可能参与调控细胞分化,对细胞变形,突起延伸及特异性酶的表达有一定作用。为进一步了解BMSCs分化的具体机制,分析BMSCs分化过程中的主要调控基因和信号传导通路,特别是不同发育阶段决定BMSCs分化方向的关键基因提供一些线索。若分化过程中PTN确实有表达的变化,那么其上下游的信号传递又是怎样的,通过调控其表达量是否能促进BMSCs向神经系细胞的分化则是需要进一步研究。
[1] Kim S,Honmou O,Kato K,et al.Neural differentiation potential of peripheral blood-and bone-marrow-derived precursor cells[J].Brain Res,2006,1123(1):27-33.
[2] Woodbury D,Schwarz EJ,Prockop DJ,et al.Adult rat and human bone marrow stromal cells differentiate into neurons[J].J Neurosci Res,2000,61(4):364-370.
[3] Sanchez-Ramos JR.Neural cells derived from adult bone marrow and umbilical cord blood[J].Journal of Neuroscience Research,2002,69(6):880-893.
[4] Jori FP,Napolitano MA,Melone MA,et al.Role of RB and RB2/P130 genes in marrow stromal stem cells plasticity[J].J Cell Physiol,2004,200(2):201-212.
[5] Woodbury D,Reynolds K,Black IB.Adult bone marrow stromal stem cells express ger mLine,ectodermal,endodermal,and mesodermal genes prior to neurogenesis[J].J Neurosci Res,2002,69(6):908-917.
[6] 连霞,李丽,李光来,等.骨髓间充质干细胞向神经元样细胞分化中褪黑素受体和多效蛋白的表达[J].中西医结合心脑血管病杂志,2010,8(2):200-202.
[7] Li YS,Milner PG,Chauhan AK,et al.Cloning and expression of a developmentally regulated protein that induces mitogenic and neurite outgrowth activity[J].Science,1990,250(4988):1690-1694.
[8] Eddy RL,Kretschmer PJ,Fairhurst JL,et al.A human gene family of neurite outgrowth promoting proteins: the gene for a heparin binding neurite outgrowth -promoting factor maps to 7q22-qter [J].Cytogenet Cell Genet,1991,58(4):1920.
[9] Wanaka A,Carroll SL,Milbrandt J.Developmentally regulated expression of pleiotrophin,a novel heparin binding growth factor,in the nervous system of the rat[J].Brain Res Dev Brain Res,1993,72(1):133-144.
[10] Kim YB,Ryu JK,Lee HJ,et al.Midkine,heparin binding growthfactor,blocks kainic acid induced seizure and neuronal cell death in mouse hippocampus[J].BMC Neuroscience,2010,11(42):2-8.
[11] Vanderwinden JM,Mailleux P,Schiffmann SN,et al.Cellular distribution of the new growth factor pleiotrophin (HB-GAM) mRNA in developing and adult rat tissues[J].Anat Embryol (Berl),1992,186(4):387-406.
[12] Li YS,Gurrieri M,Deuel TF.Pleiotrophin gene expression is highly restricted and is regulated by platelet-derived growth factor[J].Biochem Biophys Res Commun,1992,184(1):427-432.
[13] Raulais D,Rauvala H,Souttou B,et al.HB-GAM/pleiotrophin and midkine are differently expressed and distributed during retinoic acid-induced neural differentiation of P19 cells[J].Growth Factors,2003,21(3-4):139-149.
[14] Jin K,Mao XO,Batteur S,et al.Induction of neuronal markers in bone marrow cells:differential effects of growth factors and patterns of intracellular expression[J].Exp Neurol,2003,184(1):78-89.
[15] Furuta M,Shiraishi T,Okamoto H,et al.Identification of pleiotrophin in conditioned medium secreted from neural stem cells by SELDI-TOF and SELDI-tandem mass spectrometry[J].Brain Res Dev Brain Res,2004,152(2):189-197.
(本文编辑薛妮)
The Expression of Pleiotrophin in the Differentiation of Human Bone Marrow Mesenchymal Stem Cells into Neuron-like Cells in Vitro
Lian Xia,Li Guanglai,Li Dongfang,Xue Guofang,Pei Yuheng
The Second Hospital,Shanxi Medical University,Taiyuan 030001,Shanxi,China
Objective To study the expression of pleiotrophin (PTN) mRNA in the differentiation of human bone marrow mesenchymal stem cells (BMSCs) into neuron-like cells in vitro,and investigate the mechanism.Methods Human BMSCs were isolated primarily from bone marrow of adult volunteers’ iliac and purified sterilely with gradient centrifugation.The low-density cells including BMSCs were cultivated and purified by passage control.We observed the growth status of BMSCs,and identity the immunological characteristic phenotype of CD45,CD44 and CD105 by using FACS.The 6th passage of BMSCs were planted into plastic culture flask and induced.The control group did not receive any induced treatment.We observed the morphology change of BMSCs,after the induction 6 hours,neuron-specific enolase (NSE),microtubule-associated protein-2(MAP-2) and glial fibrillary acidic protein (GFAP),which were neuron marker were detected by using immunocytochemistry method.The express of PTN mRNA was detected by RT-PCR before induction and at 3 h,6 h,12 h,24 h,3 d after induction.Results The BMSCs were cultivated primarily and following passaged successfully.The living behavior of BMSCs from passage four to passage six were stable.Flow cytometry analysis showed that the cells were positive for CD44 and CD105 receptor,in contrast,negative for CD45 receptor,which demonstrated the purity of BMSCs.The treatment protocols induced BMSCs to differentiate into neuron-like cells,Which expressed NSE and MAP-2 (the express rate were 64.79%±0.06% and 60.05%±0.09%),but did not express GFAP.PTN mRNA was detected to expresse after induction,and from 12 to 24 hours after induction,the expression were highest.After three days,the expression was difficult to be detected.Conclusion The marrow mesenchymal stem cells could be obtained and purified in vitro,and the amplification was stable in our experimental conditions.After being induced,BMSCs could differentiate into neural like cells with the transformation of morphology and the expression of NSE and MAP-2,the same characters which the true neuron cells have.The expression of PTN mRNA had the same change with morphology after the induction,which indicated PTN maybe take a part of the induction.
pleiotrophin; bone marrow mesenchymal stem cells;neuron-like cells; neuron-specific enolase;microtubule-associated protein-2;glial fibrillary acidic protein
山西医科大学第二医院(太原 030001),E-mail:alianxia@126.com
信息:连霞,李光来,李东芳,等.多效生长因子在骨髓间充质干细胞向神经元样细胞分化中的表达变化[J].中西医结合心脑血管病杂志,2017,15(11):1325-1329.
R329.2 R289.9
A
10.3969/j.issn.1672-1349.2017.11.010
1672-1349(2017)11-1325-05
2016-08-01)

