九寨沟2种沉水植物叶绿素荧光特性比较
高丽楠
(成都大学 旅游与经济管理学院,四川 成都 610106)
九寨沟2种沉水植物叶绿素荧光特性比较
高丽楠
(成都大学 旅游与经济管理学院,四川 成都 610106)
为探讨九寨沟芳草海水苦荬(Veronicaundulata)和杉叶藻(Hippurisvulgaris)的光合特性和它们对高原湖泊水环境生态适应的差异性,采用调制叶绿素荧光仪Junior-PAM,测定了这2种沉水植物的最大光化学效率(Fv/Fm)、PSⅡ实际光化学效率(ΦPSⅡ)、快速光响应曲线(RLCs)相关参数、光化学淬灭(qP)和非光化学淬灭(NPQ)的日变化。结果显示:水苦荬和杉叶藻的最大潜在相对电子传递速率(rETRmax)和半饱和光强(Ek)的日变化均呈典型的单峰型曲线,Fv/Fm和ΦPSⅡ日变化均呈早晚高、中午低的近“V”型曲线。水苦荬的rETRmax、Ek、qP和NPQ日平均值都显著高于杉叶藻,表明水苦荬有更高的光合能力和耗散过剩光能的能力。杉叶藻较高的初始斜率(α)和叶绿素b(Chlb)含量以及较低的Ek值,表明其在弱光下拥有更强的光捕获能力,光合效率更高,是对弱光环境的一种适应。综上,2种沉水植物的叶绿素荧光参数有一定的差异,水苦荬对强光适应能力强于杉叶藻,表现出对当地环境更强的适应性。
快速光响应曲线;沉水植物;水苦荬;杉叶藻;光化学淬灭
被誉为“人间仙境、童话世界”的九寨沟自然保护区,位于四川省阿坝藏族羌族自治州九寨沟县(原南坪县)境内,是一条纵深40余km的山沟谷地。九寨沟区内地质构造复杂,褶皱断裂发育,碳酸盐岩分布广、厚度大,侵蚀作用强烈,特别是钙华地貌发育,形成了钙华湖泊和瀑布、钙华堤和钙华坝、植物岛和滩流等奇观,成为高寒地区独具特色的喀斯特地貌景观。但是,随着旅游资源的不断开发,巨大的游客人数、大量旅游活动以及修建旅游基础设施(包括栈道、公路、厕所、停车场、餐厅、游客活动中心等)给景区的植被、水体和土壤等造成了一定的负面影响,削弱了湖岸生态系统的水源涵养和水土保持功能,对景区旅游资源的可持续利用带来巨大挑战。目前,在九寨沟自然保护区,部分海子已经呈现沼泽化,例如芳草海尾部出现不同程度的泥沙淤积,从现有泥沙监测来看泥沙淤积正以较快的速度向湖心推进,促进了水生植物生长,从而危机湖泊的存在,并对景区的风景质量产生不利影响,也将直接影响到景区景观资源的保护和可持续利用。研究九寨沟湖泊水生植物的生长状况可为九寨沟湖泊保护与可持续利用提供基础数据和科学指导。
植物叶绿素荧光信号是一种理想的光系统探针,能快速灵敏地反映植物生理状态及其与环境的关系,可直接或间接地了解光合作用过程,该分析技术已经成为当前植物生理生态学特别是光合作用研究领域的重要研究手段之一。现今环境问题日益突出,环境因素对水生植物光合生理生态特征影响的研究将为解决水生生态系统的环境问题提供重要的科学依据。国内外学者先后开展了许多研究,主要集中在光照[1]、温度[2]、富营养化[3]等环境因子对水生植物光合生理生态特征的研究。光照是沉水植物生长的限制性因子,而且决定了沉水植物在水下分布的最大深度。如杨鑫等[4]认为太湖胥口湾的苦草(Vallisnerianatans)最大光化学效率(maximum photochemical efficiency,Fv/Fm)随着水深增加显著增加,叶片光合系统Ⅱ光化学效率亦显著提高;水下2.0 m处苦草的最大潜在相对电子传递速率(maximum relative electron transport rate,rETRmax)显著高于0.6 m处。高温40 ℃胁迫20 min后,坛紫菜(Porphyrahaitanensis)的rETRmax、Fv/Fm、光化学淬灭(photochemical quenching,qP)及非光化学淬灭(non-photochemical quenching,NPQ)均急剧下降,以热量形式耗散过剩光能的自我保护能力损失殆尽,同时光合作用活性和PSⅡ传递活性几乎完全丧失[5]。富营养化影响水生植物的生长和发育,并可导致水生植物特别是沉水植物的衰退和消亡。高营养盐质量浓度水体中的菹草(Potamogetoncripus)叶片将大部分光能用于热耗散,光合作用和耐光抑制能力显著降低,菹草的生长受到抑制并出现死亡[6]。青藏高原湖泊在全球环境变化研究中占有特殊地位,其不仅是万水之源,而且在防止全球水危机方面发挥着关键作用。因此,本研究以地处青藏高原东南部的九寨沟芳草海为研究区,以该区的优势沉水植物水苦荬(Veronicaundulata)和杉叶藻(Hippurisvulgaris)为研究对象,通过野外测量和室内实验,选择3组叶绿素荧光参数,即快速光响应曲线、PSⅡ光化学效率参数和荧光淬灭参数进行研究,分析了2种沉水植物的PSⅡ功能、光能利用与能量分配、光化学淬灭与非光化学淬灭等参数的差异,为揭示九寨沟水生植物的生理代谢响应机制提供参考,为开展九寨沟泥沙防治和环境保护提供基础。
1 材料与方法
1.1 研究区域概况
九寨沟国家级自然保护区(103°46′~104°05′E,32°55′~33°16′N)位于四川省阿坝藏族羌族自治州九寨沟县漳扎镇境内,地处青藏高原东南部,是青藏高原、四川盆地2大地貌单元的过渡带,属典型的高山峡谷地貌,海拔高度为2 000~3 000 m。九寨沟属高原湿润气候,年平均气温为7.8 ℃,极端最低气温出现在1月,为-19.1 ℃,极端最高气温出现在7月,为33.7 ℃;年降水量为539.1~811.4 mm,多年平均年降水量为675 mm,降水主要集中在5—10月。
从现有的监测结果可见,芳草海尾部泥沙淤积明显,且呈现较快的向前推进趋势,十分具有代表性。芳草海为顺沟向展布的长条形海子,海拔2 934 m,海子长540 m,宽92.2 m,一般深2~4 m。在芳草海尾部见有泥沙沉积现象,其主要来源为芳草海邻近发育呈西北-东南向的支沟(东南侧为原始森林支沟,西北侧为悬泉支沟),使其流水侵蚀有较丰富的泥沙物源[7]。所选择的水生植物为九寨沟分布广泛的杉叶藻(Hippurisvulgaris)和水苦荬(Veronicaundulata)。杉叶藻是杉叶藻科植物,在青藏高原分布广泛,生长在海拔2 700~5 200 m的沼泽、牛轭湖、积水洼地、湖滨沼泽化水塘和溪流积水滩中;水苦荬是玄参科植物,别名水莴苣,分布于流动浅水中,山区溪流及河流浅水段可见[8]。
1.2 实验方法
1.2.1 叶绿素荧光参数和环境因子的测定
试验于2015年水生植物生长旺盛期7月14—20日的晴天进行。叶绿素荧光动力学特性采用脉冲调制叶绿素荧光仪Junior-PAM(Walz,Germany)进行测定。随机选择5株植株,测定时间7:00—17:00,每2 h测定1次。快速光响应曲线(rapid light curves,RLCs)的测定由电脑控制完成,为样品依次提供66、90、125、190、285、420、625、820 μmol·m-2·s-1共8个梯度的光化光,待不同光强下荧光值达到稳定后(约10 s),提供饱和脉冲光测得该光强下最大荧光值,计算得到8个相对电子传递速率(relative electron transport rate,rETR)值,绘制快速光响应曲线[9]。快速光响应曲线拟合用Platt等[10]的公式。
rETR=rETRmax×(1-e-α×PAR/rETRmax)×e-β×PAR/rETRmax;
Ek=rETRmax/α。
式中:rETRmax代表无光抑制时的最大潜在相对电子传递速率,α为初始斜率(initial slope),β是光抑制参数。Ek为半饱和光强(half-saturation light intensity,μmol·m-2·s-1)。
7:00—17:00,每间隔2 h测定Fv/Fm、实际光化学效率(actual photochemical efficiency,ΦPSⅡ)和荧光淬灭参数的日变化。叶片经过30 min的暗适应后,先打开检测光测暗适应叶片的初始荧光(Fo),再打开饱和脉冲光测得最大荧光(Fm);紧接着照射10 min的内源光化光,开启饱和脉冲,得出光下稳态荧光(Fs)和光照状态下的最大荧光(Fm′);然后关闭光化光,打开远红光,测定光下最小荧光(Fo′)。根据这些参数可以计算:Fv/Fm=(Fm-Fo) /Fm;ΦPSⅡ=(Fm′ -Fs)/Fm′;qP=(Fm′ -Fs) / (Fm′-Fo′);NPQ=(Fm-Fm′) /Fm′[11]。
7:00—8:00,利用叶绿素荧光仪测定低光强和高光强下的荧光诱导曲线,在光化光分别为低光(190 μmol·m-2·s-1)和强光(1 150 μmol·m-2·s-1)下测定qP和NPQ。
湖泊温度(water temperature,Tw, ℃)的日变化测定使用温度计,水面下光合有效辐射(photosynthetic active radiation,PAR,μmol·m-2·s-1)日变化的测定使用AccuPAR Lp-80 Ceptometer。
1.2.2 叶绿素含量和生物量
称取1.6 g叶片剪碎,用80%的丙酮提取叶绿素。使用紫外分光光度计(UV-1240-PC, Shimadzu)测定645 nm和663 nm处的吸光度,重复测量6次,得出叶绿素a(Chla,mg·g-1)、叶绿素b(Chlb,mg·g-1)和叶绿素(a+b)[Chl(a+b),mg·g-1]含量[12]。
设置3个0.5 m×0.5 m的样方,采用收获法采集样方内的植物,于80 ℃烘干至恒质量。称量后,计算单位面积内的生物量。
1.3 数据处理
使用SPSS 17.0和Origin 7.5软件对以上数据进行处理和图表制作。使用单因素方差分析,P<0.05表示差异显著。
2 结果与分析
2.1 环境因子的日变化
芳草海的PAR日变化为典型的单峰型,7:00—13:00为显著上升阶段,从31 μmol·m-2·s-1上升到1 914 μmol·m-2·s-1;13:00—17:00为迅速下降阶段,PAR从1 914 μmol·m-2·s-1降到856 μmol·m-2·s-1。芳草海的Tw日变化也呈典型的单峰型曲线,7:00左右Tw最低(5.9 ℃),随着PAR的增强Tw逐渐升高,在13:00左右达到最高(11.2 ℃),之后Tw随着PAR的减小而缓慢下降(图1)。
2.2 杉叶藻和水苦荬的叶绿素荧光参数
2.2.1 快速光响应曲线的日变化
PSⅡ的相对电子传递速率rETR可反映实际光强下的表观电子传递效率,用来衡量体内总光合电子传递能力,即度量CO2固定的电子传递情况[13]。由图2-A可知,在13:00,杉叶藻的rETR达到峰值。7:00、9:00和17:00,杉叶藻的rETR随着PAR的增强逐渐增大,但在较高PAR(>285 μmol·m-2·s-1)时,rETR开始逐渐下降;11:00和13:00,rETR随着PAR的增强逐渐升高;而15:00,rETR在PAR为625~820 μmol·m-2·s-1时缓慢下降。从图2-B可知,水苦荬的rETR也是在13:00达到峰值,13:00的rETR随着PAR的升高而升高,呈近线性关系;7:00、9:00和17:00,在一定PAR范围内,水苦荬的rETR逐渐上升,但在较高PAR(>420 μmol·m-2·s-1)时,rETR逐渐下降;15:00的rETR随着PAR的升高逐渐增强。
从图3-A可以看出,杉叶藻的rETRmax日变化为单峰曲线,峰值(54.47 μmol·m-2·s-1)出现在13:00,此后随着PAR的增强而持续下降,峰值出现时间(13:00)与PAR一致。水苦荬rETRmax日变化与杉叶藻相似,峰值也出现在13:00,但峰值为63.17 μmol·m-2·s-1,之后也逐渐下降。杉叶藻和水苦荬Ek日变化趋势与其各自的rETRmax基本一致(图3-C),水苦荬Ek日均值(178.5 μmol·m-2·s-1)和rETRmax日均值(38.96 μmol·m-2·s-1)都极显著大于杉叶藻(P<0.01)。由图3-B可知,杉叶藻和水苦荬的初始斜率(α)日变化趋势相似,7:00—9:00,α迅速升高,峰值均出现在9:00;之后随着PAR的增强和温度的上升,α逐渐下降,13:00达到最低值;之后逐渐回升,17:00 再次出现高峰。在7:00、15:00和17:00的弱光环境下,杉叶藻α极显著高于水苦荬(P<0.01)。
2.2.2 最大光化学效率和实际光化学效率日变化
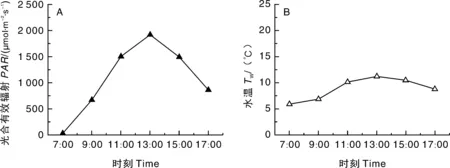
图1 芳草海水下光合有效辐射(A)和水温(B)的日变化Fig.1 Diurnal variability of underwater photosynthetic active radiation (A) and water temperature (B) in Grass lake
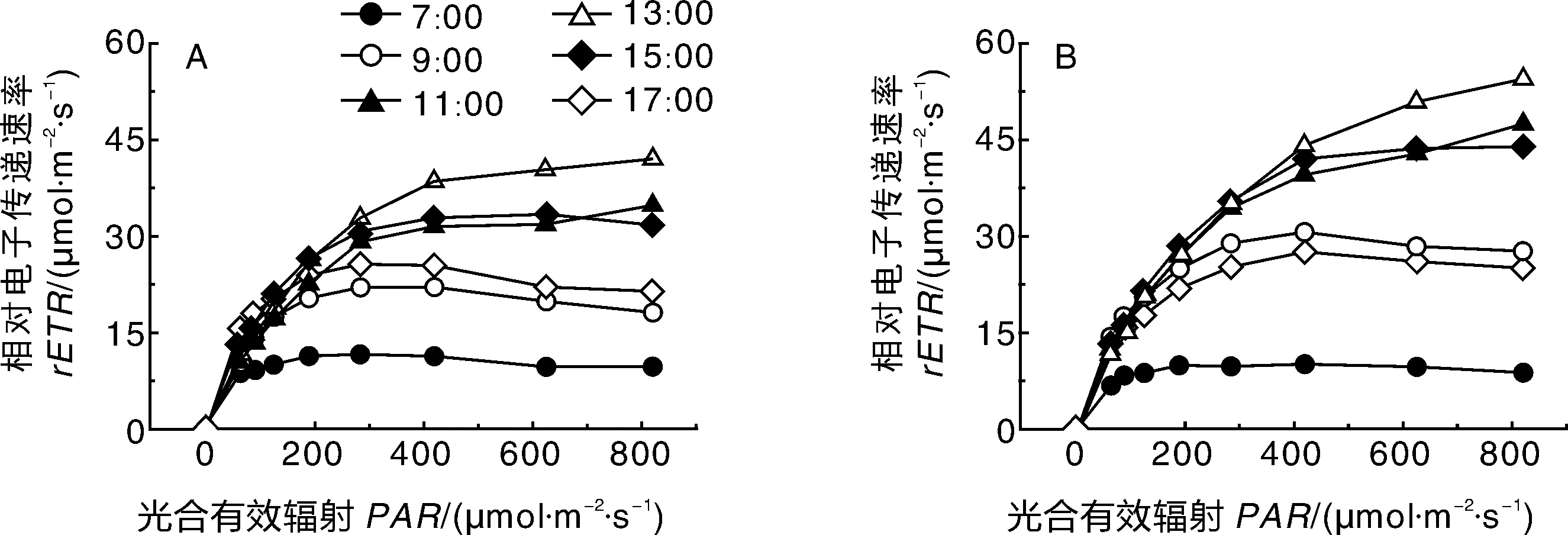
图2 杉叶藻(A)和水苦荬(B)的快速光响应曲线日变化Fig.2 Diurnal variability in rapid light curves of Hippuris vulgaris(A) and Veronica undulate(B) in Grass lake
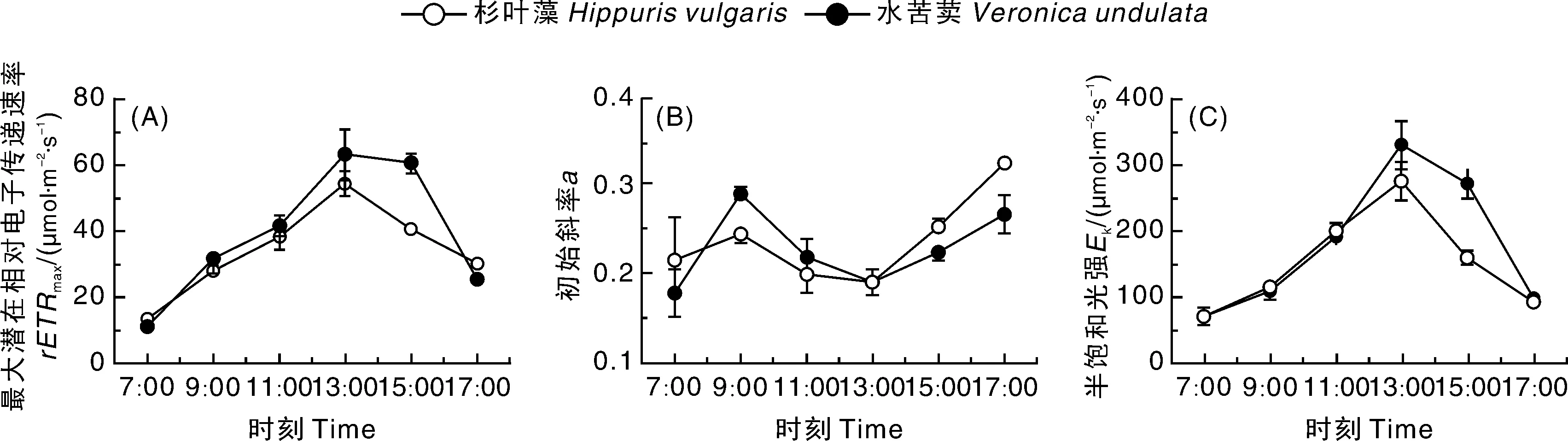
图3 杉叶藻和水苦荬最大潜在相对电子传递速率(A)、初始斜率(B)和半饱和光强(C)的日变化Fig.3 Diurnal variability in maximum relative electron transport rate (A), initial slope (B) and half-saturation light intensity (C) of Hippuris vulgaris and Veronica undulate
从图4-A可以看出,杉叶藻和水苦荬的Fv/Fm的日变化趋势相似,在7:00最高,之后逐渐降低,分别在11:00和13:00降至最低值,午后逐渐恢复,17:00,2种沉水植物的Fv/Fm均未恢复到清晨水平。杉叶藻和水苦荬ΦPSⅡ的日变化近似“V”型,早晚最大,午间最低。因为夜间和清晨PAR较弱,几乎处于开放状态的PSⅡ吸收的光能可以完全用于光化学反应,光能捕获效率较高[14];随着PAR逐渐增加,吸收的光能已经相对过剩,不能完全吸收,ΦPSⅡ相对下降,出现光抑制的现象,杉叶藻的ΦPSⅡ在11:00达到低谷,而水苦荬的ΦPSⅡ在13:00达到低谷;随后PAR迅速下降,光抑制的情况得到缓解,所以ΦPSⅡ又逐渐上升,17:00,杉叶藻和水苦荬的ΦPSⅡ均未恢复到清晨水平(图4-B)。水苦荬的Fv/Fm和ΦPSⅡ的日均值都显著高于杉叶藻(P<0.05)。
2.2.3 光化学淬灭和非光化学淬灭的日变化
qP反映了PSⅡ反应中心的开放程度,又在一定程度上代表PSⅡ天线色素吸收光能用于光化学电子传递的份额。从图5-A可以看出,杉叶藻和水苦荬qP日变化相似,二者均呈现出先增大后减小再增大的趋势,7:00—9:00逐渐上升,之后随着光强的增强qP迅速降低,并在13:00出现谷底,随后呈现上升趋势,17:00由于光强的持续降低,反应中心由半关闭状态逐渐变为打开状态。杉叶藻和水苦荬的NPQ日变化趋势也一致,7:00—9:00逐渐降低,之后随着PAR的逐渐增强呈上升趋势,在13:00达到一天中的峰值,之后逐渐降低(图5-B)。水苦荬qP和NPQ日均值均极显著高于杉叶藻(P<0.01)。
2.2.4 荧光诱导曲线
在弱光(190 μmol·m-2·s-1)和强光(1 150 μmol·m-2·s-1)下,杉叶藻和水苦荬的qP和NPQ均有显著性差异(P<0.05),水苦荬的qP和NPQ显著高于杉叶藻(图6)。
2.3 两种沉水植物的叶绿素含量和生物量
由表1可知,杉叶藻的叶绿素a、叶绿素b、叶绿素(a+b)含量均显著大于水苦荬,但是水苦荬的生物量显著大于杉叶藻,2种沉水植物的叶绿素a/b没有显著性差异。
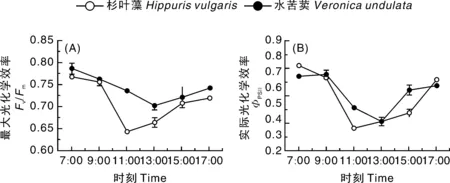
图4 杉叶藻和水苦荬最大光化学效率(A)和实际光化学效率(B)的日变化Fig.4 Diurnal variability in maximum photochemical efficiency (A) and actual photochemical efficiency (B) of Hippuris vulgaris and Veronica undulate
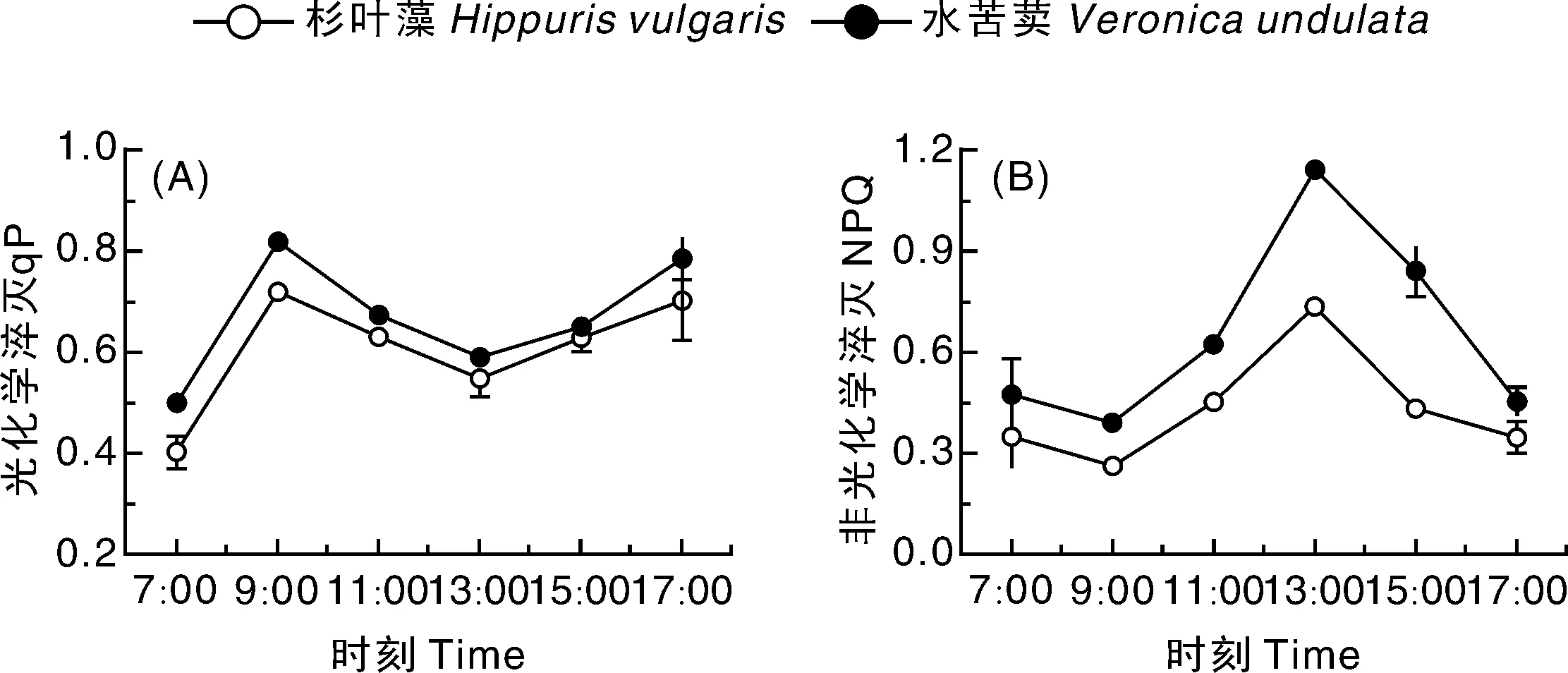
图5 杉叶藻和水苦荬光化学淬灭(A)和非光化学淬灭(B)的日变化Fig.5 Diurnal variability in photochemical quenching (A) and non-photochemical quenching (B) of Hippuris vulgaris and Veronica undulate
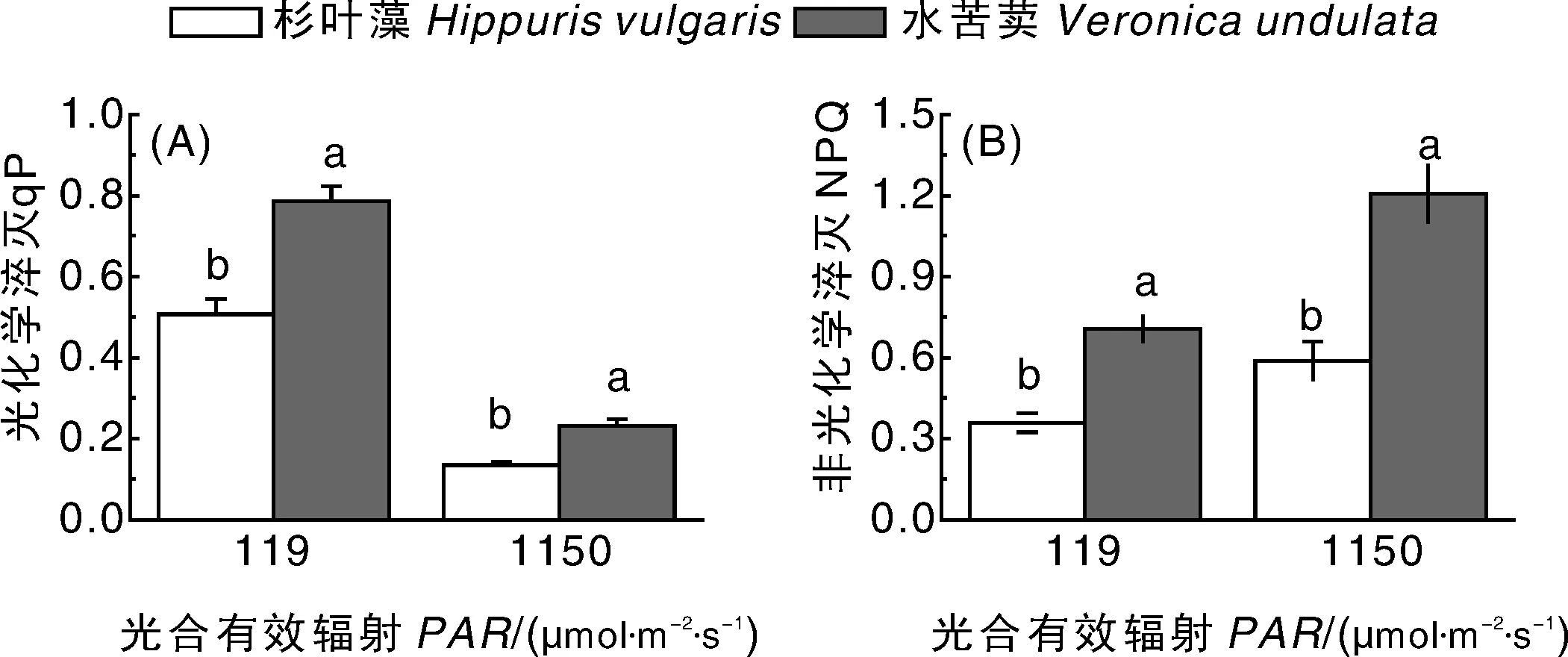
图6 在低光和高光强下杉叶藻和水苦荬的光化学淬灭(A)和非光化学淬灭(B)Fig.6 Photochemical quenching (A) and non-photochemical quenching (B) of Hippuris vulgaris and Veronica undulate under low and high light
表1 芳草海2种沉水植物的叶绿素含量和生物量
Table 1 Chlorophyll content and biomass of two submerged macrophytes in Grass lakes

植物叶绿素a/(mg·g-1)Leafchlorophylla叶绿素b/(mg·g-1)Leafchlorophyllb叶绿素(a+b)/(mg·g-1)Leafchlorophyll(a+b)叶绿素a/bChlorophylla/b生物量Biomass/(g·m-2)杉叶藻Hippurisvulgar-is0.69±0.05a0.27±0.03a0.96±0.07a2.77±0.36a564.32±48.34b水苦荬Veronicaundulata0.34±0.02b0.12±0.02b0.47±0.03b3.25±0.54a875.43±53.42a
注: 表中数据为平均值±标准差,同列数据后无相同小写字母表示差异显著(P<0.05)。
3 结论与讨论
植物的相对电子传递速率表示植物吸收的光能沿光合电子传递链被传递利用了多少,很大程度上反映了植物光合作用的能力[15]。本研究结果显示,无论是最大潜在相对电子传递速率rETRmax还是半饱和光强Ek,水苦荬都明显高于杉叶藻,表明水苦荬的光合作用能力大于杉叶藻,对强光耐受能力强,这个结果与Fv/Fm的测定结果相符合(图4)。杉叶藻较低的Ek和弱光下较高的α,表明尽管杉叶藻对强光的耐受能力较低,但它在低光强下的光能利用效率较高,可以在低光照下更有效地利用光能进行光合作用。叶绿素含量(表1)也证实了这一点,Chla主要功能是将汇聚的光能转变为化学能进行光化学反应,体内相对较高的Chla含量可以保证植物体对光能的充分利用,提高转化率[16];而Chlb是捕光色素蛋白复合体的重要组成部分,主要作用是捕获和传递光能,Chlb含量相对增加可以保证叶片在弱光照环境中吸收更多的光能用于光合作用,这是植株叶片处于弱光环境下维持正常的光合作用所必需的[17]。杉叶藻Chla和Chlb含量均高于水苦荬,可使杉叶藻在弱光强下更有效地吸收光能,从而有利于植物进行光合作用,是植物对弱光环境的一种适应。水苦荬和杉叶藻的Chla、Chlb与Ek呈显著负相关(P<0.05),与α呈显著正相关(P<0.05),表明在光能充沛的高原地区,水生植物降低叶绿素含量,减少了过剩光能进入光合系统从而产生细胞亚结构氧化伤害的潜在危险,其耐受强光能力增强[18];叶绿素含量升高则有利于水生植物在弱光强下更有效地吸收光能,提高光能利用率。另外,水苦荬的生物量显著高于杉叶藻,2种沉水植物的生物量均与rETRmax呈显著正相关(P<0.05),水苦荬较高的光合速率使其生物量较大。
随着PAR不断增强,水苦荬和杉叶藻的Fv/Fm和ΦPSⅡ都呈现出“V”型变化趋势,Fv/Fm和ΦPSⅡ分别在13:00和11:00降至最低,表明在午间这2种沉水植物均出现了光抑制。同时水苦荬Fv/Fm、ΦPSⅡ均高于杉叶藻,表明水苦荬的量子产量较高,且传递较顺畅。水苦荬的叶片明显大于杉叶藻,所以水苦荬可以截获更多光照,导致其叶温更高。在强光合有效辐射和高温下,水苦荬的光化学活性高于杉叶藻[19],所以水苦荬抗光抑制的能力较强,其Fv/Fm推迟1 h达到一天中的最低值。水苦荬具有较高的Fv/Fm和较低Chlb,其Chlb与Fv/Fm呈显著负相关(P<0.05),表明叶片的潜在活性越高,光合机构对光能的捕获能力越低,这对于避免因吸收过量光能而导致光抑制具有重要意义[20]。傍晚时2种沉水植物的Fv/Fm、ΦPSⅡ均未恢复早晨水平,这可能由于九寨沟是高海拔地区,加上湖泊水体透明度高,具有低水温、强PAR和UV-B所致。Franklin[21]研究表明,低温将进一步加剧UV-B对Fv/Fm的负面影响。
水苦荬qP日平均值高于杉叶藻,表明水苦荬的PSⅡ开放部分比例较高,具有较高的光能转换效率和电子传递活性。九寨沟位于青藏高原东缘,由图5可知,芳草海的2种沉水植物经过夜间低Tw后,清晨刚接受微弱的PAR,低温促使PSⅡ光合电子传递活性被抑制,从而导致PSⅡ反应中心开放数目下降,吸收的光能以热的形式耗散掉而不能用于光合电子传递[22],所以低温弱光促使7:00出现较低qP和较高NPQ。7:00—9:00,随着PAR的增强和温度的上升,低温对PSⅡ光化学效率和电子传递活性的抑制作用得到缓解,使得qP上升而NPQ下降。9:00—13:00因PAR过强,PSⅡ的开放中心数目减少,PSⅡ反应中心捕获的光能用于光化学电子传递份额也降低,通过NPQ等非光化学途径充分启动叶片对光合机构的自我保护机制,防止过剩激发能对光合机构的破坏,表现为qP下降NPQ上升。13:00之后随着PAR的降低,之前因强光处于半关闭状态的PSⅡ反应中心逐渐向开放状态转化,qP呈上升趋势,NPQ逐渐降低。2种沉水植物的NPQ日变化表明,温度过高或者夜间低温均可以引起光抑制,导致NPQ上升,这可能抑制了参与光反应的对温度敏感的酶,通过热耗散释放多余的光能,可以保护PSⅡ反应中心免受光破坏。在低光和高光强下,芳草海水苦荬的qP和NPQ均大于杉叶藻,进一步表明水苦荬具有较高的光合能力和对强PAR的耐受能力,光保护能力更强,对九寨沟环境具有较强的适应性。
综上所述,水苦荬rETRmax、Ek、qP和NPQ显著高于杉叶藻,表明水苦荬有着比杉叶藻更高的光合能力和耗散过剩光能的能力,对强光耐受能力和光保护能力更强,表现出对当地环境更强的适应性;杉叶藻具有较高的α和Chlb,以及较低Ek值,有利于其在弱光强下更有效地吸收光能,对低光强下的光能利用效率高,更适合在低光条件下生长。若九寨沟湖泊沼泽化进一步加剧,湖水变浅,PAR增强,有利于高光合能力和耐受强光的水生植物的生长,从而将促进水苦荬大量生长。因此,需要进一步研究沼泽化优势植物群落初级生产力的时空格局变化规律,进而结合生态清淤,通过收割法合理调控水生植物初级生产力,来达到有效控制湖泊沼泽化进程的目的。
[1] EDWARDS M S, KWANG Y K. Diurnal variation in relative photosynthetic performance in giant kelpMacrocystispyrifera(Phaeophyceae, Laminariales) at different depths as estimated using PAM fluorometry [J].AquaticBotany, 2010, 92(2): 119-128.[2] CAMPBELL S J, MCKENZIE L J, KERVILLE S P. Photosynthetic responses of seven tropical seagrasses to elevated seawater temperature [J].JournalofExperimentalMarineBiology&Ecology, 2006, 330(2): 455-468.
[3] NI L Y. Effects of water column nutrient enrichment on the growth ofPotamogetonmaackianusA. Been [J].JournalofAquaticPlantManagement, 2001, 39(1): 83-87.
[4] 杨鑫, 孙淑雲, 柏祥, 等. 水深梯度对苦草(Vallisnerianatans)光合荧光特性的影响[J]. 湖泊科学, 2014, 26(6): 879-886. YANG X, SUN S Y, BAI X, et al. Influences of water depth gradient on photosynthetic fluorescence characteristics ofVallisnerianatans[J].JournalofLakeSciences, 2014, 26(6): 879-886. (in Chinese with English abstract)
[5] 丁柳丽, 刘露, 邹定辉. 不同温度与CO2浓度对坛紫菜生长和光合作用温度反应特性的影响[J]. 生态科学, 2013, 32(2): 151-157. DING L L, LIU L, ZOU D H. Effects of different temperature and CO2concentrations on the growth and photosynthetic response to temperature inPorphyrahaitanensis[J].EcologicalScience, 2013, 32(2): 151-157. (in Chinese with English abstract)
[6] 马婷, 王国祥, 李强, 等. 富营养化水体中菹草光合荧光特性研究[J]. 生态环境, 2007, 16(3): 758-761. MA T, WANG G X, LI Q, et al. The growth ofPotamogetoncrispusin the eutrophication water [J].EcologyandEnvironment, 2007, 16(3): 758-761. (in Chinese with English abstract)[7] 甘建军. 九寨沟核心景区水循环系统研究[D]. 成都: 西南交通大学,2007. GAN J J. A system study on the geological environment and water cycle at the Jiuzhaigou vally [D]. Chengdu: Southwest Jiaotong University, 2007. (in Chinese with English abstract)
[8] 王辰, 刘全儒, 张潮. 北京水生维管植物群落调查[J]. 北京师范大学学报(自然科学版), 2004, 40(3): 380-385. WANG C, LIU Q R, ZHANG C. A study on communities of aquatic vascular plants in Beijing [J].JournalofBeijingNormalUniversity(NaturalScience), 2004, 40(3): 380-385.(in Chinese with English abstract)
[9] RALPH P J, GADEMANN R. Rapid light curves: A powerful tool to assess photosynthetic activity [J].AquaticBotany, 2005, 82(3): 222-237.
[10] PLATT T, GALLEGOS C L, HARRISON W G. Photoinhibition of photosynthesis in natural assemblages of marine phytoplankton [J].JournalofMarineResearch, 1980, 38(4): 687-701.
[11] ROHACEK K. Chlorophyll fluorescence parameters. The definitions, photosynthetic meaning and mutual relationships [J].Photosynthetica, 2002, 40(1): 13-29.[12] ARNON D I. Copper enzymes in isolated chloroplasts. Polyphenoloxidase inBetavulgaris[J].PlantPhysiology, 1949, 24(1): 3-15.
[13] GENTY B, BRIANTAIS J M, BAKER N R. The relationship between the quantum yield of photosynthetic electron transport and quenching of chlorophyll fluorescence [J].BiochimicaetBiophysicaActa, 1989, 990(1): 87-92.
[14] VREDENBERG W, DURCHAN M, PRASIL O. Photochemical and photoelectrochemical quenching of chlorophyll fluorescence in photosystem II [J].BiochimicaetBiophysicaActa, 2009, 1787(12): 1468-1478.
[15] HARRISON P J, PARSLOW J S, Conway H L. Determination of nutrient uptake kinetic parameters: A comparison of methods [J].MarineEcologyProgressSeries, 1989, 52(3): 301-312.
[16] 衣艳君, 李芳柏, 刘家尧. 尖叶走灯藓(Plagiomniumcuspidatum) 叶绿素荧光对复合重金属胁迫的响应[J]. 生态学报, 2008, 28(11): 5437-5444. YI Y J, LI F B, LIU J Y. Physiological response of chlorophyll fluorescence in mossPlagiomniumcuspidatumto mixture heavy metal solution [J].ActaEcologicaSinica, 2008, 28(11): 5437-5444. (in Chinese with English abstract)
[17] 沈宗根, 陈翠琴, 王岚岚, 等. 3种石斛光合作用和叶绿素荧光特性的比较研究[J]. 西北植物学报, 2010, 30(10): 2067-2073. SHEN Z G, CHEN C Q, WANG L L, et al. Photosynthesis and chlorophyll fluorescence characteristics of threeDendrobiumspecies [J].ActaBotanicaBoreali-OccidentaliaSinica, 2010, 30(10): 2067-2073.(in Chinese with English abstract)[18] ZHOU J L, WU Y, KANG Q S, et al. Spatial variations of carbon, nitrogen, phosphorous and sulfur in the salt marsh sediments of the Yangtze Estuary in China [J].Estuarine,CoastalandShelfScience, 2007, 71(1): 47-59.
[19] CUI X Y, TANG Y H, GUA S. Photosynthetic depression in relation to plant architecture in two alpine herbaceous species [J].EnvironmentalandExperimentalBotany, 2003, 50(2): 125-135.
[20] 赵广东, 刘世荣, 马全林. 沙木蓼和沙枣对地下水位变化的生理生态响应Ⅰ.叶片养分、叶绿素、可溶性糖和淀粉的变化[J]. 植物生态学报, 2003, 27(2): 228-234. ZHAO G D, LIU S R, MA Q L. Ecophysiological responses of two xerophytesAtraphaxisfrutescensandElaeagnusangustifoliato the change of groundwater depth in arid areaⅠ. Changes in leaf nutrient, chlorophyll, soluble sugar and starch contents [J].ChineseJournalofPlantEcology, 2003, 27(2): 228-234. (in Chinese with English abstract)
[21] FRANKLIN L A. The effects of temperature acclimation on the photoinhibitory responses ofUlvarotundataBlid [J].Planta, 1994, 192(3): 324-331.
[22] 周艳虹, 黄黎锋, 喻景权. 持续低温弱光对黄瓜叶片气体交换、叶绿素荧光淬灭和吸收光能分配的影响[J]. 植物生理与分子生物学报, 2004,30(2): 153-160. ZHOU Y H, HUANG L F, YU J Q. Effects of sustained chilling and low light on gas exchange, chlorophyll fluorescence quenching and absorbed light allocation in cucumber leaves [J].JournalofPlantPhysiologyandMolecularBiology, 2004, 30(2): 153-160. (in Chinese with English abstract)
(责任编辑 侯春晓)
Comparison of chlorophyll fluorescence characteristics between two submerged macrophytes in Jiuzhaigou National Nature Reserve
GAO Li’nan
(CollegeofTourismandEconomicManagement,ChengduUniversity,Chengdu610106,China)
TheVeronicaundulataandHippurisvulgarisin Jiuzhaigou were selected to examine diurnal variations of the maximum photochemical efficiency (Fv/Fm) and actual photochemical efficiency (ΦPSⅡ) of PSⅡ, relevant parameters of rapid light curves (RLCs), photochemical quenching (qP) and non-photochemical quenching (NPQ) using pulse-amplitude modulated fluorometer (Junior-PAM) in Grass Lake. The purpose was to investigate the photosynthetic characteristics of these two submerged macrophytes and their adaptive strategies against environmental in alpine lakes. The results showed that the diurnal variations ofVeronicaundulataandHippurisvulgarisof maximum relative electron transport rate (rETRmax) and half-saturation light intensity (Ek) presented typical unimodal curve. TheFv/FmandΦPSⅡof two submerged macrophytes showed V pattern diurnal cycle,Fv/FmandΦPSⅡwere the highest at sunrise and sunset and the lowest at noon. The daily averages ofrETRmax,Ek, qP and NPQ ofVeronicaundulatawere significantly greater than those ofHippurisvulgaris. Therefore,Veronicaundulatawas macrophytes with strong capacity of light energy utilization and dissipation. A higher initial slope (α), chlorophyll b (Chlb) content and lowerEkinHippurisvulgarisimplied that it had higher capture light capacity and photosynthetic efficiency under weak light condition. In summary, significant differences in chlorophyll fluorescence parameters were found betweenVeronicaundulataandHippurisvulgaris, andVeronicaundulatadisplayed more tolerance to strong light intensity thanHippurisvulgaris, it had a stronger ability for adaptation to local environment.Key words: rapid light curves; submerged macrophytes;Veronicaundulata;Hippurisvulgaris; photochemical quenching
10.3969/j.issn.1004-1524.2017.06.13
2016-12-21
高等学校学科创新引智计划项目(B08037)
高丽楠(1983—),女,内蒙古呼伦贝尔人,博士,讲师,主要从事植物生理生态学研究。E-mail:gaolinan20081212@163.com
X173
A
1004-1524(2017)06-0951-08
——以武汉紫阳湖为例

