水稻冷激蛋白基因OsCSP2启动子的克隆与分析
肖文斐,倪 深,裘劼人,王淑珍,忻 雅,阮松林,*
(1.杭州市农业科学研究院 生物技术研究所,浙江 杭州 310024; 2.中国水稻研究所 水稻生物学国家重点实验室,浙江 杭州 310006)
水稻冷激蛋白基因OsCSP2启动子的克隆与分析
肖文斐1,倪 深2,裘劼人1,王淑珍1,忻 雅1,阮松林1,*
(1.杭州市农业科学研究院 生物技术研究所,浙江 杭州 310024; 2.中国水稻研究所 水稻生物学国家重点实验室,浙江 杭州 310006)
为了解水稻冷激蛋白基因OsCSP2的功能,对其启动子序列和表达模式进行了分析。利用PCR技术从水稻耐盐品种汕优10号中克隆该启动子片段,命名为Poscsp2。通过构建Poscsp2驱动的GUS融合表达载体转化水稻,利用组织化学染色及荧光定量PCR方法,分析低温和高盐胁迫下OsCSP2的表达模式。启动子序列分析表明,Poscsp2序列包含大量与低温、高盐等多种逆境胁迫相关的顺式表达元件。组织化学染色和荧光定量PCR结果显示,在低温及高盐胁迫处理后,GUS报告基因和OsCSP2基因表达水平显著升高。说明Poscsp2可以显著提高在高盐及低温条件下下游基因的表达水平。
水稻;OsCSP2;启动子;低温胁迫;高盐胁迫
盐碱化、低温冷害、干旱等逆境胁迫严重威胁水稻(OryzasativaL.)的生产[1],利用植物抗逆基因资源进行作物育种改良是解决这一问题的最有效途径之一,而深入研究抗逆相关基因表达的分子机制,剖析其在植物逆境胁迫应答中的作用,对抗逆品种的培育具有积极的促进作用[2-3]。
冷激蛋白是广泛存在于生物体中的一种高度保守的应激蛋白。植物冷激蛋白在冷适应、生长发育及对抗干旱、高温、病害等其他多种逆境胁迫中发挥重要作用[4-5]。小麦冷激蛋白基因WCSP1受冷胁迫特异诱导[6],拟南芥冷激蛋白基因AtCSDP1、AtCSDP2能响应低温、高盐等逆境胁迫,超量表达AtCSDP1、AtCSDP2及AtCSDP3,可以增强植株抗低温能力;同时AtCSDP2超表达植株耐盐和抗旱能力提高[7-9]。有研究表明,低温、干旱及ABA处理能诱导水稻冷激蛋白基因OsCSP2上升表达[10],预示其可能在水稻对这些逆境胁迫的应答中具有重要作用,而其表达调控机制目前尚不明确。基因启动子作为顺式作用元件,在基因的表达调控中起着非常重要的作用[11]。因此,深入地研究OsCSP2基因启动子的表达模式和功能,对于了解OsCSP2在水稻逆境胁迫应答中的功能具有重要意义。本研究通过生物信息学方法对水稻冷激蛋白基因OsCSP2启动子的序列和表达特性进行分析,构建其与GUS基因融合表达载体并转化水稻,通过组织化学染色检测该启动子逆境胁迫下的启动活性和特异性。同时,对逆境胁迫下OsCSP2基因的表达模式进行研究,为阐明该基因在逆境胁迫下的分子作用机制奠定基础。
1 材料与方法
1.1 材料
1.1.1 植物材料
水稻(OryzasativaL.)耐盐杂交稻品种汕优10号,购于浙江勿忘农种业股份有限公司;水稻(OryzasativaL.)品种爱知旭由中国水稻所重点实验室提供,该品种为粳型常规稻,对盐胁迫较敏感。
1.1.2 载体与菌株
载体质粒pCAMBIA1391由杭州市农业科学研究院植物分子生物学实验室保存提供,TA克隆载体质粒pMD18-T,大肠埃希菌菌株DH5α和根癌农杆菌菌株(Agrobacteriumtumefaciens)EHA105均购自TaKaRa公司。
1.1.3 试剂
各种限制性内切酶和聚合酶购自TaKaRa公司;质粒回收、胶回收试剂盒购自Promega公司;氯仿、无水乙醇等为国产分析纯。
1.2 方法
1.2.1OsCSP2基因启动子的克隆及载体的构建
根据OsCSP2基因上游的启动子序列设计引物PF (5′-GATTGGTACCGTTACAACATTGCGGC-3′)和PR (5′-GATTAGATCTGGGAGTGGAAGCGA-3′),引物上分别加入了KpnⅠ和BglⅡ酶切位点,引物由生工生物工程(上海)股份有限公司合成。以水稻品种汕优10号的基因组DNA为模板,PCR扩增OsCSP2基因启动子Poscsp2,扩增条件为:95 ℃预变性5 min;95 ℃变性30 s,58 ℃退火30 s,72 ℃延伸2 min,35个循环;72 ℃延伸10 min。将PCR扩增产物与TA克隆载体pMD18-T连接,通过酶切筛选阳性克隆,再经测序验证有无碱基突变。用限制性内切酶KpnⅠ和BglⅡ消化带有Poscsp2区段的阳性克隆和携带GUS基因的载体pCAMBIA1391,连接构建成含有Poscsp2融合GUS基因的植物表达载体,命名为Poscsp2-GUS(图1)。
1.2.2 农杆菌介导的水稻遗传转化
参照林拥军等[12]的转化方法,利用热激法将构建好的转化载体Poscsp2-GUS转入根癌农杆菌EH105A,侵染水稻品种爱知旭的胚性愈伤组织。利用潮霉素筛选出抗性愈伤,经分化生根后得到转基因植株。
1.2.3 逆境处理
把萌发21 d后的Poscsp2-GUS转基因水稻植株分别经过100 mmol·L-1NaCl[13]溶液处理或4 ℃冷处理24~48 h[14]。
1.2.3 GUS组织化学染色
参照Jefferson等[15]提出的方法进行GUS组织化学染色。取转基因水稻的组织切成适当大小,浸入适量染色液[1 mmol·L-1磷酸缓冲液、0.5% Triton-100、0.5 mg·mL-1X-Gluc、0.5 mmol·L-1K3Fe(CN)6、0.5 mmol·L-1K4Fe(CN)6·3H2O,pH 7.0]中,抽真空10 min,37 ℃染色过夜。75%乙醇脱色处理,至阴性对照材料呈白色。
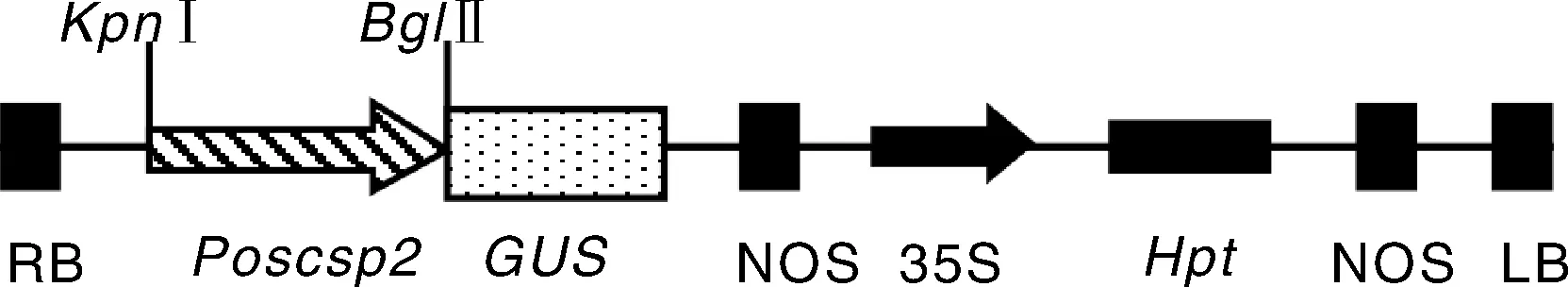
图1 表达载体Poscsp2-GUS示意图Fig.1 The schematic diagram of construct Poscsp2-GUS
1.2.4 荧光定量RT-PCR分析
采用TRIzol(Invitrogen life technologies, 美国)抽提水稻总RNA,具体步骤依据试剂说明书进行。利用反转录及荧光定量PCR试剂盒(购于TaKaRa公司)分析基因表达量。OsCSP2基因的检测引物为CSP1-2F (5′-GAGTGCCCCAGCAAGACCTA-3′)和CSP1-2R(5′-TCTCTCAAACCGACCCAACG-3′);水稻actin内参基因引物为actinF (5′-GACCTTGCTGGGCGTGAT-3′) 和actinR(5′-GTCATAGTCCAGGGCGATGT-3′)。实时荧光定量RT-PCR检测仪器为Bio-Rad opticon 2,PCR扩增反应体系:cDNA 2 μL、2×SYBR Premix ExTaq12.5 μL、上游引物(10 μmol·L-1) 0.5 μL、下游引物(10 μmol·L-1) 0.5 μL、ddH2O 9.5 μL ;PCR扩增条件:95 ℃预变性5 min;94 ℃变性30 s,58 ℃退火30 s,72 ℃延伸25 s,30个循环;72 ℃延伸10 min。
2 结果和分析
2.1OsCSP2基因启动子片段的扩增与序列分析
根据NCBI 中提供的水稻品种93-11(OryzasativaL. cv. 93-11)基因组序列,选取OsCSP2基因起始位点上游约2 kb序列设计特异引物,以水稻品种汕优10号的基因组DNA为模板进行PCR扩增,克隆OsCSP2基因启动子片段Poscsp2。PCR产物通过1%琼脂糖凝胶电泳检测,获得1条约1 900 bp的特异条带(图2)。对该扩增片段测序分析,结果表明,汕优10号中该区段序列与93-11同源度为99%,1 935 bp序列中共存在5个碱基差异。
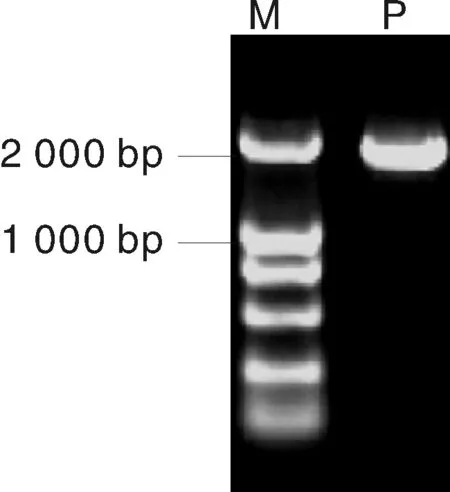
M, Marker DL2000;P, OsCSP2启动子片段M, Marker DL2000;P, OsCSP2 promoter图2 汕优10号OsCSP2启动子的扩增Fig.2 Amplification of OsCSP2 promoter from Shanyou10
2.2OsCSP2启动子顺式作用元件分析
应用PLACE Signal Scan program(http: //www.dna.affrc.go.jp/PLACE)软件对OsCSP2启动子Poscsp2中的顺式作用元件进行了预测。结果表明除了具有典型的TATA box和CAAT box外,Poscsp2还包含了大量与逆境胁迫相关的顺式作用元件(表1)。其中低温响应相关元件有28个,包括CRTDRE 2HVCBF2类元件2个,DRECRTCOREA元件6个,LTRE类元件12个,MYCCONSENSUSAT类元件8个;盐胁迫响应元件ACGTABREMOTIFA2OSM 和GT1GMSCAM4 各1个;ABRE、DRE等干旱和ABA应答相关元件26个、MYB转录因子结合位点15个、GT1CONSENSUS、WRKY71OS等水杨酸及生物胁迫相关元件42个、CURECORECR等铜离子及氧化胁迫相关元件10个,WBOXNTERF3等创伤胁迫相关元件4个。由以上结果推断,OsCSP2启动子的转录可能受到低温、高盐、干旱、病原菌等多种非生物和生物胁迫的影响。
2.3 转化载体的构建和转化植株的获得
由于PCR扩增Poscsp2的引物中引入了KpnⅠ和BglⅡ位点,故利用这两种限制性内切酶消化带有Poscsp2区段的阳性TA克隆质粒,与pCAMBIA1391连接,构建了Poscsp2-GUS融合基因的植物表达载体Poscsp2-GUS。通过农杆菌介导的遗传转化,将此载体转入水稻品种爱知旭,共获得30个转化株系。
2.4 高盐及低温胁迫下的GUS组织化学染色
为了研究OsCSP2启动子在高盐及低温胁迫下的表达情况,选取了2个Poscsp2-GUS纯合株系进行胁迫处理。将萌发21 d后的植株分别用100 mmol·L-1NaCl溶液处理或4 ℃冷处理后,进行组织化学染色。结果表明,经100 mmol·L-1NaCl溶液处理24 h及4 ℃低温处理24 h的转基因水稻叶片和根中的蓝色明显深于未经胁迫处理的对照样品,而野生型水稻则无蓝色染出。两个家系之间染色的强度稍有不同,但对逆境应答都表现出相同的趋势。以上结果表明,OsCSP2基因启动子在高盐或低温诱导条件下,能够明显增强GUS报告基因的表达。相对而言,高盐胁迫对该启动子诱导作用更强。
表1OsCSP2启动子逆境胁迫相关顺式作用元件分析
Table 1 Abiotic and biotic stress related cis-acting elements in promoter ofOsCSP2
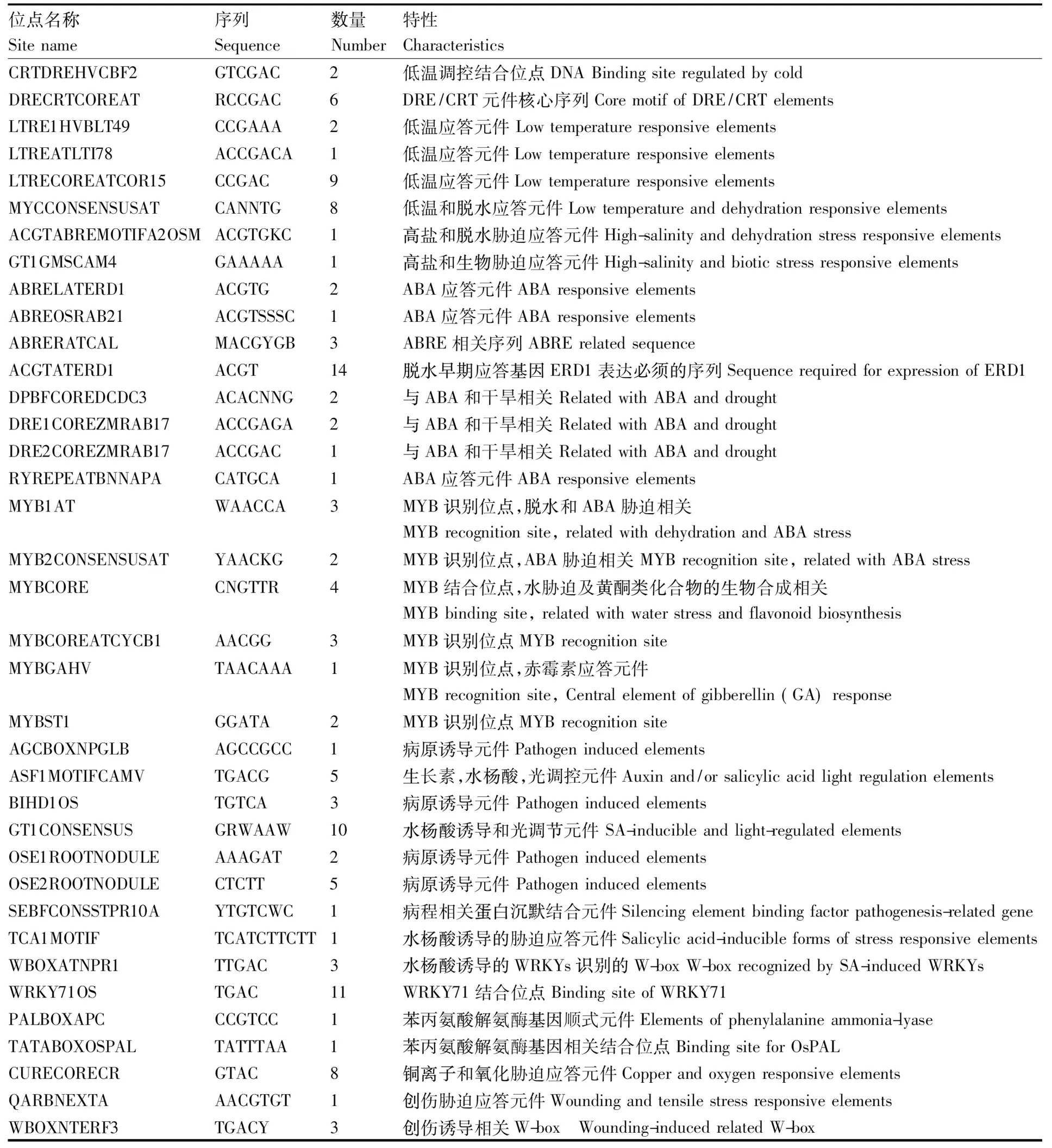
位点名称Sitename序列Sequence数量Number特性CharacteristicsCRTDREHVCBF2GTCGAC2低温调控结合位点DNABindingsiteregulatedbycoldDRECRTCOREATRCCGAC6DRE/CRT元件核心序列CoremotifofDRE/CRTelementsLTRE1HVBLT49CCGAAA2低温应答元件LowtemperatureresponsiveelementsLTREATLTI78ACCGACA1低温应答元件LowtemperatureresponsiveelementsLTRECOREATCOR15CCGAC9低温应答元件LowtemperatureresponsiveelementsMYCCONSENSUSATCANNTG8低温和脱水应答元件LowtemperatureanddehydrationresponsiveelementsACGTABREMOTIFA2OSMACGTGKC1高盐和脱水胁迫应答元件High-salinityanddehydrationstressresponsiveelementsGT1GMSCAM4GAAAAA1高盐和生物胁迫应答元件High-salinityandbioticstressresponsiveelementsABRELATERD1ACGTG2ABA应答元件ABAresponsiveelementsABREOSRAB21ACGTSSSC1ABA应答元件ABAresponsiveelementsABRERATCALMACGYGB3ABRE相关序列ABRErelatedsequenceACGTATERD1ACGT14脱水早期应答基因ERD1表达必须的序列SequencerequiredforexpressionofERD1DPBFCOREDCDC3ACACNNG2与ABA和干旱相关RelatedwithABAanddroughtDRE1COREZMRAB17ACCGAGA2与ABA和干旱相关RelatedwithABAanddroughtDRE2COREZMRAB17ACCGAC1与ABA和干旱相关RelatedwithABAanddroughtRYREPEATBNNAPACATGCA1ABA应答元件ABAresponsiveelementsMYB1ATWAACCA3MYB识别位点,脱水和ABA胁迫相关MYBrecognitionsite,relatedwithdehydrationandABAstressMYB2CONSENSUSATYAACKG2MYB识别位点,ABA胁迫相关MYBrecognitionsite,relatedwithABAstressMYBCORECNGTTR4MYB结合位点,水胁迫及黄酮类化合物的生物合成相关MYBbindingsite,relatedwithwaterstressandflavonoidbiosynthesisMYBCOREATCYCB1AACGG3MYB识别位点MYBrecognitionsiteMYBGAHVTAACAAA1MYB识别位点,赤霉素应答元件MYBrecognitionsite,Centralelementofgibberellin(GA)responseMYBST1GGATA2MYB识别位点MYBrecognitionsiteAGCBOXNPGLBAGCCGCC1病原诱导元件PathogeninducedelementsASF1MOTIFCAMVTGACG5生长素,水杨酸,光调控元件Auxinand/orsalicylicacidlightregulationelementsBIHD1OSTGTCA3病原诱导元件PathogeninducedelementsGT1CONSENSUSGRWAAW10水杨酸诱导和光调节元件SA-inducibleandlight-regulatedelementsOSE1ROOTNODULEAAAGAT2病原诱导元件PathogeninducedelementsOSE2ROOTNODULECTCTT5病原诱导元件PathogeninducedelementsSEBFCONSSTPR10AYTGTCWC1病程相关蛋白沉默结合元件Silencingelementbindingfactorpathogenesis-relatedgeneTCA1MOTIFTCATCT-TCTT1水杨酸诱导的胁迫应答元件Salicylicacid-inducibleformsofstressresponsiveele-mentsWBOXATNPR1TTGAC3水杨酸诱导的WRKYs识别的W-boxW-boxrecognizedbySA-inducedWRKYsWRKY71OSTGAC11WRKY71结合位点BindingsiteofWRKY71PALBOXAPCCCGTCC1苯丙氨酸解氨酶基因顺式元件Elementsofphenylalanineammonia-lyaseTATABOXOSPALTATTTAA1苯丙氨酸解氨酶基因相关结合位点BindingsiteforOsPALCURECORECRGTAC8铜离子和氧化胁迫应答元件CopperandoxygenresponsiveelementsQARBNEXTAAACGTGT1创伤胁迫应答元件WoundingandtensilestressresponsiveelementsWBOXNTERF3TGACY3创伤诱导相关W-box Wounding-inducedrelatedW-box
2.5 低温及高盐胁迫下OsCSP2基因的表达分析
为了更细致精确地剖析OsCSP2基因对高盐及低温胁迫的应答,本研究采用荧光定量RT-PCR法分析了水稻品种汕优10号胁迫处理后该基因的表达情况。结果如图4所示, 100 mmol·L-1NaCl溶液或4 ℃低温处理,能诱导OsCSP2基因增强表达。其中,高盐处理2 h就能诱导其上升表达,在处理24 h时达到3.5倍,而48 h表达量稍有下降;低温处理2 h时基因表达量未见明显变化,处理4 h时开始略有上升,到24 h上升到2.0倍左右,48 h后表达量达到2.4倍左右。由此可见,OsCSP2基因在高盐和低温胁迫都能增强表达,但对两种胁迫的响应模式不完全相同。此结果与Poscsp2-GUS的组织化学染色较为一致。
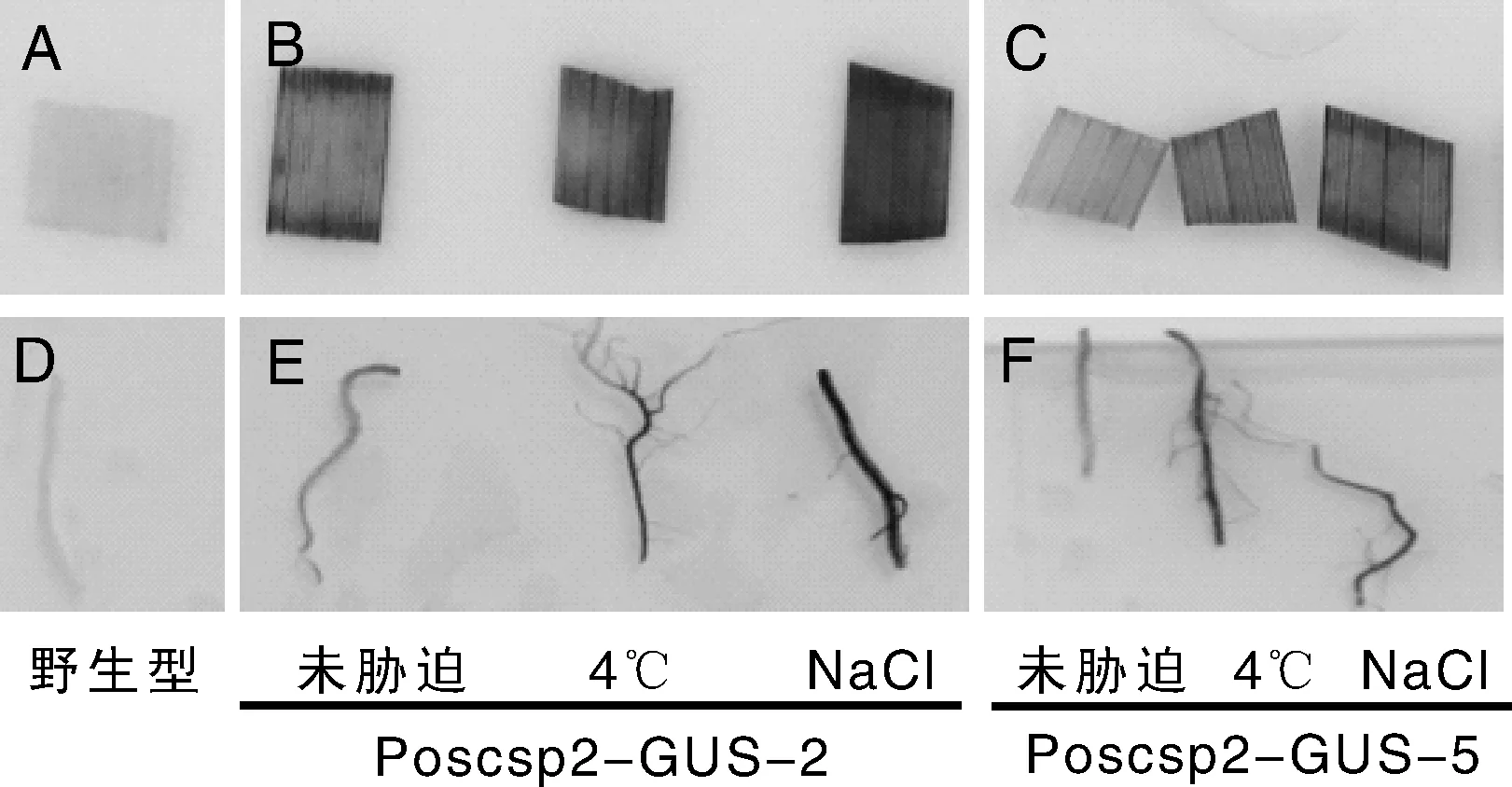
A, D:野生型;B,E:Poscsp2-GUS转基因家系2;C,F:Poscsp2-GUS转基因家系5A, D: wild type; B, E: Poscsp2-GUS transgenic line 2; C, F: Poscsp2-GUS transgenic line 5图3 转基因水稻低温和高盐胁迫后组织化学染色Fig.3 The histochemical GUS assay of transgenic rice after low temperature and high salt stress treatments
3 讨论
启动子是位于结构基因5’端上游的一段DNA序列,其区域内各种顺式作用元件与不同的反式作用因子间相互作用,共同调控下游基因转录的时空特异性及强度。植物启动子的研究有助于了解控制基因转录的模式及其调控机制,并有利于提高和改进外源目的基因的表达[16-18]。对OsCSP2基因启动子序列分析表明,Poscsp2中存在大量与低温、高盐、干旱等逆境胁迫响应相关顺式作用元件。其中有多个典型的CRT/DRE/LTRE元件,此类元件广泛存在于低温、高盐及脱水应答的一些诱导基因的启动子中。
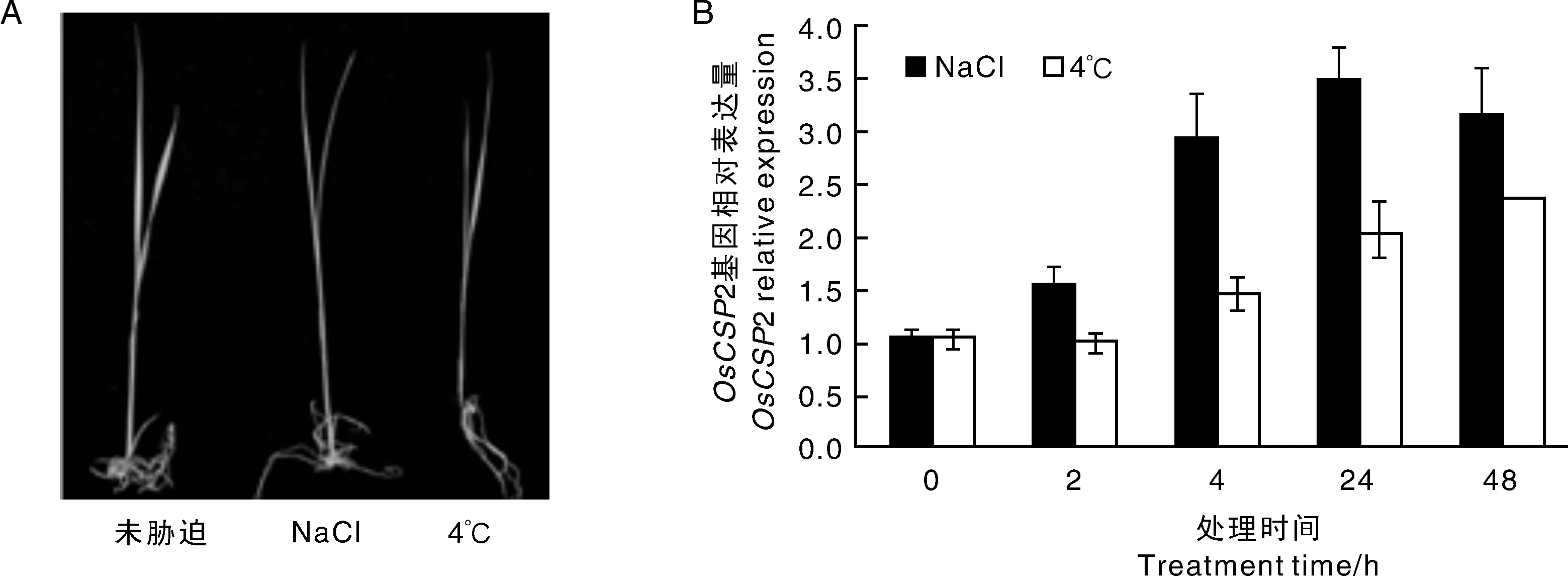
A, 汕优10号高盐和低温胁迫24 h的表型;B, OsCSP2基因表达分析A, Phenotype of Shanyou 10 under high salt and low temperature stress; B, Gene expression of OsCSP2图4 高盐和低温胁迫后OsCSP2基因表达分析Fig.4 The relative expression of OsCSP2 after low temperature and high salt stress treatment
本研究对启动子融合GUS的转基因水稻组织化学染色和荧光定量PCR检测结果证实了该启动子受低温及高盐诱导的调控特性。在正常条件下OsCSP2启动子驱动下游基因进行微量表达,而低温和高盐逆境条件能显著增强该启动子的启动能力,但两种条件下启动子的表达模式并不完全一致。其对高盐的响应更为快速,2 h就开始诱导上升,到24 h和48 h时还维持在较高的强度;而对低温的响应则稍微缓慢和微弱,可见该启动子对不同逆境信号的响应有所不同。
此外,Poscsp2还包含26个ABRE、DRE等与ABA应答相关元件。脱落酸ABA是一种重要的植物调节激素,干旱、寒冷、高温、盐渍和水涝等逆境都能使植物体内ABA迅速增加,而很多植物胁迫应答基因都受到ABA的诱导[19]。同时,在Poscsp2中共发现MYB、MYC结合位点23个,推测此类转录因子可能对OsCSP2启动子表达也有重要的调控作用。此外,在Poscsp2中还有WRKY71OS等水杨酸及生物胁迫相关元件42个、CURECORECR等铜离子及氧化胁迫相关元件10个,推测OsCSP2基因可能也参与了活性氧介导的植物抗病应答反应[20]。Poscsp2这种诱导型的启动子既可以避免下游基因持续高表达而产生的能量浪费,又可以及时响应外界刺激提高下游基因的表达水平,增强植物的耐逆性,在植物抗逆基因工程中有较好的应用价值。
[1] SUZUKI N, RIVERO R M, SHULAEV V, et al. Abiotic and biotic stress combinations[J].NewPhytologist, 2014, 203(1):32-43.
[2] ROY S J, TUCKER E J, TESTER M. Genetic analysis of abiotic stress tolerance in crops[J].CurrentOpinioninPlantBiology, 2011, 14 (3): 232-239.
[3] 刘春, 曹丽敏, 李玉中,等. 利用转基因途径提高植物非生物胁迫耐受性的研究进展[J]. 生物技术通报, 2013, 56(1):16-24. LIU C, CAO L M, LI Y ZH, et a1. Progress in the improvement of abiotic stress tolerance in plants using transgenie approaches[J].BiotechnologyBulletin, 2013,56(1):16-24. (in Chinese with English abstract)
[4] CHAIKAM V, KARLSON D T. Comparison of structure, function and regulation of plant cold shock domain proteins to bacterial and animal cold shock domain proteins[J].BMBReports, 2010, 43(1):1-8.
[5] KARLSIN D, IMAI R. Conservation of the cold shock domain protein family in plants [J].PlantPhysiology, 2003, 131(1): 12-15.
[6] KARLSON D, NAKAMINAMI K, TOYOMASU T, et al. A cold-regulated nucleic acid-binding protein of winter wheat shares a domain with bacterial cold shock proteins[J].JournalofBiologicalChemistry, 2002, 277(38):35248-35256.
[7] KIM M H, SASAKI K, IMAI R. Cold shock domain protein 3 regulates freezing tolerance inArabidopsisthaliana[J].JournalofBiologicalChemistry, 2009, 284(35):23454-23460.
[8] SASAKI K, KIM M H, IMAI R. Arabidopsis COLD SHOCK DOMAIN PROTEIN2 is a RNA chaperone that is regulated by cold and developmental signals [J].Biochemical&BiophysicalResearchCommunications, 2007, 364(3):633-638.
[9] SUJUNG P, KYUNGJIN K, TAETIN O, et al. Cold shock domain proteins affect seed germination and growth of Arabidopsis thaliana under abiotic stress conditions [J].PlantandCellPhysiology, 2009, 50(4):869-878.
[10] CHAIKAM V, KARLSON D. Functional characterization of two cold shock domain proteins fromOryzasativa[J].PlantCell&Environment, 2008, 31(7):995-1006.
[11] 文添龙, 刘雪梅, 冀亚萍,等. 高等植物胁迫诱导型启动子的研究进展[J]. 西北植物学报, 2014, 34(1):206-214. WEN T L, LIU X M, JI Y P, et al. Research progress of stress-induced promoter in higher plant[J].ActaBotanicaBoreali-OccidentaliaSinica, 2014, 34(1):206-214. (in Chinese with English abstract)
[12] 林拥军, 陈浩, 曹应龙, 等. 农杆菌介导的牡丹江8号高效转基因体系的建立[J]. 作物学报, 2002, 28(3):294-300. LIN Y J, CHEN H, CAO Y L, et al. Establishment of high-efficiency Agrobacterium-mediated genetic transformation system of Mudanjiang 8[J].ActaAgronomicaSinica, 2002, 28(3):294-300. (in Chinese with English abstract)
[13] 梅映学, 魏玮, 张诗婉,等. 干旱锻炼对盐胁迫下水稻幼苗根系抗氧化酶活性的影响[J]. 浙江农业学报, 2016, 28(8):1304-1308. MEI Y X, WEI W, ZHANG S W, et a1. Effect of PEG pretreatment on antioxidant enzymes activity under salt stress in root of rice seedling[J].ActaAgriculturaeZhejiangensis, 2016, 28(8):1304-1308. (in Chinese with English abstract)
[14] 胡晓晨, 张婷, 杨圣,等. 水稻冷胁迫响应基因OsSADMC功能标记的开发和利用[J]. 中国水稻科学, 2015, 29(5):475-480. HU X C, ZHANG T, YANG S, et al. Development and application of a functional marker for the cold stress responsive gene OsSADMC [J].ChineseJournalofRiceScience, 2015, 29(5):475-480. (in Chinese with English abstract)
[15] JEFFERSON R A, KAVANGH T A, BEVAN M W. GUS fusions: beta-glucuronidase as a sensitive and versatile gene fusion marker in higher plants[J].EMBOJournal, 1987, 6(13):3901-3907.
[16] 韦淑亚, 刘小东, 张莹莹,等. 水稻钙依赖型蛋白激酶OsCPK9基因启动子的克隆及在烟草中的瞬时表达分析[J]. 浙江农业学报, 2014, 26(2):261-267. WEI S Y, LIU X D, ZHANG Y Y, et a1. Cloning and transient expression analysis ofOsCPK9 gene promoter in rice (OryzasativaL.)[J].ActaAgriculturaeZhejiangensis, 2014, 26(2):261-267. (in Chinese with English abstract)
[17] 裴柳玲, 唐清, 张涛,等. 水稻胁迫相关基因OsPM1启动子的克隆与分析[J]. 西北植物学报, 2015, 35(11):2179-2184. PEI L L, TANG Q, ZHANG T, et al. Cloning and analysis of promoter of stress related gene OsPMl fromOryzasativa[J].ActaBotanicaBoreali-OccidentaliaSinica, 2015, 35(11):2179-2184. (in Chinese with English abstract)
[18] 郭晋艳, 郑晓瑜, 邹翠霞,等. 植物非生物胁迫诱导启动子顺式元件及转录因子研究进展[J]. 生物技术通报, 2011(4):16-20. GUO J Y, ZHENG X Y, ZOU C X, et a1. Research progress of cis-elements of abiotic stress inducible promoters and associated transcription factors[J].BiotechnologyBulletin, 2011(4):16-20. (in Chinese with English abstract)
[19] ABE H, URAO T, ITO T, et a1. Arabidopsis AtMYC2 (bHLH) and AtMYB2 (MYB) function as transcriptional activators in abscisic acid signaling[J].ThePlantCell, 2003, 15(1): 63-78.
[20] 宋钰, 荆邵娟, 余迪求. 水稻WRKY转录调控因子基因功能研究进展[J]. 中国水稻科学, 2009, 23(5):447-455. SONG Y, JING S J, YU D Q. Research progress on function analysis of riceWRKYgenes[J].ChineseJournalofRiceScience, 2009, 23(5):447-455. (in Chinese with English abstract)
(责任编辑 张 韵)
Cloning and analysis ofOsCSP2 gene promoter in rice (OryzasativaL.)
XIAO Wenfei1, NI Shen2, QIU Jieren1, WANG Shuzhen1, XIN Ya1, RUAN Songlin1,*
(1.InstituteofBiotechnology,HangzhouAcademyofAgriculturalScience,Hangzhou310024,China; 2.ChinaStateKeyLaboratoryofRiceBiology,ChinaNationalRiceResearchInstitute,Hangzhou310006,China)
To understand functional expression profiling of cold shock protein geneOsCSP2, the promoter sequence and expression ofOsCSP2 in rice were investigated. The promoter ofOsCSP2, named Poscsp2, was cloned from the salt tolerant rice cultivar Shanyou 10 using PCR. An expression vector containing the Poscsp2::GUS fusion gene was constructed and introduced into rice. The expression patterns of Poscsp2 under low temperature and high salt stress were analyzed by GUS histochemical staining and qRT-PCR. The results showed that Poscsp2 was predicted to contain a large number of cis elements associated with low temperature, high salinity and other stresses. Expression levels ofGUSreporter gene andOsCSP2 were significantly increased after low temperature and high salt stress treatment, indicating that Poscsp2 can improve expression levels of downstream genes under abiotic stresses.
rice;OsCSP2; promoter; cold stress; salt stress
10.3969/j.issn.1004-1524.2017.06.01
2016-12-19
国家自然科学基金项目(31301392)
肖文斐(1979—),女,湖南祁东人,博士,高级农艺师,主要研究方向为植物抗逆生物技术。E-mail:xiao_wenfei@126.com
*通信作者,阮松林,E-mail: ruansl1@hotmail.com
S511
A
1004-1524(2017)06-0857-07

