丁酸和戊酸互营氧化产甲烷微生物学研究进展
易 悦, 王慧中, 郑 丹, 苟 敏, 汤岳琴
(1.四川大学 建筑与环境学院环境 科学与工程系, 四川省环境保护有机废弃物资源化利用重点实验室, 四川 成都 610065; 2. 农业部沼气科学研究所, 四川 成都 610041)
丁酸和戊酸互营氧化产甲烷微生物学研究进展
易 悦1, 王慧中1, 郑 丹2, 苟 敏1, 汤岳琴1
(1.四川大学 建筑与环境学院环境 科学与工程系, 四川省环境保护有机废弃物资源化利用重点实验室, 四川 成都 610065; 2. 农业部沼气科学研究所, 四川 成都 610041)
丁酸和戊酸是产甲烷过程中重要的中间代谢产物,特别是在含蛋白废水的厌氧消化体系中,丁酸和戊酸是主要的中间代谢产物。研究互营丁酸和戊酸氧化分解的微生物学对于含蛋白废水的处理乃至厌氧消化体系稳定高效运行都是极其重要的。文章总结了目前已分离获得的丁酸和戊酸氧化菌,介绍了已知的丁酸和戊酸的氧化分解途径,同时概述了关于丁酸和戊酸互营氧化分解相关的微生物群落研究现状,对利用丁酸和戊酸产甲烷的微生物学研究的未来发展提出了建议。
丁酸; 戊酸; 互营脂肪酸氧化; 甲烷发酵; 厌氧消化
甲烷是微生物在严格厌氧条件下对有机物质进行氧化分解而产生的,是重要的温室气体,也是可再生清洁能源,在全球的碳循环中起着极其重要的作用。
微生物产甲烷过程可分为水解产酸、产氢产乙酸和产甲烷3个阶段。第1阶段由厌氧和兼性厌氧的水解和发酵细菌将纤维素、淀粉等水解成单糖,并进一步发酵生成各种有机酸、低级醇,H2及CO2;将蛋白质水解成氨基酸,并进一步发酵生成各种有机酸,释放氨,H2及CO2;将脂类水解为甘油和脂肪酸,进一步氧化分解生成有机酸、H2和CO2。第2阶段产氢产乙酸细菌氧化分解第1阶段产生的有机酸、低级醇,生成乙酸,H2和CO2。第3阶段由严格厌氧的产甲烷古菌完成,主要是氢营养型和乙酸营养型这两大类产甲烷古菌,乙酸营养型产甲烷菌直接利用乙酸产生甲烷,氢营养型产甲烷菌利用H2和CO2产生甲烷[1]。
C2~C5的脂肪酸是产甲烷过程中重要的中间代谢产物,目前研究较多的是乙酸和丙酸的互营氧化,而针对丁酸和戊酸的互营氧化研究相对较少。食品加工业废水含有较多蛋白质,在厌氧消化过程中,蛋白质水解发酵可生成各种有机酸[2]。不同的氨基酸分解生成的有机酸不同,其中,组氨酸、赖氨酸、苏氨酸、谷氨酸经过Stickland反应生成正丁酸,精氨酸、脯氨酸生成正戊酸,缬氨酸、亮氨酸和异亮氨酸则分别生成异丁酸、异戊酸和2-甲基丁酸[3]。有研究表明,在奶制品及肉制品加工厂废水的厌氧处理过程中,产生的乙酸约占总有机酸的30%,正丁酸约占20%,异丁酸约占7%,正戊酸、异戊酸、2-甲基丁酸则分别可以占到8%,16%,4%左右[4]。另有研究表明,丁酸和戊酸对于反应器的变化有更快的响应,这两种酸是最好的监测反应器性能的指标[5]。丁酸还是丙酸降解途径可能的中间产物,有研究表明,部分微生物能将丙酸转化为丁酸,再进一步氧化分解[6]。
因此,研究丁酸和戊酸氧化分解产甲烷的微生物学,对于含蛋白废水的处理以及厌氧消化反应系统稳定运行和调控都是极其重要的。
1 互营丁酸氧化菌与丁酸氧化分解途径
1.1 互营丁酸氧化菌
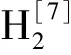
大部分互营丁酸氧化菌为弯曲杆状,生长pH值范围基本都接近中性,但从碱性环境中分离获得的Themosyntrophalipolytica最适生长pH值为碱性。互营丁酸氧化菌以中温菌居多,但从温泉中分离的Themosyntrophalipolytica和Syntrophothermuslipocalidus生长温度在45℃以上,而从永冻层土壤中分离的Algorimarinabutyrica生长温度必须低于25℃。在一些极端环境中可能还有很多具有丁酸氧化功能的菌株没有被发现,目前分离出的菌株只是冰山一角,为了能更好的了解丁酸在不同生态环境下的氧化情况,有必要进行深入研究。
目前分离培养的互营丁酸氧化菌都能与氢营养型的产甲烷菌互营共生,少部分氧化菌还能与硫酸盐还原菌共培养。大部分的丁酸氧化菌除了能利用丁酸之外,还能利用戊酸等其它大于5个碳的脂肪酸作为电子供体,产物主要为乙酸、丙酸和H2。一部分氧化菌能在含巴豆酸的基质上单独生长,因此巴豆酸通常被用来进行丁酸氧化菌的分离培养。
除了表1总结的互营丁酸氧化菌外,从盐碱湖分离获得的Desulfobotulusalkaliphilus[8],从污水处理场沉积污泥分离获得的Desulfovibriobutyratiphilus[9],从处理造纸废水的中温UASB厌氧污泥中分离获得的Desulfatirhabdiumbutyrativorans[10]和从河口沉积物中分离到的Desulfolunabutyratoxydans[11],能以硫酸、硫代硫酸盐和亚硫酸盐等为电子受体,将丁酸进行氧化分解,产物为乙酸,其中,Desulfatirhabdiumbutyrativorans还能进一步将乙酸分解为H2和CO2。

表1 互营丁酸和戊酸氧化菌

表1(续) 互营丁酸和戊酸氧化菌
注:①Syntrophomonasbryantii最初被命名为Clostridiumbryantii(Stieb and Schink 1985),之后基于16S rRNA基因序列,重命名为Syntrophomonasbryantii。
1.2 丁酸氧化途径
从表2可以看出正丁酸和异丁酸氧化分解生成乙酸的标准吉布斯自由能均大于0。为了使丁酸能够顺利被氧化,该反应需要与产甲烷反应进行耦合,将反应产物H2分压降低,使实际吉布斯自由能减小,才能保证反应的顺利进行。部分硫酸盐还原菌也能利用丁酸降解产生的H2,使氢分压保持在一个较低的范围[27]。
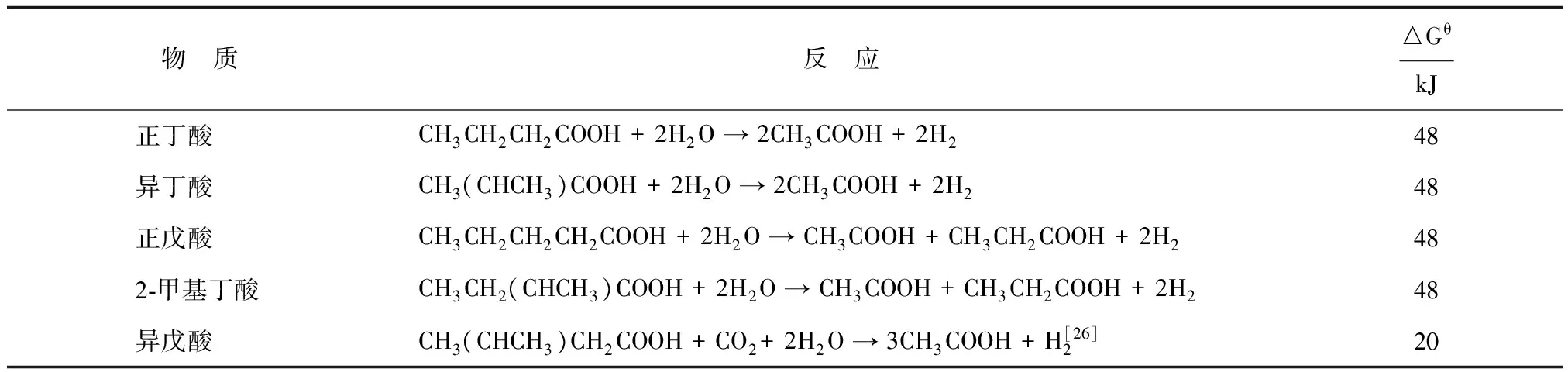
表2 丁酸和戊酸氧化分解有关的反应和标准吉布斯自由能[28]
正丁酸产甲烷过程首先是由丁酸氧化菌将丁酸氧化分解成乙酸和H2,然后再由产甲烷菌利用H2/CO2和乙酸生成甲烷。目前已知的正丁酸氧化分解途径是β氧化(见图1)。丁酸被辅酶A转移酶激活,与辅酶A生成丁酰辅酶A,在脱氢酶的作用下生成巴豆酰基辅酶A。巴豆酰基辅酶A经烯酰辅酶A水化酶作用生成羟基丁酰辅酶A,羟基丁酰辅酶A在脱氢酶的作用下转化为乙酰乙酰辅酶A。乙酰乙酰辅酶A在硫解酶的作用下生成2个乙酰辅酶A,产生的乙酰辅酶A可以通过底物水平磷酸化,形成1个ATP 和1个乙酸分子,或者继续与丁酸反应生成丁酰辅酶A。1mol的正丁酸经β氧化途径氧化分解最终生成2 mol乙酸和2 mol H2[1,28]。
1.3 丁酸异构化反应
有研究表明[30],在微生物的作用下,正丁酸和异丁酸之间能够相互转化,并且正丁酸转化为异丁酸的速率大于异丁酸转化为正丁酸的速率。Matthies[29]等从湖底沉积物中分离获得一株不具有丁酸氧化功能的厌氧细菌WoG13,该菌能够使正丁酸和异丁酸之间发生异构化(见图2),正丁酸和异丁酸异构化反应的吉布斯自由能基本为0。正丁酸和异丁酸都能被被辅酶A转移酶激活,与辅酶A生成正/异丁酰辅酶A,正/异丁酰辅酶A被一种异丁酸异位酶催化,使正/异丁酸上羧基从与之相连的碳原子转移到与该碳原子相邻的另一个碳原子上,从而导致异构的发生,该异丁酸异位酶严格依赖于辅酶B12存在。该研究还发现,H2和异丁酸积累时会抑制异构化反应的进行。除了WoG13,另有研究发现互营丁酸氧化菌Syntrophothermuslipocalidus也具有将异丁酸转化为正丁酸的功能[24]。
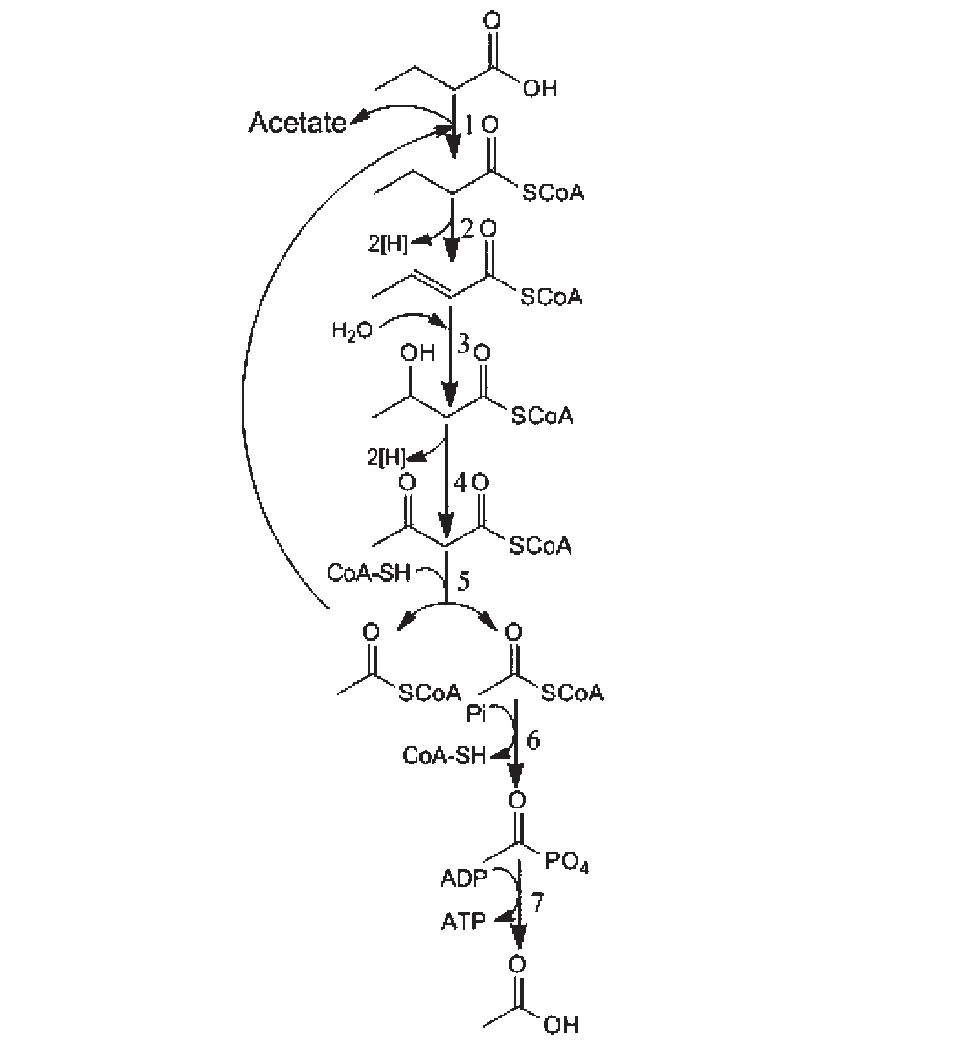
1.辅酶A转移酶; 2. 酰基辅酶A脱氢酶; 3. 烯酰辅酶A水化酶; 4. L-(+)-3-羟基丁酰辅酶A脱氢酶; 5. 3-酮脂酰辅酶A硫解酶; 6.磷酸乙酰转移酶; 7. 乙酸激酶图1 丁酸氧化分解途径[28]

图2 丁酸异构化途径[29]
2 互营戊酸氧化菌和戊酸氧化分解途径
2.1 互营戊酸氧化菌
戊酸包括正戊酸、异戊酸和2-甲基丁酸。目前分离获得的正戊酸互营氧化菌株有12株,其中有两株同时能氧化2-甲基丁酸。大部分正戊酸和2-甲基丁酸氧化菌都属于能通过β-氧化途径降解脂肪酸的互营单胞菌属(Syntrophomonas)。互营戊酸氧化菌细胞以杆状居多,生长pH值范围基本都接近中性,分离培养的菌株中中温氧化菌居多。
跟丁酸氧化菌一样,目前分离培养的正戊酸和2-甲基丁酸氧化菌都必须与氢营养型的产甲烷菌互营共生,少部分氧化菌同时还能与硫酸盐还原菌共培养。大部分戊酸氧化菌除了能够氧化戊酸之外,还能氧化丁酸等其它有机酸。一部分氧化菌能在含巴豆酸的基质上单独生长。除表1中列出的互营戊酸氧化菌外,从污水处理场沉积污泥分离获得的Desulfovibriobutyratiphilus[9]也能够氧化分解正戊酸。

1.乙酰辅酶A转移酶; 2.酰基辅酶A脱氢酶; 3.甲基巴豆酰基辅酶A 脱羧酶; 4. 3-甲基-戊烯二酰辅酶A水化酶; 5. 3-羟基-3-甲基戊二酰辅酶A裂解酶; 6. 乙酰辅酶A转移酶; 7. 磷酸乙酰转移酶; 8. 乙酸激酶图3 异戊酸氧化分解途径[26]
目前,还没有分离得到能互营氧化异戊酸的菌株,仅仅获得了一个能以异戊酸为唯一碳源的混合培养物,该混合培养物包括菌GraIval和Methanospirillumhungatei[26]。异戊酸是厌氧消化体系中重要的代谢产物,分离异戊酸氧化菌并对其进行功能的解析,对于揭示异戊酸互营氧化机理十分重要。
2.2 戊酸氧化分解途径
基于到目前为止取得的成果,认为正戊酸和2-甲基丁酸是通过与丁酸氧化类似的β-氧化途径氧化分解,产物为乙酸、丙酸和H2(见表2)[30]。吴为民[31]等研究发现,在微生物的作用下,2-甲基丁酸能通过异构化产生正戊酸,但是正戊酸通过异构化产生2-甲基丁酸的现象并没有被观察到,该反应不可逆。该研究还发现,异戊酸与正戊酸之间并不会像正丁酸和异丁酸那样在微生物的作用下发生异构化现象[30]。
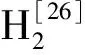
3 丁酸/戊酸产甲烷微生物群落研究

互营丁酸/戊酸氧化微生物的生理代谢功能是与其它生物及自然环境长期相互作用的结果,因此从群落水平来研究各微生物在群落中担负的角色和产生的作用能更为准确地反映出丁酸/戊酸产甲烷微生物群落的物种组成、群落结构、群落功能、群落演替,以及厌氧消化相关微生物之间及微生物与环境因子之间的相互关系等生态学基本问题,从而得以实现对厌氧消化产甲烷过程的相关微生物和环境因子的最优化,对厌氧消化过程的最佳实时监测与调控。汤岳琴[35]等研究了中温条件下,不同稀释率对以丁酸为唯一碳源的连续厌氧反应系统中群落结构的影响,发现在低稀释率下乙酸营养型的Methanosaeta和氢营养型的Methanoculleus为主要的产甲烷古菌,与Syntrophaceae相似的菌为主要的细菌;在高稀释率下是Methanosaeta,Methanosarcina和氢营养型的Methanoculleus、,Methanospirillum为主要的产甲烷古菌,属于Firmicutes的细菌和 Candidate division OP3为主要的细菌。该研究同时也表明在厌氧消化体系中存在大量未知的细菌,它们与丁酸的氧化分解之间的关系并不清楚。
由于互营脂肪酸氧化菌的难培养性,导致基于微生物分离培养的相关研究困难,需要在微生物群落水平进行这些难培养微生物结构和功能的解析,这就需要一种能够直接从复杂群落中甄别功能微生物的技术。稳定性同位素探针技术 SIP (Stable isotope probing)能将复杂群落中微生物物种组成及其生理功能耦合分析的有力工具。利用稳定性同位素示踪复杂群落中微生物基因组 DNA或RNA等物质, 能在群落水平上定向获得某种功能微生物的生物学信息,解析它们在群落水平上的功能和代谢[36]。利用SIP研究丁酸/戊酸产甲烷体系中微生物群落的报道极少,到目前为止,仅有两篇报道。Hatamoto[37]等利用13C丁酸分别标记了棕榈油厂废水中/高温颗粒污泥、棕榈油厂废水厌氧污泥及工厂固体废物的微生物,发现RNA被13C标记的细菌中,Clostridium,Clostridium及Tepidanaerobacter,Syntrophaceae分别为3种污泥中的优势菌。由此他们认为在不同的环境下,互营丁酸氧化菌的主要菌群会发生变化。张琛[27]利用13C丁酸对不同铵浓度处理的污泥进行标记,发现参与丁酸氧化产甲烷过程的细菌主要是Syntrophomonaceae,古菌主要是Methanosaetaceae和Methanospirillaceae,铵浓度的升高导致丁酸互营氧化和产甲烷过程受到不同程度的抑制。
有关自然环境中互营丁酸/戊酸氧化菌相关研究也较少,目前仅有两篇报道。Chauhan[38]等利用13C丁酸标记了佛罗里达大沼泽地的富营养区、过渡区和贫营养区的土壤微生物,发现在DNA被13C标记的细菌中,在富营养区Syntrophospora和Syntrophomonas是主要的优势菌属,在过渡区Pelospora是主要的优势菌属,在贫营养区Pelospora及一些硫酸盐还原菌是主要的优势菌属;在被13C标记的古菌中,在富营养区Methanomicrobiaceae,Methanospirillaceae和Methanosaetaceae为主要的产甲烷古菌,在过渡区Methanosarcina为主要的产甲烷古菌。刘鹏飞[39]等利用13C丁酸标记了稻田土壤中的微生物,发现一些属于Syntrophomonadaceae的细菌以及两类产甲烷古菌Methanosarcinaceae和Methanocellales的核酸被13C标记上。以上利用SIP的研究成果表明,环境中的互营脂肪酸氧化菌的种类远比我们认为的要多。
基于新兴的SIP技术的研究结果可以推测可能参与丁酸/戊酸氧化分解的物种,但它们是否确实具备这个能力以及它们如何对丁酸/戊酸进行代谢,还需要其它技术的配合,而宏组学(Metaomics)技术是最直接有效的[40]。遗憾的是,到目前为止还没有将SIP技术和宏组学技术结合起来研究厌氧消化体系中具有丁酸/戊酸氧化功能的微生物类群的研究报道。
截至目前,关于丁酸及戊酸产甲烷的微生物群落研究较少,特别是与戊酸产甲烷相关的微生物群落研究几乎还是一片空白。因此,研究丁酸/戊酸产甲烷微生物群落显得十分必要。
4 总结
综上所述,到目前为止,分离获得的正丁酸氧化菌有14株,其中2株可以氧化异丁酸,正戊酸氧化菌12株,其中2株可以氧化2-甲基丁酸,氧化异戊酸的混合培养物有一个。目前已知的丁酸和戊酸的互营氧化途径为β氧化,正丁酸和异丁酸,正戊酸和2-甲基丁酸之间存在异构化现象。利用SIP技术的群落水平研究结果表明,厌氧消化系统以及环境当中存在远比已分离菌株更高多样性的互营脂肪酸氧化菌。
目前,关于互营丁酸/戊酸氧化菌的微生物学研究还非常有限,还需要在以下几个方面开展更深入的研究: 1)将SIP技术与宏组学技术相结合,从群落水平系统研究厌氧消化体系中未知互营丁酸/戊酸氧化菌群结构及代谢特征; 2)分离未知互营丁酸/戊酸互营氧化菌,特别是异戊酸氧化菌,并对其进行功能解析,揭示互营丁酸/戊酸互营氧化机理;3)系统研究互营丁酸/戊酸氧化菌群结构和代谢对环境因子如温度、负荷、各类抑制物等的响应机制,为目标群落的调控提供基础依据。
[1] 王刘阳. 沼气发酵微生物区系变化及产甲烷古菌群落结构分析[D]. 北京:中国农业科学院, 2008.
[2] Madigan M T, Martinko J M, Stahl D A, et al. Brock biology of microorganisms[M].Prentice-Hall: 1032.
[3] Batstone D J, Pind P F, Angelidaki I. Kinetics of thermophilic, anaerobic oxidation of straight and branched chain butyrate and valerate[J].Biotechnol Bioeng, 2003, 84(2): 195-204.
[4] Ramsay I R, Pullammanappallil P C. Protein degradation during anaerobic wastewater treatment: derivation of stoichiometry[J]. Biodegradation, 2001, 12(4): 247-57.
[5] Pind P F, Angelidaki I, Ahring B K. Dynamics of the anaerobic process: effects of volatile fatty acids[J]. Biotechnol Bioeng, 2003, 82(7): 791-801.
[6] Dolfing J. Syntrophic Propionate Oxidation via Butyrate: a Novel Window of Opportunity under Methanogenic Conditions[J].Applied Environmental Microbiology, 2013, 79(14): 4515-4516.
[7] Bergey, David H. Bergeys manual of systematic bacteriology / The Firmicutes[J].Springer,2010, 38(4):89-100.
[8] Sorokin D Y, Detkova E N, Muyzer G. Propionate and butyrate dependent bacterial sulfate reduction at extremely haloalkaline conditions and description of Desulfobotulus alkaliphilus sp. nov[J]. Extremophiles, 2010, 14(1): 71-77.
[9] Suzuki D, Ueki A, Shizuku T, et al. Desulfovibrio butyratiphilus sp. nov, a Gram-negative, butyrate-oxidizing, sulfatereducing bacterium isolated from an anaerobic municipal sewage sludge digester[J]. Int J Syst Evol Microbiol, 2010, 60(3): 595-602.
[10] Balk M, Altinbas M, Rijpstra W I, et al. Desulfatirhabdium butyrativorans gen. nov, sp nov, a butyrate-oxidizing, sulfate-reducing bacterium isolated from an anaerobic bioreactor[J]. Int J Syst Evol Microbiol, 2008, 58(1): 110-115.
[11] Suzuki D, Ueki A, Amaishi A, et al. Desulfoluna butyratoxydans gen. nov, sp. nov, a novel Gram-negative, butyrate-oxidizing, sulfate-reducing bacterium isolated from an estuarine sediment in Japan[J]. Int J Syst Evol Microbiol, 2008, 58(4): 826-832.
[12] Wu C, Dong X, Liu X. Syntrophomonas wolfei subsp. methylbutyratica subsp. nov, and assignment of Syntrophomonas wolfei subsp. saponavida to Syntrophomonas saponavida sp. nov. comb. nov[J]. Syst Appl Microbiol, 2007, 30(5): 376-380.
[13] Wu C, Liu X, Dong X. Syntrophomonas cellicola sp. nov, a spore-forming syntrophic bacterium isolated from a distilled-spirit-fermenting cellar, and assignment of Syntrophospora bryantii to Syntrophomonas bryantii comb. nov[J]. Int J Syst Evol Microbiol, 2006, 56(10): 2331-2335.
[14] Stieb M, Schink B. Anaerobic oxidation of fatty acids by Clostridium bryantii sp. nov : a sporeforming, obligately syntrophic bacterium[J].Archives of Microbiology, 1985, 140(4): 387-390.
[15] Mcinerney M J, Bryant M P, Hespell R B, et al. Syntrophomonas wolfei gen. nov. sp. nov, an Anaerobic, Syntrophic, Fatty Acid-Oxidizing Bacterium[J]. Applied Environmental Microbiology, 1981, 41(4): 1029-1039.
[16] Zhang C, Liu X, Dong X. Syntrophomonas erecta sp. nov, a novel anaerobe that syntrophically degrades short-chain fatty acids[J]. Int J Syst Evol Microbiol, 2005, 55(2): 799-803.
[17] Wu C, Liu X, Dong X. Syntrophomonas erecta subsp. sporosyntropha subsp. nov, a spore-forming bacterium that degrades short chain fatty acids in co-culture with methanogens[J]. Syst Appl Microbiol, 2006, 29(6): 457-462.
[18] Roy F, Samain E, Dubourguier H C, et al. Synthrophomonas sapovorans sp. nov, a new obligately proton reducing anaerobe oxidizing saturated and unsaturated long chain fatty acids[J]. Archives of Microbiology, 1986, 145(2): 142-147.
[19] Hatamoto M, Imachi H, Fukayo S, et al. Syntrophomonas palmitatica sp. nov, an anaerobic, syntrophic, long-chain fatty-acid-oxidizing bacterium isolated from methanogenic sludge[J]. Int J Syst Evol Microbiol, 2007, 57(9): 2137-2142.
[20] Sousa D Z, Smidt H, Alves M M, et al. Syntrophomonas zehnderi sp. nov, an anaerobe that degrades long-chain fatty acids in co-culture with Methanobacterium formicicum[J]. Int J Syst Evol Microbiol, 2007, 57(3): 609-615.
[21] Zhang C, Liu X, Dong X. Syntrophomonas curvata sp. nov, an anaerobe that degrades fatty acids in co-culture with methanogens[J]. Int J Syst Evol Microbiol, 2004, 54(3): 969-973.
[22] Jackson B E, Bhupathiraju V K, Tanner R S, et al. Syntrophus aciditrophicus sp. nov, a new anaerobic bacterium that degrades fatty acids and benzoate in syntrophic association with hydrogen-using microorganisms[J]. Archives of Microbiology, 1999, 171(2): 107-114.
[23] Kendall M M, Liu Y, Boone D R. Butyrate-and propionate-degrading syntrophs from permanently cold marine sediments in Skan Bay, Alaska, and description ofAlgorimarina butyricagen. nov, sp. nov[J]. FEMS Microbiology Letters, 2006, 262(1): 107-114.
[24] Sekiguchi Y, Kamagata Y, Nakamura K, et al. Syntrophothermus lipocalidus gen. nov, sp. nov, a novel thermophilic, syntrophic, fatty-acid-oxidizing anaerobe which utilizes isobutyrate[J]. International Journal of Systematic & Evolutionary Microbiology, 2010, 50(2): 771-779.
[25] Svetlitshnyi V, Rainey F, Wiegel J. Thermosyntropha lipolytica gen. nov, sp. nov, a lipolytic, anaerobic, alkalitolerant, thermophilic bacterium utilizing short-and long-chain fatty acids in syntrophic coculture with a methanogenic archaeum[J]. International Journal of Systematic Bacteriology, 1996, 46(4): 1131-1137.
[26] Stieb M, Schink B. Anaerobic degradation of isovalerate by a defined methanogenic coculture[J]. Archives of Microbiology, 1986, 144(3): 291-295.
[27] 张 琛. 铵影响厌氧反应器污泥丙酸和丁酸互营氧化产甲烷过程的机理[D]. 北京:中国农业大学, 2013.
[28] Worm P, Koehorst J J, Visser M, et al. A genomic view on syntrophic versus non-syntrophic lifestyle in anaerobic fatty acid degrading communities[J]. Biochim Biophys Acta, 2014, 1837(12): 2004-2016.
[29] Matthies C, Schink B. Reciprocal isomerization of butyrate and isobutyrate by the strictly anaerobic bacterium strain WoG13 and methanogenic isobutyrate degradation by a defined triculture[J]. Applied & Environmental Microbiology, 1992, 58(5): 1435-1439.
[30] Wang Q, Kuninobu M, Ogawa H I, et al. Degradation of volatile fatty acids in highly efficient anaerobic digestion[J]. Biomass Bioenergy, 1999, 16(6): 407-416.
[31] Wu W M, Jain M K, Zeikus J G. Anaerobic degradation of normal-and branched-chain Fatty acids with four or more carbons to methane by a syntrophic methanogenic triculture[J]. Applied Environmental Microbiology, 1994, 60(7): 2220-2226.
[32] Yang Y, Chen Q, Guo J, et al. Kinetics and methane gas yields of selected C1 to C5 organic acids in anaerobic digestion[J]. Water Research, 2015, 87: 112-118.
[33] Wang Y, Zhang Y, Wang J, et al. Effects of volatile fatty acid concentrations on methane yield and methanogenic bacteria[J]. Biomass and Bioenergy, 2009, 33(5): 848-853.
[34] Li Y, Zhang Y, Xu Z, et al. Enhancement of sludge granulation in anaerobic acetogenesis by addition of nitrate and microbial community analysis[J]. Biochemical Engineering Journal, 2015, 95: 104-111.
[35] Tang Y Q, Shigematsu T, Morimura S, et al. Effect of dilution rate on the microbial structure of a mesophilic butyrate-degrading methanogenic community during continuous cultivation[J]. Appl Microbiol Biotechnol, 2007, 75(2): 451-465.
[36] 贾仲君. 稳定性同位素核酸探针技术DNA-SIP原理与应用[J]. 微生物学报, 2011, 51(12): 1585-1594.
[37] Hatamoto M, Imachi H, Yashiro Y, et al. Detection of active butyrate-degrading microorganisms in methanogenic sludges by RNA-based stable isotope probing[J]. Appl Environ Microbiol, 2008, 74(11): 3610-3614.
[38] Chauhan A, Ogram A. Fatty acid-oxidizing consortia along a nutrient gradient in the Florida Everglades[J]. Appl Environ Microbiol, 2006, 72(4): 2400-2406.
[39] Liu P, Qiu Q, Lu Y. Syntrophomonadaceae-affiliated species as active butyrate-utilizing syntrophs in paddy field soil[J]. Appl Environ Microbiol, 2011, 77(11): 3884-3887.
[40] Vanwonterghem I, Jensen P D, Ho D P, et al. Linking microbial community structure, interactions and function in anaerobic digesters using new molecular techniques[J]. Current Opinion in Biotechnology, 2014, 27(6): 55-64.
Microbiology Research Progress of Syntrophic Butyrate and Valerate Oxidization Producing Methane /
YI Yue1, WANG Hui-zhong1, ZHENG Dan2, GOU Min1, TANG Yue-qin1/
(1.College of Architecture and Environment, Sichuan University, Sichuan Environmental Protection Key Lab of Organic Wastes Resource Utilization, Chengdu, Chengdu 610065, China; 2.Biogas Institute of Ministry of Agriculture,Chengdu 610041,China)
Butyrate and valerate are the important intermediates during methane fermentation, especially in the anaerobic system treating wastewater containing protein. The research on microbiology of syntrophic butyrate/valerate oxidization is of great importance for treatment of the wastewater containing protein and for system stable and effective operation. This paper mainly summarized the isolated and obtained syntrophic butyrate/valerate oxidization bacteria to date, introduced the known metabolic pathway of syntrophic butyrate/valerate oxidization. In addition, the current research situation on microbial communities of syntrophic butyrate/valerate oxidization was reviewed. Suggestions for future research were proposed.
butyrate; valerate; syntrophic fatty acid oxidization; methane fermentation; anaerobic digestion
2017-02-22
项目来源: 科技部政府间国际科技创新合作重点专项(2016YFE0127700)
易 悦(1992-),女,四川广安人,本科,主要从事互营有机酸菌群解析研究,E-mail:januaryfuji@163.com 通信作者: 汤岳琴,E-mail:tangyq@scu.edu.cn
S216.4; X172
A
1000-1166(2017)03-0003-08

