超高效液相色谱-串联质谱法同时检测植物叶片中吲哚-3-乙酸及其3种氧化产物
刘志航,李平亮,周 斐,罗小勇*
(1.青岛农业大学 化学与药学院,山东 青岛 266109;2.青岛农业大学 农学与植物保护学院,山东 青岛 266109)
超高效液相色谱-串联质谱法同时检测植物叶片中吲哚-3-乙酸及其3种氧化产物
刘志航1,李平亮2,周 斐2,罗小勇2*
(1.青岛农业大学 化学与药学院,山东 青岛 266109;2.青岛农业大学 农学与植物保护学院,山东 青岛 266109)
以玉米叶片为供试材料,建立了同时测定植物体内吲哚-3-乙酸(IAA)及其3种氧化产物吲哚-3-甲醇(ICI)、吲哚-3-甲醛(ICA)、吲哚-3-羧酸(IFA)含量的超高效液相色谱-串联质谱(UPLC-MS/MS)方法。结果表明,该方法对IAA及其3种氧化产物检测的线性、精密度和重复性较好,灵敏度较高,4种化合物的检出限为0.002~1.63 μg/kg,定量下限为0.007~5.43 μg/kg;方法的加标回收率为89.5%~95.3%,相对标准偏差为2.3%~5.1%。玉米叶片的实际测定结果表明,IAA,ICI,ICA和IFA的含量分别为(196.25±7.10),(26.21±2.13),(18.65±2.02),(13.62±2.06) μg/kg。该方法已成功应用于小麦、豌豆、硬毛刺苞菊叶片的测定,通用性较好。
玉米叶片;吲哚-3-乙酸;吲哚-3-甲醇;吲哚-3-甲醛;吲哚-3-羧酸;超高效液相色谱-串联质谱(UPLC-MS/MS)
吲哚-3-乙酸(IAA)是天然植物生长素的主要活性成分,其生理作用十分广泛,可影响植物细胞的伸长与分裂、植株向地性与向光性的形成、主侧根与下胚轴的生长等过程,对植物的早期发育和形态构建具有重要意义[1]。对IAA生物合成、运输和分解代谢方面的系统研究,可深入地揭示植物生长发育的生理生化过程,阐明作物高产和抗逆性的机理[2-3]。研究表明,IAA合成和代谢之间的平衡是植物特定细胞中游离态IAA水平的主要决定因素[4]。IAA的代谢途径包括IAA结合物的形成与氧化分解两个方面。前者包括与蔗糖、肌醇、氨基酸、多肽、蛋白质等形成结合物,起IAA贮藏和避免被氧化分解的作用;后者则包括IAA的脱羧氧化和非脱羧氧化两条途径,对保持IAA的平衡具有重要作用[4-5]。IAA的氧化脱羧通常由过氧化物酶(POD)催化,早期的研究认为该酶也包括了IAA氧化酶(IAAO)[5-6]。在POD和IAAO的催化下,IAA首先被脱羧氧化为吲哚-3-甲醇(ICI),进一步转化为吲哚-3-甲醛(ICA),最终生成吲哚-3-羧酸(IFA)。一般情况下,植物体内ICI和ICA的含量高于IFA(图1)[4-5,7]。此外,用三价或六价铬化合物及氯化汞、硫化汞等处理菜豆也会影响该植物POD和IAAO的活性[8]。可见,植物体内IAA及其3种氧化产物的含量动态可反映POD及IAAO参与的IAA氧化代谢水平,准确掌握它们的变化情况对于把握植物体内的生长素水平及应对各种胁迫危害具有重要的意义。

图1 过氧化物酶催化的IAA氧化脱羧途径之一Fig.1 One oxidative decarboxylation pathway of IAA catalyzed by POD
目前对于生长素相关化合物分析方法的研究,主要集中在对IAA及其结构类似物(如吲哚丙酸等)的分析,尚未有同时检测IAA及其氧化产物的方法报道[9]。作为重要的植物内源激素,IAA及其氧化物含量较低,植物基质干扰较多,对分析方法的灵敏度和选择性要求较高[10]。目前,测定IAA相关化合物的方法有酶联免疫法(ELISA)[11]、毛细管电泳法(CE)[12]、化学发光法(CL)[13]、气相色谱法(GC)[14]、高效液相色谱法(HPLC)[15]以及液相色谱-串联质谱法(UPLC-MS/MS)[16]等。其中,酶联免疫法简单、快速,但易造成假阳性;化学发光法不易普及;毛细管电泳、高效液相色谱法的灵敏度较低,易受基质干扰;气相色谱法需衍生,操作复杂;而超高效液相色谱-串联质谱法具有高灵敏度、选择性好、特异性强和分析快速的优点,目前已成为痕量植物激素成分定性和定量分析的首选方法[17]。
本研究以玉米叶片为检测基质,通过优化前处理方法和色谱-质谱检测参数,建立了同时检测玉米叶片中IAA及其氧化产物(ICI,ICA和IFA)的UPLC-MS/MS分析方法,并以小麦、豌豆和硬毛刺苞菊叶片为供试材料进行了验证。
1 实验部分
1.1 仪器与试剂
超高效液相色谱-质谱联用仪(Agilent公司,美国):Agilent 1290 Infinity液相色谱系统,Agilent 6430串联三重四极杆质谱仪,配Mass Hunter Qualitative Analysis 工作站;Agilent Poroshell 120 EC-C18超高效液相色谱柱(75 mm×2.1 mm,2.7 μm);SK5200LH 型超声波清洗仪(上海科导超声仪器厂);GL21M 高速冷冻离心机(长沙英泰仪器有限公司);AR2140电子分析天平(精度1/100 000,上海衡平仪器仪表厂);RE-2000A 旋转蒸发仪(上海亚荣仪器厂);SUPELCO 固相萃取装置(北京康林科技有限责任公司)。
吲哚-3-乙酸标准品(IAA,纯度99%)购于美国Sigma公司;吲哚-3-甲醇(ICI,纯度96%)、吲哚-3-甲醛(ICA,纯度97%)、吲哚-3-羧酸(IFA,纯度98%)购于上海麦克林生化科技有限公司;甲醇(色谱纯)购自美国Merck公司;流动相所用超纯水由美国Millipore 公司的超纯水系统制备,以0.22 μm 滤膜过滤后,加入0.1%甲酸;未封端的 C18固相萃取小柱购自天津博纳艾杰尔科技有限公司,型号Cleanert C18-N-SPE(Cat,185006-N-SY;Spec,500 mg/6 mL);其他所用试剂均为分析纯,购自国药集团北京化学试剂有限公司;玉米(ZeamaysL.)、小麦(TriticumaestivumL.)、豌豆(PisumsativumL.)种子购于青岛德地得农化科技有限公司。硬毛刺苞菊(AcanthospermumhispidumDC.)种子为自繁。
IAA,ICI,ICA及IFA标准品用甲醇溶解配制成500 mg/L的标准母液,于4 ℃保存备用;使用时以甲醇分别稀释成终浓度为5,10,50,100,500 μg/L的标准溶液。
1.2 植物材料
供试植物的种子种植于光照培养箱(25/20 ℃;光/暗时间比14 h∶10 h)中含有营养土的白色方盘内,待分别培养至15 d(小麦、豌豆)和30 d(玉米、硬毛刺苞菊)时,各选取叶片1.00 g,去除叶柄,剪碎装入10 mL冻存管中,-80 ℃冰箱保存。
1.3 样品前处理
样品的前处理方法参考已有方法[18-19]加以改进,具体步骤:准确称取各叶片样品0.10 g,加液氮研磨后,置于50 mL离心管中,加入10 mL冷却的提取液(V甲醇∶V水=9∶1),4 ℃下提取12 h。浸提液以10 000 r/min离心15 min,上清液装入50 mL梨形瓶后用旋转蒸发仪(45 ℃)将甲醇蒸干后,加入去离子水使提取液总体积仍为10 mL。Supelco 固相萃取装置安装完成后,提取液过不封端的C18小柱(使用前,用3.0 mL 去离子水和3.0 mL甲醇活化),然后用1.0 mL 20% 的甲醇(含0.1%甲酸)洗涤小柱去除杂质,最后用1.0 mL 90%的甲醇淋洗小柱,收集淋洗液,淋洗液用 0.22 μm 针筒过滤器过滤,待上机检测。
1.4 检测条件
色谱条件:Agilent Poroshell 120 EC-C18超高效液相色谱柱(75 mm×2.1 mm,2.7 μm),柱温25 ℃;以甲醇-0.1%甲酸(4∶6,体积比)为流动相进行等度洗脱,流速为0.2 mL/min,进样体积为 5.0 μL,分离总时间为5.0 min。
质谱条件:电喷雾离子源,正离子电离(ESI+)模式;毛细管电压为 4.0 kV;锥孔反吹气流速为 10.0 L/min,温度为 350 ℃;去溶剂气为高纯氮气,流速为10.0 L/min,温度350 ℃;碰撞气为高纯氮气;采用多反应监测(MRM)模式,吲哚-3-乙酸的监测离子为m/z176 和130,碰撞能为16 eV;吲哚-3-甲醇的监测离子为m/z148 和118,碰撞能为3 eV;吲哚-3-甲醛为m/z146和118,碰撞能为12 eV;吲哚-3-羧酸为m/z162和118,碰撞能为12 eV;检测完成后,由Mass Hunter Qualitative Analysis工作站软件进行数据处理。
1.5 基质效应
采用相对响应值法研究植物叶片的基质效应[20-21],以TIC峰面积为仪器响应值。玉米叶片空白基质溶液和甲醇溶剂中,IAA,ICI,ICA和IFA混合标准溶液的最终添加浓度分别为10,100 μg/L。根据公式ME=Am/Ac×100%计算基质效应,式中ME表示基质效应,Am表示植物叶片基质添加标准药剂的TIC峰面积,Ac表示甲醇溶剂添加标准药剂的TIC峰面积。由于叶片本身含有4种化合物,所以Am值是标准添加叶片中物质的总TIC峰面积(Amtotal)减去空白叶片样品中的峰面积(Amblank),因此基质效应计算的表达式ME=(Amtotal-Amblank)/Ac×100%。当ME值小于 100%时,表示基质有抑制效应;ME值大于 100%时,为增强效应;当ME值为90%~110%时,则认为基质效应不明显。
2 结果与讨论
2.1 萃取方法的选择
作为植物代谢的中心器官,叶片中含有大量的色素、脂类等成分,而IAA及其氧化物的含量较低,因而选择简便快速、回收率好的前处理方法是建立分析方法的首要工作。目前,分析植物内源激素IAA等成分时常采用甲醇等有机溶剂进行初萃取,再经固相萃取或液-液萃取等方法进行提纯[9]。由于液液萃取的时间较长,有机溶剂用量较大,而固相萃取可较快地完成样品富集和净化,提高检测灵敏度,且有机溶剂用量少[17]。因此,本研究采用固相萃取(SPE)法对玉米叶片进行样品前处理。
针对IAA及其氧化物的结构特点,本研究借助不封端的C18小柱进行样品的净化,并对净化步骤中杂质洗涤液和目标成分淋洗液组成进行了优化。结果表明,用90%甲醇作为浸提液时,4种化合物的回收率大于80%。 IAA及其氧化物吸附于C18小柱后,用有机比例较低的少量甲醇水溶液虽然难以洗出IAA及其氧化物,但可以去除很多叶片杂质成分,而用有机比例较高的少量甲醇水溶液可有效回收IAA及其氧化物。进一步优化试验表明,以1 mL 20%的甲醇水溶液(含0.1%甲酸)和1 mL 90%的甲醇水溶液分别作为杂质洗涤液和目标化合物淋洗液,4种化合物在玉米叶片样品中的加标回收率均大于85%。因此,本研究选择这两种溶液作为采用SPE处理的杂质洗涤液和目标化合物的淋洗液。
2.2 色谱-质谱条件的优化
为优化质谱检测参数,采用电喷雾正离子和负离子模式对标准液浓度为100 μg/L的IAA,ICI,ICA和IFA分别进行了母离子扫描。结果表明,4种化合物在正离子模式下的信号丰度远高于负离子模式,因而确定采用正离子检测模式[M+H]+。IAA,ICI,ICA和IFA的母离子分别为m/z176,148, 146, 162,进一步对子离子、碰撞能量等参数进行优化,结合方法的灵敏度和选择性,分别选择离子m/z176>130(IAA),m/z148>118(ICI),m/z146>118(ICA),m/z162>118(IFA)为监测离子对。
为了缩短样品分析时间和减少干扰,对色谱流动相和分离条件进行了优化。结果表明,以甲醇和0.1%甲酸(体积比4∶6)作为流动相进行等度洗脱时,4种化合物的峰形较好,可实现目标化合物的准确定性与定量,IAA,ICI,ICA和IFA的保留时间分别为2.778,2.599,2.591,2.637 min,单个样品检测的总时间为5.0 min。
2.3 基质效应的评价
基质效应(ME)是指色谱分离时的共洗脱物质影响了目标成分的离子化效率,从而引起质谱信号的抑制或提高[22]。由于叶片基质的组成复杂,多种因素均有可能影响检测目标的质谱信号。本研究根据“1.5”方法计算了玉米叶片的基质效应。结果显示,IAA,ICI,ICA,IFA在玉米叶片基质中最终添加量为10 μg/L时,ME值分别为85.7%,84.0%,88.3%,87.7%,存在微弱的基质抑制效应;添加量增至100 μg/L 时,ME值分别92.2%,90.8%,94.6%,97.4%,基质效应表现不明显。
2.4 线性范围、定量下限、精密度及准确度
为了减少基质效应对分析结果的影响,本研究采用叶片空白基质配制标准曲线进行校正。以峰面积(y)对浓度(x,μg/L)绘制标准曲线,计算各化合物的线性范围、回归方程、检出限、定量下限和相对标准偏差。结果表明,各化合物在一定浓度范围内的线性关系较好(r2>0.995),检测精密度和重复性较高;4种化合物的检出限(S/N=3)为0.002~1.63 μg/kg,定量下限(S/N=10)为0.007~5.43 μg/kg,日内精密度和日间精密度分别为2.9%~4.7%和2.4%~5.0%,化合物的分析灵敏度顺序为ICA>IAA>IFA>ICI(见表1)。考虑到IAA及其类似物在植物样本中的含量多在10~500 μg/kg范围内[22],因而所建立方法可满足玉米等植物叶片内IAA及其氧化物的定性和定量分析需求。
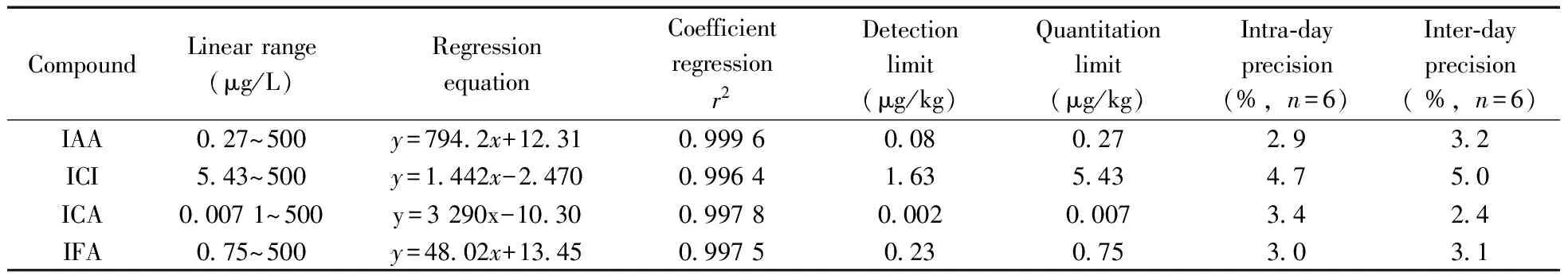
表1 玉米叶片中吲4种待测物的线性回归方程、检出限及定量下限
采用所建立的方法,测定了IAA,ICI,ICA,IFA在玉米叶片样品中的加标回收率,其结果见表2。其中IAA的加标量分别为10,25,50 μg/kg;ICI,ICA和IFA的加标量为分别2,10,50 μg/kg。测得玉米叶片中IAA,ICI,ICA和IFA的加标回收率分别为92.3%~95.3%,89.5%~89.8%,90.5%~94.0% 和90.4%~92.5%,相对标准偏差(RSD)分别为2.8%~3.1%,3.9%~5.1%, 2.9%~4.1% 和 2.3%~2.9%,说明该方法分析准确度和精密度较高,可满足玉米叶片中IAA及其氧化产物的定量分析要求。

表2 玉米叶片中4种待测物的加标回收率及相对标准偏差(n=5)
2.5 实际样品的测定
采用建立的方法,对玉米叶片中IAA,ICI,ICA和IFA的含量进行了检测,实际样品的检测色谱图如图2所示。结果表明,玉米生长30 d后,叶片中IAA的含量为(196.25±7.10) μg/kg,与已有文献中关于玉米叶片IAA含量值较为相似[23];3种氧化产物ICI,ICA和IFA的含量分别为(26.21±2.13),(18.65±2.02),(13.62±2.06) μg/kg,均高于本方法的定量下限;4种化合物含量大小顺序为IAA>ICI>ICA>IFA,符合图1所示氧化产物生成顺序,而ICI,ICA,IFA含量的显著增加以及IAA含量的显著减少可认为是POD催化的IAA氧化增加。玉米是一种世界范围内的重要经济作物, 其IAA含量的降低易引起营养物质供应不足而导致玉米籽粒败育降低产量[24],含量降低部分是由其氧化代谢所致,因而本方法可为玉米叶片中IAA氧化相关研究提供可靠的分析手段。
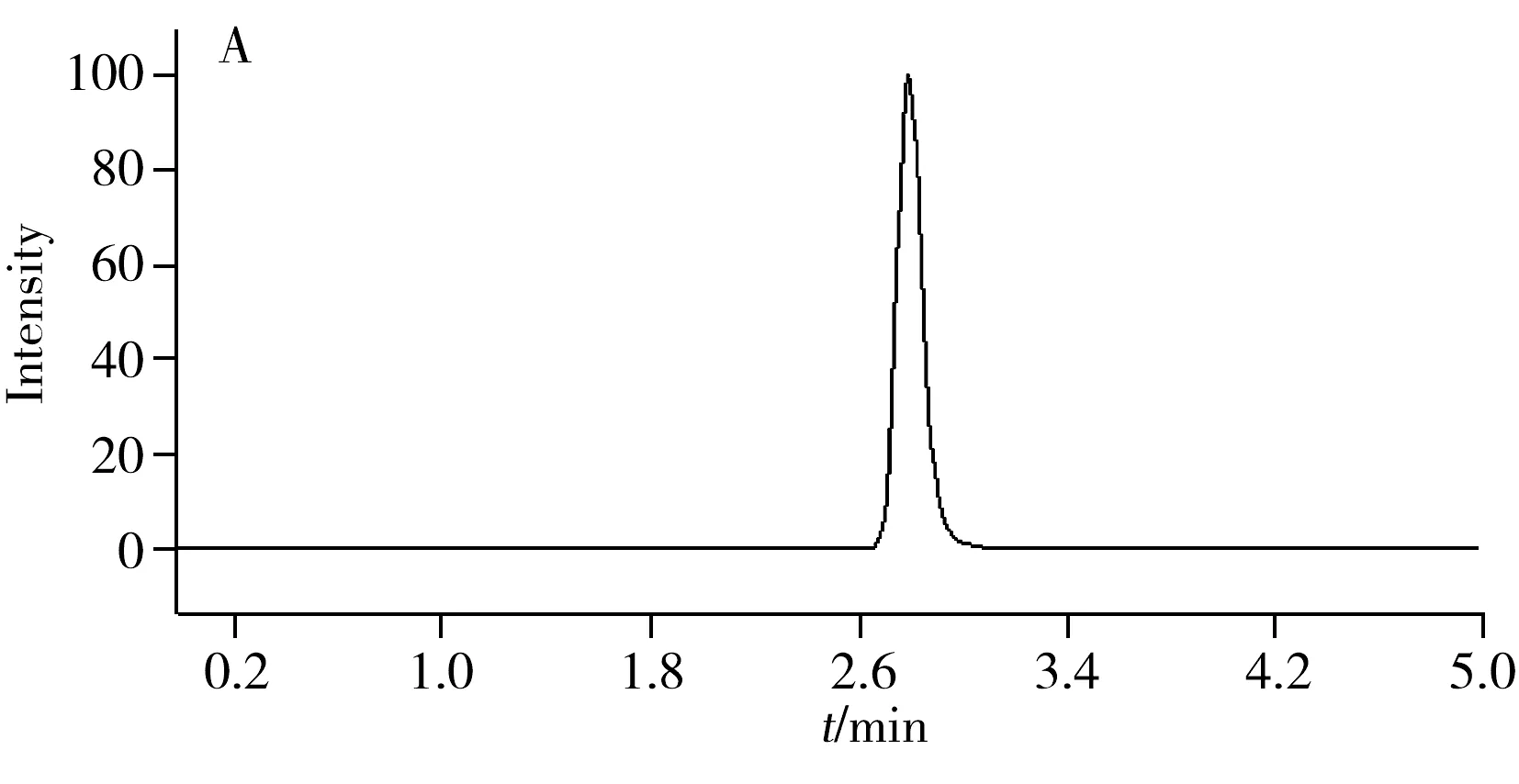
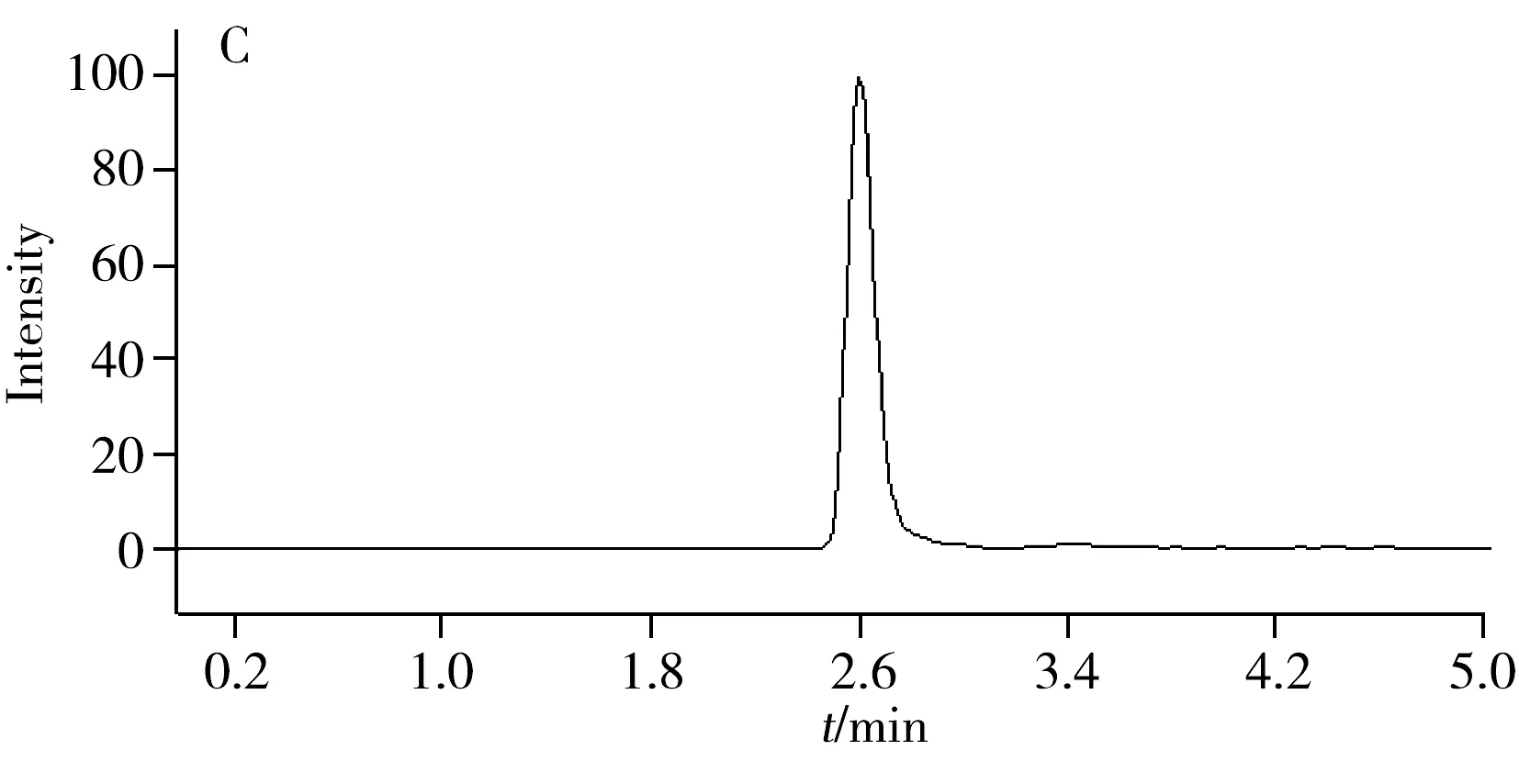
为了验证本方法在其他植物叶片中的适用性,对小麦、豌豆和和硬毛刺苞菊叶片中IAA,ICI,ICA和IFA含量进行了初步研究,结果见表3。在3种植物叶片中均检测到IAA,ICI,ICA和IFA,且以IAA的含量最高,其含量分别为(177.38±6.43),(150.02±10.38),(208.32±8.25) μg/kg;小麦和硬毛刺苞菊中IAA的3种氧化产物含量大小顺序为ICI>ICA>IFA,但在豌豆中含量顺序则为ICI>IFA>ICA。以上结果表明,本方法适用于除玉米之外的其他植物。小麦和豌豆是世界范围内的重要经济作物[25],IAA氧化相关物质的分析有助于研究该两种作物的生长发育。而硬毛刺苞菊(AcanthospermumhispidumDC.)是一种广泛分布于热带和部分温带地区的菊科杂草[26],一些除草剂可通过影响杂草体内IAA的氧化代谢,干扰杂草的生长发育[27-28],因而测定杂草体内的上述4种化合物有助于研究部分除草剂的作用机理。

表3 小麦、豌豆和硬毛刺苞菊叶片中4种待测物的含量(n=3)
3 结 论
本研究采用SPE的前处理手段,结合UPLC的快速分离特性以及MS/MS检测器的高灵敏度和高选择性,建立了植物叶片内IAA及其3种氧化产物的定量分析方法。IAA,ICI,ICA和IFA的保留时间分别为2.778,2.599,2.591 ,2.637 min,单个样品的分离时间为5 min,方法适用于叶片样品的自动化和高通量检测。方法的加标回收率不低于85%,在玉米叶片中的检出限和定量下限分别为0.002~1.63 μg/kg和0.007~5.43 μg/kg。通过对小麦、豌豆、硬毛刺苞菊等植物叶片的进一步测定,验证了该方法的通用性。该方法简单,灵敏度和选择性较好,可用于植物叶片生长期内IAA,ICI,ICA和IFA的同时快速分析。
[1] Duan N,Jia Y K,Xu J,Chen H L,Sun P.Chin.Agric.Sci.Bull.(段娜,贾玉奎,徐军,陈海玲,孙鹏.中国农学通报),2015,31(2):159-165.
[2] Chen D H,He Z P,Xu L H,Zhou G S,Wu Y K.ActaAgron.Sin.(陈德华,何钟佩,徐立华,周桂生,吴云康.作物学报),2000,26(6):659-665.
[3] Li J,Cui J Z,Mi X J.Biotechnol.Bull.(李静,崔继哲,弭晓菊.生物技术通报),2012,6:13-17.
[4] Ni D A,Xu Z H.PlantPhysiol.Commun.(倪迪安,许智宏.植物生理学通讯),2001,37(4):352-376.
[5] Davies P J.Physiology,BiochemistryandMolecularBiology.The Netherlands:Kluwer Academic Publishers,1995:53-54.
[6] Yuan M D,Hou Z X,Zhai M P,Su Y.Chin.Agric.Sci.Bull.(原牡丹,侯智霞,翟明普,苏艳.中国农学通报),2008,8:88-92.
[7] Chen L S,Liu X H.J.WuhanBot.Res.(陈立松,刘星辉.武汉植物学研究),2002,20(2):131-136.
[8] Parmar N G,Chanda S V.Turk.J.Biol.,2005,29(1):15-21.
[9] Xie J,Zhang Y Z.J.Instrum.Anal.(谢君,张义正.分析测试学报),2001,20(1):60-62.
[10] Lu Y L,Dong C X,Dong Y Y,Xiong C L,Shen Q R.PlantNutr.Fert.Sci.(卢颖林,董彩霞,董园园,熊春丽,沈其荣.植物营养与肥料学报),2007,13(1):129-135.
[11] Ziegler A G,Haupt F,Scholz M,Weininger K,Wittich S,Löbner S,Matzke C,Gezginci C,Riethausen S,Beyerlein A,Zillmer S,Amoroso M,Coles R, Powell M,Furmaniak J,Smith B R,Winkler C,Bonifacio E,Achenbach P.DiabetesTechnologyTherapeutics,2016,18(11):687-693.
[12] Yan X J,Sun L L,Zhu G J,Cox O F,Dovichi N J.Proteomics,2016,16(23):2945-2952.
[13] Nguyen H T,Umemura K,Kawano T.Biosci.Biotech.Biochem.,2016,8:1-9.
[14] Perrine F M,Rolfe B G,Hynes M F,Hocart C H,PlantPhysiol.Biochem.,2004,42:723-729.
[15] Gong X C,Song C F,Wang M H,Zheng F C,Miao W G,Wang J S.JiangsuJ.Agric.Sci.(龚晓崇,宋从凤,王鸣华,郑服丛,缪卫国,王金生.江苏农业学报),2012,28(1):225-227.
[16] Kleinnijenhuis A J,Ingola M,Toersche J H,Van Holthoon F L,Van Dongen W D.Bioanalysis,2016,8(9):891-904.[17] Lu Z,Zou Z H,Lu J,Wang R Z.CropRes.(鲁哲,邹振华,路婧,王若仲.作物研究),2011,25(5):531-534.
[18] Zhu J R,Jiang S R,Shen L Q.J.AnhuiAgric.Sci.(祝俊儒,姜仕仁,沈莲清.安徽农业科学),2011,39(33):20303-20305,20309.
[19] Hou S J,Zhu J,Ding M Y,Lv G H.Talanta,2008,76:798-802.
[20] Matuszewski B K,Constanzer M L,Chavez-Eng C M.Anal.Chem.,2003,75(13):3019-3030.
[21] DAMS R,Huestis M A,Lambert W E,Murphy C M.J.Am.Soc.Mass.Spectrom.,2003,14(11):1290-1294.
[22] Jiao W T,Xiao Y,Qian X S,Tong M M,Hu Y Z,Hou R Y,Hua Y M.FoodChem.,2016,210 :26-34.
[23] Zhou W X,Li C H,Liu T X,Wang X P,Yan Z G.ActaEcol.Sin.(周卫霞,李潮海,刘天学,王秀萍,闫志广.生态学报),2013,33(14):4315-4323.
[24] Sun L H,Chen C Q,Li Y M,Kong F,Ye Y S.LiaoningAgric.Sci.(孙丽惠,陈长青,李月明,孔菲,叶雨盛.辽宁农业科学),2011,4:64-66.
[25] Wang K,Arntfield S D.FoodChem.,2014,157:364-372.
[26] Luo X Y,Matsumoto H.WeedBiol.Manag.,2002,2:98-103.
[27] Barnwell P,Cobb A H.Pestic.Biochem.Physiol.,1993,47:87-97.
[28] Shimabukuro R H,Hoffer B L.Pestic.Biochem.Physiol.,1994,48:85-97.
Simultaneous Determination of Indole-3-acetic Acid and Its Three Oxidative Products in Plant Leaves by UPLC-MS/MS
LIU Zhi-hang1,LI Ping-liang2,ZHOU Fei2,LUO Xiao-yong2*
(1.College of Chemistry and Pharmacy,Qingdao Agricultural University,Qingdao 266109, China;2.College of Crop Protection and Agronomy,Qingdao Agricultural University,Qingdao 266109, China)
An ultra-performance liquid chromatography-tandem mass spectrometric(UPLC-MS/MS) method was developed for the simultaneous determination of indole-3-acetic acid(IAA) and its three oxidative products,indole-3-methanol(ICI),indole-3-carboxaldehyde(ICA) and indole-3-carboxylic acid(IFA) in corn(ZeamaysL.) leaves.The results showed that the detection limits for the four compounds were in the range of 0.002-1.63 μg/kg,and the quantitation limits were 0.007-5.43 μg/kg.The recoveries ranged from 89.5% to 95.3% with RSDs of 2.3%-5.1%.The mthod was applied in the determination of the contents of IAA,ICI,ICA and IFA in corn leaves with their results of (196.25±7.10),(26.21±2.13),(18.65±2.02),(13.62±2.06) μg/kg,respectively.Meanwhile,the proposed method was also successfully applied in the analysis of wheat(TriticumaestivumL.),pea(PisumsativumL.) and bristly starbur(AcanthospermumhispidumDC.),which indicated that the method had a good generality.
corn leaves;indole-3-acetic acid;indole-3-methanol;indole-3-carboxaldehyde;indole-3-carboxylic acid;ultra-performance liquid chromatography tandem mass spectrometry(UPLC-MS/MS)
2017-02-12;
2017-02-28
国家自然科学基金项目(31272066)
10.3969/j.issn.1004-4957.2017.06.005
O657.63;Q946.8851
A
1004-4957(2017)06-0732-06
*通讯作者:罗小勇,教授, 研究方向:除草剂毒理学,Tel:0532-86080835,E-mail:luo-xiaoyong@163.com

