食品中霉菌毒素样品前处理及分析方法研究进展
谭 杰,杜苑琪,肖小华,李攻科
(中山大学 化学学院,广东 广州 510275)
食品中霉菌毒素样品前处理及分析方法研究进展
谭 杰,杜苑琪,肖小华*,李攻科*
(中山大学 化学学院,广东 广州 510275)
霉菌毒素广泛存在于食物和动物饲料中,可经食物链传递危及动物与人体健康,带来严重的食品安全问题。食品基体复杂,霉菌毒素结构多样、含量极低,其分离分析需要高效的前处理技术及快速灵敏的分析方法。该文综述了基于分子印迹聚合物、量子点材料、石墨烯类碳材料、生物材料等新型分离介质的固相(微)萃取、液相(微)萃取、免疫亲和层析、磁分离等样品前处理技术及液相色谱-质谱、免疫分析法、生物传感器等分析方法在食品霉菌毒素分析中的应用,并展望了其发展趋势。
食品;霉菌毒素;样品前处理;分析方法;综述
霉菌毒素是霉菌的次生代谢产物,不仅可使血管发生扩张、收缩或对中枢神经系统产生严重伤害,而且有些毒素(如黄曲霉毒素)还具有严重的致癌、致畸、致突变性[1]。霉菌毒素根据其繁殖环境可分为田间霉菌毒素和仓储霉菌毒素,其中田间霉菌毒素是农作物在田间生长过程中受霉菌污染而分泌,主要包括萎蔫酸、烟曲霉毒素、念珠菌毒素、单端孢霉烯毒素、呕吐毒素、蛇形菌素等;仓储霉菌毒素是谷物在储藏过程中受霉菌污染而产生,主要包括黄曲霉毒素(Aflatoxins,AFs)、青霉菌毒素等。根据其化学结构不同,霉菌毒素可分为刚性共面苯环结构(如黄曲霉毒素)、部分共面结构(如玉米赤霉烯酮(也称F-2毒素)和赫曲霉毒素(OTA))以及非共面倍半萜烯结构(如呕吐毒素和T-2毒素)3大类,常见的毒素结构如图1所示。
霉菌毒素广泛存在于花生、蚕豆、豌豆、玉米、小麦等食物中,尤其是易被霉菌污染的谷物、坚果、果脯、咖啡、可可粉、香料、油籽、干豌豆、黄豆等。这些食物在生产、加工、运输和储藏过程中的任一环节均可能受到霉菌的污染,而霉菌毒素普遍耐高温、化学性质极其稳定,因此常规的食物加工条件无法将它们破坏或除去[2];食用含有这些霉菌毒素的食物可导致人体一系列疾病[3],从而引发严重的食品安全事件。因此,对食品中霉菌毒素进行快速准确分析检测具有重要意义。但是,这些毒素的化学结构差异大、含量跨度范围广且样品基体复杂多变,其快速高效的样品前处理方法和灵敏准确的分析方法研究成为近年来的热点。目前,基于分子印迹聚合物(MIPs)、量子点材料(QDs)、石墨烯类碳材料、生物材料等新型分离介质的高效样品前处理技术[4]如固相萃取(SPE)、QuEChERS(Quick,Easy,Cheap,Effective,Rugged,Safe)、液相微萃取、磁分离、免疫亲和层析等,以及酶联免疫吸附法(ELISA)、液相色谱-质谱联用法(LC-MS)[5]和生物传感器等高灵敏分析方法在霉菌毒素分析中的应用越来越多。本文综述了近年来食品中霉菌毒素的样品前处理技术和分析方法研究进展,并展望了其发展趋势。
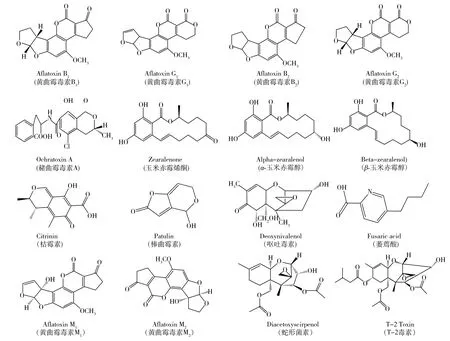
图1 常见霉菌毒素的分子结构Fig.1 Molecular structures of typical mycotoxins
1 霉菌毒素样品前处理方法研究进展
常用的霉菌毒素样品前处理方法有固相萃取法、QuEChERS法、液相微萃取法、免疫亲和层析法与磁分离技术等,表1总结了常用的霉菌毒素样品前处理方法的适用范围及优缺点。
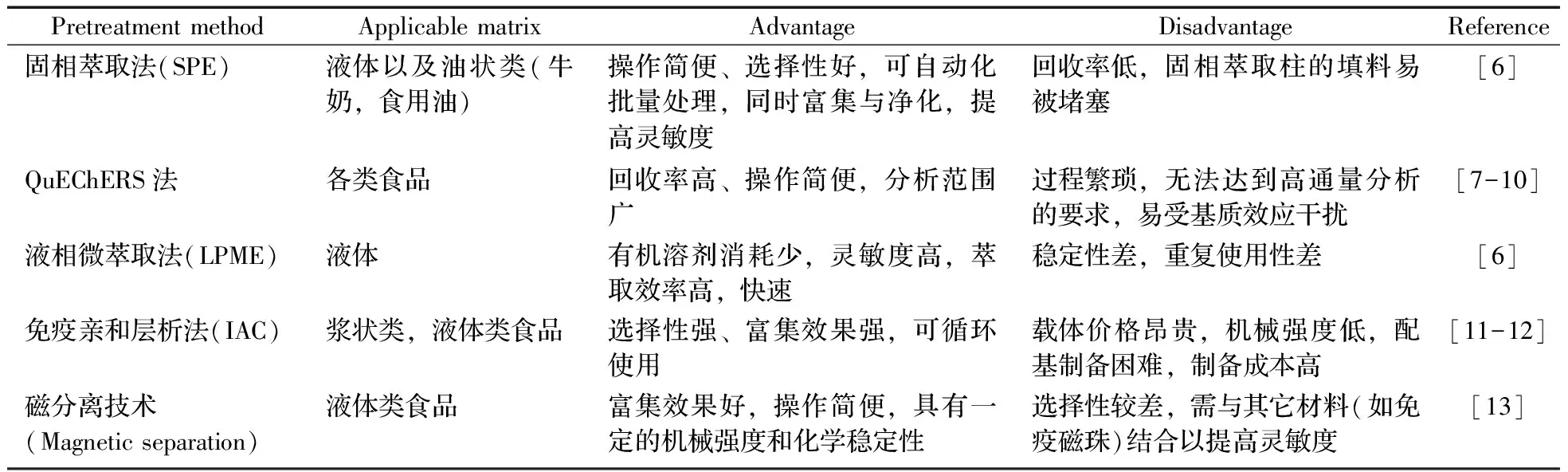
表1 常用的霉菌毒素样品前处理方法的适用范围及优缺点
1.1 固相萃取法
固相萃取法(Solid-phase extraction,SPE)是目前食品中霉菌毒素分析的主要前处理方法。需要根据霉菌毒素的结构和性质选择合适的吸附剂,传统的吸附剂包括硅藻土、人造丝、蓝棉、C18、聚合物吸附剂[14]等。近年来,一些新的分离介质如石墨烯类碳材料、分子印迹材料、金属有机骨架(MOFs)材料等逐步得到应用。Wang等[15]比较了C18,PSA,HLB,MCX,Silica,NH26种不同吸附剂对链格孢毒素、赭曲霉毒素A(OTA)、棒曲霉素和桔青素等8种霉菌毒素的吸附效果,发现MCX和NH2的吸附效果较好。
碳纳米管、石墨烯等碳材料具有较大的比表面积和良好吸附性能,常用于SPE等前处理方法中。将多壁纳米管涂覆到十八烷基硅胶修饰的磁性纳米粒子上后[16],这类磁性纳米粒子对霉菌毒素具有很好的吸附效果,可用于玉米中痕量玉米赤霉烯酮(ZEN)及其次级代谢产物(包括β-玉米赤霉醇、α-玉米赤霉烯醇、α-玉米赤霉醇和玉米赤霉酮)的富集和净化。将含羧基的氧化石墨烯与含氨基的二氧化硅微球偶联制得的二氧化硅-氧化石墨烯复合材料作为固相萃取材料,利用氧化石墨烯的良好吸附能力,用于植物油中黄曲霉毒素 B1(AFB1)和B2(AFB2)的高效富集[17],经HPLC分析后的检出限分别为0.17,0.05 μg/L。
采用分子印迹材料作为吸附剂,可改善SPE的选择性并提高分析方法的灵敏度[18-20],其与固相萃取、固相微萃取等联用技术可进一步解决样品中的基质干扰问题。如以商品化的印迹萃取柱AFFINIMIP富集啤酒、红酒、葡萄汁中赭曲霉毒素时[21],单支萃取柱可循环使用10次以上。将OTA印迹材料通过大孔膜密封在微固相萃取柱中,富集后将萃取柱取出并超声解吸[22],结合HPLC方法可高灵敏地分析咖啡、葡萄汁和尿液中的赭曲霉毒素,其检出限低至0.06 ng/g和0.02 ng/mL。Abou-Hany等[23]采用4种结构类似交链孢霉素的模板制备分子印迹聚合物微粒,实现了西红柿等样品中交链孢霉素的选择性富集测定。由于霉曲毒素标准品量少价高,直接采用目标毒素作为模板分子的成本较高。因此,采用便宜易得、具有类似化学结构的化合物作为替代模板分子开展印迹聚合物研制受到了广泛关注,如以2-萘甲酸作为桔霉素的替代模板、2,4-二羟基苯甲酸环十二酯作为ZEN的替代模板[24];以吡啶甲酸为镰孢菌酸的模板分子[25];或以N-(4-氯-1-羟基-2-萘甲酰基氨基)-L-苯丙氨酸作为OTA的替代模板[26]等。此外,以掺杂 Al3+的硅溶胶为功能单体,赭曲霉毒素为模板分子时,Al3+的原子轨道与赭曲霉毒素的羟基产生强配位并取代硅烷水解后的羟基氢,从而提高分子印迹聚合物膜的稳定性和特异性识别能力[27],这种配位印迹电化学传感器对赭曲霉毒素有良好的选择性和灵敏度。
SPE方法简单、富集效率高且易于与液相色谱在线联用,可减少样品损耗并提高方法灵敏度[28-30],Campone等[31]建立了牛奶和奶制品中AFM1的在线SPE-UPLC/MS分析方法。采用盐析液液微萃取去除样品中的蛋白质并萃取分析物后,将萃取液固相萃取富集、净化并在线分析,整个在线分析时间不足20 min,方法的定量下限可低至0.5~0.6 ng/kg,低于欧盟限量标准25倍以上。
1.2 QuEChERS法
QuEChERS的原理与高效液相色谱(HPLC)和固相萃取(SPE)相似,利用吸附剂填料与基质中杂质相互作用而达到除杂净化的目的。因其可分析对象的范围广、分析速度快、溶剂使用量少,近年来已逐渐成为霉菌毒素分析的常用前处理手段。Liu等[32]将芝麻酱样品用乙腈水溶液提取、硫酸镁和氯化钠盐析后,用正己烷和C18净化,并结合UHPLC-MS/MS分析了黄曲霉毒素、赭曲霉毒素等26种霉菌毒素,其检出限低于欧盟允许的最大残留量。采用QuEChERS/气相色谱-质谱联用(GC-MS)测定爆米花中的多种毒素(呕吐毒素、雪腐镰刀菌烯醇、15-乙酰基脱氧雪腐镰刀菌烯醇、镰刀菌酮-X、玉米赤霉烯酮)时[33],其检出限和定量下限分别小于65,196 μg/kg。此外,QuEChERS法也成功地用于葛根[34]、香菇[35]和鸡蛋[36]等食品中数十种霉菌毒素的同时分离富集分析。
Frenich 等[37]采用 QuEChERS/UHPLC-MS/MS 法测定了蛋制品中的 10 种毒素(白僵菌素、环肽 A、环肽 A1、环肽 B1、桔霉素、AFB2、AFG1、AFB1、AFG2和 OTA),检出限为 1.0~5.0 μg/kg。Zhou等[38]结合分散固相萃取法和QuEChERS法对样品预处理后,用电喷雾串联质谱仪在负离子MRM模式下进行测定,建立了面粉中10种霉菌毒素的UHPLC-MS/MS分析方法。Sun等[39]将谷类样品用0.1%甲酸乙腈溶液提取后,采用QuEChERS法净化,建立了谷物中25种霉菌毒素的UHPLC-MS/MS分析方法,检出限为 0.03~15 μg/kg。QuEChERS法与LC-MS/MS进行联用后,不仅可实现多种类别物质的分析,同时大大提高了分析通量,扩展了其应用范围。Dzuman等[40]建立了389种多类别食品有机污染物(323种农药残留,55种霉菌毒素和11种吡咯烷类生物碱)的QuEChERS/HPLC-HRMS/MS分析方法,该方法在小麦、韭菜和茶叶中得到成功应用。
QuEChERS法作为一种广谱性的残留前处理技术,已被广泛用于各类初级农产品、水产品、乳制品、深加工食品、生态环境和纺织品等基质中农药、兽药、毒素和其它污染物的分析。食品中霉菌毒素广泛且种类繁多,QuEChERS在食品检测领域中是较为常用的前处理方法,可对不同类别的物质进行同时分析检测,节约了大量的溶剂和分析时间,Pizzutti等[41]采用QuEChERS法提取和净化,建立了葡萄酒中36种霉菌毒素的UHPLC-MS/MS分析方法。采用类似方法分析谷物中22种杀虫剂和17种霉菌毒素时[42],方法的检出限可低至0.20~29.7 μg/kg。Romero-González等[43]分析了小麦、黄瓜和红酒中约90种食品有机污染物(农药、生物农药和霉菌毒素),霉菌毒素有黄曲霉毒素(AFB1,AFB2,AFG1,AFG2),赭曲霉毒素A,T2毒素,HT-2毒素,发现QuEChERS结合HPLC-MS可成功应用于实际样品中目标物的测定。总体而言,QuEChERS法的应用对象不受限制,液态、固态和粘稠态等状态的物质均能应用,通过与LC-MS分析方法相结合,可分析的对象多,分析速度快,准确度高,在食品领域中发挥着十分重要的作用。
1.3 液相微萃取
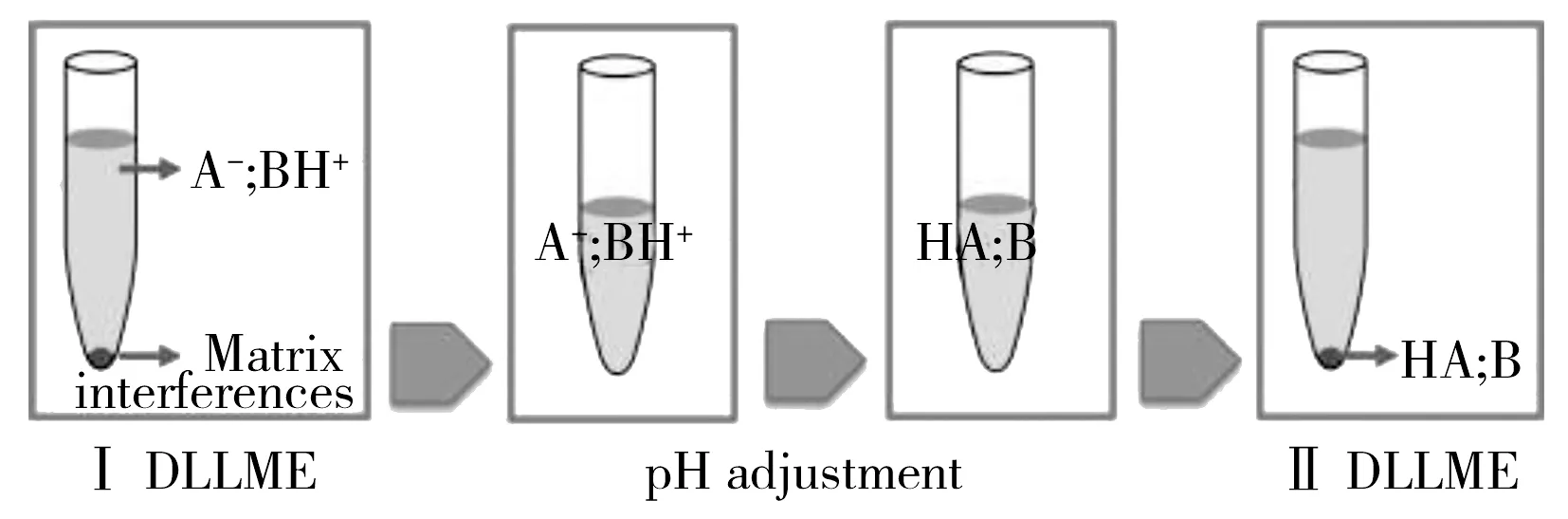
图2 通过pH 值调节的分散液液微萃取的基本原理[46]Fig.2 Schematic illustration of pH-controlled dispersive liquid-liquid microextraction[46]
液相微萃取(Liquid-phase microextraction,LPME)法集萃取、浓缩于一体,因具有消耗溶剂少、富集效率高、操作简单等优点而得到快速发展和应用。正庚醇、正辛醇、甲苯等中低极性溶剂是常用的萃取剂。如Rempelaki等[44]以甲苯为萃取剂,建立了啤酒中玉米赤霉烯酮的LPME-LC/MS分析方法,检出限为0.44 μg/kg。分散液液微萃取(Dipersive liquid-liquid microextraction,DLLME)是近年来一种新的液相微萃取形式,它通过微量注射器将萃取剂注入样液中,在分散剂-水相内形成萃取剂微珠,扩展了萃取剂与水样的接触面积,从而可加快萃取平衡,提高萃取效率和富集倍数。采用氯仿和乙腈分别作为萃取剂和分散剂时,啤酒中玉米赤霉烯酮毒素(ZEN)的富集因子为43.3,萃取液经HPLC分析后,其检出限为0.12 pg/μL[45]。最近,Campone等[46]建立了一种基于pH值控制的DLLME方法,通过不同pH值下的2个连续DLLME过程来实现。谷物样品先用甲醇萃取,萃取液中的疏水性杂质在pH 8.0的条件下用氯仿去除(一级DLLME),然后将上清液调至pH 2.0,OTA用二溴乙烷浓缩(二级DLLME),然后采用HPLC分析,OTA的检出限和定量下限分别为0.019,0.062 μg/kg,其基本原理如图2所示。该方法不仅可改善分散液液微萃取的选择性,还可拓展其在可电离化合物分离富集中的应用。
离子液体是一种结构可调、化学物理性能独特的新型绿色溶剂,Bozkurt等[47]以1-丁基-3-甲基咪唑双三氟甲磺酰亚胺离子液体为分散液富集玉米赤霉烯酮,建立了啤酒和谷物食品中玉米赤霉烯酮的DLLME/HPLC分析方法,检出限为0.25 μg/L。而以1-丁基-3-甲基咪唑六氟磷酸盐离子液体为涡旋辅助分散液液微萃取的萃取剂时[48],玉米类食品中玉米赤霉烯酮的HPLC方法检出限为0.3 μg/kg,这些应用均表明离子液体在霉菌毒素分离富集中具有良好的应用潜力。
1.4 免疫亲和层析
免疫亲和层析(Immunoaffinity chromatography,IAC)是利用生物体内抗原、抗体之间高度特异性的亲和力进行分离,其选择性好、富集效率高。目前,黄曲霉毒素(AFs)、赭曲霉毒素、玉米赤霉烯酮(ZEN)、杂色曲霉素[49]等霉菌毒素的免疫亲和柱均已商品化。Xie等[50]将活化的琼脂糖珠与AFB1单克隆抗体蛋白偶联制得AFB1免疫亲和柱,建立了大豆、玉米、小麦等13种食品中AFB1的免疫亲和柱/超高效液相色谱-串联质谱法(IAC /UPLC-MS)分析方法,检出限低至0.01~0.05 μg/kg。而将冰激凌样品的磷酸盐(PBS)提取液经免疫亲和柱净化后采用UPLC-MS/MS分析,AFM1的检出限低至0.4~3.0 ng/kg[51]。为进一步将高效的IAC富集和快速的光分析法结合,Duan等[52]通过微乳化技术封装CdSe/ZnS制备出量子点微珠,并将量子点置于免疫层析装置中测定玉米赤霉烯酮(ZEN),方法的检出限为3.6 μg/kg,其交叉反应表明其他霉菌毒素对ZEN无干扰,可用于实际样品中ZEN的快速筛查。
部分商品化的免疫亲和柱也可用于多种霉菌毒素的同时富集,如蜂花粉中的黄曲霉毒素(AFB1,AFB2,AFG1,AFG2)和赭曲霉毒素(OTA)[53];猪肉、鱼肉、猪肝等动物源食品中的6种黄曲霉毒素(AFB1,AFB2,AFG1,AFG2,AFM1和AFM2)和6种玉米赤霉醇类真菌毒素[54]以及小麦、玉米及其制品中的黄曲霉毒素(AFB1,AFB2,AFG1,AFG2)、赭曲霉毒素、伏马菌素(B1,B2)、玉米赤霉烯酮(ZEN)、呕吐毒素、雪腐镰刀菌烯醇、T-2以及HT-2等[55]。结合HPLC-MS/MS方法,毒素的检出限一般可低至0.05 μg/kg数量级,远低于欧盟的限量标准。为了进一步提高免疫亲和柱的同时分析能力,研制新型多毒素免疫亲和柱得到了较多关注。Zhang等[56]先制备AFs,OTA,ZEN和T-2毒素的单克隆抗体,将4种抗体与琼脂糖-4B结合制备得到多抗体的免疫亲和柱(mIAC),结合HPLC-MS/MS分析了农产品中的7种霉菌毒素,方法的检出限为0.04~0.4 μg/kg。Hu等[57]采用自制的多毒素免疫亲和柱同时富集黄曲霉毒素(AFB1,AFB2,AFG1,AFG2),ZEN,OTA,杂色曲霉素和T-2毒素,使用HPLC方法分析的检出限为0.006~0.12 ng/mL,该方法已成功用于80多种饲料中霉菌毒素的分析,具有快速、灵敏度高且耐用等优点,符合中国和欧盟国家的分析标准。
1.5 磁分离(Magnetic separation)
磁分离技术是将物质进行磁场处理的一种技术,材料与目标物在外加磁场的作用下发生相互作用而实现强化分离。Turan等[58]制备了分子印迹磁性微球,建立了葡萄汁中赭曲霉毒素的印迹微球萃取/紫外光谱分析方法。材料的饱和吸附量为34.5 mg/g,印迹因子为3.9,方法检出限为0.374 μg/mL。Xu等[59]通过磁性静电纺丝控制磁性,建立了一种黄曲霉毒素B1的高灵敏免标记电化学发光分析方法。它通过静电纺丝良好的导电性能和生物相容性、较大的比表面积,以及可放大鲁米诺电化学发光信号的特性,将黄曲霉毒素B1(AFB1)与特异性抗体相结合,经过电化学发光信号放大后,AFB1的检出限为0.02 ng/mL。该方法已成功应用于实际样品的检测,且稳定性和重现性好。Taherimaslak等[60]以乙二醇双巯基乙酸酯修饰的磁性Fe3O4纳米微球富集AFM1,采用β-环糊精作为荧光增敏试剂,建立了牛奶样品中黄曲霉毒素M1的分析方法。高表面积和磁性特性使该方法比传统的固相萃取法更快速,其富集因子更高(约57),检出限更低。Mashhadizadeh等[61]采用同样的材料富集谷物中的赭曲霉毒素,建立了谷类食物中赭曲霉毒素的SPE/HPLC分析方法,该方法对大米、小麦和玉米样品中赭曲霉毒素的检出限分别为0.06,0.03,0.05 ng/mL。
另一方面,采用高分散磁性四氧化三铁微球吸附抗体后,大大降低了ELISA方法中AFB1的检出限[62],可检出实际样品提取液中低至2 pg/mL的AFB1。Urusov等[63]通过磁性四氧化三铁微球固定抗体后,大大减少了样品基体的影响,加快了样品处理速度并降低了ELISA方法的检出限,提高了方法灵敏度。大麦和玉米萃取液中黄曲霉毒素B1的检出限低至20 pg/mL,而总分析时间仅需20 min,大大优于常规的ELISA方法。经抗体修饰的磁珠可用作免疫磁珠探针,如Wang等[64]将黄曲霉毒素B1抗体用金纳米粒子标识后,用黄曲霉毒素B1-牛血清白蛋白偶联物修饰磁珠并以其作为探针,将探针与金纳米粒子标记的抗体相结合,磁分离后未结合的溶液则直接通过紫外光谱分析。该方法的检出限为12 ng/L,赭曲霉毒素、T2毒素等不干扰黄曲霉毒素B1的检测。霉菌毒素经免疫磁珠分离后,通过色谱等方法进行分析,可进一步提高分析方法的灵敏度和准确度。邢言言等[65]通过将N-羟基丁二酰亚胺偶联磁珠与抗黄曲霉毒素抗体偶联得到免疫磁珠,建立了陈皮中 4 种黄曲霉毒素的免疫磁珠分离/超高效液相色谱(UHPLC)分析方法,检出限为0.013~0.038 μg/kg。
经抗体修饰的免疫磁珠可与IAC结合使用,用于霉菌毒素的快速检测。黄艳梅等[66]以喷涂了检测抗原黄曲霉毒素M1-BSA 和驴抗鼠二抗形成检测线和质控线的硝酸纤维膜制备免疫层析试纸条,采用乙基-(3-二甲基丙基)碳二亚胺盐酸盐-N-羟基琥珀酰亚胺(EDC/NHS)法制备偶联了AFM1单克隆抗体的免疫磁珠。将免疫磁珠与待检样本混合,经捕获、磁分离后,浓缩重悬液直接采用免疫层析试纸条检测,建立了集浓缩样本与免疫层析于一体的AFM1快速检测法。方法用于原料乳中AFM1的检测,检出限为0.1 μg/L,低于我国制定的AFM1限量标准(0.5 μg/L),与其它真菌毒素和原料乳中常检的违法添加物无交叉反应,分析结果与酶联免疫吸附法(ELISA)结果吻合,有很好的应用前景。
1.6 超声波辅助萃取法(UAE)
在食品等复杂样品中痕量霉菌毒素的分离分析中,霉菌毒素的分离主要分为2个过程:毒素从样品中转移到萃取溶剂,以及毒素从溶剂中被分离富集。其中第一个过程相对较慢,决定了萃取速度;第二个过程相对较快,决定富集效率。近年来,采用热、声、电、磁、力及微波场等外场辅助萃取技术通过外场强化样品处理过程中的传热和传质过程,加快了样品处理速度,提高了样品处理效率。其中,UAE可通过超声波的空化作用增加溶剂进入样品的渗透性,加强其传质过程,提高样品中目标组分的萃取率,近年来在食品、环境、生物、医药等领域应用广泛,在霉菌毒素的分离分析中应用越来越多。如采用UAE方法可增加谷物产品中赭曲霉毒素的提取效率[67]。在实际应用中,一般将UAE与其他富集方法(如分散固相萃取、分散液液微萃取、QuEChERS等方法)结合使用,在提高样品处理速度的同时提高霉菌毒素的富集效果,结合高灵敏分析方法实现霉菌毒素的高效高灵敏分析。如采用超声辅助-分散固相萃取结合HPLC分析奶粉中的AFM1[68]、超声波辅助-分散液液微萃取/HPLC分析水果中OTA和橘霉素[69]、超声波辅助-微QuEChERS萃取/UPLC分析谷类食物中的玉米赤霉烯酮(ZEN)[70]等,均能大幅减少溶剂消耗和样品损失,并使霉菌毒素的检出限低至μg/kg以下水平。Kong等[71]将肉豆蔻样品用UAE萃取后,采用商品化的免疫亲和柱净化富集,用HPLC-光电衍生-FLD分析,建立了一种超声辅助-固液萃取/免疫亲和柱/柱后光电衍生-高效液相色谱法分析多种毒素(AFB1,AFB2,AFG1,AFG2,OTA)的方法,检出限和定量下限分别为0.02~0.25 μg/kg和0.06~0.8 μg/kg,并成功用于13种市售肉豆蔻中黄曲霉毒素和赭曲霉毒素的高灵敏分析检测。
2 霉菌毒素分析方法研究进展
霉菌毒素经过不同前处理方法处理后,一般采用液相色谱法、液相色谱-质谱联用法、气相色谱-质谱联用法、免疫分析法、荧光分析法等方法进行分析。以OTA分析为例,表2列出了不同样品中OTA的分析方法及其结果对比情况。
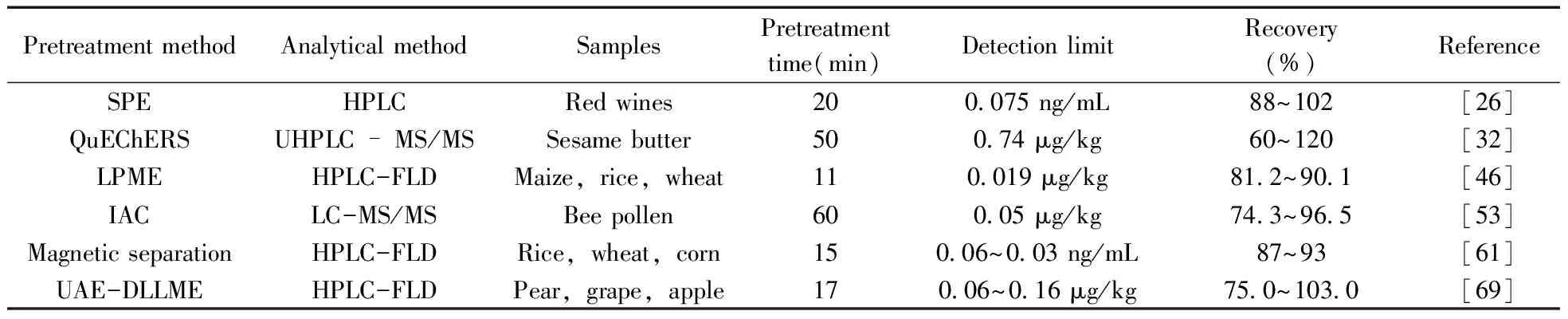
表2 不同样品中OTA的分析方法及其结果对比
从表2可以看出,霉菌毒素存在于各类食品中,QuEChERS法可对各类样品进行前处理,能满足高通量的分析需求,结合液相色谱质谱联用技术甚至对不同类别的物质也能同时分析,是霉菌毒素分析的主要前处理方法;LC-MS/MS分析方法与前处理技术的联用则能达到更高的灵敏度,同时液相色谱应用面广,成为霉菌毒素分析的主要方法。
2.1 液相色谱及液相色谱-质谱联用
高效液相色谱(HPLC)和液相色谱-质谱联用(LC-MS/MS)方法简单、快速、灵敏和高通量,是目前霉菌毒素分析通行的标准方法。采用LC-MS分析饲料中多种霉菌毒素及其代谢物[72],其检出限为0.11~0.60 μg/L。结合SPE和QuEChERS等高效样品前处理技术可进一步提高分析方法的灵敏度和准确度,如采用微固相萃取/液相色谱-串联质谱(LC-MS)对饮料和罐装咖啡等食物中的黄曲霉毒素进行分析[73]。在LC-MS中采用多反应监测模式下的正离子和负离子同时检测,可实现数十种霉菌毒素的同时分析检测。如Liu等[74]以ZEN作为内标物,建立了槟榔中11种霉菌毒素的UHPLC-ESI-MS/MS分析方法,定量下限低于50 μg/kg,检出限为0.1~20 μg/kg。
2.2 气相色谱-质谱联用法(GC-MS)
由于霉菌毒素的挥发性较低、热稳定性高,因此与HPLC-MS法相比,GC-MS法在霉菌毒素的实际检测中存在一定的局限性,目前主要用于镰刀霉菌毒素及棒曲霉素等的分析检测。如Yelko等[75]建立了谷物中单端孢霉烯族毒素、棒曲霉素和ZEN毒素的QuEChERS/气相色谱-质谱联用分析方法,定量限低于10 μg/kg,相对标准偏差低于9%。Pereira等[76]采用类似方法同时检测了婴儿食品中12种棒曲霉素,方法的检出限和定量下限分别为0.37~19.19 μg/kg和1.24~63.33 μg/kg,该方法已成功用于9种市售婴儿食品中棒曲霉素的检测。通过样品衍生化方法可拓展GC-MS方法在霉菌毒素分析中的应用,如Qian等[77]将食用植物油中的玉米赤霉烯酮及其5种衍生物毒素用含0.1%三甲基氯硅烷的N,O-双(三甲基硅烷基)乙酰胺硅烷衍生化后采用GC-MS分析,方法的定量下限为0.03~0.2 μg/kg,回收率为80.3%~96.5%,可满足分析要求。
2.3 免疫分析法
免疫分析法也是食品中霉菌毒素较常使用的分析方法。其中,酶联免疫吸附法(ELISA)因特异性强、灵敏度高、使用简单而应用较多。目前,商品化的ELISA检测试剂盒已推向市场,主要包括黄曲霉毒素、OTA、ZEN等。但ELISA一般只能检测一种物质且受基体影响,易导致“假阳性”,常用于实际样品中霉菌毒素的快速初筛。曹冬梅等[78]基于G8-AP建立了检测AFB1的一步 ELISA 法,检出限为2.6 ng/mL。王吕等[79]以驴抗鼠二抗包被微孔板,以捕获方式包被抗OTA单克隆抗体,利用噬菌体随机七肽库筛选 OTA 模拟抗原表位,并以其替代检测抗原,建立了基于噬菌体展示技术的酶联免疫吸附分析检测OTA的方法,OTA 的检出限为0.03 ng/mL。以合成OTA-牛血清白蛋白偶联物作为抗原免疫 Balb/c小鼠产生高亲和性抗OTA单克隆抗体,建立了灵敏的间接竞争酶联免疫吸附测定法,该方法对OTA的检出限为1.4 μg/kg[80]。用黄绿青霉素-牛血清蛋白(CIT-BSA)免疫 Balb/c小鼠得到CIT单克隆抗体,建立了灵敏的CIT间接竞争酶联免疫吸附测定方法[81];采用类似方法可建立AFB1的间接竞争酶联免疫分析方法[82]。此外,Li等[83]制备了一种高度特异性、高灵敏度的抗T-2毒素单克隆抗体,该抗体仅与T-2毒素结合,能排除大多数毒素的干扰(包括HT-2毒素),其检测结果与UHPLC-MS/MS方法吻合。
在多种霉菌毒素同时检测方面,Du等[84]建立一种分析多类霉菌毒素的斑点酶联免疫法(dot-ELISA),该方法能对多类霉菌毒素进行半定量分析。Venkataramana等[85]制备了一种高度特异性的OTA单克隆抗体,并建立了一种夹心斑点ELISA(s-dot ELISA)法,该方法对OTA的检出限为5.0 ng/mL。ELISA能与金、硅等纳米粒子产生共振现象,形成电浆ELISA。与传统的ELISA方法相比,将纳米复合材料-SiO2@PAA @CAT@OTA1∶1作为竞争性抗原,可提高电浆ELISA 法的灵敏度[86],该方法对OTA的检出限为5 × 10-20g/mL,如图3所示。
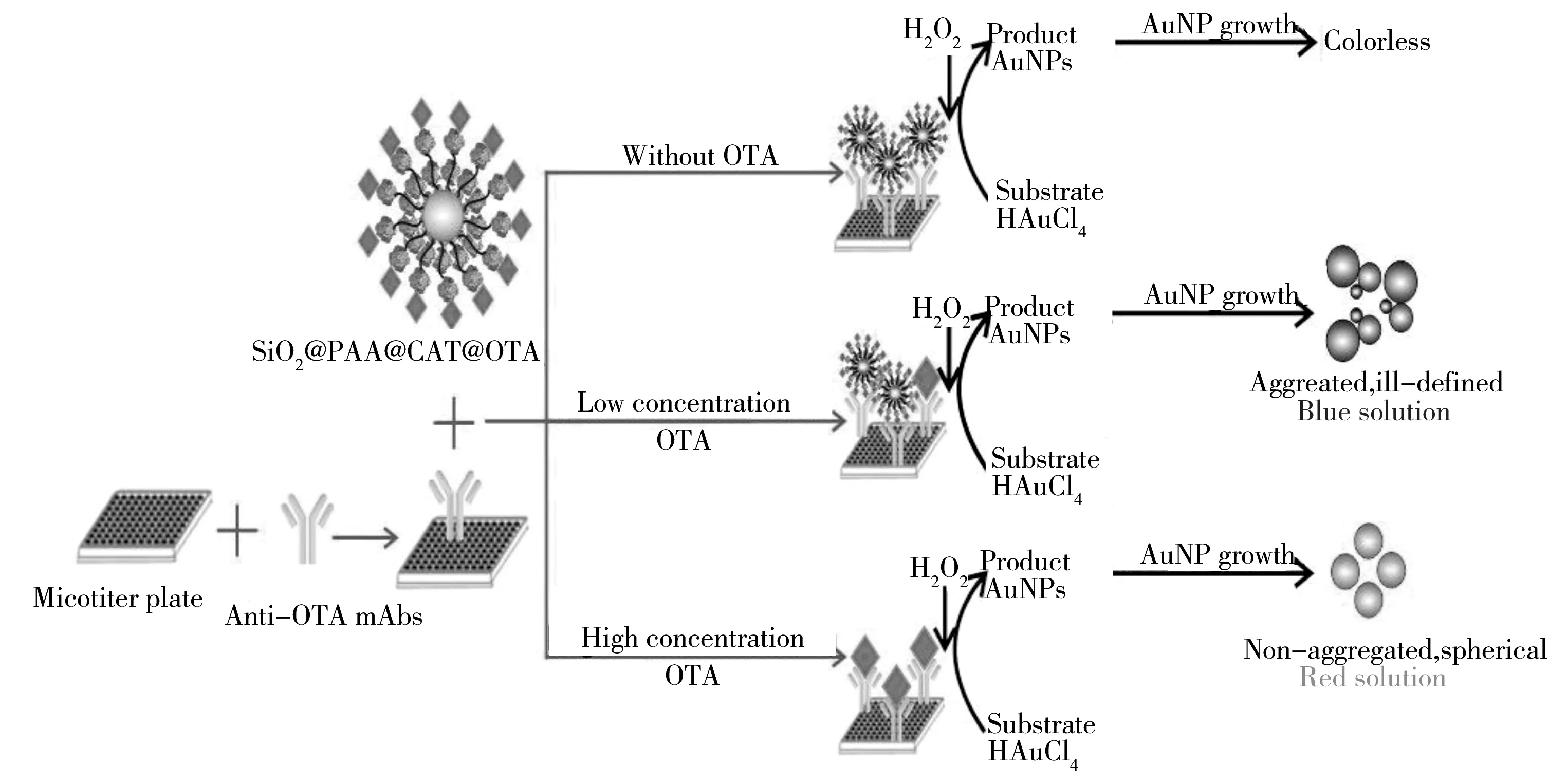
图3 基于过氧化氢酶催化长大的金纳米粒子的定量免疫测定法示意图[86]Fig.3 Schematic diagram of the proposed quantitative immunoassay based on CAT-catalyzed growth of AuNPs [86]
胶体金免疫层析技术是在酶联免疫吸附法(ELISA)、单克隆抗体技术、胶体金技术、乳胶凝集试验、免疫层析技术和新材料技术基础上发展起来的一种快速、灵敏的免疫检测方法[87]。郑百芹等[88]采用柠檬酸三钠还原法制备直径 40 nm 的胶体金溶液,然后利用胶体金标记抗脱氧雪腐镰刀菌烯醇(DON)单克隆抗体制备胶体金免疫复合物,建立了DON的免疫胶体金快速检测方法。该方法在15 min内即可完成检测,特异性、稳定性、准确性均较好,有望成为脱氧雪腐镰刀菌烯醇样本的快速筛选手段。Kolosova等[89]建立了同时快速检测脱氧雪腐镰刀菌烯醇(DON)和玉米赤霉烯酮毒素的侧流免疫胶体金方法。10 min内即可快速可视化定性,可用于食品中霉菌毒素的现场筛选。采用包裹AFB1抗体蛋白的金胶体作为识别探针,将植物油的油相与水混合,之后在免疫试条上对AFB1进行可视化检测,其检出限为1.5 mg/kg,分析时间仅需5 min,该方法可实际应用于家用植物油中AFB1毒素的检测[90]。
2.4 生物传感器
生物材料的进一步发展主要体现在生物传感器[91]、胶体金、适配体芯片等技术的应用[92-93]。杜祎等[94]将AFs氧化酶固定化后与过氧化氢电极构成电流型酶电极,构建了用于测定AFB1的生物传感器,并成功用于花生样品的测定,其测定结果与薄层色谱法、ELISA法有较好的一致性。基于固定乙酰胆碱酯酶构建的电导型生物传感器可用于不同霉菌毒素的分析测定[95],但更适合AFB1或总毒素含量的测定。而基于巯基乙胺自组装膜构建的电化学传感器[96]对串珠镰刀菌毒素的检出限为8.3× 10-10mol/L,且其结果与HPLC无显著性差异。此外,Kong等[97]以研制的多免疫层析(IAC)试纸条对20种霉菌毒素进行半定量和定量检测,其半定量检测结果只需20 min即可通过肉眼观察到,可用于现场检测和谷物样品中霉菌毒素的快速筛选。Pacheco等[98]在玻碳电极上先后修饰多壁碳纳米管和分子印迹涂层,构建了一种OTA的电化学传感器,其对OTA的检出限为1.7 μg/L,定量下限为5.7 μg/L,已成功用于啤酒和白酒等实际样品中OTA的分析检测。将羧酸化的多壁碳纳米管沉积到ITO表面,然后修饰AFB1单克隆抗体用于构建电化学传感器[99],可高灵敏、选择性地分析AFB1,其检出限低至0.08 ng/mL。周琳婷等[100]依次电沉积氧化石墨烯、2,5-二(2-噻吩)-1-对苯甲酸吡咯和氯金酸于金电极表面,以EDC/NHS为活化剂,将AFB1抗体共价连接在导电高分子膜上,最后滴涂1,3-二丁基咪唑六氟磷酸盐离子液体于该修饰电极表面,制得AFB1免疫传感器,该传感器对AFB1的检出限为1.1× 10-15mol/L,可用于花生等样品中痕量AFB1的测定。
石墨烯的比表面积大且富含π电子,具有良好的热稳定性及化学稳定性[101],已作为性能优良的吸附材料广泛应用于样品前处理研究[102]。石墨烯经过适当处理可得到表面有羧基、羟基等活性基团的氧化石墨烯,进一步修饰得到的功能化石墨烯可用于食品、药物、环境污染物、生物分子中痕量分析物的分离富集[103-104]。当使用氧化石墨烯纳米片作为赭曲霉毒素适体(OTA-apt)的电化学探针时[105],由于OTA-apt通过π-π 共轭作用力与氧化石墨烯选择性结合,使得该探针具有较高的选择性和抗干扰性。结合石墨烯材料良好的吸附能力和免疫分析的高灵敏检测,构建了霉菌毒素高灵敏免疫传感器。如在导电高分子膜的内外分别引入导电性好和比表面积大的石墨烯和纳米金,可提高修饰层的电子转移速率,制得的免疫传感器对AFB1的检出限低至 1.1×10-15mol/L[100]。将氧化石墨烯还原并与聚吡咯和吡咯丙酸复合,通过石墨烯增强稳定性和导电性,以吡咯丙酸充当共价连接体,制成免疫传感器[106],该传感器对AFB1也具有高度选择性和高灵敏度。此外,将磁性的Fe3O4-氧化石墨烯复合物作为吸附材料,抗体标记的CdTe量子点作为探针检测AFM1[107],检出限为0.3 pg/mL;与商品化的酶联免疫吸附试剂盒方法相比,该方法具有更高的灵敏度,更快的分析速度。
采用一步电沉积法将金纳米粒子和壳聚糖沉积到金基微电极上,并进一步固载AFB1抗体构建无标记免疫传感器[108],将其用于玉米中AFB1的分析检测,检出限为0.19 ng/mL。采用端粒酶和EXO Ⅲ两级放大策略构建电化学适体传感器[109],其对AFB1的检出限可低至0.6×10-16mol/L。
与抗体相比,适配体的特异性更强,对目标靶分子具有更强的亲和力,而且它们可根据需要在体外大量快速地制备合成,因此被广泛用于霉菌毒素等化学物质的分析检测[110-111]。Guo等[112]采用单壁碳纳米管作为荧光猝灭剂,构建了羧基荧光素(FAM)-适配体传感器,与传统的传感器相比,该方法对OTA的检出限为24.1 nmol/L。张勇等[113]开发了一种便携式适配体生物传感器,结合血糖仪用于婴幼儿米粉和羊草中OTA的定量检测,检出限为 6.7×10-9mol/L,回收率为84%~122%。文献[114]基于氧化石墨烯(GO)阻止核酸酶切割破坏适配体,并调节GO尺寸得到AFB1的不同线性响应范围,从而构建了一种基于纳米氧化石墨烯(GO)和适配体修饰的AFB1的荧光传感器,其检出限可低至0.35 ng/mL。Dai等[115]将OTA适配体结合的近红外上转换纳米颗粒(apt-UCNPs)和寡核酸苷修饰的磁性纳米粒子混合得到复合材料,构建近红外适配体传感器并用于啤酒样品中OTA的检测,其检出限为0.005 ng/mL。
2.5 荧光分析法(XRF)
量子点是一种新型的半导体荧光探针,具有独特的量子效应、高的量子产率和光化学稳定性,其激发光谱宽且连续分布,已被广泛用于生命化学、环境分析等领域[116]。采用1-乙基-(3-二甲基氨基丙基)碳二亚胺(EDC)将OTA与量子点偶联制备的荧光探针[117],可高灵敏、快速检测玉米中 OTA ,其单个样品检测时间为10 min。通过水包油反相微乳化作用将CdSe/CdS/ZnS核壳型量子点包裹于二氧化硅纳米粒子中,然后进行氨基、羧基和环氧基修饰并用聚乙二醇片段稳定后,可得到稳定的荧光标记探针,该荧光标记探针与抗体共轭结合后可对呕吐毒素进行快速、高灵敏度的现场测定[118]。量子点荧光探针在黄曲霉毒素分析中得到较多应用,如Speranskaya等[119]将CuInS2/ZnS量子点封装于聚乙二醇中得到水溶性量子点,然后与AFB1-蛋白衍生物结合作为荧光探针对AFB1进行荧光测定。与传统的酶联免疫吸附法相比,该方法具有更高的灵敏度。采用CdTe量子点与AFB1单克隆抗体结合形成共轭配合物建立直接竞争荧光免疫吸附法,检出限低至0.016 ng/mL[120]。此外,基于量子点与AFB1的结合,设计了基于荧光共振能量转移的荧光探针,其结果与商品化AFB1的酶联免疫吸附测定结果无显著性差异[121]。
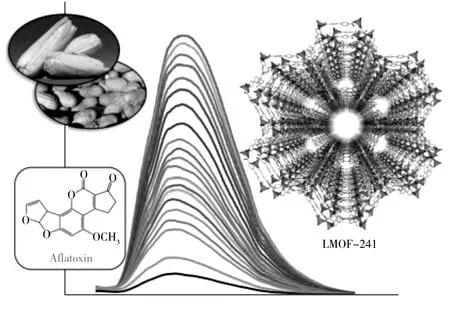
图4 基于LMOF-241材料分析黄曲霉毒素[123]Fig.4 Analysis of aflatoxin based on the LMOF-241 materials [123]
环糊精的“内疏水外亲水”空腔结构使其能与许多有机物和无机离子相结合,它们与黄曲霉毒素结合产生不同的光学现象。将β-CD-Hg 作为荧光增强剂替代国标方法的传统衍生试剂,建立了高灵敏、快速测定AFB1的荧光分析法[122],检出限为0.08 μg/L,结果与国标方法及速测方法均无显著性差异。Hu等[123]设计合成的新型发光金属有机骨架材料LMOF-241(图4)可通过荧光猝灭法实现黄曲霉毒素和OTA的灵敏检测。
2.6 其他分析方法
近年来,荧光免疫法、近红外光谱法也在霉菌毒素检测分析中得到应用。将异硫氰酸荧光素(FITC)标记 AFB1抗体制得 FITC-AFB1荧光标记抗体[124],建立了AFB1的直接竞争荧光免疫分析方法并用于中药材中 AFB1的快速检测,回收率为 90.4% ~106.6%。Hernandez-Hierro等[125]采用近红外光谱仪分析了霉菌毒素,AFB1,OTA和总黄曲霉毒素的最小二乘法相关系数和预测修正的标准差分别为0.955和0.2 μg/kg、0.853和2.3 μg/kg、0.938 和0.3 μg/kg。与色谱法相比,近红外光谱法采用光纤探头,成本更低、分析速度更快,且不需粉碎、浸提、层析等繁琐的样品前处理过程,建立的霉菌毒素检测软件与校正模型能够快速准确检测霉菌毒素的含量,从而为实际样品的快速筛选提供了依据。Arduini等[126]研制了一种同时采用比色法检测AFB1和采用荧光法检测OTA的便携式光纤检测仪,AFB1和OTA的检出限分别为10,0.1 μg/L,可用于食品等样品中AFB1和OTA的现场快速筛查。
3 展 望
霉菌毒素因存在范围广,对家禽、哺乳动物和人类健康具有严重危害而受到了社会的广泛关注,世界各国纷纷制定了食品、饲料中各类霉菌毒素严格的检测和限量标准。虽然色谱-质谱联用技术、各种免疫分析和生物传感器方法快速灵敏,一些针对食品中黄曲霉毒素等快速检测的仪器也纷纷问世。但是,受色谱法冗长的前处理过程、免疫分析法的低通量和“假阳性”等的限制,发展高选择性、高效、高通量的前处理技术,新的高灵敏分析方法,以及简捷灵敏的前处理-分析检测联用技术如样品前处理-色谱/光谱联用技术将具有广泛的发展空间和应用潜力。
[1] Turner N W,Subrahmanyam S,Piletsky S A.Anal.Chim.Acta,2009,632:168-180.
[3] Fokunang C N,Tembe-Fokunang E A,Tomkins P.OutlookAgric.,2006,35:247-253.
[4] Chen X W,Hai X,Wang J H.Anal.Chim.Acta,2016,922:1-10.
[5] Chauhan R,Singh J,Sachdev T,Basu T,Malhotra B D.Biosen.Bioelectron.,2016,81:532-545.
[6] Wu Q,Wang L,Wu D P,Duan C F,Guan Y F.Chin.J.Chromatogr.(吴倩,王璐,吴大朋,段春凤,关亚风.色谱),2014,32(4):319-329.
[7] Correia-Sá L,Fernandes V C,Carvalho M,Calhau C,Domingues V F,Delerue-Matos C.J.Sep.Sci.,2012,35(12):1521-1530.
[8] Fernandes V C,Domingues V F,Mateus N,Delerue-Matos C.J.Sep.Sci.,2013,36(2):376-382.
[9] Karageorgou E G,Samanidou V F.J.Sep.Sci.,2011,34(15):1893-1901.
[10] João Ramalhosa M,Paíga P,Morais S,Delerue-Matos C,Prior Pinto Oliveira M B.J.Sep.Sci.,2009,32:3529-3538.[11] Li B Y,Li C,Jiang H Y,Wang Z H,Cao X Y,Zhao S J,Zhang S X,Shen J Z.J.AOACInt.,2008,91:1488-1493.[12] Li C,Wang Z H,Cao X Y,Beier C,Zhao S X,Ding S Y,Li X W,Shen J Z.J.Chromatogr.A,2008,1209:1-9.
[13] Sathe T R,Agrawal A,Nie S.Anal.Chem.,2006,78:5627-5632.
[14] Pérez-Ortega P,Gilbert-López B,García-Reyes J F,Ramos-Martos N,Molina-Díaz A.J.Chromatogr.A,2012,1249:32-40.
[15] Wang M,Jiang N,Xian H,Wei D,Shi L,Feng X.J.Chromatogr.A,2016,1429:22-29.
[16] Moreno V,Zougagh M,Ríos.Microchim.Acta,2016,183:871-880.
[17] Wang H L,Yu L,Li P W,Li M,Zhang Q,Zhang W.Chin.J.Anal.Chem.(王恒玲,喻理,李培武,李敏,张奇,张文.分析化学),2014,(9):1338-1342.
[18] Zhong Q S,Hu Y F,Hu Y L,Li G K.J.Chromatogr.A,2012,1241:13-20.
[19] Hu Y L,Pan J L,Zhang K G,Lian H X,Li G K.TrAC,TrendsAnal.Chem.,2013,43:37-52.
[20] Xiao X H,Yan K L,Xu X F,Li G K.Talanta,2015,138:40-45.
[21] Cao J,Kong W,Zhou S,Yin L,Wan L,Yang M.J.Sep.Sci.,2013,36(7):1291-1297.
[22] Lee T P,Saad B,Khayoon W S,Salleh B.Talanta,2012,88:129-135.
[23] Abou-Hany R A G,Urraca J L,Descalzo A B,Gómez-Arribas L N,Moreno-Bondi M C,Orellana G.J.Chromatogr.A,2015,1425:231-239.[24] Fang G,Fan C,Liu H,Pan M,Zhu H,Wang S.RSCAdv.,2014,4:2764-2771.
[25] Appell M,Jackson M A,Wang L C,Ho C H,Mueller A.J.Sep.Sci.,2014,37:281-286.
[26] Giovannoli C,Passini C,Di Nardo F,Anfossi L,Baggiani C.J.Agric.FoodChem.,2014,62:5220-5225.
[27] He B,Wang Q,Chen M M,Wen W,Zhang X H,Wang S F.J.HubeiUniv.:Nat.Sci.(贺博,王茜,陈苗苗,文为,张修华,王升富.湖北大学学报:自然科学版),2015,3:271-275.
[28] Zhang Q C,Li G K,Xiao X H.Talanta,2015,131:127-135.
[29] Zhang C J,Li G K,Zhang Z M.J.Chromatogr.A,2015,1419:1-9.
[30] Pan J L,Zhang C J,Zhang Z M,Li G K.Anal.Chim.Acta,2014,815:1-15.
[31] Campone L,Piccinelli A L,Celano R,Pagano I,Russo M,Rastrelli L.J.Chromatogr.A,2016,1428:212-219.
[32] Liu Y,Han S,Lu M,Wang P,Han J,Wang J.J.Chromatogr.B,2014,970:68-76.
[33] Ferreira I,Fernandes J O,Cunha S C.FoodControl,2012,27:188-193.
[34] Wang S,Cheng L,Ji S,Wang K.J.Pharmaceut.Biomed.,2014,98:201-206.
[35] Han Z,Feng Z,Shi W,Zhao Z,Wu Y,Wu A.J.Sep.Sci.,2014,37:1957-1966.
[36] Zhu R,Zhao Z,Wang J,Bai B,Wu A,Yan L,Song S.J.Chromatogr.A,2015,1417:1-7.
[37] Frenich A G,Romero-González R,Gómez-Pérez M L,Vidal J L M.J.Chromatogr.A,2011,1218:4349-4356.
[38] Zhou Q,Li F,Chen L,Jiang D.J.FoodSci.,2016,81(11):2886-2890.
[39] Sun J,Li W,Zhang Y,Hu X,Wu L,Wang B.Toxins,2016,8(12):375.
[40] Dzuman Z,Zachariasova M,Veprikova Z,Godula M,Hajslova J.Anal.Chim.Acta,2015,863:29-40.
[41] Pizzutti I R,de Kok A,Scholten J,Righi L W,Cardoso C D,Rohers G N,da Silva R C.Talanta,2014,129:352-363.[42] Zhang J M,Wu Y L,Lu Y B.J.Chromatogr.B,2013,915:13-20.
[43] Romero-González R,Frenich A G,Vidal J M,Prestes O D,Grio S L.J.Chromatogr.A,2011,1218:1477-1485.[44] Rempelaki I E,Sakkas V A,Albanis T A.Anal.Methods,2015,7(4):1446-1452.
[45] Antep H M,Merdivan M.Anal.Methods,2012,4(12):4129-4134.
[46] Campone L,Piccinelli A L,Celano R,Rastrelli L.Anal.Chim.Acta,2012,754:61-66.
[47] Bozkurt S S,Isik G.J.Liq.Chromatogr.Relat.Technol.,2015,38:1601-1607.
[48] Wang L,Luan C L,Chen F F,Wang R,Shao L H.J.Sep.Sci.,2015,38:2126-2131.
[49] Sasaki R,Hossain M Z,Abe N,Uchigashima M,Goto T.MycotoxinRes.,2014,30(2):123-129.
[50] Xie J,Peng T,He J,Shao Y,Fan C,Chen Y,Jiang W,Chen M,Wang Q,Pei X,Ding S,Jiang H.J.Chromatogr.B,2015,998/999:50-56.
[51] Ossa D E H,Hincapié D A,Peuela G A.FoodControl,2015,56:34-40.
[52] Duan H,Chen X,Xu W,Fu J,Xiong Y,Wang A.Talanta,2015,132:126-131.
[53] Xue X F,Selvaraj J N,Zhao L W,Dong H M,Liu F M,Liu Y,Li Y.FoodAnal.Methods,2014,7(3):690-696.
[54] Sun X,Xi C X,Tang B B,Wang G M,Chen D D,Zhao H.Chin.J.Anal.Chem.(孙雪,郗存显,唐柏彬,王国民,陈冬东,赵华.分析化学),2016,6:970-978.
[55] Lattanzio V M T,Ciasca B,Powers S,Visconti A.J.Chromatogr.A,2014,1354:139-143.
[56] Zhang Z W,Hu X F,Zhang Q,Li P W.J.Chromatogr.B,2016,1021:145-152.
[57] Hu X F,Hu R,Zhang Z W,Li P W,Zhang Q,Wang M.Anal.Bioanal.Chem.,2016,408:1-10.
[58] Turan E,Sahin F.Sens.ActuatorB,2016,227:668-676.
[59] Xu G,Zhang S,Zhang Q,Gong L,Dai H,Lin Y.Sens.ActuatorB,2016,222:707-713.
[60] Taherimaslak Z,Amoli-Diva M,Allahyary M,Pourghazi K.Anal.Chim.Acta,2014,842:63-69.
[61] Mashhadizadeh M H,Amoli-Diva M,Pourghazi K.J.Chromatogr.A,2013,1320:17-26.
[62] Petrakova A V,Urusov A E,Zherdev A V,Dzantiev B B.Anal.Methods,2015,7:10177-10184.
[63] Urusov A E,Petrakova A V,Vozniak M V,Zherdev A V,Dzantiev B.Sensors,2014,14:21843-21857.
[64] Wang X,Niessner R,Knopp D.Sensors,2014,14:21535-21548.
[65] Xing Y Y,Tong L,Chen N,Yu Z G,Zhao Y L.Chin.J.Chromatogr.(邢言言,佟玲,陈楠,于治国,赵云丽.色谱),2015,12:1320-1326.
[66] Huang Y M,Liu D F,Lai W H,Xiong Y H,Yang W C,Liu K,Wang S Y.Chin.J.Anal.Chem.(黄艳梅,刘道锋,赖卫华,熊永华,杨万春,刘坤,王树颖.分析化学),2014,42:654-659.
[67] Nguyen K T N,Ryu D.J.AOACInt.,2014,97(5):1384-1386.
[68] Manoochehri M,Asgharinezhad A A,Safaei M.J.Chromatogr.Sci.,2015,53(6):1000-1006.
[69] Ruan C Q,Diao X,Li N,Zhang H,Pang Y,Liu C L.Anal.Methods,2016,8:1586-1594.
[70] Porto-Figueira P,Camacho I,Camara J S.J.Chromatogr.A,2015,1408:187-196.
[71] Kong W J,Liu S Y,Qiu F,Xiao X H,Yang M H.Analyst,2013,138(9):2729-2739.
[72] Zhuang Q,Qu B H,Li Y,Wu Y,Mu A L,Li H.J.Anal.Sci.(庄倩,曲宝涵,李彦,吴燕,穆阿丽,李辉.分析科学学报),2016,32:37-42.
[73] Khayoon W S,Saad B,Salleh B,Manaf N H A,Latiff A A.FoodChem.,2014,147:287-294.
[74] Liu H,Luo J,Kong W,Liu Q,Hu Y,Yang M.Chemosphere,2016,150:176-183.
[75] Rodríguez-Carrasco Y,Moltó J C,Berrada H,Maes J.FoodChem.,2014,146:212-219.
[76] Pereira V L,Fernandes J O,Cunha S C.FoodChem.,2015,182:143-155.
[77] Qian M,Zhang H,Wu L,Jin N,Wang J,Jiang K.FoodChem.,2015,166:23-34.
[78] Cao D M,Xu Y,Tu Z,Li Y P,Xiong L,Fu J H.Chin.J.Anal.Chem.(曹冬梅,许杨,涂追,李燕萍,熊亮,付金衡.分析化学),2016,7:1085-1091.
[79] Wang L,Xiong S C,Zou X Q,Chen C C,Shao H F,Chen X L.Chin.J.Anal.Chem.(王吕,熊斯诚,邹旭强,陈超超,邵辉锋,陈雪岚.分析化学),2015,43:856-861.
[80] Zhang X,Sun M,Kang Y,Xie H,Wang X,Song H,Li X,Fang W.Toxicon,2015,106:89-96.
[81] Jin N,Ling S,Yang C,Wang S.Toxicon,2014,90:226-236.
[82] Xie H,Zhang X,Wang X,Fan P C,Shi Y F,Fang W H.Microbiol.Chin.(谢珲,章先,王歆,凡鹏程,时玉菲,方维焕.微生物学通报),2015,42:2033-2040.
[83] Li Y,Luo X,Yang S,Cao X,Wang Z,Shi W,Zhang S.J.Agric.FoodChem.,2014,62:1492-1497.
[84] Du H,Liu J,Xun Y P,Liang J H,Li S X,Chen G Y.Anal.Lett.,2014,47:1912-1920.
[85] Venkataramana M,Rashmi R,Uppalapati S R,Chandranayaka S,Balakrishna K,Radhika M,Gupta V K,Batra H V.Front.Microbiol.,2015,6:511.
[86] Huang X,Chen R,Xu H,Lai W,Xiong Y.Anal.Chem.,2016,88:1951-1958.
[87] Frens G.Nature,1937,241:20-22.
[88] Zheng B Q,Li A J,Mi Z J,Gao Z T,Dong L X,Chen X X,Yu A P,Si F Y.Chin.J.Veter.Drug(郑百芹,李爱军,米振杰,高振同,董李学,陈笑笑,虞爱萍,斯飞月.中国兽药杂志),2013,47:46-50.
[89] Kolosova A Y,Sibanda L,Dumoulin F,Lewis J,Duveiller E,Van Peteghem C,De Saeger S.Anal.Chim.Acta,2008,616:235-244.
[90] Sun Q,Zhu Z,Deng Q,Liu J,Shi G.Anal.Methods,2016,8(3):564-569.
[91] Alloush H M,Anderson E,Martin A D,Ruddock M W,Angell J E,Hill P J,Mehta P,Smith M A,Smith J G,Salisbury V C.Clin.Chem.,2010,56:1862-1870.
[92] Henao-Escobar W,Del Torno-De Román L,Domínguez-Renedo O,Alonso-Lomillo M A,Arcos-Martínez M J.FoodChem.,2016,190:818-823.
[93] Eltzov E,Cohen A,Marks R S.Anal.Chem.,2015,87:3655-3661.
[94] Du Y,Li J L,Bi C Y.FoodSci.Technol.(杜祎,李敬龙,毕春元.食品科技),2015,40:310.
[95] Stepurska K V,Soldatkin O O,Kucherenko I S,Arkhypova V M,Dzyadevych S V,Soldatkin A P.Anal.Chim.Acta,2015,854:161-168.
[96] Jodra A,Hervás M,López M,Escarpa A.Sens.ActuatorB,2015,221:777-783.
[97] Kong D,Liu L,Song S,Suryoprabowo S,Li A,Kuang H,Wang L,Xu C.Nanoscale,2016,8:5245-5253.
[98] Pacheco J G,Castro M,Machado S,Barroso M F,Nouws H P A.Sens.ActuatorB,2015,215:107-112.
[99] Singh C,Srivastava S,Ali M A,Gupta T K,Sumana G,Srivastava A,Mathur R B,Malhotra B D.Sens.ActuatorB,2013,185:258-264.
[100] Zhou L T,Li Z J,Fang Y J.Chin.J.Anal.Chem.(周琳婷,李在均,方银军.分析化学),2012,40:1635-1641.[101] Novoselov K S A,Geim A K,Morozov S V,Jiang D,Katsnelson M I ,Grigorieva I V,Dubonos S V,Firsov A A.Nature,2005,438:197-200.
[102] Wu S,Duan N,Ma X,Xia Y,Wang H,Wang Z,Zhang Q.Anal.Chem.,2012,84:6263-6270.
[103] Liu Q,Shi J,Sun J,Wang T,Zeng L,Jiang G.Angew.Chem.Int.Ed.,2011,123:6035-6039.
[104] Yao S,Hu Y F,Li G K.Electrochim.Acta,2015,155:305-311.
[105] Loo A H,Bonanni A,Pumera M.Chem.Electron.Chem.,2015,2:743-747.
[106] Gan N,Zhou J,Xiong P,Hu F,Cao Y,Li T,Jiang Q.Toxins,2013,5:865-883.
[107] Tang D,Cui Y,Chen G.Analyst,2013,138:981-990.
[108] Ma H H,Sun J Z,Zhang Y,Bian C,Xia S H,Zhen T.Biosens.Bioelectron.,2016,80:222-229.
[109] Zheng W L,Teng J,Cheng L,Ye Y W,Pan D D,Wu J J,Xue F,Liu G D,Chen W.Biosens.Bioelectron.,2016,80:574-581.
[110] Schmittgen T D,Livak K J.Nat.Protocols,2008,3:1101-1108.
[111] Guo X,Wen F,Zheng N,Luo Q,Wang H,Wang H,Li S,Wang J.Biosen.Bioelectron.,2014,56:340-344.
[112] Guo Z,Ren J,Wang J,Wang E.Talanta,2011,85:2517-2521.
[113] Zhang Y,Zheng N,Wen F,Zhang Y D,Li F D,Wang J Q.J.Agric.Sci.Technol.(张勇,郑楠,文芳,张养东,李发弟,王加启.中国农业科技导报),2016,18:182-188.
[114] Zhang J J,Li Z M,Zhao S C,Lu Y.Analyst,2016,141(13):4029-4034.
[115] Dai S L,Wu S J,Duan N,Wang Z P.Talanta,2016,158:246-253.
[116] Tang D,Cui Y,Chen G.Analyst,2013,138:981-990.
[117] Zhou Y F,Xiong S C,Jiang H,Duan H,Xiong Y H,Wang A.Chin.J.Anal.Chem.(周耀锋,熊斯诚,江湖,段宏,熊勇华,Wang Andrew.分析化学),2015,43:1837-1843.
[118] Goftman V V,Aubert T,Ginste D V,Deun R V,Beloglazova N V,Hens Z,Saeger S D,Goryacheva I Y.Biosens.Bioelectron.,2016,79:476-481.
[119] Speranskaya E S,Beloglazova N V,Abé S,Aubert T,Smet P F,Poelman D,Goryacheva I Y,Saeger S D,Hens Z.Langmuir,2014,30:7567-7575.
[120] Zhang Z,Li Y,Li P,Zhang Q,Zhang W,Hu X,Ding X.FoodChem.,2014,146:314-319.
[121] Xu W,Xiong Y,Lai W,Xu Y,Li C,Xie M.Biosens.Bioelectron.,2014,56:144-150.
[122] Zhang M,Zhang Y H,Ma L.Chin.J.Anal.Chem.(张敏,张宇昊,马良.分析化学),2011,39:1907-1911.
[123] Hu Z,Lustig W P,Zhang J,Zheng C,Wang H,Teat S J,Gong Q,Rudd N D,Li J.J.Am.Chem.Soc.,2015,137:16209-16215.
[124] Yu Y Y,Qiu Y L,Zhang H Y,Zou Y H,Wang T Y.Chem.Bull.(余宇燕,邱亚利,张红艳,邹艳辉,王彤颖.化学通报),2015,78:830-834.
[125] Hernández-Hierro J M,García-Villanova R J,González-Martín I.Anal.Chim.Acta,2008,622:189-194.
[126] Arduini F,Neagu D,Pagliarini V,Scognamiglio V,Leonardis AM,Gatto E,Amine A,Palleschi G.Talanta,2016,150:440-448.
Progress on Pretreatment and Analytical Methods for Mycotoxins in Food Samples
TAN Jie,DU Yuan-qi,XIAO Xiao-hua*,LI Gong-ke*
(School of Chemistry,Sun Yat-sen University,Guangzhou 510275,China)
Mycotoxins are widely present in food and animal feed.They are harmful to animal and human health through the food chain,and will reduce the nutritional value of feed and cause serious food safety problem.It is very necessary to develop efficient sample pretreatments and sensitive analytical methods for rapid analysis of these targets in complex matrix.In this paper,some pretreatment methods including solid-phase microextraction,liquid-phase microextraction,magnetic separation,immuno affinity chromatography etc. are introduced.Meanwhile,the applications and developments of analytical methods for mycotoxins,such as liquid chromatography-mass spectrometry,enzyme-linked immune-sorbent assay and biosensors etc.,are also reviewed.
food samples;mycotoxins;sample pretreatment;analytical method;review
2017-01-22;
2017-02-20
国家自然科学基金项目(21375155,21475153,21675179,21675178);国家重大科学仪器设备开发专项(2011YQ0301240901);广东省自然科学基金(2015A030311020);广东省公益研究与能力建设专项(2015A030401036);广州市民生科技重大专项资助项目(201604020165)
10.3969/j.issn.1004-4957.2017.06.022
O657.63;S852.44
A
1004-4957(2017)06-0829-12
*通讯作者:肖小华,博士,副教授,研究方向:色谱、食品分析,Tel:020-84111664,E-mail:xiaoxhua@mail.sysu.edu.cn 李攻科,博士,教授,研究方向:色谱与光谱分析、复杂体系分离分析, Tel:020-84110922,E-mail:cesgkl@mail.sysu.edu.cn

