基于16S rRNA基因的食源性致病菌实时荧光定量PCR检测研究
刘玲雪++孙红炜++李凡++徐晓辉++高瑞++杨淑珂++路兴波
摘要:本研究以16S rRNA基因作为靶基因,利用TaqMan探针技术建立了针对志贺氏菌(Shigella)、沙门氏菌(Salmonella)和金黄色葡萄球菌(Staphylococcus aureus)三种主要食源性致病菌的多重实时荧光定量PCR检测技术。结果表明,建立的荧光定量PCR检测体系特异性良好、灵敏度高、简便快捷,大大缩短了检测时间,在食源性致病菌快速筛查方面具有良好的应用前景。
关键词:食源性致病菌;16S rRNA基因;多重实时荧光定量PCR;TaqMan探针
中图分类号:TS207.4文献标识号:A文章编号:1001-4942(2017)06-0126-09
AbstractIn this study, a multiplex real-time quantitative PCR detection technology for the three food-borne pathogens, Shigella, Salmonella and Staphylococcus aureus, had been established utilizing the TaqMan probe and 16S rRNA gene as a target gene. The results indicated that the established multiplex real-time quantitative PCR detection system had good specificity and sensitivity, was simple and efficient, and greatly reduced the detection time, so it had a good prospect in the rapid screening for food-borne pathogens.
KeywordsFood-borne pathogen; 16S rRNA gene; Multiplex real-time quantitative PCR; TaqMan probe
食品种类的日益增多在丰富人们消费体验的同时,也带来了更多的食品安全事件。食品安全事件造成的经济损失十分惊人。据相关部门统计,2015年上半年因各类食品安全事件,经济损失至少300亿元,死伤人数近万人[1]。据统计,在全球各类疾病中,食源性疾病的发病率位居前列,因食源性疾病而导致死亡的人数每年约有220万[2]。据世界卫生组织(WHO)报道,影响食品安全最主要的因素之一是由病原微生物引起的食源性疾病。通过对我国食源性疾病监测系统个案报告的资料分析可知,我国发生的食品安全事件中有将近一半是由食源性致病菌所导致的[3,4],而有效预防和控制食源性疾病的重要环节是快速检测和鉴别食源性致病菌。本研究以食品中常见的三种致病性细菌——志贺氏菌(Shigella)、沙门氏菌(Salmonella)和金黄色葡萄球菌(Staphylococcus aureus)为对象,研究建立针对这三种致病菌的多重实时荧光定量PCR快速检测技术,这对及时切断病原菌传播途径以达到减少食源性疾病发生的目的具有十分重要的意义。
1材料与方法
1.1材料
1.1.1供试菌株本研究所用菌株共9株,其中福氏志贺氏菌株购自北纳创联生物技术有限公司;金黄色葡萄球菌、鼠伤寒沙门氏菌及6种对照菌株(大肠杆菌、黄单胞菌、枯草杆菌、产气杆菌、变形杆菌、八叠球菌)均由山东师范大学生命科学学院李世国老师馈赠。将以上菌种分别接种于牛肉膏蛋白胨培养基试管斜面上,存于4℃冰箱中备用。
1.1.2主要仪器设备台式冷冻离心机(MIKRO 22R),德国Hettich公司;BioPhotometer Plus仪,德国Eppendorf公司;PCR八联管,美国应用生物系统公司;Step One Plus实时荧光定量PCR系统,美国应用生物系统公司;微量移液器(0.5~10 μL,10~100 μL),德国Eppendorf公司。
1.2试验方法
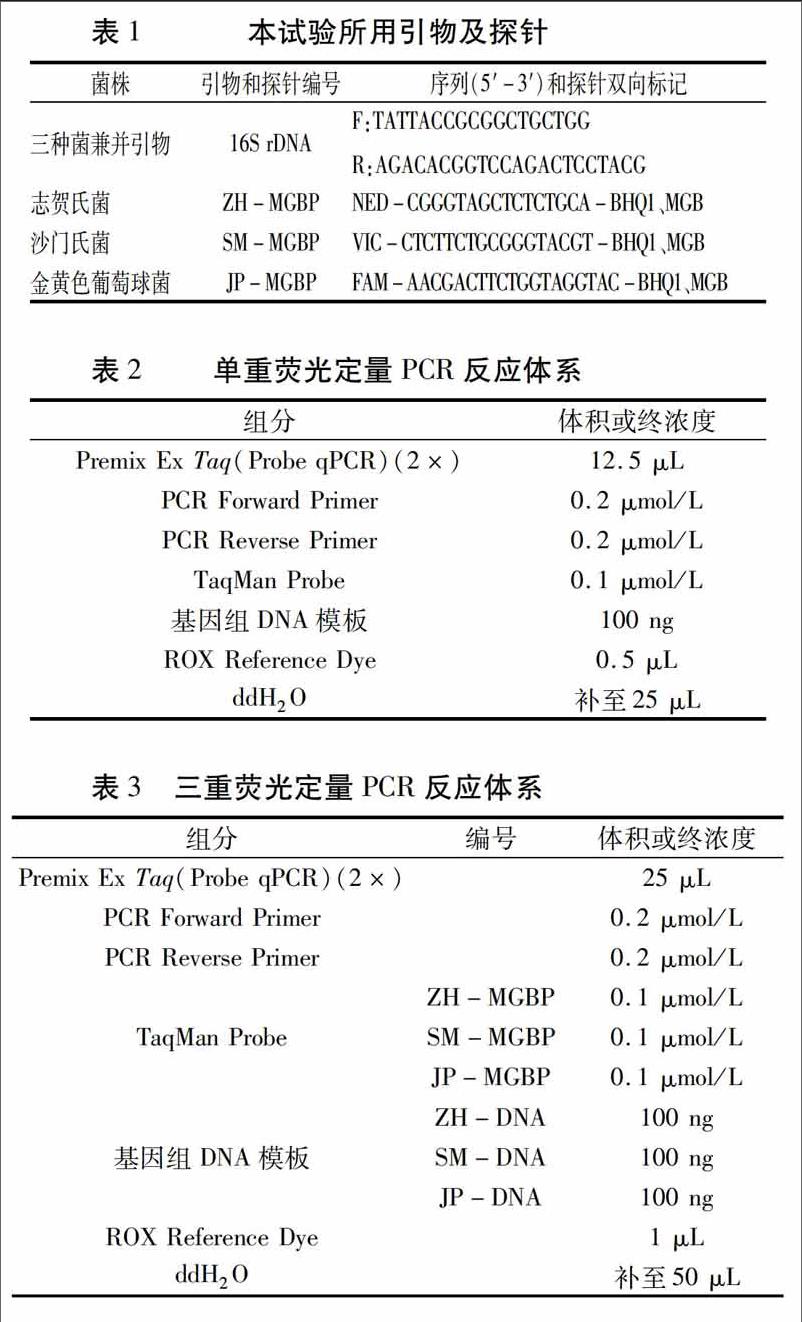
1.2.1细菌基因组DNA的提取分别采用三种不同的细菌DNA提取方法,即普通的CTAB法、CWBIO Bacteria Genomic DNA Kit和TIANGEN细菌基因组DNA提取试剂盒,并对其提取结果进行比较,选取效果最好的提取方法。最终选用TIANGEN细菌基因组DNA提取试剂盒法。
1.2.2引物与探针的设计根据GenBank中三种细菌16S rRNA基因序列,用DNAMAN V6中文版进行同源性比对分析,选择其高度保守的区域,根据引物设计的原则,运用软件Primer Premier 5.0设计一对兼并引物[5]。
利用DNAMAN V6软件对Shigella、Salmonella和Staphylococcus aureus进行同源性序列的分析比对,选取三种菌双链DNA序列中最特异的区段作为靶序列,用Primer Express V 3.0软件设计各菌的TaqMan探针。交由生工生物工程技术服务公司(上海)合成。选择各条探针的荧光标记,5′端报告基团可以为FAM、VIC、NED等,3′端的熒光淬灭基团用MGB、BHQ1等。引物和探针见表1。
1.2.3多重荧光定量PCR反应体系的建立采用50 μL反应体系,将单重荧光定量PCR各组分浓度(表2)加倍,将3株菌的探针和模板DNA放入同一个PCR反应管中,成为三重荧光定量PCR反应体系(表3)。扩增程序为95℃预变性30 s;95℃变性1 s,60℃退火20 s,40个循环。
1.3荧光定量PCR反应体系性能评价
1.3.1特异性本试验利用建立的多重荧光定量PCR反应体系对供试3株细菌及另外6株细菌(大肠杆菌、黄单胞菌、枯草杆菌、八叠球菌、产气杆菌、变形杆菌)进行荧光定量PCR试验,对该PCR体系的特异性进行评价。
1.3.2灵敏度用BioPhotometer Plus仪测定提取的细菌基因组DNA原液浓度,然后稀释到100 ng/μL,在此基础上按10倍梯度稀释,DNA浓度从10 ng/μL到10-5 ng/μL共设7个梯度。按照建立的荧光定量PCR体系进行试验,确定该体系能够检测到的最低DNA浓度,评价体系的灵敏度。
1.4模拟样品试验
1.4.1模拟水样和牛奶样本的制备分别挑取3种供试菌单菌落接种到LB琼脂平板,37℃过夜培养,取菌苔至5 mL无菌PBS中制备菌悬液,用无菌PBS 10倍系列稀释菌悬液至10-8。取10-5、10-6、10-7、10-8四个梯度各100 μL涂LB琼脂平板,重复3次,37℃过夜培养,利用平板计数法推算原菌悬液的准确浓度。对经菌落计数的菌悬液用无菌PBS 10倍系列稀释,取浓度为n×107、n×106、n×105、n×104、n×103、n×102、n×101 cfu/mL(1≤n<10,视菌体菌落计数结果而定)的菌液各1 mL分别加入到50 mL离心管中,离心管中加入24 mL饮用水或市售巴斯德消毒的纯牛奶(伊利),混匀,得到浓度为n×107~ n×101 cfu/25mL的样本。
1.4.2模拟水样本的检测针对各梯度饮用水模拟样本,2 000×g离心10 min,沉淀小心地重悬于1 mL PBS中,转移到1.5 mL离心管中,13 000×g 離心5 min,弃上清,沉淀用细菌基因组DNA提取试剂盒提取DNA,最后用50 μL纯净水洗脱,取1 μL为模板,进行单重、多重荧光定量PCR检测。
1.4.3模拟牛奶样本的检测针对各梯度牛奶模拟样本,每个离心管中加入2.4 mL triton X-100、1%(W/V)的固体粉末状胰蛋白酶,漩涡震荡以彻底混匀,37℃培养30 min,2 000×g离心10 min,沉淀小心地重悬于1 mL PBS中,转移到1.5 mL离心管中,13 000×g离心5 min,弃上清,沉淀用细菌基因组DNA提取试剂盒提取DNA,最后用50 μL纯净水洗脱。取1 μL作为模板,进行单重、多重实时荧光定量PCR检测。
2结果与分析
2.1细菌基因组DNA提取结果
用普通的CTAB法、CWBIO Bacteria Genomic DNA Kit和TIANGEN细菌基因组DNA提取试剂盒分别提取志贺氏菌、沙门氏菌和金黄色葡萄球菌的基因组DNA,取5 μL进行琼脂糖凝胶电泳分析。由图1可知,普通的CTAB法提取效果较差,志贺氏菌及金黄色葡萄球菌出现微弱的杂带,且目的条带不明亮;CWBIO Bacteria Genomic DNA Kit提取效果也不理想,目的条带单一但不明亮;TIANGEN细菌基因组DNA提取试剂盒提取的目的条带单一且明亮,效果好。故选择TIANGEN细菌基因组DNA提取试剂盒来提取病原菌的基因组DNA。
2.2多重实时荧光定量PCR反应体系建立
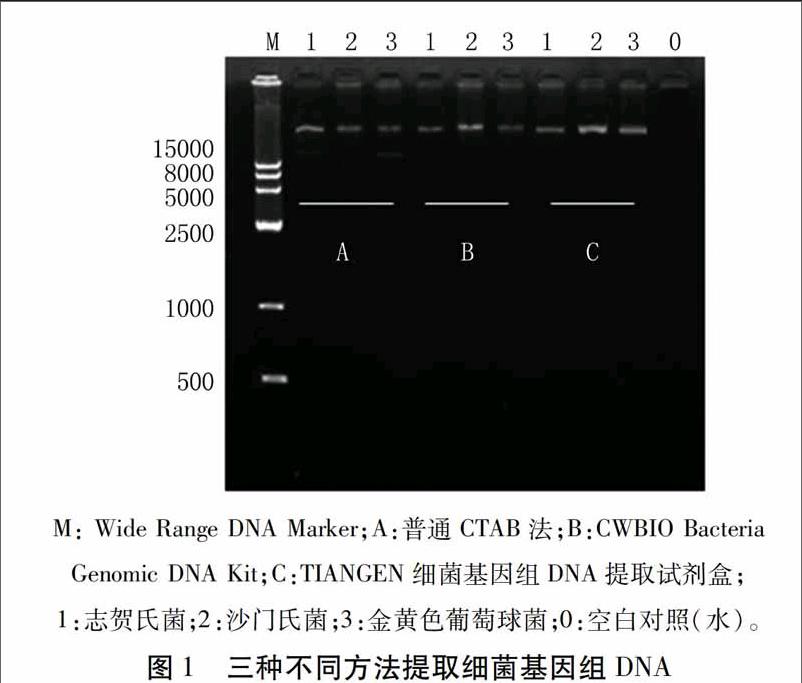
将3株菌的探针和模板DNA放入同一个PCR反应管中,成为三重实时荧光定量PCR反应体系。在多重荧光定量PCR反应中,个别菌株的扩增曲线可能会发生改变,这是由于探针数目多时使体系的荧光本底值上升,彼此间产生干扰,但影响不大,只要保证三条扩增曲线同时起峰,曲线间的间距拉大,达到便于观察和结果准确的目的即可。本研究建立的三重实时荧光定量PCR体系达到了该目的要求,结果准确美观,扩增结果如图2所示。
2.3实时荧光定量PCR性能评价
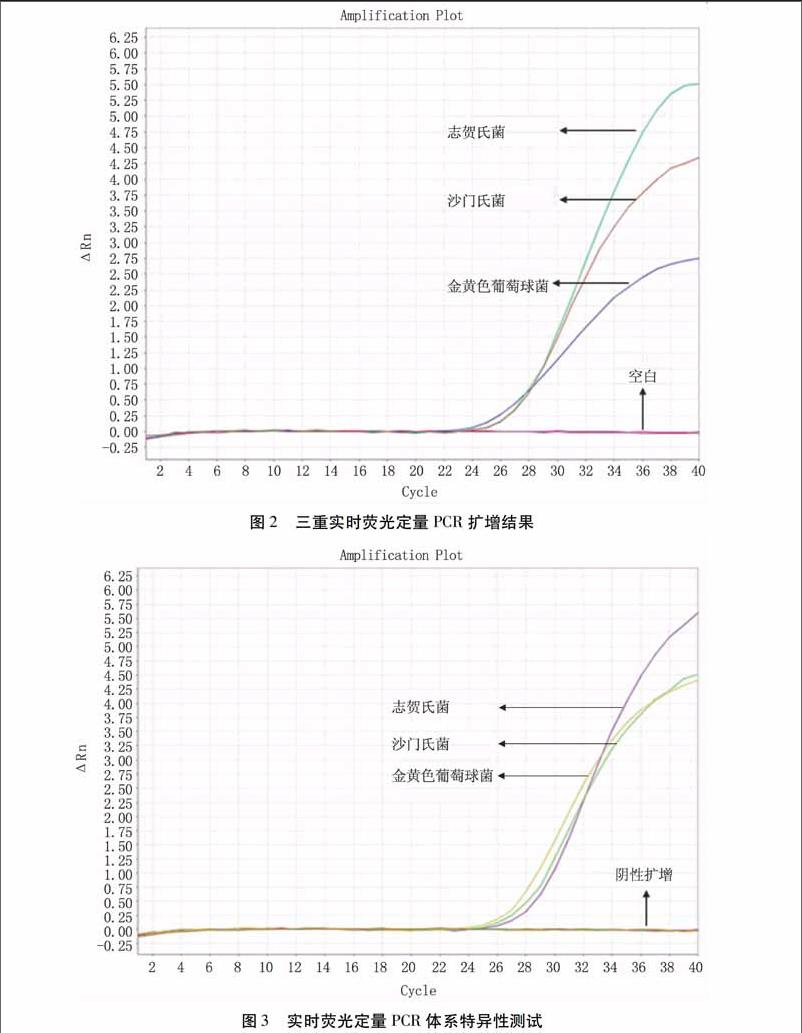
2.3.1特异性实时荧光定量PCR试验利用引物和探针的双重定位作用,使其能专一性地检测目标菌。利用生物信息学手段设计引物和探针是非常关键的一步,而通过试验对大量的近缘及远缘菌株进行特异性验证才能真正保证该体系检测的准确性。由图3可知,只有目标菌株有阳性扩增信号产生,其他细菌和空白对照均检测不到信号值或信号值很低,可以认定是阴性扩增或轻微的污染所致。说明本研究所选引物和探针特异性良好。
2.3.2灵敏度将三种菌的基因组DNA按照10倍梯度稀释,共设7个梯度:10、1、10-1、10-2、10-3、10-4、10-5 ng/μL。结果(图4)显示该荧光定量PCR体系在基因组DNA水平上的检测灵敏度可达到10-4 ng/μL。
2.4模拟样品检测结果
待测样品的处理问题是试验成功与否的关键点和难点。本研究检测的是常见的志贺氏菌、沙门氏菌和金黄色葡萄球菌三种食源性致病菌,因此我们选择饮用水、牛奶两种样品作为检测对象。
2.4.1菌液计数结果经菌落计数,结果见表4,志贺氏菌、沙门氏菌、金黄色葡萄球菌原菌悬液
浓度分别为2.57×109、1.37×1010、5.23×109 cfu/mL。先将沙门氏菌的菌液(1.37×1010 cfu/mL)用PBS稀释成1.37×109 cfu/mL,再10倍梯度稀释至1.37×101 cfu/mL;用PBS将志贺氏菌和金黄色葡萄球菌的菌液分别10倍梯度稀释至2.57×101、5.23×101 cfu/mL。取107~101梯度菌液用作下述试验。
2.4.2模拟水样的单重实时荧光定量PCR灵敏度检测结果以上述梯度稀释菌液污染饮用水提取的DNA为模板,测试反应体系的灵敏度。结果如图5,该反应体系在101梯度时仍有扩增信号出现,即最低分别能检测到1.37×101 cfu/25mL水样(沙门氏菌)、2.57×101 cfu/25mL水样(志贺氏菌)、5.23×101 cfu/25mL水样(金黄色葡萄球菌)的细菌。
2.4.3模拟牛奶样品的单重实时荧光定量PCR灵敏度检测结果以上述梯度稀释菌液污染市售纯牛奶(伊利)提取的DNA为模板,测试实时荧光反应体系的灵敏度。结果如图6,该反应体系在102梯度时仍有扩增信号出现,即最低分别能检测到2.57×102 cfu/25mL牛奶样(志贺氏菌)、1.37×102 cfu/25mL牛奶样(沙门氏菌)、5.23×102 cfu/25mL牛奶样(金黄色葡萄球菌)的细菌。
2.4.4模拟水样多重实时荧光定量PCR检测结果在上述模拟水样单重实时荧光定量PCR基础上,对三种致病菌进行多重实时荧光定量PCR检测,志贺氏菌、沙门氏菌及金黄色葡萄球菌分别选用菌液浓度为2.57×107、1.37×107、5.23×107 cfu/25mL水样作为模板。结果如图7,三种致病菌在CT值25左右均出现扩增信号,空白对照(水)未出现扩增信号。说明该体系特异性良好。
2.4.5模拟牛奶样品多重实时荧光定量PCR检测结果在上述模拟牛奶样品单重实时荧光PCR基础上,对三种致病菌建立多重实时荧光PCR体系,志贺氏菌、沙门氏菌及金黄色葡萄球菌分别选用菌液浓度为2.57×107、1.37×107、5.23×107 cfu/25mL牛奶样作为模板。结果如图8,三种致病菌在CT值28左右均出现扩增信号,空白对照(未污染牛奶)未出现扩增信号。说明该体系特异性良好。
3讨论与结论
实时荧光定量PCR(real-time quantitative polymerase chain reaction)是指在PCR指数扩增期间通过连续检测荧光信号的强弱来即时测定特异性产物的量。其代表性方法TaqMan熒光探针技术近些年在食品致病菌检测方面表现尤为突出,其优点在于:采用序列特异性探针,增强了检测特异性;可以在单管中检测多个靶标,适合多重反应。例如刘生峰等[6]利用TaqMan探针荧光PCR建立肠出血性Escherichia coli O157∶H7的检测方法;国内学者刘渠等[7]利用相同基因建立的定量PCR体系,可检出最低 45个拷贝的细菌DNA,特异性和重复性良好。
而本研究采用的新型TaqMan MGB探针比普通TaqMan探针更短,从而降低了成本,另外在3′端标记非淬灭荧光分子MGB使荧光本底降低的同时,也使探针杂交稳定性极大增加,所以它的结果更为精确[8]。
本研究针对食品中常见的三种致病菌Shigella、Salmonella和Staphylococcus aureus建立多重实时荧光定量PCR检测体系,其中引物的设计直接关系到PCR反应的特异性,且对多重PCR来说,引物对的复杂多样,会造成引物配对、扩增效率、反应条件等诸多方面难以兼顾[9]。本研究在查阅大量关于特异性保守基因的基础上,选择了16S rRNA基因作为其共同的靶基因并设计了一对兼并引物[10],根据Tm值的差异分析确定可以将其作为荧光定量PCR扩增的靶基因和特异性引物,为建立多重荧光定量PCR检测方法奠定了基础。另外,我们首先利用单重荧光定量PCR反应对反应条件进行优化,保障反应体系具有较高的灵敏度,提高检测效率,节约检测成本,从而为食品中多种致病菌的同时快速检测奠定基础。
为了充分验证该检测体系的特异性,本研究采用了阳性菌株和干扰菌株的对照法,从试验结果来看,建立的检测方法具有良好的特异性,没有出现假阳性和假阴性,这也说明了靶基因选择的科学性及其引物探针设计的正确性。本课题还对体系的灵敏度进行了验证,试验结果显示该体系在基因组DNA水平上的检测灵敏度可达到10-4 ng/μL,具有很高的灵敏度。
参考文献:
[1]杨建秀. 食品安全与食源性疾病[J]. 热带医学杂志, 2004, 4(2): 201-203.
[2]WHO. Food safety, a world wide challenge[R]. Food Chain, 2001.
[3]庞璐, 张哲, 徐进. 2006—2010年我国食源性疾病暴发简介[J]. 中国食品卫生杂志, 2011(6): 560-563.
[4]王茂起, 刘秀梅, 王竹天. 中国食品污染监测体系的研究[J]. 中国食品卫生杂志, 2006(6): 491-497.
[5]王如景. 三种食源性致病菌多重PCR快速检测方法的研究[D]. 河北: 河北农业大学, 2012.
[6]刘生峰, 肖进文, 刘利成,等. TaqMan探针荧光PCR检测肠出血性大肠埃希菌O157∶ H7方法的建立[J]. 微生物学杂志, 2012, 32(5): 6-10.
[7]刘渠, 廖灵灵, 徐亚军,等. 荧光定量PCR检测金黄色葡萄球菌肠毒素A方法研究[J]. 中国卫生检验杂志, 2010(4): 788-789.
[8]伊鋆, 蔡雪凤. TaqMan荧光探针技术在食源性致病菌检测中的应用[J]. 食品工业科技, 2013(7): 17.
[9]Harmsen D, Karch H. 16S rRNA for diagnosing pathogens: a living tree[J]. ASM News-American Society for Microbiology, 2004, 70(1): 19-24.
[10]李凡, 许恒毅, 李福来. 多重PCR技术在食源性致病菌检测中应用的研究进展[J]. 食品工业科技, 2015, 36(21): 372-375.

