稳定高表达TGF-β1的大鼠心肌细胞H9c2细胞株的构建及鉴定
许淑文,李艳,李继强,戴雯
(1.武汉大学人民医院检验科,湖北武汉430060;2.武汉市第一医院神经外科,湖北武汉430022)
·论著·
稳定高表达TGF-β1的大鼠心肌细胞H9c2细胞株的构建及鉴定
许淑文1,李艳1,李继强2,戴雯1
(1.武汉大学人民医院检验科,湖北武汉430060;2.武汉市第一医院神经外科,湖北武汉430022)
目的构建及鉴定稳定高表达TGF-β1的大鼠心肌细胞H9c2细胞株。方法利用RNA干扰技术提取pEGFP-TGF-β1质粒后采用ABI3130基因测序仪进行测序鉴定,将鉴定后的质粒转染到大鼠心肌细胞H9c2细胞株,利用G418筛选转染的H9c2细胞,通过RT-PCR和Western blot技术对转染后的H9c2细胞进行鉴定,本实验将转染了pEGFP-TGF-β1质粒和pEGFP对照质粒的细胞株分为pEGFP-TGF-β1质粒组和pEGFP对照质粒组。结果pEGFP-TGF-β1质粒测序结果包含TGF-β1序列,筛选后的pEGFP-TGF-β1质粒组和pEGFP对照质粒组细胞转染效率分别为85%和93%。RT-PCR结果显示,pEGFP-TGF-β1质粒转染组的TGF-β1mRNA相对表达量为(2.563±0.198),与对照组(1.037±0.022)比较差异具有统计学意义(t=3.056,P=0.028);Western blot结果显示,pEGFP-TGF-β1质粒转染组的TGF-β1蛋白相对表达量为(3.275±0.234),显著高于对照组的(1.011±0.015),差异具有统计学意义(t=4.372,P=0.015)。结论本研究所构建的大鼠心肌细胞H9c2细胞株能稳定高表达TGF-β1,可用于后续TGF-β1在大鼠心肌细胞的生物学作用及相关信号通路的研究。
大鼠心肌细胞;H9c2细胞株;转化生长因子-β1;质粒
转化生长因子-β1(transforming growth factor-β1,TGF-β1)是在心衰过程中急剧增加的重要细胞因子,它是一种调控细胞生长的关键细胞因子,参与调节免疫、细胞增殖与凋亡、创伤修复、胚胎发生和造血调控[1]。研究显示,TGF-β1可促进组织纤维化和成纤维细胞转化,同时使巨噬细胞失活并抑制炎症趋化因子的表达。而压力负荷增加的心力衰竭动物学模型表明,在胸主动脉缩窄后进行TGF-β1抑制可减少纤维化,且可以在不造成心肌肥厚的情况下改善心脏收缩功能[2]。因此,TGF-β1将可能成为治疗心衰的新靶点。本研究将利用pEGFP-TGF-β1质粒构建稳定高表达TGF-β1的大鼠心肌细胞H9c2细胞株,为后续研究TGF-β1在大鼠心肌细胞中的生物学作用及相关信号通路提供细胞水平实验材料。
1 材料与方法
1.1 主要试剂及仪器DMEM高糖培养基、胎牛血清、链霉素-青霉素双抗、G418、β-actin一抗、TGF-β1一抗、Licor荧光二抗、Lipofectamine®2000转染试剂、逆转录试剂盒、GAPDH引物、TGF-β1引物、奥德赛扫膜仪(购自美国LICOR公司)、正置荧光显微镜(日本OLYMPUS公司)、倒置荧光显微镜(购自日本OLYMPUS公司)。
1.2 细菌、质粒和细胞株大肠杆菌DH5α及pEGFP-TGF-β1质粒购自上海吉凯基因化学技术有限公司,载体为GV143质粒,表达卡那霉素原核抗性、新霉素真核抗性及绿色荧光蛋白EGFP。大鼠心肌细胞H9c2细胞株购自中科院细胞库,H9c2细胞采用含10%胎牛血清和1%链霉素-青霉素双抗的DMEM高糖培养基培养。
1.3 pEGFP-TGF-β1质粒的提取及鉴定分别将含有pEGFP-TGF-β1的高表达质粒和阴性对照质粒的感受态大肠杆菌DH5α接种在具有卡那霉素抗性的LB平板上培养并挑选单菌落克隆,将挑选出来的单克隆菌落接种到含新霉素的150 mL LB培养基,置于37℃、300 r/min摇床过夜。本实验将转染了pEGFP-TGF-β1质粒和pEGFP对照质粒的细胞株分为pEGFP-TGF-β1质粒组和pEGFP对照质粒组。采用QIAGEN公司的中量质粒抽提试剂盒提取pEGFP-TGF-β1质粒100µL。利用ABI3130基因测序仪对提取的质粒进行测序,测序引物序列为5'-GATCCCGGGCCCGCGGTACCGTCACTTCAGACACAGAAATCAAC-3'。
1.4 pEGFP-TGF-β1质粒的转染及筛选将大鼠心肌细胞H9c2细胞株接种于六孔板,采用含10%胎牛血清和1%链霉素-青霉素双抗的DMEM高糖培养基培养,当细胞增殖到覆盖培养基底部90%以上面积时进行转染。取两支无菌EP管,加入100µL不含血清及双抗的DMEM高糖培养基,分别向培养基中加入1.2µL高表达TGF-β1质粒和阴性对照链大鼠心肌细胞H9c2细胞株质粒,混匀后分别加入5µL Lipofectamine®2000转染试剂,轻轻混匀后室温下静置10~15 min以便转染复合体的形成,将转染体系分别加入含有2 mL的培养基的H9c2细胞孔中,置于37℃含5%CO2的培养箱中培养。24 h后给细胞换液,48 h后在倒置荧光显微镜下观察质粒转染情况(见图1)。利用G418筛选转染细胞,当细胞增殖到95%以上时,向培养基中加入G418 1µL,每日观察细胞生长情况及绿色荧光表达情况,当存活细胞剩余10%~20%时给细胞换液,重复筛选步骤4~5次。
1.5 稳定高表达TGF-β1的大鼠心肌细胞H9c2细胞株的鉴定采用RT-PCR和Western blot对构建的稳定高表达TGF-β1的大鼠心肌细胞H9c2细胞株进行鉴定。RT-PCR引物:GAPDH(上游引物:5'-CAAGGTCATCCATGACAACTTTG-3';下游引物:5'-GTCCACC ACCCTGTTGCTGTAG-3'),TGF-β1(上游引物:5'-GGA CTACTACGCCAAAGAAG-3';下游引物5'-TCAAAA GACAGCCACTCAGG-3')。
1.6 TGF-β1mRNA和蛋白表达定量对转染pEGFP-TGF-β1质粒后的心肌细胞H9c2进行总RNA提取,对提取RNA进行逆转录、基因扩增及琼脂糖凝胶电泳,利用PCR条带分析软件分析条带灰度值并计算TGF-β1相对于内参GAPDH的mRNA表达量(TGF-β1/GAPDH)。并对转染pEGFP-TGF-β1质粒后的心肌细胞H9c2进行总蛋白提取,将提取的蛋白进行聚丙烯酰胺凝胶电泳及蛋白印迹分析。
1.7 统计学方法利用Odyssey软件分析蛋白印迹灰度值并分别计算相对于内参GAPDH的蛋白表达量(TGF-β1/GAPDH)。经三次以上实验,条带灰度值采用均数±标准差(x-±s)表示,采用SPSS20.0统计软件进行统计学分析,组间比较采用t检验,以P˂0.05为差异具有统计学意义。
2 结果
2.1 pEGFP-TGF-β1质粒鉴定ABI3130基因测序仪测序结果显示质粒序列中包含以下碱基序列,与NCBI数据库TGF-β1基因序列比对完全一致,表明质粒构建成功[3]。
2.2 pEGFP-TGF-β1质粒的转染和筛选结果比较pEGFP-TGF-β1质粒和pEGFP阴性对照质粒转染48 h后,在荧光显微镜下观察转染效率。通过细胞荧光显微镜下细胞计数,pEGFP-TGF-β1质粒组转染效率为22%,pEGFP对照组为29%。利用G418筛选4个周期后,pEGFP-TGF-β1质粒转染效率为85%,pEGFP对照组为93%,见图1。
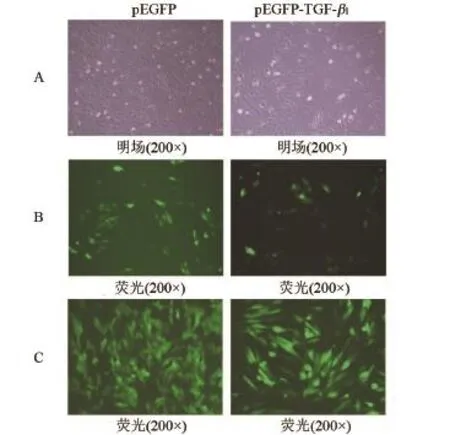
图1pEGFP-TGF-β1质粒转染及筛选结果注:A,转染前;B,转染48 h;C,G418筛选4个周期。
2.3 稳定高表达TGF-β1的大鼠心室肌细胞H9c2细胞株的鉴定结果
2.3.1 RT-PCRpEGFP-TGF-β1质粒转染组的TGF-β1mRNA相对表达量为(2.563±0.198),与对照组的(1.037±0.022)比较显著升高,差异具有统计学意义(t=3.056,P=0.028),表明染pEGFP-TGF-β1质粒明显增强BAG3基因的转录,见图2。

图2RT-PCR结果注:A,琼脂糖凝胶电泳;B,TGF-β1mRNA相对表达量;与对照组比较,aP˂0.05。
2.3.2 Western blotpEGFP-TGF-β1质粒转染组的TGF-β1蛋白相对表达量为(3.275±0.234),显著高于对照组的(1.011±0.015),差异具有统计学意义(t= 4.372,P=0.015),表明pEGFP-TGF-β1质粒明显增加TGF-β1蛋白表达量,见图3。

图3Western blot结果注:A,琼脂糖凝胶电泳;B,TGF-β1蛋白相对表达量;与对照组比较,aP˂0.05。
3 讨论
心力衰竭是由于心脏结构和功能的改变造成心脏回流和射血功能受损的一种复杂临床综合征。心力衰竭已成为日益严重的公共卫生问题,目前全球约有3 800万HF患者,近15年来HF发病率以每年50%的速率增加[4]。TGF-β是在HF过程中急剧增加的重要细胞因子,它是一种调控细胞生长的关键细胞因子,参与调节免疫、细胞增殖与凋亡、创伤修复、胚胎发生和造血调控。TGF-β包括TGF-β1、TGF-β2和TGF-β3,三种亚型中以TGF-β1为主,广泛存在于人体多种细胞,如上皮细胞、内皮细胞、心肌细胞等,TGF-β1是心血管系统中最主要的亚型[5]。低水平TGF-β1是维持人体正常生理功能所必需,当心脏损伤、压力超负荷、氧化应激、炎症刺激等多种因素存在时,TGF-β1明显上调,此时TGF-β1将主要发挥促炎、促纤维化和促凋亡的作用[1,6]。TGF-β1可刺激CFs增生、胶原合成、心肌细胞肥大,在心室重构中起着极其重要的作用[7]。TGF-β1作为最重要的促MF细胞因子,其表达的负调控可能对抑制MF发挥重要的作用,可作为心力衰竭的治疗靶点[8]。对TGF-β1表达的研究将为心力衰竭的防治提供更多依据,而本研究通过质粒转染技术构建稳定高表达TGF-β1的心肌细胞H9c2细胞株,有利于心力衰竭的基础研究。
GV143载体是由海吉凯基因化学技术有限公司开发的高效真核表达载体,在其载体序列中,含有TGF-β1基因,被整合进真核细胞基因组后,通过转录、翻译,能够获得抗性产物氨基糖苷磷酸转移酶的高效表达,使获得抗性而能在含有G418的选择性培养基中生长,未整合目的质粒的细胞在长期G418的压力下会发生死亡,这样就可以使用G418筛选出稳定表达TGF-β1的心肌细胞H9c2细胞系[9-10],在本实验中,我们筛选出的心肌细胞H9c2细胞系经过多次传代,仍然能够稳定表达TGF-β1基因,表达效率近90%,达到预期的实验目的。
本研究采用质粒转染技术,在基因测序证实质粒包含特定序列后将pEGFP-TGF-β1质粒及其对照质粒pEGFP转染到心肌细胞H9c2细胞株,并用G418进行转染细胞筛选,利用荧光显微镜观察荧光表达情况从而确定pEGFP-TGF-β1质粒转染组和pEGFP对照组转染效率分别为86%和89%,通过采用RT-PCR、Western blot及免疫荧光分析等手段鉴定构建的心肌细胞H9c2细胞株能稳定高表达TGF-β1。实验结果表明,通过构建稳定高表达TGF-β1质粒,心肌细胞H9c2细胞系TGF-β1mRNA和蛋白表达量均显著升高。构建稳定高表达TGF-β1质粒可以用于后续TGF-β1在心肌细胞中的生物学作用及相关信号通路的研究。
[1]Khan S,Joyce J,Margulies KB,et al.Enhanced bioactive myocardial transforming growth factor-β in advanced human heart failure[J]. Circulation,2014,78(11):2711-2718.
[2]Villar AV,Garcia R,Llano M,et al.BAMBI(BMP and activin membrane-bound inhibitor)protects the murine heart from pressure-overload biomechanical stress by restraining TGF-beta signaling[J].Biochim BiophysActa,2013,1832(2):323-335.
[3]Fan DM,Feng XS,Qi PW,et al.Forkhead factor FOXQ1 promotes TGF-β1expression and induces epithelial-mesenchymal transition[J]. Mol Cell Biochem,2014,397(1):179-186.
[4]Braunwald E.The war against heart failure:the Lancet lecture[J]. Lancet,2015,385(9970):812-824.
[5]Edgley AJ,Krum H,Kelly DJ.Targeting fbrosis for the treatment of heart failure:a role for transforming growth factor-β[J].Cardiovascular Therapeutics,2012,30(1):e30-e40.
[6]Dobaczewski M,Chen W,Frangogiannis NG.Transforming growth factor(TGF)-beta signaling in cardiac remodeling[J].J Mol Cell Cardiol,2011,51(4):600-606.
[7]Bujak M,Frangogiannis NG.The role of TGF-beta signaling in myocardial infarction and cardiac remodeling[J].Cardiovasc Res,2007, 74(2):184-195.
[8]Kapur NK,wilson S,Yunis AA,et al.Reduced endoglin activity limits cardiac firosis and improves survival in heart failure[J].Circulation,2012,125(22):2728-2738.
[9]李继强,杨吉安,陈谦学,等.稳定低表达BAG3的胶质母细胞瘤U87细胞株的构建及鉴定[J].中国临床神经外科杂志,2015,20(6):353-356.
[10]任杰,高江平,阎瑾琦,等.人PSCA真核表达质粒的构建及稳定转染B16细胞系的建立[J].中国免疫学杂志,2010,26(10):867-870.
Construction and identification of rat cardiomyocyte H9c2 cell line with stable and high expression of TGF-β1.
XU Shu-wenLI Yan,LI Ji-qiang,DAI Wen.
1.Department of Clinical Laboratory,Renmin Hospital of Wuhan University,Wuhan 430060,Hubei,CHINA;2.Department of Neurosurgery,the First Hospital of Wuhan,Wuhan 430022, Hubei,CHINA
ObjectiveTo construct and identify rat cardiomyocyte H9c2 cell line with stable and high expression of transforming growth factor-β1(TGF-β1).MethodsPlasmid pEGFP-TGF-β1was extracted by RNA interference,and sequenced by ABI3130 Genetic Analyzer for identification.The identified pEGFP-TGF-β1were then transfected into rat cardiomyocyte H9c2 cell line(pEGFP-TGF-β1group).After screening culture by G418,the expression of TGF-β1was verified by RT-PCR and Western blot.The cells transfected withempty control plasmid pEGFP were used as the control group.ResultsThe sequencing results confirmed that pEGFP-TGF-β1extracted contained TGF-β1sequence.The transfection efficiency of pEGFP-TGF-β1group and control group were 85%and 93%,respectively. RT-PCR showed that TGF-β1mRNA expression level was(2.563±0.198)in pEGFP-TGF-β1group,which was significantly higher than(1.037±0.022)in control group(t=3.056,P=0.028).Western blot revealed that TGF-β1protein expression level was(3.275±0.234)in pEGFP-TGF-β1group,which was significantly higher than(1.011±0.015)in control group(t=4.372,P=0.015).ConclusionThe constructed rat cardiomyocyte H9c2 cell line could stably express TGF-β1at high level,which could be used for our further research regarding the role of TGF-β1in rat cardiomyocyte and the related signaling pathway.
Rat cardiomyocyte;H9c2 cell line;Transforming growth factor-β1(TGF-β1);Plasmid
R-332
A
1003—6350(2017)11—1721—041,121
2017-02-22)
10.3969/j.issn.1003-6350.2017.11.001
国家自然科学基金(编号:81572069、81501815)
李艳。E-mail:yanlitf1120@163.com

