鼠神经生长因子对弥漫性轴索损伤患者MBP和S100β蛋白的影响及疗效观察
王明强 刘小军 祁绍艳 周明锴 王生锋
郑州大学第二附属医院重症医学科 郑州 450014
鼠神经生长因子对弥漫性轴索损伤患者MBP和S100β蛋白的影响及疗效观察
王明强 刘小军△祁绍艳 周明锴 王生锋
郑州大学第二附属医院重症医学科 郑州 450014
目的 探讨鼠神经生长因子对弥漫性轴索损伤(DAI)患者血清中髓鞘碱性蛋白(MBP)和 S100β蛋白的影响及脑保护作用。方法 收录符合诊断标准的60例DAI患者并随机分为鼠神经生长因子治疗组和对照组各30例,用ELISA法分别检测2组患者治疗前及治疗后各时间点血清中MBP和 S100β蛋白水平,于治疗后的第7、14天对2组患者进行格拉斯哥昏迷评分(GCS),90 d后格拉斯哥预后评分(GOS)评判疗效。结果 治疗组血清中MBP和 S100β蛋白水平显著低于对照组,且治疗组格拉斯哥昏迷评分、预后评分明显高于对照组(P<0.05)。结论 鼠神经生长因子可显著降低 DAI 患者血清中MBP和S100β蛋白表达水平,具有明显神经保护作用。
鼠神经生长因子;弥漫性轴索损伤;髓鞘碱性蛋白;S100β蛋白
弥漫性轴索损伤(diffuse axonal injury,DAI)指头颅在受到特殊外力作用后,深部的脑组织在剪应力作用下出现以神经元轴索肿胀、断裂和轴索球形成为主要病理特征的损伤[1],临床上以原发持久的意识障碍为主要表现,一般病情较重,病死率高达40%~42%,伤残率为30%~40%[2],是外伤后长期昏迷及严重神经功能障碍的最主要原因之一,尚缺乏特异治疗方法,目前认为神经营养类药物对该病患者可能获益,但临床多中心随机对照研究资料缺乏。髓鞘碱性蛋白(myelin basic protein,MBP)和S100β蛋白为颅脑损伤的敏感指标,对脑组织损伤程度的判定及指导治疗有重要意义。本研究通过测定DAI 患者血清中MBP及S100β蛋白的含量,评价应用鼠神经生长因子对 DAI 的神经保护作用,以期为鼠神经生长因子治疗DAI提供理论支持。
1 资料与方法
1.1 研究对象 收集2013-01—2015-01入住我院ICU科的 DAI 患者 60 例,伤后入院时间<12 h。入选标准[3]:(1)有头部加速和(或)减速外伤史;(2)受伤当时便出现昏迷,且昏迷时间连续超过6 h;(3)CT 或 MRI 检查显示弥漫性双侧脑白质水肿、白质与灰质界限不清、脑组织肿胀,脑室系统变窄,无中线移位,脑组织散在多发小出血灶(直径<20 mm)或小梗死灶、小挫裂伤灶;(4)尽管临床表现较重,但未显现颅压增高或影像学未出现明显异常。排除标准:(1)高血压、糖尿病和肝脏与肾脏功能不全等严重慢性疾病者;(2)合并严重的全身多发伤和(或)复合伤者;(3)开放性颅脑损伤或因病情变化开颅手术者,伴发较重颅内感染者;(4)来院就诊时发现两侧瞳孔散大固定、无自主呼吸等濒死状态者及孕产妇;(5)年龄<18岁或>65岁;(6)已使用类似药物或对鼠神经生长因子代谢造成影响的药物者。所有患者均上报医院伦理委员会并且经审核通过,并遵循知情同意原则,经患者及家属签字。
1.2 一般资料 符合上述 DAI 诊断标准的60例患者,依照纳入次序随机进行分配,治疗组应用鼠神经生长因子治疗,对照组和治疗组各30例。治疗组男18例,女12例,年龄20~63(37.5±3.8)岁,格拉斯哥昏迷量表评分(GCS)(4.78±1.52)分;对照组男19例,女11例,年龄19~64(36.8±4.7)岁,GCS(4.23±1.79)分。2组患者在性别、年龄、脑损伤程度GCS评分等方面,差异无统计学意义(P>0.05),具有可比性。
1.3 治疗方法 2组均采用DAI常规处理,保持呼吸道通畅、循环支持、降颅压、止血、抗感染、维持内环境平衡、预防消化道出血、局部亚低温治疗等;治疗组除常规治疗外,在入院第1次采血后立刻予以30 μg注射用鼠神经生长因子(商品名苏肽生,舒泰神(北京)药业有限公司生产)加入 0.9% 氯化钠注射2 mL肌内注射,连续应用 2周。对照组则应用0.9%氯化钠注射液2 mL肌内注射,连续应用 2周。
1.4 血清中MBP及S100β蛋白含量的测定 入院期间在药物治疗前及药物治疗后的第1、2、3、7、14天分别采集静脉血 4 mL,冰浴,并于冰箱内4 ℃ 保存2 h,凝血后以 4 000 r / min 分离血清,当血清离出后,再次置于-2 ℃冰箱内等待检测。应用酶联免疫吸附法(ELISA)测定血清 MBP及S100β蛋白含量。
1.5 疗效判定 在治疗后第7、14天采用格拉斯哥昏迷评分(GCS),分别对2组评分比较。3 个月后采用格拉斯哥预后评分量表(Glasgow outcome scale,GOS)的 5 级标准评分,5分为良好:恢复正常生活,但有轻度缺陷;4分为中残:残疾但可独立生活,能在适度保护下参加社会工作;3分为重残:残疾但意识清楚,生活不能自行处理;2分为植物生存:仅有最小反应(如无意识睁-闭眼);1分为死亡。治疗结果以GOS评分5分及4分表示显效。显效率=(中残+恢复良好)/总例数×100%。

2 结果
2.1 2组血清MBP 含量变化比较 鼠神经生长因子治疗前及治疗后第1、14天血清中 MBP 水平与对照组经比较差异无统计学意义;治疗组于第 3、7天血清中MBP 水平与对照组相比,差异有统计学意义(P<0.05)。见表1 。
2.2 2组血清S100β蛋白含量变化比较 鼠神经生长因子治疗前血清中S100β蛋白水平与对照组相比差异无统计学意义(P>0.05);治疗组于第 1、2、3、7天S100β蛋白水平与对照组相比,差异有统计学意义(P<0.05)。见表2。

表1 不同时间点2组血清中 MBP 含量 比较
注:与对照组相比,*P<0.05

表2 不同时间点2组血清中S100β蛋白 含量比较
注:与对照组相比,*P<0.05
2.3 2组治疗第7天和第14天GCS评分及治疗3个月后GOS评分比较 2组治疗第7天和第14天GCS 评分均有不同程度的改善,但治疗组与对照组比较改善更为显著(P<0.05)。2组比较,3 个月后治疗组 GOS 评分也明显高于对照组,差异有统计学意义(P<0.05)。见表3。
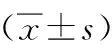
表3 2组第7天和第14天后GCS 评分及治疗 3个月后GOS 评分比较
注:与对照组相比,*P<0.05
2.4 2组疗效比较 治疗组显效率显著高于对照组,差异有统计学意义(P<0.05)。见表4。

表4 2组疗效比较 [n(%)]
注:与对照组相比,*P<0.05
3 讨论
DAI是临床上致残率和病死率均较高的重型颅脑损伤类型,因其主要病理损伤部位为脑白质内广泛轴索受损,故影像学主要表现大脑皮髓质交汇处、大脑中线结构区域出现弥散分布的小出血灶,一般直径<2 cm。针对该病的治疗,目前尚缺乏特异治疗方法,多采用颅脑损伤综合治疗方法,包括括降低颅内压、高压氧疗及防治并发症等。有学者[4]认为脑神经保护药物可促进患者神经功能障碍恢复,主张早期应用,但尚缺乏大量临床应用研究支持。MBP包绕神经纤维使神经冲动传导时减少周围组织的干扰而加快传导速度;当神经系统遭受损伤时可经受损的血脑屏障进入血液,其血液中的含量能够反映神经轴索受损的数量,间接反映了脑白质受损的程度[5]。国内亦有文献报道血清MBP含量在脑外伤早期即可出现升高,且其升高程度可反映髓鞘破坏程度,即血清MBP含量和损伤病情程度呈正相关[6]。S100β蛋白是一种仅存在于脑和脊髓的神经胶质细胞中酸性、可溶性蛋白,其生物功能具有两面性,一方面能够参与胞内信号的传导、调节细胞的可塑性等作用进而起到保护神经组织的作用[7];另一方面若其过高超过一定水平,表现为神经毒性,可以诱导神经细胞和神经胶质细胞的凋亡、坏死[8]。目前研究发现,S100β蛋白是颅脑损伤的敏感指标,其在出现影像学可发现的病理改变之前血清中就可检测到升高,且其血清中含量的高低能反映脑部受损程度。Kanfler等[9]学者认为S100B蛋白在目前能反映脑外伤程度指标中特异性最高。
本研究发现,应用鼠神经生长因子的治疗组于颅脑损伤第 3、7天MBP 水平均显著低于对照组,而S100β蛋白含量在损伤后各观察时间点与对照组相比显著降低,说明损伤早期应用该药可减轻脑组织病变程度;治疗组GCS评分、GOS评分较对照组明显改善,表明应用鼠神经生长因子可改善弥漫颅脑损伤患者预后,减轻患者伤残程度。鼠神经生长因子有可能通过营养神经元、促进神经纤维形成新突触,进而促进神经功能的尽快恢复,同时通过抗自由基、拮抗兴奋性氨基酸神经毒性及抑制钙超载等作用减轻创伤后病理损伤过程,发挥神经保护作用。
总之,本研究表明鼠神经生长因子治疗弥漫轴索变性患者取得较好治疗作用,可有效降低颅脑损伤程度,改善患者预后,减轻伤残程度,为今后的临床应用及研究提供参考和借鉴。
[1] Li XY,Feng DF.Diffuse axonal injury:Novel insights into detection and treatment[J].Clin Neurosci,2009, 16(4):614-619.
[2] 段志新,王洪财,吴芳芳,等.大鼠弥漫性轴索损伤后β-淀粉样前体蛋白表达的动态变化[J].神经损伤与功能重建,2009,4(6):391-393.
[3] 庄仲伟,费智敏,王勇,等.脑弥漫性轴索损伤的诊断与治疗[J].中国临床神经外科杂志,2008,13(5):296-297.
[4] 屠传建,章月江,柳建生,等.重型颅脑损伤中的弥漫性轴索损伤的救治[J].浙江创伤外科,2003,8(6):355-357.
[5] Leivi L,Guilburd JN,Lemberger A,et al.Diffuse axonal injury:analysis of 100 patients with radiological signs[J].Neurosurgery,1990,27(3):429-432.
[6] 夏勤学,鲍文公.颅脑损伤患者血清髓鞘碱性蛋白与伤情及临床预后关系[J].中国临床神经外科杂志,2002, 7(1):55-56.
[7] Nakatomi H,Kuriu T,Okabe S,et al.Regeneration of hippocampal pyramidal neurons after ischemic brain injury by recruitment of endogenous neural progenitor[J].Cell,2002,110(4):429-441.
[8] Wilder PT,Rustandi RR,Drohat AC,et al.SIOOB inhi-bits the protein kinase C-dependent phosphorylation of a peptide derived from p53 in a Ca2+dependent manner?[J].Protein Sci,1998,7(5):794-798.
[9] KannerAA,Marchi N,Fazio V,et al.sellJm Sl00beta:a noninvasive maker of blood-brain barrier function and brain lesions[J].Cancer,2003,97(11):2 806-2 813.
(收稿2016-10-31)
R651.1+5
B
1673-5110(2017)05-0106-03
△通讯作者:刘小军,E-mail:13673695138@139.com

