西格列汀对成人隐匿性自身免疫性糖尿病患者CD4+、CD8+T淋巴细胞的影响
陈家炜 牟新周 旦 阳
·临床报道·
西格列汀对成人隐匿性自身免疫性糖尿病患者CD4+、CD8+T淋巴细胞的影响
陈家炜 牟新周 旦 阳
成人隐匿性自身免疫糖尿病;西格列汀;T淋巴细胞
成人隐匿性自身免疫性糖尿病作为1型糖尿病自身免疫亚型,是由T细胞介导的胰岛β细胞选择性破坏所致的自身免疫疾病,患者体内CD4+、CD8+ T细胞存在一定变化[1]。本研究对成人隐匿性自身免疫糖尿病患者在胰岛素四次强化治疗的基础上加用DPP-4(dipeptidyl peptidase-4,二肽酰基肽酶-4)抑制剂西格列汀,以观察其对T淋巴细胞比例的影响。
1 临床资料
选取我院内分泌门诊2013年5月—2015年12月明确诊断的成人隐匿性自身免疫糖尿病患者30例,按1:1随机分成治疗组和对照组,两组患者一般情况比较,差异无统计学意义(P>0.05),见表1。纳入标准[2]:符合成人隐匿性自身免疫糖尿病诊断标准:成年起病,存在胰岛自身抗体,诊断后至少6个月不依赖胰岛素;性别不限,年龄18~70岁;内生肌酐清除率(CCr)稳定在50mL/min以上;糖化血红蛋白(HbA1c)8%~10%;签署知情同意书。排除癌症、妊娠及对治疗方案中相关药物过敏者。本研究方案患者知情且经杭州市红十字会医院伦理委员会批准。
表1 两组成人隐匿性自身免疫性糖尿病患者基线资料比较

表1 两组成人隐匿性自身免疫性糖尿病患者基线资料比较
?
2 方法
治疗方法:对照组予胰岛素四次强化(门冬胰岛素+甘精胰岛素)治疗,治疗组在对照组基础上加用西格列汀(商品名:捷诺维)10mg,1天1次口服,治疗12周。
监测指标:所有患者治疗前后静脉采血,高效液相层析法检测HbA1c,全自动生化分析仪检测空腹血糖(FPG),化学发光法检测空腹C肽、CD4+、CD8+ T淋巴细胞比例。两组患者治疗前后均采用CGMS(美敦力)连续监测血糖3天,采用CGMS软件分析平均血糖波动幅度(MAGE)。
统计学方法:应用SPSS17.0统计软件进行统计分,计量资料以表示,采用t检验,计数资料采用χ2检验,以P<0.05为差异有统计学意义。
3 结果
3.1 两组患者治疗前后CD4+、CD8+T淋巴细胞比较治疗组治疗12周后CD4/CD8比值较治疗前明显升高(P<0.05);对照组治疗12周后CD4/CD8比值较治疗前变化不大;两组治疗后CD8+、CD4/CD8比较差异有统计学意义(P<0.05)。见表2。
表2 两组成人隐匿性自身免疫性糖尿病患者治疗前后CD4+、CD8+T淋巴细胞比较

表2 两组成人隐匿性自身免疫性糖尿病患者治疗前后CD4+、CD8+T淋巴细胞比较
注:与治疗前比较,*P<0.05;与对照组比较,△P<0.05
?
3.2 两组患者治疗前后血糖情况比较治疗12周后,治疗组MAGE较对照组下降明显,差异有统计学意义(P<0.05),见表3。
4 讨论
成人隐匿性自身免疫糖尿是自身免疫糖尿病的一个亚型,目前的发病机制仍不清楚。因其自身免疫耐受的缺失而选择性破坏胰腺β细胞,临床上呈现出胰岛素分泌不足的特点,并同时伴有α细胞胰高血糖素的不适当分泌[3]。胰岛素的替代治疗依然是经典的1型糖尿病的首选治疗手段。
表3 两组成人隐匿性自身免疫性糖尿病患者治疗前后血糖情况比较
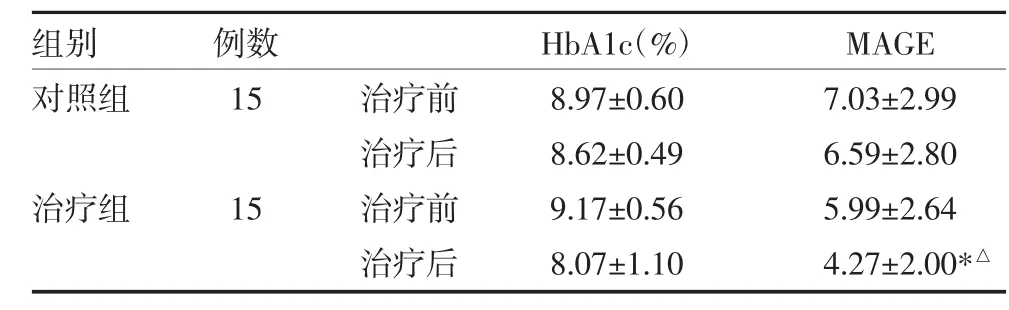
表3 两组成人隐匿性自身免疫性糖尿病患者治疗前后血糖情况比较
注:与治疗前比较,*P<0.05;与对照组比较,△P<0.05;HbA1c:糖化血红蛋白;MAGE:平均血糖波动幅度
?
T淋巴细胞在自身免疫性糖尿病的发病过程中起着重要作用。CD4+T淋巴细胞根据其功能及其产生的细胞因子种类的不同而分为多个亚群,其中Th1淋巴细胞亚群具有破坏胰岛β细胞的作用。CD8+T细胞部分是抑制性T细胞,通过抑制CD4+T细胞的增殖,而减少CD4+T细胞对β细胞的破坏[1]。Shimada等[4]研究发现1型糖尿病及成人隐匿性自身免疫糖尿病患者CD4+T细胞明显高于2型糖尿病和健康对照组(P<0.01)。杨治芳等[5]研究发现成人隐匿性自身免疫糖尿病患者与健康对照组相比,CD4+ CD25+T淋巴细胞占CD4+T细胞比例显著性升高(P<0.01),CD8+T细胞比例升高(P<0.01),CD4+/CD8+ T细胞比值降低(P<0.01)。成人隐匿性自身免疫糖尿病患者与2型糖尿病组比较,CD4+/CD8+T细胞比值降低(P<0.05)。经典1型糖尿病发病前也存在淋巴细胞亚群异常,CD4+/CD8+T细胞比值降低[6]。这些实验结果说明自身免疫性糖尿病患者体内存在T淋巴细胞亚群失调,免疫功能的缺陷。
肠促胰岛素激素包括糖依赖性胰岛素释放肽(GIP)和胰高血糖素样肽-1(GLP-1),这两种激素都有促进葡萄糖依赖的胰岛素分泌的作用[7]。GIP可促进脂类合成,刺激胰高血糖素分泌,降低餐后血糖。GLP-1能够抑制肝糖原分解,延缓胃排空,抑制餐后胰高血糖素分泌,减慢糖吸收,增加饱腹感,减少摄食[8]。GLP-1在体内很快被DPP-4酶灭活,而失去作用,故而DPP-4抑制剂通过抑制DPP-4酶的活性,间接增加内源性GLP-1的浓度,增强GLP-1的作用[9-11]。
DPP-4酶参与蛋白类激素的代谢、T细胞的激活及增殖。静息状态下T细胞DPP-4的表达水平较低,而T细胞活化后DPP-4的表达量明显增加[12]。体外研究表明,可溶性及膜性CD26均能调节T细胞增殖,并影响T细胞的免疫应答[13]。抗原提呈细胞与T细胞表面的CD26二聚体结合后,最终激活NK-kB,促进T细胞增殖,提高IL-2水平[14]。研究[15]表明,1型糖尿病患者胰岛β细胞的破坏与部分T细胞功能异常相关,与健康人相比,1型糖尿病患者的血DPP-4酶活性明显升高,淋巴细胞膜表面CD26的表达量较健康人降低,这可能是1型糖尿病患者T淋巴细胞调节功能异常的表现之一。DPP-4抑制剂治疗1型糖尿病,一方面可以降低血糖水平,另一方面可能参与调节T淋巴细胞的功能。
本研究结果显示,患者加用DPP4抑制剂可使CD4/CD8T细胞的比值升高,改善成人隐匿性自身免疫性糖尿病患者淋巴细胞亚群的失衡。本研究研究样本数量小,干预时间短,实验结果可能存在偏倚,DPP-4抑制剂对于成人隐匿性自身免疫性糖尿病患者淋巴细胞的影响及淋巴细胞亚群异常的改善,是否与患者血糖波动减少有关,尚需要大规模随机对照临床试验进一步加以证实。
[1]石昌红,管庆波.成人隐匿性自身免疫糖尿病患者CD4+ CD25+T细胞的变化研究[J].中国免疫学杂志,2006,22(8);771-774.
[2]金月萍,苏晓飞.成人隐匿性自身免疫性糖尿病诊治的相关研究进展[J].中国糖尿病杂志,2015,23(6):570-573.
[3]李征寒,冯静,苏晶莹,等.沙格列汀联合胰岛素治疗对1型糖尿病患者血糖波动的影响[J].中国基层医药,2016,23(10);1555-1560.
[4]Shimada A,Kodama K,Morimoto J et al.Detection of GAD-reactive CD4+cells in so-called“type 1 B”diabetes[J].Ann NY Acad Sci,2003,1005(5):378-386.
[5]杨治芳,周智广,唐炜立,等.成人隐匿性自身免疫糖尿病CD4+调节性T细胞研究[J].中华医学杂志,2006,86(36):2533-2536.
[6]Denise F,George EJ,John D.Abnormal T-lymphocyte subsets in type 1diabetes[J].Diabetes,1989,38:1462-1468.
[7]Drucker D.The biology of incretin hormones[J].CellMet,2006,3(3):153-165.
[8]李敬华,张红,侯雯莉,等.肠促胰岛素生理作用及应用研究进展[J].武警医学院学报,2001,20(7):597-599,604.
[9]Stonehouse A,Okerson T,Kendall D.Emergingincretin based therapies for type 2 diabetes:incretin mimetics and DPP-4 inhibitors[J].Curr Diabetes Rev,2008,4(2):101-109.
[10]Kobayashi H,Hosono O,Mimori T et al.Reduction of serum soluble CD26/dipeptidyl peptidase IV enzyme activityand its correlation with disease activity in systemic lupus erythematosus[J].Thg Journal of rheumatology,2002,29(9):1858-1866.
[11]Firneisz G,Lakatos PL,Szalay F,et al.Serum dipeptidyl peptidase IV activity in chronic hepatitis C[J].Scandinavian Journal of Gastroenterology,2001,36(8):877-880.
[12]Ohnuma K,Yamochi L,Uchiyama M,et aI.CD26 mediates dissociation of Tollipand IRAK-l from caveolin-l and induces upregulation of CD86 on antigen-presenting cells[J].Molecular andCellular Biology,2005,25(17):7743-7 757.
[13]Ohnuma K,Takahashi N,Yamochi T.Role of CD26/dipeptidyl peptidase IV in humanT cell activation and function[J].Frontiners Bioscience,2008,13:2299-2310.
[14]Varga T,Somogyi A,Barna G,et a1.Higher serum DPP-4 Enzyme Activity anddecreeased lymphocyte CD26 expression intype l Diabetes[J].Pathology 0ncologyresearch:P-OR,2011,17(4):925-930.
[15]Shirakawa L,Fujii H,Ohnuma K.Diet-induced adipose tissue inflammationand liver steatosis are prevented by DPP-4 inhibition in diabetic mice[J].Diabetes,2011,60(04):1246-1257.
(收稿:2016-09-12修回:2016-12-15)
杭州市医药卫生科技计划项目(No.2013A36)
杭州市红十字会医院内分泌科(杭州310003)
陈家炜,Tel:13346173406;E-mail:2170524@qq.com

