利用细胞模型和动物模型筛选抗过敏菌株
段翠翠,赵玉娟,高磊,牛春华,王春玲,李盛钰
(吉林省农业科学院农产品加工研究所,长春130033)
利用细胞模型和动物模型筛选抗过敏菌株
段翠翠,赵玉娟,高磊,牛春华,王春玲,李盛钰
(吉林省农业科学院农产品加工研究所,长春130033)
食物过敏是机体对食物中的主要过敏原产生不正常免疫应答而导致的一种变态反应。相关研究表明食物过敏主要是由Th1/Th2细胞失衡所致,提示纠正Th1/Th2失衡可缓解食物过敏。近年来,利用益生菌特有的抗过敏作用缓解食物过敏是治疗食物过敏的新方向。但缺少筛选用于治疗或预防过敏反应的益生菌的方法,本研究利用细胞模型和动物模型筛选具有提高IFN-γ分泌水平,降低IL-4分泌水平的乳酸菌,可快速准确地筛选到具有抗过敏功能的菌株。
植物乳杆菌;抗过敏;动物模型;Th1/Th2平衡
0 引言
食物过敏是机体对食物中的过敏原产生不正常免疫应答所引发的一种变态反应,可造成过敏性鼻炎、哮喘、腹泻等疾病[1]。益生菌是对宿主健康发挥有益作用的活的微生物,在过敏机体中补充益生菌可缓解过敏反应[2]。研究者发现乳酸杆菌具有重要的免疫调节作用,可调节免疫细胞分泌不同细胞因子来影响免疫反应,提示具有抗过敏潜力[3-4]。乳酸杆菌可抑制致敏小鼠体内总IgE和抗原特异性IgE的产生,增强IL-12和IFN-γ的分泌而抑制IL-4的产生,进而调节Th1/Th2平衡[5-7]。
本研究利用细胞模型和动物模型筛选具有提高IFN-γ分泌水平,降低IL-4分泌水平的乳酸杆菌,并通过动物实验验证所筛选菌株的抗过敏效果。该方法简单可行、实验周期短、可信度非常高,可为科研工作者节约大量时间。
1 实验
1.1 材料
1.1.1 实验动物
4~6周龄雌性清洁级Balb/c小鼠,体重16~18 g,购自长春生物制品研究所有限责任公司,动物合格证号:SCXK(吉)2011-0007,饲养于室温22℃,光照14 h(06:00-20:00),黑暗10 h条件下,自由采食和饮水。
1.1.2 菌株
28株植物乳杆菌分离自东北酸菜和内蒙古发酵乳制品,由吉林省农业科学院农产品加工所乳品加工实验室保存。
1.1.3 主要化学试剂
卵白蛋白(Ovalbumin,OVA),弗氏完全佐剂,RPMI-1640培养液,青链霉素,胎牛血清,红细胞裂解液,总IgE试剂盒,IFN-γ和IL-4 ELISA试剂盒。
1.1.4 仪器设备
Model 680酶标仪,MLS-3780高压蒸汽灭菌锅,BCN-1360B超净工作台,HZQ-Q电热恒温培养箱,胎牛血清,梅特勒-托利多Delta320 pH计,移液枪。
1.2 方法
1.2.1 菌株的活化及菌悬液的制备
将28株植物乳杆菌(耐酸耐胆盐)的冻干粉接种于MRS液体培养基中,37℃传代培养至稳定期,3 000 r/min离心10 min收集菌体。无菌PBS重悬,平板计数测定菌数,将菌悬液浓度调整至约1×109mL-1备用。
1.2.2 脾细胞的分离培养
将小鼠脱颈处死,于70%酒精中浸泡5 min对小鼠进行表面杀菌,无菌条件下取脾脏,放入装有RP⁃MI-1640完全培养液(10%胎牛血清+1%青链霉素)的平皿中,用1 mL注射器反复冲洗脾脏,直至脾脏由暗红色变为浅红色。弃脾,收集脾细胞,离心去上清,加入红细胞裂解液裂解1 min,RPMI-1640完全培养液洗涤3次,获得脾细胞,调整细胞浓度为5×106mL-1备用。
1.2.3 植物乳杆菌刺激脾细胞分泌细胞因子的测定
将脾细胞与植物乳杆菌按照1∶1共培养,加入刺激物OVA(Ovalbumin),终质量浓度为1 mg/mL。72 h后离心收集细胞上清,利用ELISA方法检测细胞培养上清中IL-4和IFN-γ的分泌水平。
1.2.4 建立动物模型
将6~8周龄雌性Balb/c小鼠适应性喂养3 d,然后随机分为4组(每组8只),分别为空白组、致敏组、预防组和治疗组。致敏组腹腔注射0.2 mL质量浓度为1 mg/mL混匀的过敏原(1 mL弗氏佐剂+1 mL质量浓度1 mg/mL OVA),每周1次,共3次注射,第3次注射6 h后处死。为了判断是否成功建立动物模型,我们观察了致敏症状,每周尾静脉采血检测IgE水平。预防组小鼠灌胃0.1 mL 1×109mL-1的菌液,每周3次,持续3周,并在第7、14、21 d腹腔注射1 mg/mL混匀的过敏原;治疗组在小鼠最后一次致敏后,以0.1 mL灌胃1×109mL-1的菌液,共灌胃9 d;空白组则灌胃0.1 mL的生理盐水,每周3次,持续两周。建模结束后处死小鼠,分离脾脏,提取脾细胞,采用眼球取血,分离血清-80℃保存,待检测各项指标。
1.2.5 肠道通透性的检测
第二周皮下注射后,致敏组小鼠中取2只尾静脉注射1mL芝加哥蓝(1%),10 min后脱颈处死小鼠,截取同部位等质量的小肠,置于500 μL甲酰胺中,5 d后使用分光光度计测量620 mn处的吸光值,即代表小鼠的肠壁血管通透性,治疗组和预防组在实验结束后,以同样方式处理,检测灌胃植物乳杆菌后肠壁血管的通透性。
1.2.6 ELISA法检测脾细胞上清中细胞因子水平
无菌取小鼠脾细胞,调细胞密度为2×106mL-1分别接种于6孔板中,同时加入OVA和植物乳杆菌与脾细胞共培养,37℃质量分数为5%的CO2条件下培养48 h,离心收集上清用于检测IL-4和IFN-γ的水平。
1.2.7 ELISA法检测血清中细胞因子水平
建模结束后,摘眼球取血,37℃恒温箱中静置1 h,然后4℃条件下,转速为3 000 r/min离心10 min,取上清,放置于-80℃冰箱中保存,采用ELISA法检测小鼠血清中细胞因子IL-4和IFN-γ的水平。
1.2.8 ELISA法检测血清总IgE水平
建模结束后,摘眼球取血,37℃恒温箱中静置1 h,然后4℃条件下,转速为3 000 r/min离心10 min,取上清,放置于-80℃冰箱中保存,按试剂盒说明书测定血清总lgE的水平。450 nm处读取OD值。
1.3 统计学分析
实验结果均以平均数±标准差(x±s)表示,采用SPSS 17.0软件进行统计分析,组间比较进行单因素方差分析(One-way ANOVA),P<0.05认为差异具有显著性统计学意义。
2 结果
2.1 植物乳杆菌对小鼠脾细胞分泌细胞因子的影响
28株植物乳杆菌分别与小鼠脾细胞体外共培养,加入OVA刺激,采用ELISA法检测脾细胞上清中IFN-γ和IL-4的分泌水平。IFN-γ主要由活化的T细胞和NK细胞产生,属于Th1型细胞因子,机体发生过敏反应时,IFN-γ促进Th细胞向Th1分化从而对I型超敏反应起到抑制作用,由于菌株对脾细胞产生相应细胞因子的水平差异较大,选择可刺激脾细胞分泌
IFN-γ水平为主要因素,体外实验初步筛选获得SnT、Sc52、Sc9和CH4,这4株菌能够刺激脾细胞分泌较高水平的IFN-γ,所以我们选择这4株菌作为具有免疫调节潜力的益生菌株进行下一步实验。

表1 植物乳杆菌对小鼠脾细胞分泌细胞因子的影响pg/mL
2.2 成功建立食物过敏动物模型的判定方法
为了利用体内实验验证体外所筛选菌株的抗过敏功能,以OVA为致敏原,利用Balb/c小鼠建立食物过敏动物模型。第一次腹腔注射OVA致敏后,观察小鼠免疫状态,发现致敏组小鼠出现抓耳、挠腮、活力降低、呼吸困难,毛发竖起的反应。建模过程中小鼠体重比空白组明显下降,出现此现象可能是因腹腔注射OVA致敏所致,小鼠对OVA致敏反应强烈,导致体重下降。此外,建模结束处死小鼠后,摘取脾脏,发现致敏组与空白组相比免疫器官脾脏出现肥大现象。每周尾静脉采血,检测血清中的IgE水平,在末次激发后,IgE水平达到最高,是成功建立食物过敏模型的典型标志(图1)。
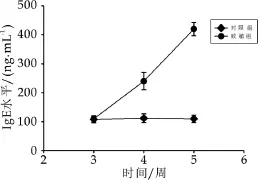
图1 不同处理时间血清中的IgE水平
2.3 植物乳杆菌对致敏小鼠肠壁血管通透性的影响
受到抗原刺激后,小鼠发生过敏反应,肠壁血管通透性会发生变化,如图2所示。由图2可以看出,致敏组小鼠肠壁血管通透性最高,但是灌胃4株乳酸菌后,肠壁血管通透性显著下降,与对照组没有显著差异,说明灌胃筛选到的植物乳杆菌后,肠壁血管通透性恢复正常,治疗组与预防组结果一致。图2中,∗表示与致敏组相比差异显著(P<0.05)。
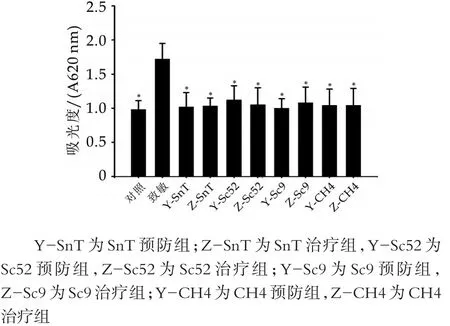
图2 植物乳杆菌对致敏小鼠肠壁血管通透性的影响
2.4 植物乳杆菌对致敏小鼠血清分泌细胞因子的影响
I型过敏性反应的显着特征是血清中IgE水平的升高,通常被认为是由Th1和Th2型细胞失衡造成的[4]。本研究结果如下表所示,致敏组小鼠血清中IL-4水平显著升高(P<0.05),IFN-γ水平显著降低(P<0.05)。预防组和治疗组结果提示,4株植物乳杆菌均可下调IL-4的分泌水平(P<0.05),上调IFN-γ的分泌水平(P<0.05),并且SnT、Sc52和Sc9治疗组IFN-γ的分泌水平显著增加(P<0.05)。这些结果提示,植物乳杆菌可能通过下调IL-4,上调IFN-γ的水平来影响Th1/ Th2平衡,进而缓解过敏反应,可通过科学调配应用于防治食物过敏症状。
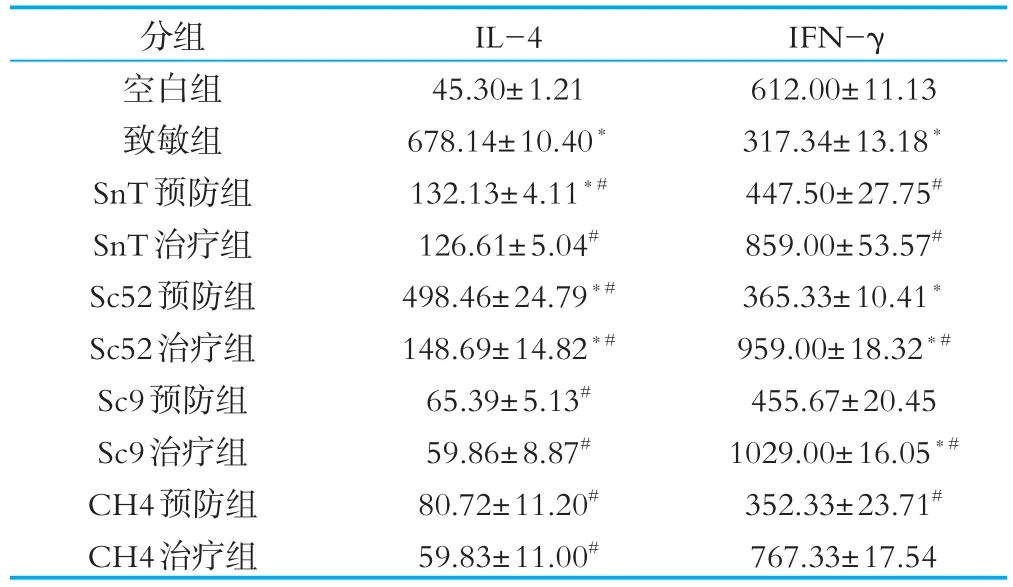
表2 植物乳杆菌对致敏小鼠血清分泌Th细胞因子的影响pg/mL
2.5 植物乳杆菌对致敏小鼠脾细胞分泌细胞因子的影响
Th1细胞主要分泌IFN-γ、TNF-α、IL-12等细胞因子,抑制机体产生IgE。Th2细胞主要分泌IL-4、IL-5等细胞因子,促进机体产生IgE。细胞因子间相互刺激,在动态平衡中调节机体的细胞免疫。实验结束后,取各组小鼠脾细胞进行体外共培养实验,结果如表3所示。与致敏组相比,四株植物乳杆菌均可抑制致敏小鼠脾细胞分泌IL-4,其中SnT和Sc52显著抑制IL-4分泌水平的增加,而植物乳杆菌Sc9下调IL-4的作用最显著,接近对照组,植物乳杆菌CH4组IL-4水平低于致敏组,但是差异不显著。此外,我们检测了植物乳杆菌对致敏小鼠脾细胞分泌IFN-γ的影响,结果表明,灌胃植物乳杆菌SnT、Sc52和Sc9后,小鼠脾细胞分泌IFN-γ的水平显著增加,而灌胃植物乳杆菌CH4后,虽然IFN-γ的分泌水平与致敏组相比显著增加,但是显著低于空白组。
2.6 植物乳杆菌对小鼠血清总IgE水平的影响
实验结束后,摘眼球取血,利用ELISA方法检测各实验组中血清中总IgE水平的变化,如图3所示。结果表明,致敏小鼠血清总IgE含量显著高于空白组(P<0.05),灌胃各种乳酸菌的预防组和治疗组小鼠血清中的总IgE水平均显著低于致敏组(P<0.05)。通过结果可知,SnT、Sc52、Sc79和CH4均有效抑制总IgE水平(P<0.05),进而缓解食物过敏。图3中,∗表示与致敏组相比差异显著(P<0.05)。
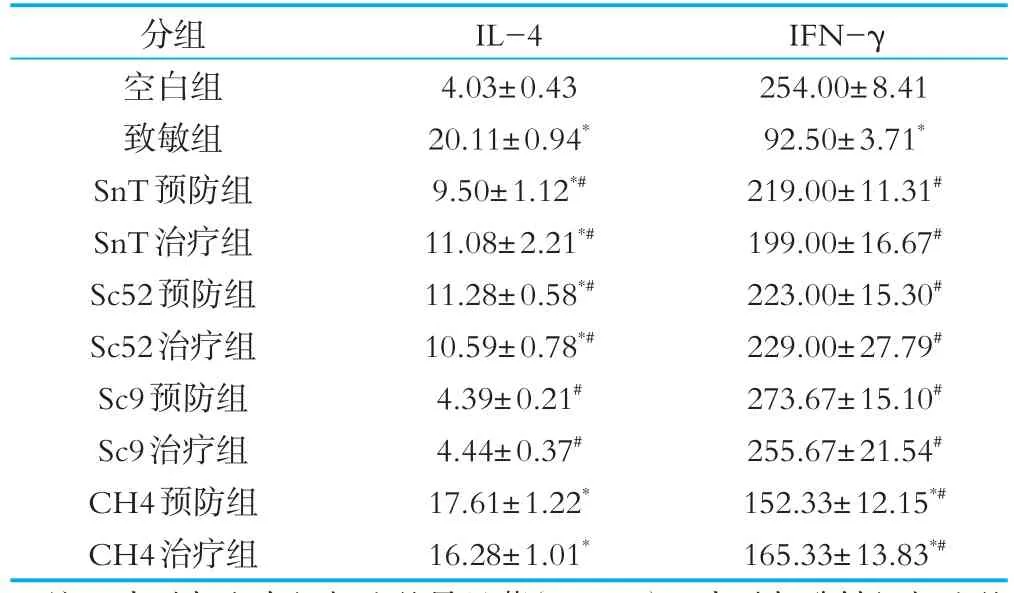
表3 植物乳杆菌对致敏小鼠脾细胞分泌Th细胞因子的影响pg/mL
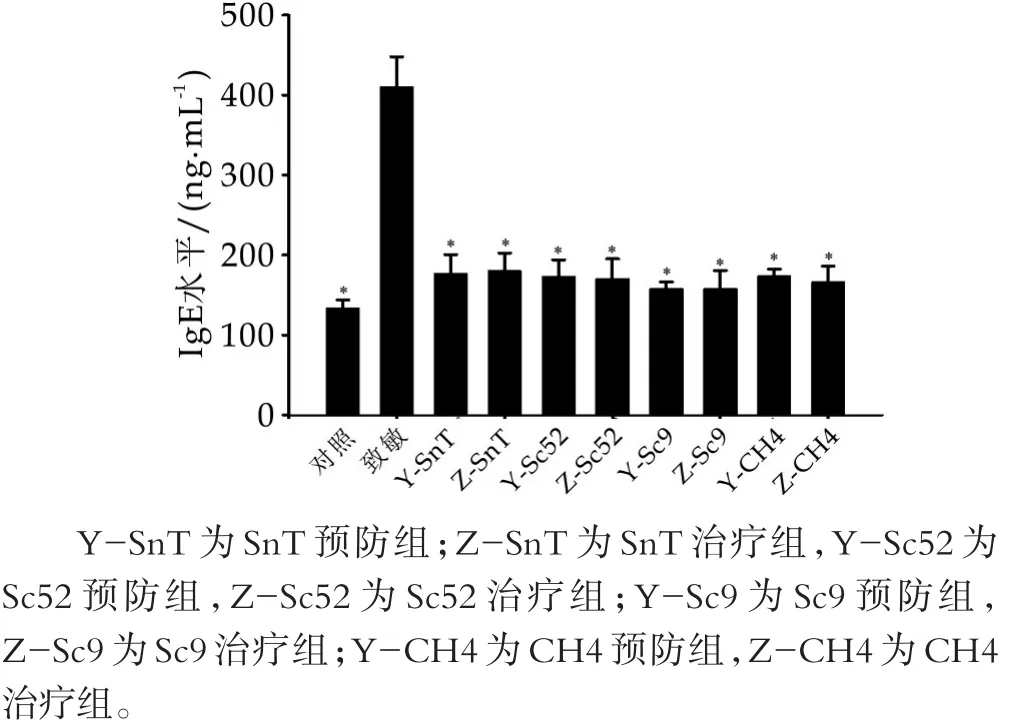
图3 植物乳杆菌对小鼠血清总IgE水平的影响
3 讨论
大量研究证实某些乳酸菌具有抗过敏功能,表现为刺激免疫细胞分泌某种细胞因子来发挥抗过敏作用[8-9]。因此,可以利用这一特点来筛选具有抗过敏潜力的乳酸菌。食物过敏的显著特征是IL-4水平升高,IFN-γ水平降低,即存在Th1/Th2细胞失衡,本研究首先利用体外细胞实验从耐酸、耐胆盐菌株中筛选能够刺激免疫细胞分泌高水平IFN-γ的菌株,然后以OVA为致敏原,Balb/c小鼠为实验动物建立致敏动物模型,灌胃筛选到的具有抗过敏潜力的乳酸菌,利用动物模型进一步验证所筛选菌株的抗过敏能力。
在体外细胞实验中,我们分离培养脾细胞,将28株乳酸菌与脾细胞共培养,利用ELISA方法检测脾细胞培养上清中的细胞因子水平。我们筛选到了四株具有抗过敏潜力的乳酸菌,分别为SnT,Sc52,Sc79和CH4,这4株菌可以刺激脾细胞产生较高水平的IFN-γ,提示其可能通过上调机体中IFN-γ水平来缓解过敏反应,但是体外实验并不能完全证实此益生功能,我们需要进一步实验进行验证。
以Balb/c小鼠为实验动物,腹腔注射致敏原OVA,建立食物致敏模型,灌胃植物乳杆菌后,致敏症状减轻,不再表现出抓耳、挠腮、活力降低和呼吸困难等症状。实验结束后我们检测了脾细胞培养上清中的细胞因子水平,结果证实4株乳酸菌可以上调致敏小鼠脾细胞培养上清中IFN-γ的水平,下调IL-4的水平,提示乳酸菌可通过纠正过敏机体中的Th1/Th2平衡来缓解食物过敏,血清检测结果也证实了这一推断。
IgE在食物过敏反应中起重要作用。当初次接触过敏原后刺激机体产生IgE,IgE在肥大细胞和嗜碱性粒细胞表面结合使机体呈致敏状态。研究表明,在益生菌干预下可有效降低IgE的产生[4,6,10]。因此我们检测了各组小鼠血清中的IgE水平,灌胃植物乳杆菌4株乳酸菌后,小鼠血清中IgE水平显著降低,提示这4株乳酸菌可通过降低体内IgE水平缓解食物过敏反应。从免疫学角度来说,IgE水平降低往往伴随IFN-γ水平升高,即IFN-γ可调控IgE的产生。这与我们的实验结果一致。
本研究利用体外细胞实验筛选到具有抗过敏潜力的乳酸菌,并利用动物模型验证了4株乳酸菌的抗过敏能力,成功获得具有抗过敏功能的乳酸菌。该方法实验周期短,投入成本低,如果将过敏原换成β-乳球蛋白就可以建立牛乳过敏模型,因此这是一种可以推广使用的用于筛选抗过敏菌株的有效方法。
[1]HOST A,HALKEN S.Cow's milk allergy:where have we come from and where are we going[J].Endocr Metab Immune Disord Drug Targets.,2014,14:2-8.
[2]QUIGLEY E M.Gut bacteria in health and disease[J].Gastroenterol Hepatol.,2013,9:560-569.
[3]SHAH N P.Functional cultures and health benefits[J].Int Dairy J.,2007,17:1262-1277.
[4]SEGAWA S,NAKAKITA Y,TAKATA Y,et al.Effect of oral admin⁃istration of heat-killed Lactobacillus brevis SBC8803 on total and oval⁃bumin-specific immunoglobulin E production through the improve⁃ment of Th1/Th2 balance[J].Int J Food Microbiol.,2008,121:1-10.
[5]CHIANG S S,PAN T M.Antiosteoporotic effects of Lactobacil⁃lus-fermented soy skim milk on bone mineral density and the micro⁃structure of femoral bone in ovariectomized mice[J].J Agric Food Chem.,2011,59:7734-7742.
[6]FUJIWARA D,INOUS S,WAKABAYASHI H,et al.The anti-aller⁃gic effects of lactic acid bacteria are strain dependent and mediated by effects on both Th1/Th2 cytokine expression and balance[J].Int Arch Allergy Immunol.,2004,135:205-215.
[7]POHJAVUORI E,VILJANEN M,KORPELA R,et al.Lactobacillus GG effect in increasing IFN-gamma production in infants with cow’s milk allergy[J].J Allergy Clin Immunol.,2004,114:131-136.
[8]SONG S,LEE S J,PARK D J,et al.The anti-allergic activity of Lac⁃tobacillus plantarum L67 and its application to yogurt[J].J Dairy Sci.,2016,99:9372-9382.
[9]WATTS A M,WEST N P,SMITH P K,et al.Probiotics and Allergic Rhinitis:A Simon Two-Stage Design to Determine Effectiveness[J].J Altern Complement Med.,2016,22:1007-1012.
[10]MATSUZAKI T,YAMAZAKI R,HASHIMOTO S,et al.The ef⁃fect of oral feeding of Lactobacillus casei strain Shirota on immuno⁃globulin E production in mice[J].J Dairy Science.,1998,81:48-53.
Screening of Lactic acid bacteria(LAB)characterized by antianaphylaxis using cell and animal models
DUAN Cuicui,ZHAO Yujuan,GAO Lei,NIU Chunhua,WANG Chunling,LI Shengyu
(Institute of Agri-food Technology,Jilin Academy of Agricultural Sciences,Changchun 130033,China)
Food allergy is an allergic reaction caused by abnormal immune response by human body to the main allergens in food.Related studies have shown that food allergies are mainly caused by Th1/Th2 imbalance,indicating that shifting Th1/Th2 imbalance can alleviate food allergies.In recent years,it is a new direction for the treatment of food allergy to use probiotic-specific anti-allergic effects.However,it is lack of screening method to obtain probiotics for the treatment or prevention of allergic reaction.This study used cell and animal models to screen anti-allergyLactic acid bacteriathat could up-regulate IFN-γ secretion level and down-regulate IL-4 secretion level so as to quickly and accurately obtain the target strains.
Lactobacillus plantarum;antianaphylaxis;animal model;Th1/Th2 balance
Q93-331
A
1001-2230(2017)05-0010-04
2016-10-24
国家现代农业(奶牛)产业技术体系建设专项(CARS-37);中国博士后科学基金面上资助项目(2016M591500);吉林省农业科学院博士后科研启动基金项目(c5282010318)。
段翠翠(1984-),女,博士研究生,研究方向为乳品加工。
李盛钰

