DCE-MRI定量参数Ktrans值评估抗血管生成药物治疗裸鼠胃癌原位移植瘤的疗效
史学莲,时高峰,王小玲,王 琦,刘 辉
(河北医科大学第四医院CT/MRI室,河北 石家庄 050011)
DCE-MRI定量参数Ktrans值评估抗血管生成药物治疗裸鼠胃癌原位移植瘤的疗效
史学莲,时高峰*,王小玲,王 琦,刘 辉
(河北医科大学第四医院CT/MRI室,河北 石家庄 050011)
目的 分析MR动态增强扫描(DCE-MRI)定量参数Ktrans值评估甲磺酸阿帕替尼治疗裸鼠胃癌原位移植瘤的疗效。方法 建立裸鼠胃癌原位移植瘤模型后,随机分为治疗组(n=15,胃内灌注甲磺酸阿帕替尼100 mg/kg体质量)和对照组(n=15,胃内灌注无菌去离子水),治疗18天后行DCE-MRI,并定量测量Ktrans值。检查结束后,取出瘤体测量微血管密度(MVD)值和血管内皮生长因子(VEGF)水平,并对比组间差异。结果 与对照组相比,治疗组MVD值(χ2=4.89,P<0.05)、VEGF水平明显减低(χ2=8.69,P<0.01),治疗组Ktrans值[(0.63±0.05)/min]明显低于对照组 [(1.66±0.23)/min;t=17.05,P<0.01]。结论 DCE-MRI定量参数Ktrans值可作为胃癌抗血管生成药物甲磺酸阿帕替尼疗效的评估指标。
磁共振成像;胃肿瘤;模型,动物;血管生成抑制剂
甲磺酸阿帕替尼(Apatinib mesylate,商品名:艾坦)是一种新型的血管内皮生长因子受体(vascular endothelial growth factor receptor, VEGFR-2)酪氨酸激酶抑制剂,可以有效抑制细胞增殖、转移,是治疗晚期胃癌的新选择[1-2]。微血管密度(microvessel density, MVD)是评估肿瘤相关血管生成以及胃癌预后的有效指标,血管内皮生长因子(vascular endothelial growth factor, VEGF)的表达与胃癌血管受侵、转移和临床预后有关[3-4],但MVD、VEGF等的测定方法为有创操作,无法动态、重复地观察肿瘤血管生成情况,亦无法检测肿瘤血管早期的变化。MR动态增强扫描(dynamic contrast enhanced MRI, DCE-MRI)是一种无创评估肿瘤血管改变的影像学检查方法,常被用于抗肿瘤疗效的评估。T1加权DCE-MRI可进行半定量或定量分析,其参数可以反映血管的生理学和解剖学特点[5-6]。本研究通过建立裸鼠胃癌原位移植瘤模型,评估DCE-MRI监测抗血管生成药物疗效的可行性。
1 材料与方法
1.1材料 中分化人胃癌细胞株(SGC7901,购自中国科学院上海细胞研究所);雄性BALB/c-nu裸小鼠48只[4~6周龄,体质量16~20 g,购于北京维通利华实验动物技术有限公司,许可证号:SCXK(京)2012-0001];CD34单克隆抗体、鼠抗人VEGF单克隆抗体(英国Abcam公司);免疫组化试剂、DAB显色液(北京中杉金桥生物技术开发公司);EDTA修复液(Gene Tech公司)。实验动物均在河北医科大学第四医院动物实验中心标准环境中饲养,所有实验均经伦理委员会批准。
1.2模型的建立 人胃癌细胞株SGC7901常规复苏、传代后,取至少5×106个/100 μl PBS细胞悬液,注射于3只裸小鼠右腋下建立皮下移植瘤模型,接种3周左右瘤体生长至直径约10 mm时取出以传代,取传代5次的瘤体,处理后备用。裸鼠术前停食12 h,腹腔注射2%戊巴比妥钠麻醉,常规消毒,取腹正中切口,于剑突下切开约1.5 cm皮肤,自白线处切开腹膜,将胃稍拉出腹腔,在胃大弯侧血管丰富区划开胃浆膜层成“一”字,观察到出血后将备用瘤块接种于此。在“一”字处滴少量OB胶,将网膜组织覆盖在胶上,待粘合牢固后将鼠胃还纳入腹,逐层关腹[7]。采用上述方法建立30只裸鼠胃癌模型,术后继续饲养3周。
1.3分组 将建模成功裸鼠随机分为治疗组(n=15),每天每只给予甲磺酸阿帕替尼2 mg,以无菌去离子水溶解至0.1 ml进行灌胃治疗,累及剂量约 100 mg/kg体质量);对照组(n=15),每天每只0.1 ml无菌去离子水灌胃,18天[8]后行DCE-MRI。
1.4 DCE-MRI 扫描前麻醉裸鼠,采用26G留置针行尾静脉穿刺,将裸鼠置于硬质板保定并保温。采用Siemens SKYRA 3.0T超导型MR扫描仪,Loop线圈。平扫序列包括TSE序列T2WI、T1WI,然后以5°、10°、12°、15°翻转角行T1加权的轴位容积式插入法屏气检查(volumetric interpolated breath-hold examination, VIBE)序列,随后行翻转角为12°的VIBE动态灌注成像。第1期时间为4.14 s,随后各期时间为1.50 s。扫描5期后,经尾静脉手动推注对比剂(钆喷酸葡胺注射液),0.3 mmol/kg体质量,同时连续无中断扫描160期,共计扫描时间为4 min 5 s。扫描参数见表1。
将数据传至Syngo VX91B图像处理工作站,采用Tissue 4D软件分析,在2名资深放射科专家监督下,参考配准校正后的动态图像,分别在2个不同层面肿瘤强化最明显处勾画ROI,面积约1 mm2。采用Tofts模型进行分析(分析模型采用“slow”,对比剂剂量0.01 ml)获得定量参数:转运常数(volume transfer coefficient, Ktrans)、血管外细胞外容积分数(extravascular extracellular volume fraction, Ve)和速率常数(reverse reflux rate constant, Kep)。每个数值测量2次后取平均值。
1.5免疫组化染色及判定标准 荷瘤裸鼠接受DCE-MRI后立即处死,取出瘤体,以10%中性甲醛溶液固定。尽量选取与MR轴位扫描对应的肿瘤强化位置进行脱水透明、浸蜡包埋。HE染色后于显微镜下观察移植瘤生长情况及癌灶坏死情况。采用MaxVisionTM/HRP即用型快捷免疫组化染色方法进行免疫组化染色。本研究选择CD34作为标记物,将成簇的血管内皮细胞与邻近的微血管、肿瘤细胞和结缔组织分开,被CD34标记的成簇的血管内皮细胞认为是一个单独、可计数的微血管。低倍镜下确定热点区域,并计数染色的微血管数均值,所有样本均计算3个血管热点区域微血管数量的平均值,获得每个样本的MVD。将所有样本MVD按照从高到低进行排列,取前10%定义为高MVD,其余为低MVD。

表1 裸鼠各扫描序列参数

表2 治疗组和对照组DCE-MRI定量参数

表3 治疗组和对照组MVD和VEGF表达水平[只(%),n=15]

图1 裸鼠移植瘤Ktrans图 A.对照组Ktrans图,Ktrans=1.625/min; B.治疗组Ktrans图,Ktrans=0.707/min
VEGF表达水平的观察,由2名病理医师分别对每张切片(观察500个细胞)的VEGF结果进行判读,计算VEGF阳性细胞占所观察细胞的百分数,有异议的切片要共同观察得出结论;将VEGF分为高表达(VEGF染色细胞占所观察细胞的百分数≥50%)和低表达(VEGF染色细胞占所观察细胞的百分数<50%)。
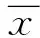
2 结果
肿瘤呈类圆形,T1WI呈等或稍低信号,T2WI呈稍高或等信号,信号欠均匀,肿瘤边缘清楚。肿瘤强化最明显区域多位于肿瘤周边区域。治疗组Ktrans值、Kep值低于对照组,Ve高于对照组,差异均有统计学意义 (P均<0.01,表2,图1)。
CD34表达定位于细胞质或细胞膜(图2),治疗组、对照组共计30个裸鼠移植瘤中,高MVD率为56.67%(17/30),低MVD率为43.33%(13/30);治疗组与对照组表达情况差异有统计学意义(χ2=4.89,P<0.05,表3)。VEGF表达定位于细胞质(图3),VEGF高表达率为56.67%(17/30),而低表达率为43.33%(13/30);治疗组与对照组的VEGF表达水平差异有统计学意义(χ2=8.69,P<0.01,表3)。
3 讨论
研究[3,9]表明,肿瘤介导的血管生成是由高水平的促血管生成因子和下调的内源性血管生成抑制剂综合作用的结果,其在胃恶性肿瘤的发病机制中起着基础性作用。多项研究[10]表明,MVD参与肿瘤的发展和转移,且肿瘤MVD与癌细胞进入血流的机会呈正相关[11],因此,MVD是评估肿瘤血管生成的可靠指标,可用于评估肿瘤的生长和进展。MVD越高,肿瘤的营养状况越好,越有利于促进肿瘤生长,预后越差[12]。研究[13]显示,肿瘤细胞来源的VEGF作用于血管内皮细胞促进血管生成和肿瘤生长。在不同程度的胃癌病变中均发现VEGF免疫组化结果阳性,其表达与胃癌血管受侵、转移和临床预后有关[3-4]。
T1加权DCE-MRI定量药代动力学分析是通过分析ROI内对比剂的吸收获得定量参数,这些参数可反映血管的生理学和解剖学特点,所得结果更接近真实的组织微循环[5-6]。基于Tofts双室模型,定量参数分析能够测量对比剂从血浆渗漏到血管外细胞外间隙(extravascular extracellular space, EES)的正向转运常数(Ktrans)、对比剂从EES返回到血浆的反向转运常数(Kep)和EES容积分数(Ve)[14-15],三者关系为Kep=Ktrans/Ve。从生理学角度讲,DCE-MRI定量参数中Ktrans值最有意义,因为其在血流量受限或组织渗透性受限的情况下,均能进行评估。复杂情况下,则代表血流量和渗透性[16]。DCE-MRI已经越来越多地应用于描述各种肿瘤的特征、抗肿瘤治疗过程中肿瘤血流灌注的变化及鉴别诊断。不同肿瘤模型的研究[13,17-18]表明,DCE-MRI能够监测抗血管生成治疗的反应。

图2 CD34免疫组化染色结果(×100) A.低MVD; B.高MVD 图3 VEGF免疫组化染色结果(×100),棕色染色的细胞被定义为VEGF阳性细胞 A.低表达; B.高表达
自Folkman提出恶性肿瘤的生长、转移依赖肿瘤新生血管的假说后,直接和间接证据均表明肿瘤生长和转移伴随着新生血管的生长,证明抗血管生成药物治疗肿瘤的合理性和可行性[3,19]。甲磺酸阿帕替尼是一种VEGFR-2抑制剂,临床前数据表明,阿帕替尼对于实体肿瘤和白血病有较高的治疗效果,可有效地抑制人脐静脉内皮细胞的增殖和迁移,阻断大鼠主动脉环,抑制裸鼠移植瘤的生长[8,20-21]。VEGFR-2和VEGF分子结合可有效地、选择性地抑制血管内皮生长因子信号的传导。其作用机制是VEGFR-2和VEGF分子结合后首先发生受体二聚化,其次是受体本身羧基末端激酶区域的自动磷酸化作用,随后多个不同的分子路径同时被激活,如Raf/MEK/Erk通路引起内皮细胞的增殖;p38-MAPK通路与内皮细胞迁移有关;PI3K/AKT/mTOR通路负责增强内皮细胞的生存期,增加血管的通透性[1]。因此,治疗组应用VEGFR-2抑制剂后,抑制了VEGFR-2和VEGF分子结合的信号传导,从而抑制了血管内皮细胞的迁移和管腔的形成[22],使肿瘤内血管退化、MVD降低,导致血流量下降,使肿瘤异常血管“正常化”、肿瘤毛细血管渗透性下降,表现为治疗组胃癌组织Ktrans值下降。研究[11]表明,肿瘤中VEGF上调诱导内皮细胞的增殖,促进新生血管的形成,MVD增加,从而维持肿瘤的增殖,与本研究治疗组VEGF低表达率明显高于对照组的结果一致。本研究结果显示,Ktrans值在治疗组、对照组有差异,且变化趋势与MVD、VEGF变化趋势相一致,
总之,阿帕替尼对裸鼠胃癌原位移植瘤治疗有效,且推测Ktrans值有可能作为胃癌抗血管生成药物疗效的评估指标,以期在临床动态、无创地监测抗血管生成药物的疗效,但还需要进一步研究证实。
[1] Fuchs CS, Tomasek J, Yong CJ, et al. Ramucirumab monotherapy for previously treated advanced gastric or gastro-oesophageal junction adenocarcinoma (REGARD): An international, randomised, multicentre, placebo-controlled, phase 3 trial. Lancet, 2014,383(9911):31-39.
[2] Geng R, Li J. Apatinib for the treatment of gastric cancer. Expert Opin Pharmacother, 2015,16(1):117-122.
[3] Wu J, Shi YQ, Wu KC, et al. Angiostatin up-regulation in gastric cancer cell SGC7901 inhibits tumorigenesis in nude mice. World J Gastroenterol, 2003,9(1):59-64.
[4] Chen CN, Cheng YM, Lin MT, et al. Association of color Doppler vascularity index and microvessel density with survival in patients with gastric cancer. Ann Surg, 2002,235(4):512-518.
[5] Malamas AS, Jin EL, Zhang Q, et al. Anti-angiogenic effects of bumetanide revealed by DCE-MRI with a biodegradable macromolecular contrast agent in a colon cancer model. Pharm Res, 2015,32(9):3029-3043.
[6] Sourbron SP, Buckley DL. Tracer kinetic modelling in MRI: Estimating perfusion and capillary permeability. Phys Med Biol, 2012,57(2):R1-R33.
[7] Furukawa T, Fu X, Kubota T, et al. Nude mouse metastatic models of human stomach cancer constructed using orthotopic implantation of histologically intact tissue. Cancer Res, 1993,53(5):1204-1208.
[8] Tian S, Quan H, Xie C, et al. YN968D1 is a novel and selective inhibitor of vascular endothelial growth factor receptor-2 tyrosine kinase with potent activity in vitro and in vivo. Cancer Sci, 2011,102(7):1374-1380.
[9] Saito H, Tsujitani S. Angiogenesis, angiogenic factor expression and prognosis of gastric carcinoma. Anticancer Res, 2001,21(6B):4365-4372.
[10] Wang YD, Wu P, Mao JD, et al. Relationship between vascular invasion and microvessel density and micrometastasis. World J Gastroenterol, 2007,13(46):6269-6273.
[11] Xie L, Shen LD, Qing C, et al. Correlational study of vascular endothelial growth factor expression and microvessel density in primary malignant gastric lymphoma. Med Oncol, 2012,29(3):1711-1715.
[12] Wang YB, Ba CF, Yang LF, et al. Expression of differentiation inhibiting factor 1 and vascular endothelial growth factor and the relation between them and microvessel density in gastric cancer tissue. Hepatogastroenterology, 2013,60(121):197-199.
[13] Li L, Wang K, Sun XL, et al. Parameters of dynamic contrast-enhanced MRI as imaging markers for angiogenesis and proliferation in human breast cancer. Med Sci Monit, 2015,21:376-382.
[14] Ahn SJ, An CS, Koom WS, et al. Correlations of 3T DCE-MRI quantitative parameters with microvessel density in a human-colorectal-cancer xenograft mouse model.Korean J Radiol, 2011,12(6):722-730.
[15] Tofts PS, Brix G, Buckley DL, et al. Estimating kinetic parameters from dynamic contrast-enhanced T(1)-weighted MRI of a diffusable tracer: Standardized quantities and symbols. J Magn Reson Imaging, 1999,10(3):223-232.
[16] Khalifa F, Soliman A, El-Baz A, et al. Models and methods for analyzing DCE-MRI: A review. Med Phys, 2014,41(12):124301.
[17] 胡运胜,张贵祥,赵京龙,等.VEGF反义核酸调控兔VX2肿瘤早期血管生成的DCE-MRI研究.中国医学影像技术,2005,21(11):1640-1643.
[18] Ceelen W, Smeets P, Backes W, et al. Noninvasive monitoring of radiotherapy-induced microvascular changes using dynamic contrast enhanced magnetic resonance imaging (DCE-MRI) in a colorectal tumor model. Int J Radiat Oncol Biol Phys, 2006,64(4):1188-1196.
[19] Rosen LS. Angiogenesis inhibition in solid tumors. Cancer J, 2001,7(3):S120-S128.
[20] Hu X, Zhang J, Xu B, et al. Multicenter phase Ⅱ study of apatinib, a novel VEGFR inhibitor in heavily pretreated patients with metastatic triple-negative breast cancer. Int J Cancer, 2014,135(8):1961-1969.
[21] Tong XZ, Wang F, Liang S, et al. Apatinib (YN968D1) enhances the efficacy of conventional chemotherapeutical drugs in side population cells and ABCB1-overexpressing leukemia cells. Biochem Pharmacol, 2012,83(5):586-597.
[22] Guggenheim DE, Shah MA. Gastric cancer epidemiology and risk factors. J Surg Oncol, 2013,107(3):230-236.
Ktransof dynamic contrast enhanced MRI in evaluation of anti-angiogenic effects on nude mice with orthotopic transplantation tumor model of gastric cancer
SHIXuelian,SHIGaofeng*,WANGXiaoling,WANGQi,LIUHui
(DivisionCT/MRI,theFourthAffiliatedHospitalofHebeiMedicalUniversity,Shijiazhuang050011,China)
Objective To assess the feasibility of Ktransvalue of dynamic contrast enhanced MRI (DCE-MRI) in evaluation of anti-angiogenic effects on nude mice with orthotopic transplantation tumor model of gastric cancer. Methods Nude mice with orthotopic transplantation tumor model of gastric cancer were randomly assigned to two groups: Treatment group (n=15), mice were given apatinib intragastrically for 18 days (100 mg/kg), and control group (n=15), mice were given ddH2O2in the same manner. After 18 days, DCE-MRI was performed and Ktransvalue was measured. Then the tumors were dissected from the adjacent tissues in order to detect the microvessel density (MVD) and vascular endothelial growth factor (VEGF) expression levels. MVD and VEGF expression level were compared between treatment group and the control group. Results MVD (χ2=4.89,P<0.05) and VEGF expression level (χ2=8.69,P<0.01) of treatment group were much lower than those of control groups. The Ktransvalue of treatment group was significantly lower than that of control groups ([0.63±0.05]/min vs [1.66±0.23]/min,t=17.05,P<0.01). Conclusion The value of ktransin DCE-MRI can be utilized to assess the effects of apatinib on nude mice with orthotopic transplantation model of gastric cancer.
Magnetic resonance imaging; Stomach neoplasms; Models, animal; Angiogenesis inhibitors
史学莲(1982—),女,山东阳信人,博士,主治医师。研究方向:肿瘤影像学。E-mail: alian1982@126.com
时高峰,河北医科大学第四医院CT/MRI室,050011。E-mail: 18531117285@163.com
2016-10-30
2016-12-13
R735.2; R445.2
A
1003-3289(2017)06-0843-05
10.13929/j.1003-3289.201610144

