肝脏T2值评估HBV相关慢加急性肝衰竭
兰莲君,舒 健*,陆笑非,陈 文,李 芹
(1.西南医科大学附属医院放射科,2.传染消化科,四川 泸州 646000)
肝脏T2值评估HBV相关慢加急性肝衰竭
兰莲君1,舒 健1*,陆笑非1,陈 文2,李 芹2
(1.西南医科大学附属医院放射科,2.传染消化科,四川 泸州 646000)
目的 探讨肝脏T2值对HBV相关慢加急性肝衰竭的评估价值。方法 收集HBV相关慢加急性肝衰竭(HBV-ACLF)组、慢性乙型肝炎组和正常对照组,分别对3组受检者行多回波梯度—自旋回波(M-GRASE)序列扫描,获得T2图,并计算肝脏平均T2值及T2弛豫率(R2)。收集HBV-ACLF组和慢性乙型肝炎组MR检查前2天内肝功能血液生化指标。比较3组间T2和R2值的差异及T2值与生化指标的相关性,采用ROC曲线评价T2值对HBV-ACLF的诊断效能。结果 3组间T2值(χ2=19.074,P<0.001)和R2值(F=10.411,P<0.001)差异均有统计学意义。T2值诊断慢加急性肝衰竭曲线下面积为0.86(P<0.001),诊断阈值为57.73 ms(R2=0.017)。T2值与凝血酶原时间国际标准化比值(INR)、凝血酶原时间(PT)及透明质酸(HA)呈中度正相关(rs=0.65、0.67、0.39,P均<0.05),与凝血酶原活动度(PTA)、白蛋白(ALB)、前白蛋白(PA)呈中度负相关(rs=-0.67、-0.48、-0.37,P均<0.05)。结论 T2或R2值可较好地反映肝脏功能情况,并与较多的肝功能实验室指标均具有相关性,对HBV-ACLF具有较好的诊断效能。
肝功能衰竭;磁共振成像;T2值

图1 ROI放置示意图 A.TE=17 ms的M-GRASE序列图像; B.T2图
根据中华医学会感染病学分会和中华医学会肝病学分会发布的2012年版肝衰竭诊治指南[1],肝衰竭分为急性、亚急性、慢加急性(亚急性)肝衰竭(acute-on-chronic liver failure, ACLF)和慢性肝衰竭。在我国,多数肝衰竭是在慢性HBV感染基础上发生的ACLF(HBV-ACLF)或慢性肝衰竭,死亡率高。目前肝衰竭的诊断和评估主要依据临床表现及实验室检查指标,但这些指标常不能全面反映肝功能,且部分实验室指标受治疗等因素的影响[2]。因此,急需探索一种客观有效的评估方案。MR扫描中T2值的变化可直接反映组织器官结构和氢质子含量的改变,间接反映肝细胞的肿胀、变性、坏死及细胞外基质胶原纤维沉积等[3],已成为研究的热点。本研究采用肝脏MRI T2值评估肝功能,旨在为临床早期诊断及治疗ACLF提供更准确、详尽的信息。
1 资料与方法
1.1一般资料 收集2015年1月—2016年5月西南医科大学附属医院符合2012年版肝衰竭诊治指南[1]的诊断标准、首次诊断为HBV-ACLF的患者(HBV-ACLF组)和符合慢性肝炎分度标准[4]、诊断为中重度慢性乙型肝炎而未达肝衰竭程度的患者(慢性肝炎组)。HBV-ACLF组28例,男23例,女5例,年龄12~69岁,平均(43.3±12.6)岁;慢性肝炎组11例,男8例,女3例,年龄15~68岁,平均(49.3±15.4)岁。收集同期性别、年龄匹配的健康体检者14名作为对照组,男8名,女6名,年龄28~60岁,平均(40.1±10.7)岁。HBV-ACLF组和慢性肝炎组患者MR检查前2天内检验肝功能血液生化指标,包括凝血酶原活动度(prothrombin activity, PTA)、凝血酶原时间国际标准化比值(international normalized ratio, INR)、凝血酶原时间(prothrombin time, PT)、白蛋白(albumin, ALB)、前白蛋白(prealbumin, PA)、总胆红素(total bilirubin, TB)、丙氨酸氨基转移酶(alanine aminotransferase, ALT)、天冬氨酸氨基转移酶(aspartate aminotransferase, AST)、三型前胶原N端肽、层黏连蛋白(laminin, LN)、IV型胶原、透明质酸(haluronicacid, HA)。本研究经西南医科大学伦理委员会批准,所有研究对象均知情同意。
1.2仪器与方法 采用Philips Achieva 3.0T双梯度超导高场MR扫描仪,16通道相控阵腹部线圈。患者于确诊后3天内行MR扫描。扫描范围自膈顶至肝脏下缘。扫描序列包括:双回波化学位移成像序列、快速自旋回波脂肪抑制T2W序列、T1W高分辨各向同性容积激发序列、DWI以及多回波梯度—自旋回波(multi-echo gradient and spin echo, M-GRASE)序列。M-GRASE序列扫描参数:TR 1 552 ms,TE 17、34、51、68、85 ms,翻转角90°,激励次数1,矩阵180×103,TSE factor 5,EPI factor 9,FOV 280 mm×350 mm,层厚7 mm,层间隔1 mm,层数18层,3次屏气完成扫描。将图像传输至后处理工作站(Philips Extended MR WorkSpace 2.6.3.4)自动生成T2图。
1.3图像处理 选择受心脏搏动及膈肌呼吸运动影响较小的肝门上下层面的肝右叶放置ROI,分别于肝右叶腋前线、腋中线、腋后线区域放置3个圆形、大小80~150 mm2的ROI,各ROI外缘距肝脏边缘约 0.5~1.0 cm。由于T2图像组织分辨率较差,为更好地避开血管及伪影,先在TE=17 ms的图像放置ROI,然后复制到相应层面的T2图(图1)。测量T2值并计算T2弛豫率(R2):R2=1/T2,T2或R2值为2个层面内所有ROI的平均值。
1.4统计学分析 采用SPSS l7.0统计分析软件。计数资料的比较采用χ2检验。正态性分布采用Shapiro-Wilk检验,方差齐性检验采用Levene检验。R2值符合正态分布、方差齐性,3组间比较采用单因素方差分析,两两比较采用LSD法;T2值不符合正态分布,其比较采用KruskalWallisH检验,两两比较采用Wilcoxon秩和检验,根据比较次数调整检验水准α=0.017。各影像指标与各生化指标间的相关性采用Spearman秩相关分析(rs<0.3为低度相关,0.3~0.8为中度相关,rs>0.8为高度相关)。采用ROC曲线评价影像指标对HBV-ACLF的诊断效能,并确定最佳诊断界点。以P<0.05为差异有统计学意义。
2 结果
HBV-ACLF组、慢性肝炎组和对照组3组间性别(χ2=3.00,P=0.20)及年龄(F=1.88,P=0.16)差异无统计学意义。
2.1T2和R2值 3组肝脏的T2值和R2值见表1,图2。3组间T2值(χ2=19.074,P<0.001)和R2值 (F=10.411,P<0.001)的差异均有统计学意义,且HBV-ACLF组与对照组间T2值(Z=-3.98,P<0.001)及R2值(P<0.001)、HBV-ACLF组与慢性肝炎组间T2值(Z=-2.57,P=0.01)及R2值(P=0.03)的差异均有统计学意义;对照组与慢性肝炎组间T2或R2值的差异无统计学意义(P均>0.05)。见表1。
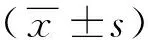
表1 HBV-ACLF组、慢性肝炎组和对照组肝脏 T2值及R2值比较
注:*:与对照组比较,P<0.05;#:与慢性肝炎组比较,P<0.05
2.2T2值与实验室指标的相关性 T2值与INR、PT及HA呈中度正相关(rs=0.65、0.67、0.39,P<0.001、P<0.001、P=0.025),与PTA、ALB、PA呈中度负相关(rs=-0.67、-0.48、-0.37,P<0.001、P=0.004、0.030),与其他的肝功能血液生化指标无相关性(P均>0.05)。
2.3T2值对ACLF的诊断效能 将正常组与肝炎组合并为非肝功能衰竭组,以T2值诊断HBV-ACLF,ROC曲线(图3)显示T2值曲线下面积为0.86(P<0.001),其诊断阈值为57.73 ms(R2=0.017)。以T2> 57.73 ms(R2<0.017)诊断HBV-ACLF的敏感度为95.50%,特异度为75.00%,准确率为83.33%,阳性预测值为95.00%,阴性预测值为75.00%。
3 讨论
虽然组织病理学检查在肝衰竭的诊断、分类及预后评估中具有重要价值,但由于肝衰竭患者的凝血功能严重低下,实施肝穿刺具有一定的风险,因此临床并不建议采用穿刺活检的方法评估肝衰竭程度,且常用的肝衰竭评估方法又易受治疗等因素的影响,故本研究采用一种新的、客观的评估肝衰竭的方法——肝脏T2值。
T2值是通过多回波序列扫描获得同一层面不同回波时间的信号强度,经后处理工作站计算获得。T2值可反映组织中水分子的含量,常用于关节软骨损伤的评价,可定量分析软骨基质中生化成分的变化及代谢方面的信息[5],其对骨性关节炎的早期诊断已获得广泛认可[6-7]。近年来T2值亦用于肝铁沉积的评估及弥漫性肝病的研究。
本研究显示T2值随着肝功能损害的加重而增大,与多数研究[8-12]显示的肝纤维化或肝硬化的肝组织T2值明显高于正常对照组基本一致,且随着纤维化分期或肝硬化的CTP分级的进展及肝脏炎症评分分级的增加而增加。Chow等[9]的研究表明注射CCl4
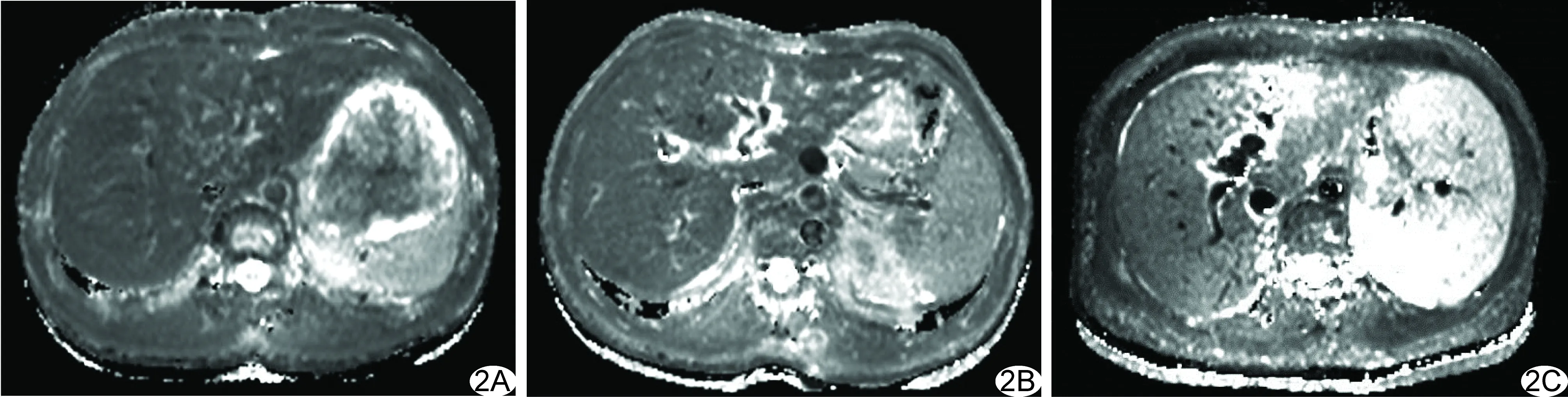
图2 T2 map图,T2值随着肝功能损害的加重而升高 A.患者男,28岁,对照组,T2=46.42 ms; B.患者男,47岁,慢性肝炎组,T2=52.25 ms; C.患者女,39岁,HBV-ACLF组,T2=96.30 ms

图3 T2值诊断HBV-ACLF的ROC曲线,曲线下面积为0.86(P<0.001)
的小鼠肝纤维化和炎性浸润的范围越广,肝脏T2值越高。但有研究[13]指出T2值随着肝纤维化分期的进展而减低。当肝脏受到慢性损害后,其病理变化可分为两个方面[3]:一方面是肝细胞本身的变性、坏死,导致肝脏组织中含水量增加,使肝组织T2值延长;另一方面,细胞外基质中胶原纤维逐渐沉积,而其中氢质子含量较少,且肝细胞的再生以及假小叶的形成可代替部分变性、坏死的肝细胞,从而导致肝组织T2值降低。肝脏纤维化时多是两种病理改变并存,而这两种病理改变对T2值的影响正好相反,故T2值的变化是一个综合的结果。当肝细胞以变性、坏死为主时T2值增大,而以细胞外基质胶原纤维沉积、肝细胞再生和假小叶形成为主时,则T2值缩短。另外,T2值还可对铁沉积进行评估,顺磁性的铁能改变局部磁环境,造成局部磁场不均匀,从而加快质子的失相位,导致周围组织信号强度减低,同时降低组织的T2值,研究[14-15]显示肝脏T2值随着肝铁浓度的增大而减低。
本研究中T2值随着肝功能损害的加重而增大,提示该研究对象中肝功能的损害可能主要表现为肝细胞变性、坏死及炎性细胞浸润,并非以细胞外基质胶原纤维增生及肝细胞的再生为主,且这些病理改变对T2值的影响超过少量铁沉积对T2值的影响;与ACLF在慢性肝损害的基础上,发生新的程度不等的肝细胞坏死性病变相一致。本研究结果表明,当肝脏T2值>57.73 ms时,提示有发生肝衰竭的风险,应积极采取早期治疗措施。本研究结果还表明肝脏T2值与较多的实验室指标有中度相关性,提示肝脏T2值可较好地反映肝脏的损害情况。故本研究认为T2值可作为定量评估慢性肝炎肝脏功能情况的理想指标之一。
本研究的不足:①未对受检者行肝组织活检,未对患者肝纤维化/肝硬化、肝铁浓度等进行定量测定;②因样本量较小,未根据病情严重程度对ACLF进行分层研究;③实验室指标与T2值的相关性在一定程度上受治疗方式的影响。
总之,肝脏T2值除可对肝脏的铁沉积、肝纤维化、肝硬化或炎症活动度进行定量评估以外,还是一种对弥漫性肝病的无创的、客观的评价方法,甚至可量化肝脏损害的程度,一定程度补充现有肝衰竭评估方法的不足,对于慢加急性肝衰竭的早期诊断、治疗和评估具有重要价值。
[1] 中华医学会感染病学分会肝衰竭与人工肝学组,中华医学会肝病学分会重型肝病与人工肝学组.肝衰竭诊治指南(2012年版).实用肝脏病杂志,2013,16(3):210-216.
[2] Carey E, Carey WD. Noninvasive tests for liver disease, fibrosis, and cirrhosis: Is liver biopsy obsolete. Cleve Clin J Med, 2010,77(8):519-527.
[3] 李绍林,张雪林,朱幼芙,等.磁共振成像T1值、T2值和ADC值与肝脏纤维化模型病理评分分级纤维化分期诊断结果相关性研究.医学影像学杂志,2009,19(1):56-60.
[4] 周永兴.慢性乙型肝炎临床分度、诊断的一些问题.世界华人消化杂志,2003,11(6):762-766.
[5] Lüsse S, Claassen H, Gehrke T, et al. Evaluation of water content by spatially resolved transverse relaxation times of human articular cartilage. Magn Reson Imaging, 2000,18(4):423-430.
[6] 陈玲,Queenie Chan,梁文,等.磁共振T1ρ和T2 mapping成像定量评价早期骨性关节炎.中国医学影像技术,2014,30(5):776-779.
[7] Crema MD, Roemer FW, Marra MD, et al. Articular cartilage in the knee: Current MR imaging techniques and applications in clinical practice and research. Radiographics, 2011,31(1):37-61.
[8] Heye T, Yang SR, Bock M, et al. MR relaxometry of the liver: Significant elevation of T1 relaxation time in patients with liver cirrhosis. Eur Radiol, 2012,22(6):1224-1232.
[9] Chow AM, Gao DS, Fan SJ, et al. Measurement of liver T1 and T2 relaxation times in an experimental mouse model of liver fibrosis. J Magn Reson Imaging, 2012,36(1):152-158.
[10] Aubé C, Moal F, Oberti F, et al. Diagnosis and measurement of liver fibrosis by MRI in bile duct ligated rats. Dig Dis Sci, 2007,52(10):2601-2609.
[11] Guimaraes AR, Siqueira1 L, Uppal R, et al. T2 relaxation time is related to liver fibrosis severity. Quant Imaging Med Surg, 2016,6(2):103-114.
[12] Cassinotto C, Feldis M, Vergniol J, et al. MR relaxometry in chronic liver diseases: comparison of T1 mapping, T2 mapping, and diffusion weighted imaging for assessing cirrhosis diagnosis and severity. Eur J Radiol, 2015,84(8):1459-1465.
[13] Anderson SW, Jara H, Ozonoff A, et al. Effect of disease progression on liver apparent diffusion coefficient and T2 values in a murine model of hepatic fibrosis at 11.7 Tesla MRI. J Magn Reson Imaging, 2012,35(1):140-146.
[14] Song R, Lin W, Chen Q, et al. Relationships between MR transverse relaxation parameters R*(2), R(2) and R'(2) and hepatic iron content in thalassemic mice at 1.5 T and 3 T. NMR Biomed, 2008,21(6):574-580.
[15] Wood JC, Enriquez C, Ghugre N, et al. MRI R2 and R2*mapping accurately estimates hepatic iron concentration in transfusion-dependent thalassemia and sickle cell disease patients. Blood, 2005,106(4):1460-1465.
Hepatic T2 value in evaluation of HBV based acute-on-chronic liver failure
LANLianjun1,SHUJian1*,LUXiaofei1,CHENWen2,LIQin2
(1.DepartmentofRadiology, 2.DepartmentofInfectiousGastroenterology,theAffiliatedHospitalofSouthwestMedicalUniversity,Luzhou646000,China)
Objective To investigate the value of hepatic T2 value in evaluation of chronic HBV-related acute-on-chronic liver failure (HBV-ACLF). Methods The HBV-ACLF group, chronic hepatitis B group and control group who underwent liver MRI (M-GRASE sequence) were enrolled. The T2 map was produced from the post-processing software, and the mean T2 and R2 value of liver was calculated. The blood biochemical indexes from HBV-ACLF and chronic hepatitis B group were collected in 2 days pre-MR scaning. The differences of T2 and R2values among 3 groups and the correlation between biochemical indexes and T2value were analyzed. ROC curve was conducted to evaluate diagnostic efficiency of T2value for HBV-ACLF. Results There were significant differences of T2value (χ2=19.074,P<0.001) or R2 value (F=10.411,P<0.001) among the 3 groups. The AUC of T2 value for diagnosing HBV-ACLF was 0.86 (P<0.001), with the cut-off value 57.73 ms (R2=0.017). Moderate positive correlation was shown between T2 values and international normalized ratio (INR), prothrombin time (PT), haluronicacid (HA) values (rs=0.65, 0.67, 0.39, allP<0.05), and moderate negative correlation was shown between T2 values and prothrombin activity (PTA), albumin (ALB), prealbumin (PA) values (rs=-0.67, -0.48, -0.37, allP<0.05). Conclusion T2 or R2 value could reflect the liver function, and were correlated with some biochemical indexes, which illustrated a good diagnostic efficiency for diagnostic of HBV-ACLF.
Liver failure; Magnetic resonance imaging; T2 value
兰莲君(1987—),女,四川内江人,在读硕士,医师。研究方向:腹部MRI诊断。E-mail: 547692306@qq.com
舒健,西南医科大学附属医院放射科,646000。E-mail: shujiannc@163.com
2016-10-07
2017-03-15
10.13929/j.1003-3289.201610013
R575.3; R445.2
A
1003-3289(2017)06-0902-05

