富血小板血浆诱导骨髓基质干细胞联合软骨支架治疗兔激素性股骨头坏死*
陈得胜,林炎水
成都医学院第一附属医院 关节外科(成都 610500)
·论著·
富血小板血浆诱导骨髓基质干细胞联合软骨支架治疗兔激素性股骨头坏死*
陈得胜,林炎水△
成都医学院第一附属医院 关节外科(成都 610500)
目的 观察自体富血小板血浆(platelet-rich plasma,PRP)诱导骨髓基质干细胞联合同种骨软骨支架治疗早期兔激素性股骨头坏死的疗效,探索早期股骨头坏死治疗的新方法。方法 采用含有抗凝剂的真空采血管从实验兔的耳中央动脉采取动脉血5 mL,再通过离心方法获取PRP,用16号骨髓穿刺针从实验兔自体股骨髓腔抽取骨髓5 mL,把抽取的骨髓进行密度梯度离心,获取兔骨髓基质干细胞,并进行细胞原代培养和成骨诱导。对已获取PRP和骨髓基质干细胞的实验兔进行激素性股骨头坏死造模,取同种股骨髁部骨软骨制作软骨支架,最后以制备的软骨支架为载体,将经过成骨诱导的骨髓基质干细胞移植到软骨支架上,形成细胞-支架复合物,用16号骨髓穿刺针对坏死的股骨头进行髓芯减压术,术中将细胞-支架复合物植入坏死的股骨头下。实验动物共分为4组,每组20只,A组为空白对照;B组仅进行髓芯减压;C组髓芯减压后植入经过成骨诱导培养的细胞;D组髓芯减压后植入细胞-支架复合物。实验后在第2、4、8周各组分别处死6、6、8只,每只实验兔的股骨头行大体标本及组织学检查。结果 D组治疗效果最显著,通过空骨陷窝计数发现D组与其他各组的差异有统计学意义(P<0.05)。结论 骨髓基质干细胞通过PRP的诱导向成骨细胞分化;软骨支架材料为骨髓基质干细胞向成骨细胞分化提供良好的空间结构,有利于其向成骨细胞分化;PRP和软骨支架材料联合应用可促进早期兔激素性股骨头坏死的修复。
富血小板血浆;骨髓基质干细胞;软骨支架;激素性股骨头坏死
股骨头缺血性坏死是常见的骨科疾病,常会降低患者生活质量,给家庭经济带来负担,其常见的病因有创伤、酒精和激素等,该病的发病率呈上升趋势[1]。其病因复杂,发病机制尚不完全清楚,目前已知的和股骨头坏死相关的病因有70多种[2]。已经证实激素是引起股骨头坏死的一大发病因素,激素会引起骨髓基质干细胞的活性降低,因此激素性骨头坏死是与骨髓基质干细胞相关的一类疾病,国内外早已有应用骨髓基质干细胞治疗兔激素性股骨头坏死的研究,主要集中在BMSCs对激素性股骨头坏死的早期干预和成骨方面的修复,希望能有效逆转该病的进程,从而达到早期治疗的目的。骨髓基质干细胞可向多种细胞分化,经过某些细胞因子的诱导能够向软骨细胞和成骨细胞转化。但国内外在BMSCs诱导和分化方面主要是使用外源性细胞因子或是基因转染技术进行,但此方法价格昂贵、存在异源性问题,且在使用过程中极易损失。本实验通过提取自体富血小板血浆(platelet rich plasma,PRP),并应用PRP诱导骨髓基质干细胞分化。PRP是血小板浓缩物,其血小板含量远远超过未经处理的血液,血小板内细胞生长因子丰富,如血小板源性生长因子、转化生长因子-β和血管内皮生长因子等。血小板浓缩物内的生长因子浓度较正常血小板内更丰富,能够促进BMSCs的增殖和成骨分化的能力[3-4]。作为骨髓基质干细胞向成骨细胞诱导和分化的诱导剂,自体PRP与外源性细胞因子的作用机制不同,有自身的优势,如不存在异源性、获取方便、价格低廉等。本研究将经过PRP诱导过的骨髓基质干细胞与兔源性软骨支架结合,形成细胞-支架复合物,通过髓芯减压把细胞-支架复合物植入坏死的股骨头以观察该治疗方案的效果。
1 材料与方法
1.1 实验材料
1.1.1 实验动物 成都达硕实验动物中心提供2~3月龄新西兰雄性大白兔120只,体质量1.9~2.3 kg。
1.1.2 实验试剂与材料 戊巴比妥钠(上海哈灵化学试剂有限公司,中国上海);注射器、真空采血管 (洪达医用耗材有限公司,中国重庆);骨髓穿刺包(永宁医疗器械有限公司,中国扬州);胎牛血清(Hyclone公司,美国);Percoll细胞分离液(密度为1.077/mg)(Hyclone公司,美国);DMEM+F12培养基(Hyclone公司,美国);胰蛋白酶消化液(Sigma公司,美国);肝素钠(江苏万邦制药,中国)。
1.1.3 动物实验用器械及材料 聚维酮碘、酒精,手术器械经高温消毒后使用。
1.2 方法
1.2.1 PRP的制备[5]和保存 先麻醉处理实验兔(用质量比为3%的戊巴比妥钠做麻醉剂,给量为1 mL/kg,通过兔耳缘静脉推注),麻醉生效后用真空采血管从兔耳中央动脉抽取血液5 mL。按照Petrungaro法,分2次离心,第1次离心力为1 500×g,离心时长间6 min,离心后可见离心管内血液分为3层,上层液体的颜色较透明,为血小板血浆层,中间有一较薄的过渡层,为血小板血浆和红细胞的交界处,下层液体为红色,是红细胞细胞沉淀物,用吸管吸取上清液面下至红细胞与血小板血浆的过渡层液面稍下1 mm的全部液体,移置另一离心管内,液体配平后离心,离心力为1 000×g,再次离心6 min,此时管内液体仅为两层,上层液体颜色较下层液体颜色稍浅,血小板含量较少,为贫血小板血浆,下层液体颜色较上层液体颜色稍深,血小板含量较丰富,为血小板浓缩物。吸取上层上清液丢弃,剩余部分液体为1 mL即为PRP,再与含有胎牛血清的DMEM培养基99 mL混匀,即得到含PRP浓度为1%的细胞培养基,该培养基对骨髓基质干细胞有成骨诱导作用,冰冻保存含PRP培养基备用[6]。
1.2.2 兔骨髓基质干细胞的获取及原代培养[7]先麻醉处理实验兔(用质量比为3%的戊巴比妥钠做麻醉剂,给量为1 mL/kg,经兔耳缘静脉推注),待麻醉生效后在实验兔膝关节前侧常规备皮、消毒,以股骨髁部为进针点,用16号骨髓穿刺针刺入股骨髓腔,用10 mL注射器(已用抗凝剂预湿)抽取骨髓约10 mL。用准备好的50 mL玻璃离心管装载抽取的骨髓(注意沿管壁缓慢注入),在离心管内加入等量体积含有10%胎牛血清的改良杜氏伊格尔培养基(Dulbecco′s modifiedEagle medium,DMEM),充分混匀液体。再将混匀后的液体移置备有等体积、密度为1.073 g/mL的Percoll细胞分离液的离心管中,配平液体,离心机离心,离心速度2 500 r/min、离心半径8 cm、离心时长30 min,离心后管内液体分层明显,共5层,其中第2层云雾状液体即为富含骨髓基质干细胞层,吸取第2层白色云雾状的液体置入20 mL离心管内,在离心管内加入磷酸盐缓冲液(phosphatebuffered saline,PBS)10 mL,将细胞吹打、漂洗,以1 500 r/min(离心半径为8 cm)离心5 min,可见离心管底部有少许沉淀物,其余大部分液体为PBS冲洗液,底部沉淀物即为骨髓基质干细胞,去除大部分PBS冲洗液,用10 mL含10%胎牛血清的DMEM培养基吹打、漂洗细胞,再次离心5 min(调整离心速度为1 000 r/min、离心半径8 cm),进一步清洗细胞内的杂质,可见管内液体仍为两层,上层为DMEM冲洗液,下层沉淀物为骨髓基质干细胞,仅保留离心管底部的沉淀物,再用5 mL含10%胎牛血清的DMEM培养基吹打细胞多次,完成细胞悬液制备。将制备好的细胞悬液移入容量为250 mL的细胞培养瓶内,细胞培养箱内常规培养细胞2~3 d后半量换液,以后每3天全量换液1次,待细胞生长融合至80%~90%时用胰蛋白酶进行消化传代培养(培养液中加入1%的PRP进行骨髓基质干细胞的成骨诱导)。取第3代细胞进行实验。
1.2.3 兔激素性股骨头坏死模型建立 参照文献[8]方法,对转移生长环境的实验兔进行适应性喂养,在造模的过程中首先给予抗生素预防感染(腹腔注射阿米卡星1.63×104 U/kg、青霉素钠5.0 mg/kg,1次/d,持续2周),在首次抗生素给药后24 h开始臀肌注射醋酸泼尼松龙20 mg/kg,首次激素给药后48 h兔耳缘静脉注射脂多糖5.0 μg/kg,注射脂多糖后24 h双侧臀肌间隔24 h交替注射醋酸泼尼松龙20 mg/kg各1次。
1.2.4 兔源性软骨支架制备 参照文献[7]方法麻醉状态下处死实验兔,提取膝关节股骨髁部骨软骨,用手术刀片把软骨剔除下来,制作成长条状软骨块,用含有蛋白酶抑制剂的10 mM Tris-HCl液浸泡软骨块15~30 min,并以3 000 r/min离心3次,再将1 % Triton X-100 Tris-HCl 缓冲液(pH值为 7.5)浸泡经过离心冲洗的软骨块,并放置在恒温震荡仪上震荡48 h;震荡后取出软骨块,置于含有1 U/mL RNase A,50 U/mL DNase Ⅰ的消化酶液中, 37 ℃下消化24 h,经过消化后再用PBS反复冲洗,4 ℃保存备用。
1.2.5 细胞-支架复合物的结合 取经过诱导培养的第3代骨髓基质干细胞用于实验,在细胞移置到支架之前用流式细胞仪进行细胞计数,调整细胞浓度为2×106个/cm2后将细胞接种到制备好的软骨支架上,为在移植前细胞在支架上有良好的贴附,先将细胞-支架复合物在细胞培养箱内孵育一定时间,等细胞贴附在支架上后加入一定量的DMEM+F12细胞培养基,隔夜换液,2~3 d后将细胞-支架复合物通过髓芯减压植入坏死股骨头模型中,仅细胞-支架组移植,其他组均不移植。
1.2.6 不同组别动物处理 所有实验动物均用抗生素预防感染(腹腔注射阿米卡星1.63×104 U/kg、青霉素钠5.0 mg/kg,持续2周)。A组无其他处理,B组以16号骨髓穿刺针进行股骨头髓芯减压,C组髓芯减压后植入1 mL密度为2×106个/cm2兔BMSCs,D组(髓芯减压+细胞支架复合物组)经过髓芯减压后植入载有密度为2×106个/cm2的兔BMSCs的软骨支架。
1.2.7 观测指标 对手术后实验动物的伤口愈合情况、进食及活动情况等进行观察。参照文献[9]方法,于手术后第2、4 、8周各组分别处死6 、6 、8只实验兔,解剖B、C、D组实验侧股骨头,A组随机取一侧股骨头解剖,对实验标本进行大体标本和HE染色观察。肉眼观察实验兔各组股骨头的表面情况,如颜色、是否有瘀斑、光滑度、是否有骨质破坏和缺损等。把各组标本做成病理切片,光镜下观察不同组别、同一组别不同时间段股骨头骨质、骨髓的组织结构变化。光镜下,随机选取5个高倍视野(10×40)计算空骨陷窝的数量,每个标本5个高倍视野下空骨陷窝的总数纳入统计学分析。骨坏死诊断标准为:骨小梁连续性中断,并可见弥漫性空骨陷窝或核皱缩,伴有周围骨髓细胞坏死[10]。空骨陷窝百分率(%)=空骨陷窝数/总骨陷窝数×100%,骨坏死发生率(%)=任何一侧股骨头出现骨坏死的动物数/组内动物总数×100%。
1.3 统计学方法

2 结果
2.1 兔BMSCs的培养及鉴定
原代细胞形态最初多成圆形或椭圆形,细胞贴壁时间为培养后1~2 d,细胞的形态由圆形或是椭圆形逐渐变为梭形,培养2~3 d后换液,5~7 d后细胞长成集落状,>90%的细胞贴壁完成。用流式细胞仪对培养细胞进行鉴定,结果:CD29+细胞占92.76%,CD90+细胞占97.20%,CD45-细胞占99.20%。取3代细胞进行实验。
2.2 激素性股骨头坏死模型建立
日常生存状态观察:第1次注射激素后所有实验兔较正常状态下无明显变化,正常进食、饮水、活动等。静脉注射脂多糖后6~12 h实验兔的精神状态变化较大,出现精神萎靡,活动量减少,甚至俯卧不动,进食量减少,在脂多糖给药后24~72 h内实验兔死亡现象明显,死亡率达20%。第2次进行激素给药后实验兔精神状态开始恢复,活动量、饮食量均好转,实验兔死亡数量明显减少。第3次激素给药后实验兔的精神状态好转,进食量增加、日常活动量增加。组织学观察:股骨头造模后对已经死亡或处死濒死实验兔取股骨头标本行HE染色观察,造模1周后股骨头骨小梁排列紊乱,连续性中断,可见骨陷窝内骨细胞缺失。造模后2周髓腔内脂肪细胞明显增多,脂肪栓塞形成,骨髓造血细胞减少,骨小梁内空骨陷窝大量出现。造模3周后空骨陷窝率76%~90%,造模3周后股骨头坏死率达100%。
2.3 激素性股骨头坏死修复动物实验的结果
2.3.1 一般情况 术后5只实验兔发生非计划死亡,其中B组在术后1周内死亡1只,C组在1周内死亡1只,D组在术后1、2周分别死亡2、1只。术后3 d,各组伤口均出现轻微红肿,5~7 d后红肿逐渐消退,术后1~3 d内实验兔活动量、进食量均较前减少,间歇性跛行,3 d后逐渐恢复(图1)。
2.3.2 大体标本观察 所有实验动物伤口均无感染。A组肉眼可见股骨头表面软骨破坏,软骨塌陷,表面颜色暗黑,大量瘀斑、充血,骨质变脆,易于折断。B组股骨头表面粗糙,局部颜色暗黑,可见瘀斑和充血现象,随着时间变长,暗黑颜色变浅,8周时局部瘀斑、充血范围减小。C组股骨头术后2周颜色仍暗黑,局部瘀斑、充血,4周时股骨头表面颜色变浅,瘀斑、充血范围减小,8周时股骨头表面颜色变浅,瘀斑、充血现象明显改善。D组术后2周时股骨头仍可见瘀斑、充血,4周时局部瘀斑、充血范围较前明显减少,股骨头颜色暗黑现象较前减轻;8周时股骨头软骨面光滑,颜色接近正常兔股骨头(图2)。

图1 实验兔术后情况
注:A:实验兔术后1 d坐立不起,精神萎靡,饮食、活动量均明显减少,甚至不愿意活动、进食;B:术后3 d实验兔开始恢复进食,活动量较前增加;C:实验兔术后2周伤口愈合良好;D:实验兔术后3 d开始半蹲位活动,精神状态较前好转
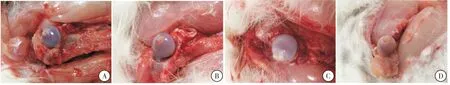
图2 术后大体标本情况
注:A:8周时A组肉眼可见股骨头表面软骨破坏,骨面粗糙,表面颜色暗黑,大量瘀斑、充血,骨质变脆,易于折断;B:8周时B组股骨头表面粗糙、不平整,局部颜色较同期A组稍浅;C:8周时C组股骨头颜色变浅,与同期A、B两组对比明显;D:8周时D组可见股骨头表面光滑、平整,股骨头颜色浅淡,无明显瘀斑、充血现象,接近正常
2.3.3 组织学观察 术后第2、4、8周解剖已死亡或者处死实验兔,A组随机取一侧股骨头,B、C、D组取实验侧股骨头, HE染色后光镜下观察。A组典型股骨头缺血性坏死,骨小梁变细、断裂,可见血管栓塞,空骨陷窝数无明显变化。B组在术后2周时无明显变化,髓腔内可见脂肪栓塞,4周时逐渐有新骨出现,8周时新生骨数量较前明显增多,但是骨组织的成熟程度一致。C组术后2周时镜下可见少量成骨前体细胞和成骨细胞,4周时可见少量哈佛氏管内细胞增加,但明显低于未经处理的正常兔。8周时空骨陷窝数量明显减少,但是仍未完成骨改造。D组术后2周即出现空骨陷窝数量减少,并可见增生活跃的成骨细胞和少量的增生血管;4周时新生骨小梁形成,骨小梁内的空骨陷窝数量进一步减少;8周时空骨陷窝继续减少,新生骨小梁排列整齐、连续,新生骨改造接近正常松质骨(图3和图4)。各组术后2、 4 、8周股骨头空骨陷窝计数见表1, D组空骨陷窝数与各组比较差异有统计学意义(P<0.05)(表1)。

图3 A 、B两组术后8周镜下表现
注:A:A组8周时光镜下(400×)显示骨小梁断裂,骨细胞数量减少;B:A组8周时光镜下(400×)显示骨小梁内空骨陷窝布满,骨细胞细胞核萎缩; C:B组8周时光镜下(400×)显示骨小梁内可见多个空骨陷窝,骨细胞形态不规则;D:B组8周时光镜下(100×)显示骨小梁塌陷、连续性中断,髓腔内脂肪细胞充盈

图4 C、D两组术后8周镜下表现(400×)
注:A:C组光镜下:骨陷窝丰富,空骨陷窝较少;B:C组光镜下:骨小梁连续、排列较整齐;C:D组光镜下骨陷窝内骨细胞形态规则,空骨陷窝数量少,可见新生血管形成;D:D组光镜下骨小梁排列规律、连续、整齐
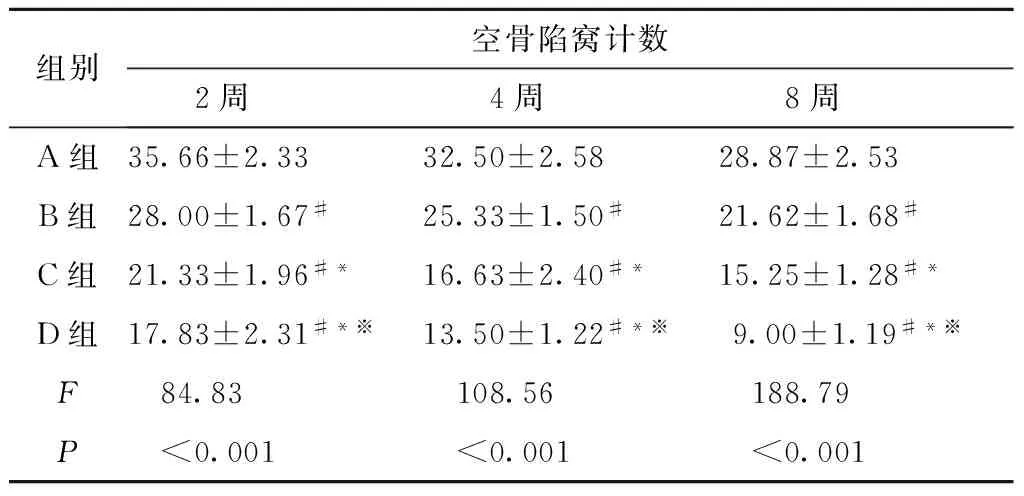
表1 各组术后2、4、8周后空骨陷窝计数(n=20)
注:与A组比较,#P<0.05;与B组比较,*P<0.05;与C组比较,*P<0.05
3 讨论
股骨头缺血性坏死是一种常见疾病,致残率较高,早期表现为患肢疼痛、活动障碍,晚期会出现一些列器质性病变,如重度髋关节骨关节炎表现、因股骨头塌陷引起的肢体短缩,从而严重影响患者日常的行走和体力劳动,致使患者生活质量下降,严重者可丧失劳动力,其病因和发病机制复杂,目前各种学术观点的共识是:股骨头内血液循环障碍造成股骨头缺血性坏死。激素是造成股骨头坏死的一个重要原因。有研究发现股骨头缺血性坏死患者的BMSCs数量减少,活性下降,国外研究[11]发现,在激素性股骨头坏死中,激素可降低骨BMSCSc前体细胞的数量和活性,股骨头缺血性坏死是与BMSCs相关的疾病。国内外对BMSCs与股骨头缺血性坏死之间的关系进行的研究,主要集中在BMSCs对股骨头缺血性坏死早期的干预和成骨方面的修复,如用细胞因子、化学试剂、仿生支架材料、基因转染技术来诱导BMSCs向成骨细胞、软骨细胞、血管内皮细胞分化,从而达到治疗股骨头坏死的疗效。近年发现PRP有促进BMSCs向成骨细胞分化的作用,其作用机制可能是和血小板血浆内的某些生长因子有关,如胰岛素样生长因子、血管内皮生长因子、血小板源性生长因子等都是血小板血浆内的主要成分[12],这些生长因子在诱导BMSCs向成骨细胞分化、促进骨缺损的再生修复方面有重要的作用[13-16]。
细胞因子对干细胞向成骨细胞分化发挥重要作用,本实验采用自体PRP对BMSCs进行诱导和分化,不存在异源性、获取方便、价格低廉。 本实验还采取同种异体关节软骨为原料制备软骨支架,形成细胞-支架复合物移植治疗兔激素性股骨头坏死。关节软骨支架与其他支架材料相比更有优势,它不但保持了软骨基质中的主要成分,其生物相容性和理化性质也较良好,是可以开发和应用的一种新型组织工程材料。实验结果表明,各组别之间的股骨头坏死修复差别显著,D组效果最佳,且各组的空骨陷窝数随治疗时间增加而减少,但减少的数量和速度差异明显,空骨陷窝减少的数量、速度与实验干预的方法、时间呈正相关。造成结果差异的原因可能与PRP增强骨髓基质干细胞向成骨细胞分化的能力、外支架为种子细胞提供重要的媒介作用有关,但在PRP诱导BMSCs向成骨细胞分化的最佳浓度、外支架材料最合适的大小、兔股骨头坏死治疗达到最佳疗效的时间等方面还需进一步研究。
[1]Song H J, Lan B S, Cheng B,etal. Peripheral blood stem cell transplantation for ischemic femoral head necrosis[J]. Transplant Proc, 2010, 42(5): 1862-1864.
[2] 孙伟. 骨头坏死的病因、病理和发病机制[J]. 中华全科医师杂志, 2006, 5(2): 75-77.
[3] Robiony M, Zorzan E, Polini F,etal. Osteogenesis distraction and platelet-rich plasma: combined use in restoration of severe atrophic mandible. Long-term results[J]. Clin Oral Implants Res, 2008, 19(11): 1202-1210.
[4] Pieri F, Lucarelli E, Corinaldesi G,etal. Effect of mesenchymal stem cells and platelet-rich plasma on the healing of standardized bone defects in the alveolar ridge: a comparative histomorphometric study in minipigs[J]. J Oral Maxillofac Surg, 2009, 67(2): 265-272.
[5] Petrungaro P S. Using platelet-rich plasma to accelerate soft tissue maturation in esthetic periodontal surgery[J]. Compend Contin Educ Dent, 2001, 22(9): 729-732.
[6] 刘玉英, 欧阳锡林, 刘景汉. 富含血小板血浆冰冻保存及保存效果的研究[J]. 第三军医大学学报, 2001, 23(12): 1455-1456.
[7] 谭洪波, 崔运利, 王富友, 等. 脱细胞骨软骨支架复合自体骨髓间充质干细胞修复羊骨软骨缺损的研究[J]. 中华关节外科杂志(电子版), 2010, 4(6): 765-771.
[8] 喻钧伦, 罗天友, 吴少平, 等. 激素联合脂多糖建立股骨头缺血坏死模型兔的技术改良[J]. 中国组织工程研究, 2015, 19(20): 3129-3133.
[9] 周传友, 朱亚林, 贺瑞, 等. 骨髓基质干细胞联合rhBMP-2/rhVEGF治疗兔早期激素性股骨头缺血性坏死的实验研究[J]. 医学综述, 2011, 17(12): 1870-1873.
[10] Miyanishi K, Yamamoto T, Irisa T,etal. A high low-density lipoprotein cholesterol to high-density lipoprotein cholesterol ratio as a potential risk factor for corticosteroid-induced osteonecrosis in rabbits[J]. Rheumatology (Oxford), 2001, 40(2): 196-201.
[11] Hernigou P, Beaujean F, Lambotte J C. Decrease in the mesenchymal stem-cell pool in the proximal femur in corticosteroid-induced osteonecrosis[J]. J Bone Joint Surg Br, 1999, 81(2): 349-355.
[12] Fréchette J P, Martineau I, Gagnon G. Platelet-rich plasmas: growth factor content and roles in wound healing[J]. J Dent Res, 2005, 84(5): 434-439.
[13] Froum S J, Wallace S S, Tarnow D P,etal. Effect of platelet-rich plasma on bone growth and osseointegration in human maxillary sinus grafts: three bilateral case reports[J]. Int J Periodontics Restorative Dent, 2002, 22(1): 45-53.
[14] Tischler M. Platelet rich plasma. The use of autologous growth factors to enhance bone and soft tissue grafts[J]. N Y State Dent J, 2002, 68(3): 22-24.
[15] Fréchette J P, Martineau I, Gagnon G. Platelet-rich plasmas: growth factor content and roles in wound healing[J]. J Dent Res, 2005, 84(5): 434-439.
[16] Eppley B L, Woodell J E, Higgins J. Platelet quantification and growth factor analysis from platelet-rich plasma: implications for wound healing[J]. Plast Reconstr Surg, 2004, 114(6): 1502-1508.
A Study on the Therapeutic Effect of Platelet-rich Plasma Induced Bone Marrow Stromal Stem Cells Combined with Cartilage Scaffold in Treating Steroid-induced Femoral Head Necrosis of Rabbits
Chen Desheng, Lin Yanshui△.
Department of Orthopedics and Joint Surgery, The First Affiliated Hospital of Chengdu Medical College, Chengdu 610500, China
Objective To observe the therapeutic effect of autologous platelet-rich plasma (PRP) induced bone marrow stromal stem cells (BMSCs) combined with the same osteochondral scaffolds in the treatment of early femoral head necrosis in rabbits and to explore a new method for the treatment of early steroid-induced femoral head necrosis. Methods 5 mL of arterial blood was taken from the central artery of the experimental rabbits by using the anticoagulant-containing vacuum blood collection tube. Then the platelet-rich plasma (PRP) was obtained from those blood by centrifugation. 5 mL of bone marrow was extracted from the autologous femoral cavity of the rabbits by the 16th bone marrow aspiration needle. The rabbit bone marrow stromal stem cells were obtained from those bone marrow by density gradient centrifugation for the primary culture and osteogenesis induction of cells. Then, the rabbits of the extracted PRP and BMSCs were made as the steroid-induced femoral head necrosis models. The same kind of femoral condyle bone cartilage was taken to produce the cartilage scaffold. Finally, BMSCs induced by osteogenesis were transplanted into cartilage scaffolds to form cell-scaffold complexes. The bone-core decompression was performed on the necrotic femoral head with the 16th bone marrow aspiration needle, and the cell-scaffold complex was implanted into the necrotic femoral head. The rabbits were divided into four groups and each group consisted of 20 rabbits. Different groups were given different interventions: Group A was the blank control; Group B was only given decompression of core decompression; Group C was treated with the implantation with osteoblast-induced cells after decompression; Group D was administered with the implantation with cell-scaffold complex. 6 rabbits in each group were sacrificed at Week 2 and 4 respectively, and the other 8 rabbits were sacrificed at Week 8. The gross and histological examinations were performed in all the femoral heads. Results The therapeutic effect of Group D was the most significant, and Group D was significantly different from the other three groups respectively in the numbers of empty bone lacunae (P<0.05). Conclusion The bone marrow stromal cells differentiate into osteoblasts by the induction of platelet-rich plasma. Cartilage scaffolds provide a good spatial structure for differentiation of bone marrow stromal cells into osteoblasts in order to differentiate into osteoblasts. Platelet-rich plasma and cartilage scaffolds can be combined together to promote the repair of early steroid-induced femoral head necrosis of rabbits.
Platelet-rich plasma; Bone marrow stromal stem cells; Cartilage scaffold; Steroid-induced femoral head necrosis
http://kns.cnki.net/kcms/detail/51.1705.R.20170523.1116.010.html
10.3969/j.issn.1674-2257.2017.03.006
四川省卫生厅科研基金资助项目(No:120483)
R681.8
A
△通信作者:林炎水,E-mail:lys0596@163.com

