UHRF1蛋白在胃癌组织中表达及其与胃癌患者临床病理特征关系
张战胜,徐东为
UHRF1蛋白在胃癌组织中表达及其与胃癌患者临床病理特征关系
张战胜,徐东为
目的 探讨UHRF1蛋白在胃癌组织中的表达及其与胃癌患者临床病理特征的关系。方法 采用反转录-聚合酶链反应(RT-PCR)及免疫组织化学方法分别检测胃癌102例胃癌组织和癌旁组织中UHRF1的mRNA及蛋白表达水平,并分析UHRF1蛋白表达与胃癌患者临床病理特征关系。结果 RT-PCR及免疫组织化学检查结果显示胃癌患者胃癌组织中UHRF1 mRNA及蛋白表达水平均显著高于其癌旁组织,差异均具有统计学意义(P<0.05)。UHRF1蛋白表达与胃癌患者的某些病理特征显著相关,在UHRF1蛋白表达量较高的胃癌患者中,其肿瘤直径较大、TNM临床分期较晚、浸润程度较深,且出现淋巴结转移概率较大、组织分化程度也较高。结论 UHRF1在胃癌组织中呈高表达,并与肿瘤恶性表型相关,可作为判断胃癌发生和发展的重要辅助指标。
胃肿瘤;UHRF1;病理状态
尽管随着医疗技术和治疗手段不断革新,胃癌发病率和病死率已显著下降,但其仍然占据我国消化系统恶性肿瘤病死率第1位,严重影响人们身体健康及生活质量[1]。传统胃癌治疗方式以手术和放化疗等为主,虽然传统治疗在一定程度上提高了胃癌患者生存率,但仍有极大比例胃癌患者术后出现复发和转移,故亟须在基因水平上阐明胃癌发生及转移机制[2]。胃癌发生和发展极为复杂,是一个多基因、多因素并经多阶段演变的过程,其中因1种或多种基因在细胞内异常表达而使细胞周期紊乱是导致细胞恶性增殖的关键[3-4]。泛素样含植物同源结构域(PHD)和环指域1(UHRF1)是近年新发现的一种与细胞生长有关的核蛋白基因,它参与细胞增殖、周期转换及DNA损伤修复等多种生物学过程[5-6]。有研究显示,UHRF1在多种肿瘤组织中呈过表达状态,并与肿瘤侵袭、转移及预后密切相关,已成为多种癌症研究中的重要指标之一[7]。本研究通过检测胃癌组织中UHRF1表达水平,来探究其在胃癌发生及发展中所扮演的角色,以期为开辟新的胃癌治疗策略提供一定参考。
1 资料与方法
1.1 一般资料 选取2014年2月—2016年5月第四军医大学附属唐都医院收治的经病理学检查诊断为胃癌并行胃癌根治术治疗102例作为研究对象,均未合并其他类型恶性肿瘤。102例中男57例,女45例,年龄32~67(51.36±13.71)岁,中位年龄52岁。肿瘤发生部位:胃底或贲门54例,胃体26例,胃窦或幽门22例。TNM临床分期:Ⅰ期16例,II期33例,III期35例,Ⅳ期18例。分化程度:高分化27例,中分化24例,低分化51例。存在淋巴结转移46例,无淋巴结转移56例。102例术前均未接受放化疗等抗癌治疗,且其癌旁组织病理学检查均为阴性。取102例肿瘤组织作为试验样本,同时取其癌旁组织作为对照样本。
1.2 仪器与试剂 DMEM高糖培养基购自美国Gibco公司;细胞RNA提取试剂TRIzol购自Thermo Fisher公司,RNA反转录试剂盒及反转录-聚合酶链反应(RT-PCR)试剂盒均来自于日本Takara公司,RT-PCR引物由上海生工生物技术公司合成,实时荧光定量聚合酶链反应(PCR)仪购自美国Bio-Rad公司,倒置显微镜购自日本奥林巴斯。Anti-UHRF1兔抗人购自Santa Cruze公司,GAPDH抗体、羊抗鼠、羊抗兔IgG二抗等抗体均购自日本MBL公司。二氨基联苯胺(DAB)显色剂购自北京中杉金桥生物技术有限公司。
1.3 试验方法
1.3.1 RT-PCR法检测胃癌组织中UHRF1 mRNA表达情况:取1 ml TRIzol分别加入至100 mg胃癌组织及癌旁组织样品中并且充分匀浆,然后加入200 μl氯仿,剧烈震荡后置于冰上直至到分层出现,4℃离心(12 000 r/min,15 min),可看见界限清晰下层红色有机相、中间层以及上层无色水相。小心转移上层水相到新的离心管中,注意不要吸到中间层,加入相同体积异丙醇,剧烈混匀后在冰上放置30 min。4℃离心(12 000 r/min,10 min)并弃上清,再用75%预冷乙醇洗涤沉淀1次,吸净上清,通风橱干燥后加入无核糖核酸酶(RNase)水,此即为细胞内总RNA。将所提取RNA测定浓度后取适量作为反转录PCR的反应模板,根据反转录试剂盒相关说明配置标准的反应体系,设定相应的反转录条件,将RNA反转录为cDNA,此即为RT-PCR的反应模板。随后根据UHRF1的cDNA序列设计RT-PCR引物,UHRF1的上游引物序列为5'-GACGGCCATACCCTCTTCG-3',下游引物序列为5'-GCTGGCCTGCTGTCAGTCTC-3',PCR片段长度约为200 bp;同时以GAPDH抗体作为内参,上游引物序列为5'-CAAGGCTGAGAACGGGAAGC-3',下游引物序列为5'-GATGACCCTTTTGGCTCCCC-3',PCR片段长度约为150 bp。将RT-PCR的反应标准体系加至荧光定量PCR 96孔板中,设置反应程序,反应结束即可以获得所需要的数据。
1.3.2 免疫组织化学染色:用4%的多聚甲醛固定组织样品,常规石蜡进行包埋,4 μm厚连续切片后黏附于多聚赖氨酸处理过的玻片上,50℃烘箱中烘烤1 h后,常规二甲苯脱蜡并梯度乙醇水化,蒸馏水洗涤3次后,再在0.1%的枸橼酸钠溶液中加热修复2次,每次10 min,磷酸缓冲液(PBS)洗涤3次后,于3%过氧化氢溶液中灭活内源性过氧化物酶15 min,PBS再次洗涤3次。滴加UHRF1兔抗人一抗(单抗),并置于湿盒内4 ℃孵育过夜,次日PBST浸洗3次,每次8 min,滴加辣根过氧化物酶(HRP)标记的羊抗兔二抗,并于室温下孵育1.5 h,PBST再次浸洗3次,使用DAB显色试剂盒进行显色,显微镜下观察程度并终止显色反应,再经苏木精复染、0.1%盐酸分化、自来水返蓝、梯度乙醇脱水以及二甲苯透明,最后中性树胶封片并镜检。
1.4 免疫组织化学检查观察与评定 UHRF1阳性信号定位于细胞核内,不同组织蛋白表达水平的差异主要体现在阳性信号的着色强弱。根据信号的着色强弱分为4个等级:0分(无着色),1分(浅棕色),2分(棕黄色),3分(深褐色)。根据阳性细胞率也分为4个等级:1分(0~25%),2分(25%~50%),3分(50%~75%),4分(≥75%)。综合阳性细胞率及信号着色强弱两个标准对免疫组织化学结果进行评估,由2名资深病理医师各自独立观察并给出评价结果。
1.5 统计学方法 应用SPSS 21.0统计学分析软件对数据进行分析,计数资料用率(%)表示并进行χ2检验,样本间比较采用t检验,采用Spearman进行相关性分析,以α=0.05为检验水准。
2 结果
2.1 RT-PCR检查结果 琼脂糖凝胶电泳结果显示,UHRF1的引物特异性较好,在两组织中都扩增出高特异性条带,可进行RT-PCR,见图1a。RT-PCR检查结果如图1b所示,UHRF1 mRNA在癌旁组织中表达水平较低,而在胃癌组织中呈高表达状态,定量分析结果显示二者的UHRF1 mRNA水平比较差异具有统计学意义(P<0.05)。

图1 胃癌组织和癌旁组织中UHRF1 mRNA表达情况注:aP<0.05
2.2 免疫组织化学检查结果 如图2a所示,UHRF1蛋白主要表达在细胞核内,在癌旁组织中,UHRF1的阳性细胞率较低,且染色着色程度较浅;而在胃癌组织中,UHRF1的阳性细胞率显著增加,且均呈棕黄色或深褐色,即UHRF1在胃癌组织中呈高表达现象。综合两组织中UHRF1的阳性细胞率与着色程度对免疫组织化学检查结果进行定量分析发现,与癌旁组织相比,胃癌组织中UHRF1蛋白的灰度值明显增加,统计学分析显示两组比较差异具有统计学意义(P<0.05),见图2b。
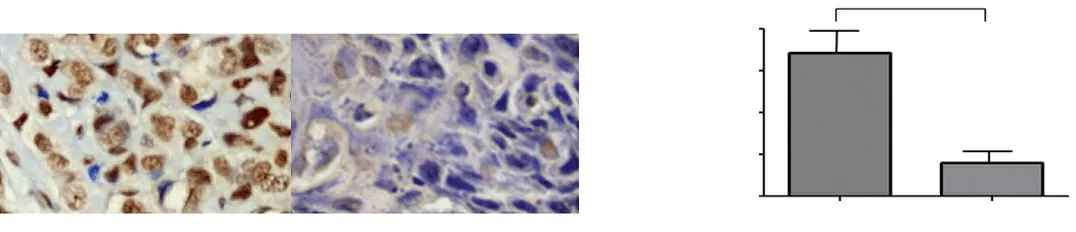
图2 胃癌组织和癌旁组织中UHRF1蛋白免疫组织化学检查结果及其定量分析注:DAB×400;aP<0.05
2.3 UHRF1蛋白表达与胃癌患者临床病理特征关系 进一步分析UHRF1蛋白表达与胃癌患者临床病理特征之间的关系发现,UHRF1蛋白表达与胃癌患者的年龄、性别无关,而与肿瘤直径、TNM临床分期、浸润程度、淋巴结转移以及组织分化程度有一定相关性(P<0.05),即在UHRF1蛋白表达量较高的胃癌患者中,其肿瘤直径较大、TNM临床分期较晚、浸润程度较深,且出现淋巴结转移概率较大、组织分化程度也较高,见表1。
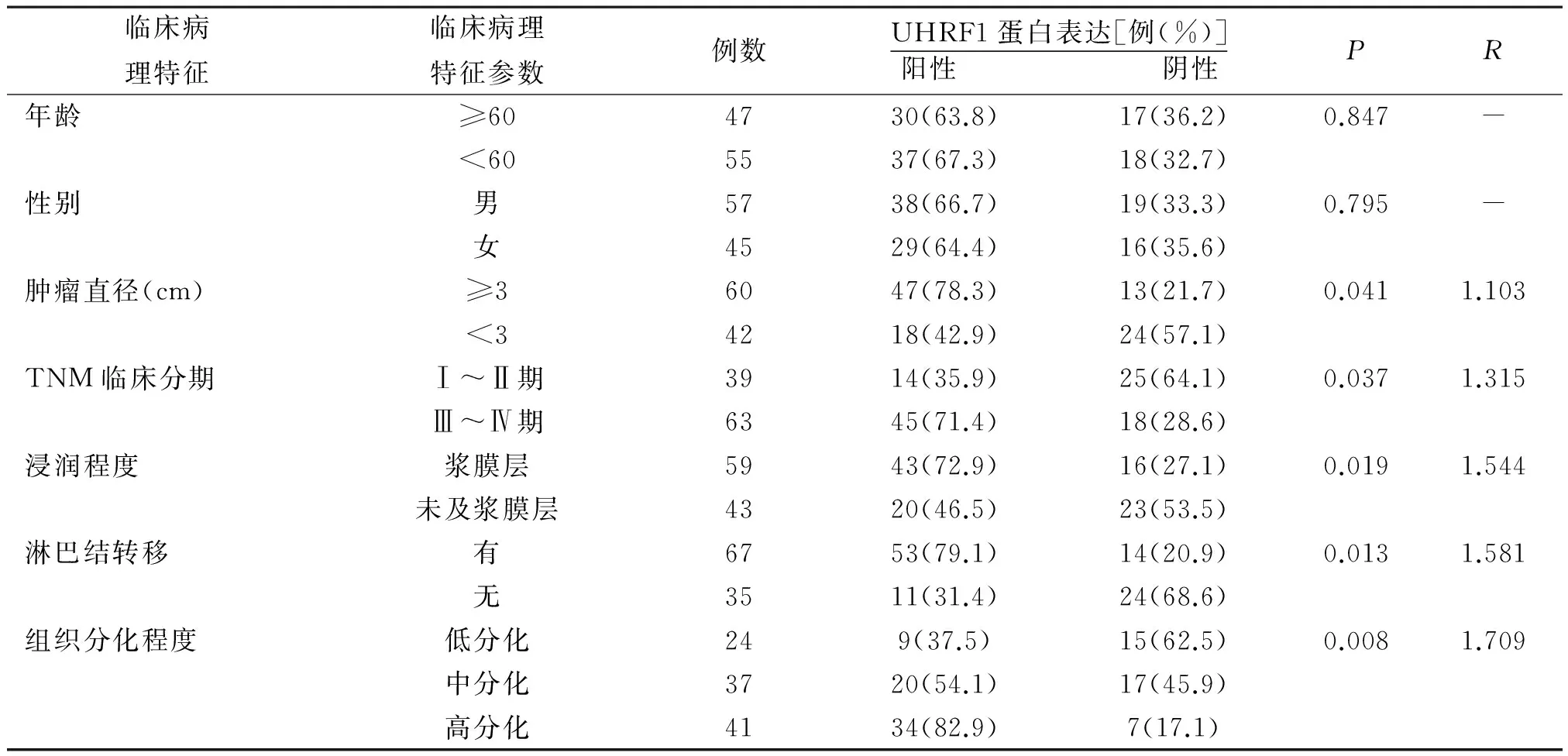
表1 UHRF1蛋白表达与胃癌患者临床病理特征关系
3 讨论
胃癌是全球范围内发病率最高的癌症之一,病死率居各类肿瘤的第2位。大部分胃癌患者就诊时已处于进展期,而该阶段胃癌治疗效果远不尽人意,即便是在早期行胃癌根治术的胃癌患者术后复发率和转移率也较高[8-13]。因此,传统治疗手段尚不能从根本上对胃癌治疗提供强有力保障。近年来,肿瘤细胞的增殖、凋亡、细胞周期、侵袭浸润以及血管生成等逐渐成为胃癌治疗的研究热点,从基因水平上对胃癌的发生进行探讨将极大地促进胃癌分子靶向治疗的发展[14-19]。
UHRF1属UHRF超家族成员之一,是新发现的一种与细胞生长相关的核蛋白基因,在细胞内参与多种生物学过程,如细胞增殖、周期调控、侵袭转移以及细胞放射敏感性等[20-21]。UHRF1含有多个功能结构域,可通过其SRA结构域识别半甲基化的DNA,并招募甲基转移酶到DNA复制位点,催化新合成的DNA链发生甲基化,从而发挥调控基因表达的作用[22]。UHRF1的表达与细胞的分化程度和增殖能力密切相关,即细胞增殖能力越强、分化程度越低,UHRF1的表达水平越高[23-24]。有研究显示,UHRF1在甲状腺癌、乳腺癌、非小细胞肺癌及胰腺癌等多种肿瘤组织中呈过表达,并通过调控细胞周期、凋亡以及抑癌基因失活等多种过程来影响肿瘤的发生及发展,已成为某些肿瘤早期诊断和预后评价的重要指标之一[25-27]。但目前为止,国内文献对UHRF1在胃癌组织中的表达以及其与胃癌患者临床病理特征的关系少有报道。本研究通过检测UHRF1在胃癌组织中的表达水平,并对其与胃癌患者临床病理特征的关系进行分析,以期为探讨UHRF1在胃癌发生和发展过程中的调控机制与胃癌患者治疗策略制定提供一定参考。
本研究RT-PCR检查结果显示,UHRF1 mRNA表达水平在胃癌组织及癌旁组织中呈现较大的差异,UHRF1 mRNA在胃癌组织中呈高表达状态,而在癌旁组织中表达水平极低。随后通过免疫组织化学方法进一步检测UHRF1在两组织中的蛋白表达差异,发现UHRF1蛋白在胃癌组织中的阳性细胞率及着色程度均远远高于癌旁组织。以上研究结果说明UHRF1在胃癌组织中是以过表达的状态存在。
另外,本研究对UHRF1蛋白表达与胃癌患者临床病理特征关系进行相关性分析发现,UHRF1蛋白表达与胃癌患者肿瘤直径、TNM临床分期、浸润程度、淋巴结转移以及组织分化程度等特征密切相关,即在UHRF1蛋白表达较高的胃癌患者中,肿瘤直径较大、TNM临床分期较晚、浸润程度较深,且出现淋巴结转移概率较大、组织分化程度也较高。提示UHRF1蛋白在胃癌的发生及发展中可能起重要作用,并可能为胃癌诊断提供一定参考价值。
综上所述,胃癌组织中UHRF1过表达可能通过多种调控影响肿瘤发生、浸润与转移等,若能进一步明确UHRF1在胃癌发生和发展过程中的具体作用过程及诊断治疗价值,将可能为胃癌个体化治疗提供新的研究思路及药物作用靶点。
[1] Zhang C X, Wang S Y, Chen S Q,etal. Association between pretreatment Glasgow prognostic score and gastric cancer survival and clinicopathological features: a meta-analysis[J].Onco Targets Ther, 2016,9:3883-3891.
[2] Abdelfatah E, Kerner Z, Nanda N,etal. Epigenetic therapy in gastrointestinal cancer: the right combination[J].Therap Adv Gastroenterol, 2016,9(4):560-579.
[3] 李佳,王东旭,张辰新,等.抗凋亡蛋白Mcl-1、Survivin和Bag-1在肠化、不典型增生和胃癌中的表达及意义[J].解放军预防医学杂志,2015,33(6):608-610.
[4] Wang H S, Nie X, Wu R B,etal. Downregulation of human Wnt3 in gastric cancer suppresses cell proliferation and induces apoptosis[J].Onco Targets Ther, 2016,9:3849-3860.
[5] Kent B, Magnani E, Walsh M J,etal. UHRF1 regulation of Dnmt1 is required for pre-gastrula zebrafish development[J].Dev Biol, 2016,412(1):99-113.
[6] Liang C C, Cohn M A. UHRF1 is a sensor for DNA interstrand crosslinks[J].Oncotarget, 2016,7(1):3-4.
[7] Matsushita R, Yoshino H, Enokida H,etal. Regulation of UHRF1 by dual-strand tumor-suppressor microRNA-145 (miR-145-5p and miR-145-3p): Inhibition of bladder cancer cell aggressiveness[J].Oncotarget, 2016,7(19):28460-28487.
[8] 蒋秀兰.围手术期应用L-精氨酸联合整蛋白复方制剂对胃癌患者术后抗肿瘤免疫及肿瘤负荷的影响[J].海南医学院学报,2016,22(19):2305-2308.
[9] 梁寒.胃癌远端胃切除术后消化道重建手术方式的选择及临床评价[J].中华消化外科杂志,2016,15(3):216-220.
[10]焦喜林,王振全,陈金辉,等.胃癌根治术联合改良胃旁路术在胃癌合并2型糖尿病患者中的应用[J].解放军医药杂志,2015,27(9):82-85.DOI:10.3969/j.issn.2095-140X.2015.09.017.
[11]Turkmen E, Erdogan B, Kodaz H,etal. Post progression survival analysis of metastatic gastric and gastroesophageal junction cancerpatients after second-line treatment[J].Acta Gastroenterol Belg, 2016,79(2):211-215.
[12]Kuai J, Yang F, Li G J,etal. In vitro-activated tumor-specific T lymphocytes prolong the survival of patients with advancedgastric cancer: a retrospective cohort study[J].Onco Targets Ther, 2016,9:3763-3770.
[13]阴法文,尚磊,张传宝.进展期胃癌患者全胃切除D2淋巴结清扫微创手术效果研究[J].中国普通外科杂志,2015,24(11):1636-1639.
[14]杨宏,崔明,邢加迪,等.腹腔镜辅助胃癌根治术的临床疗效[J].中华消化外科杂志,2016,15(3):234-240.
[15]高东,孙静.胃癌分子靶向治疗研究进展[J].武警后勤学院学报:医学版,2014,23(8):714-717.
[16]Harada K, Baba Y, Shigaki H,etal. Prognostic and clinical impact of PIK3CA mutation in gastric cancer: pyrosequencing technologyand literature review[J].BMC Cancer, 2016,16(1):400.
[17]Li K, Chen F, Xie H. Decreased FOXP3+ and GARP+ Tregs to neoadjuvant chemotherapy associated with favorableprognosis in advanced gastric cancer[J].Onco Targets Ther, 2016,9:3525-3533.
[18]郭水龙,朱圣韬,程芮,等.miR-365通过靶向E2F2抑制胃癌细胞增生和肿瘤形成[J].首都医科大学学报,2016,37(1):1-5.
[19]王硕,李智,郑春雷,等.利用TCGA及GEO数据集分析claudin11在胃癌中的表达及临床意义[J].武警后勤学院学报:医学版,2016,25(6):424-427,封3.
[20]Liu Y, Zhang B, Kuang H,etal. Zinc Finger Protein 618 Regulates the Function of UHRF2 (Ubiquitin-like with PHD and Ring FingerDomains 2) as a Specific 5-Hydroxymethylcytosine Reader[J].J Biol Chem, 2016,291(26):13679-13688.
[21]Sheng Y, Wang H, Liu D,etal. Methylation of tumor suppressor gene CDH13 and SHP1 promoters and their epigenetic regulationby the UHRF1/PRMT5 complex in endometrial carcinoma[J].Gynecol Oncol, 2016,140(1):145-151.
[22]Myrianthopoulos V, Cartron P F, Liutkeviciute Z,etal. Tandem virtual screening targeting the SRA domain of UHRF1 identifies a novel chemical toolmodulating DNA methylation[J].Eur J Med Chem, 2016,114:390-396.
[23]Greiner V J, Kovalenko L, Humbert N,etal. Site-selective monitoring of the interaction of the SRA domain of UHRF1 with target DNA sequences labeled with 2-aminopurine[J].Biochemistry, 2015,54(39):6012-6020.
[24]Wang X, Wu Q, Xu B,etal. MiR-124 exerts tumor suppressive functions on the cell proliferation, motility and angiogenesis ofbladder cancer by fine-tuning UHRF1[J].FEBS J, 2015,282(22):4376-4388.
[25]Taniue K, Kurimoto A, Sugimasa H,etal. Long noncoding RNA UPAT promotes colon tumorigenesis by inhibiting degradation of UHRF1[J].Proc Natl Acad Sci U S A, 2016,113(5):1273-1278.
[26]Abu Alainin W, Gana T, Liloglou T,etal. UHRF1 regulation of the Keap1-Nrf2 pathway in pancreatic cancer contributes to oncogenesis[J].J Pathol, 2016,238(3):423-433.
[27]Soleimani A, Ghanadi K, Noormohammadi Z,etal. The correlation between miR-146a C/G polymorphism and UHRF1 gene expression level in gastrictumor[J].J Dig Dis, 2016,17(3):169-174.
UHRF1 Protein Expression in Gastric Cancer Tissues and Its Relationship with Clinicopathological Characteristics of Gastric Cancer
ZHANG Zhan-sheng, XU Dong-wei
(Department of General Surgery, Tangdu Hospital Affiliated to the Fourth Military Medical University, Xi'an 710038, China)
Objective To investigate UHRF1 protein expression in gastric cancer tissues and its relationship with clinicopathological characteristics of gastric cancer. Methods The mRNA and protein expressions of UHRF1 in cancer and ambient tissues were detected in 102 patients with gastric cancer by reverse transcription- polymerase chain reaction (RT-PCR) and immunohistochemistry methods respectively, and the relationship between UHRF1 protein expression and clinicopathological characteristics was analyzed. Results RT-PCR and immunohistochemistry results showed that mRNA and protein expressions of UHRF1 in gastric cancer tissues were significantly higher than those in ambient tissues (P<0.05). UHRF1 protein expression had significant relationship with some clinicopathological characteristics. Gastric cancer tissues of higher UHRF1 protein expression had larger tumor diameter, later TNM staging, deeper infiltration depth, higher incidence rate of lymph node metastasis and histological differentiation degree (P<0.05). Conclusion UHRF1 is highly expressed in patients with gastric cancer, and it is closely correlated with malignant phenotype of gastric cancer, and therefore it can be used as an important assistance index for judging occurrence and development of gastric cancer.
Stomach neoplasms; UHRF1; Pathological conditions
710038 西安,第四军医大学附属唐都医院普通外科
徐东为,电话:18992871711
R735.2
A
1002-3429(2017)05-0089-05
10.3969/j.issn.1002-3429.2017.05.028
2017-01-12 修回时间:2017-02-10)

