p75NTR在胃癌组织中的表达及临床意义
靳海峰,赵 敏,赵 亮,王 力,吴 峥,赵会懂,侯会池,朱焱华,孙 蓉,姚 欣,吴晓云,谷建芳
p75NTR在胃癌组织中的表达及临床意义
靳海峰,赵 敏,赵 亮,王 力,吴 峥,赵会懂,侯会池,朱焱华,孙 蓉,姚 欣,吴晓云,谷建芳
目的 探讨p75NTR在胃癌组织中的表达及临床意义。方法 选择2015年1月—2016年1月在解放军白求恩国际和平医院行手术切除的胃癌60例,将其胃癌组织标本作为研究对象,根据患者淋巴结是否转移及病灶浸润深度进行分组。统计比较淋巴结转移阴性组、淋巴结转移阳性组以及病灶浸润肌层组、病灶浸润全层组p75NTR检测情况,并对淋巴结转移阴性组和淋巴结转移阳性组治疗后生活质量进行比较。结果 淋巴结转移阴性组p75NTR检出阳性率显著高于淋巴结转移阳性组,两组比较差异有统计学意义(P<0.05)。病灶浸润肌层组p75NTR检出阳性率显著高于病灶浸润全层组,两组比较差异亦具有统计学意义(P<0.05)。治疗后淋巴结转移阴性组日常生活能力评分、躯体功能评分、心理功能评分及社会功能评分均显著高于淋巴结转移阳性组,两组比较差异均具有统计学意义(P<0.05)。结论 p75NTR水平检测可提示胃癌组织淋巴结转移情况以及病灶浸润深度,p75NTR水平检测可作为预测胃癌患者预后情况的依据。
胃肿瘤;p75NTR;基因表达
现已有文献报道显示,胃癌是世界范围内严重危害公众健康的一种疾病,我国是胃癌高发国家,在我国各类恶性肿瘤疾病中胃癌发病率居第4位[1-3]。相关资料表明,p75NTR对多种肿瘤组织性质判断以及对多种肿瘤患者生存以及预后水平影响有重要意义[4-5]。为探讨p75NTR在胃癌组织中的表达及临床意义,本研究选择胃癌60例的组织标本作为研究对象进行分析,并对患者的临床资料进行回顾分析,现报告如下。
1 资料与方法
1.1 一般资料 选择2015年1月—2016年1月在解放军白求恩国际和平医院行手术切除的胃癌60例,男43例,女17例;年龄35~70(52.6±3.8)岁;病程1~3个月。所有患者皆经胃镜活组织病理检查明确诊断,肿瘤位于胃体小弯及胃窦部,病理检查均示腺癌,临床分期T3NxM0。择期行原发癌以及区域淋巴结切除(胃癌根治术)治疗,术前均未行系统性放化疗干预。选取此60例胃癌组织标本作为研究对象。本研究内容经院医学伦理委员会批准,且患者签署知情同意书。
1.2 分组 根据患者术后病理检查淋巴结是否转移将60例分为淋巴结转移阴性组(n=30)和淋巴结转移阳性组(n=30);根据患者术后病理检查病灶浸润深度将60例分为病灶浸润肌层组(n=30)和病灶浸润全层组(n=30)。
1.3 观察指标及方法 统计比较淋巴结转移阴性组、淋巴结转移阳性组以及浸润肌层组、浸润全层组p75NTR检出情况,并对淋巴结转移阴性组和淋巴结转移阳性组治疗后[均给予FOLFOX4(奥沙利铂、亚叶酸钙、氟尿嘧啶)方案化疗8个周期]生活质量进行比较。采用SP法进行免疫组织化学检查,常规石蜡切片并经二甲苯脱蜡,抗原微波修复后进行孵育处理,p75NTR定位于细胞质,以可见棕黄色改变或显现棕褐色颗粒为阳性判断依据。生活质量采用日常生活能力(ADL)评分、躯体功能评分、心理功能评分及社会功能评分进行评定。

2 结果
淋巴结转移阴性组p75NTR检出阳性率为100.00%(30/30),显著高于淋巴结转移阳性组20.00%(6/30),两组比较差异有统计学意义(χ2=14.276,P<0.001),两组典型病例病理检查结果见图1、图2。病灶浸润肌层组p75NTR检出阳性率为66.67%(20/30),显著高于病灶浸润全层组43.33%(13/30),两组比较差异具有统计学意义(χ2=7.589,P<0.001),两组典型病例病理检查结果见图3、图4。治疗后淋巴结转移阴性组ADL评分、躯体功能评分、心理功能评分及社会功能评分,均显著高于淋巴结转移阳性组,两组比较差异均具有统计学意义(P<0.05),见表1。
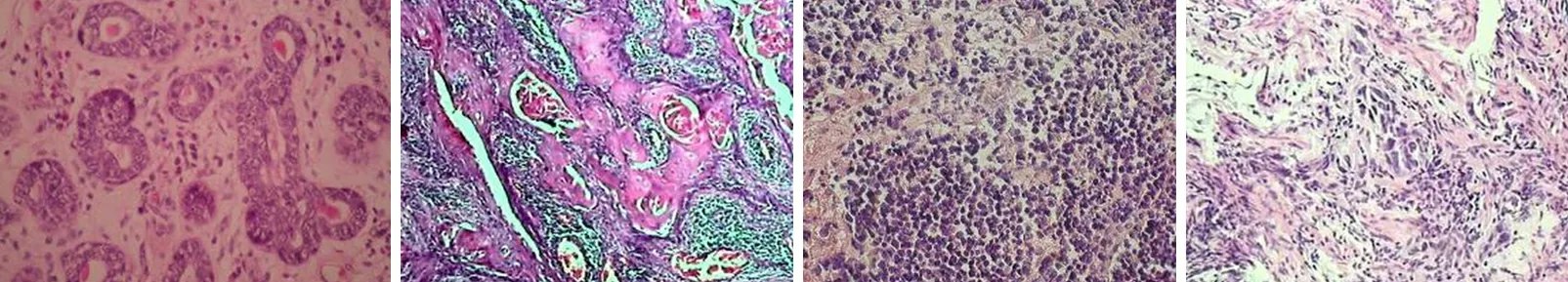
图1 淋巴结转移阴性胃癌患者p75NTR检测情况(男,63岁;免疫组织化学×200)
图2 淋巴结转移阳性胃癌患者p75NTR检测情况(男,55岁;免疫组织化学×200)
图3 病灶浸润肌层胃癌患者p75NTR检测情况(女,61岁;免疫组织化学×200)
图4 病灶浸润全层胃癌患者p75NTR检测情况(女,49岁;免疫组织化学×200)

表1 淋巴结是否转移胃癌两组治疗后生活质量评定比较±s,分)
3 讨论
胃癌是常见恶性肿瘤,为侵袭性强、致死率高的难治性恶性肿瘤。胃癌发展到一定程度后就会发生转移,胃癌早期多数患者症状不典型,而且胃癌病程较短,有相当一部分胃癌患者在确诊之时已有明显转移症状,并很快出现恶病质[6-9]。有研究显示,胃癌淋巴结转移是胃癌转移的重要途径,而且发生较早。淋巴结转移占胃癌转移70%,胃下部癌肿常转移至幽门下、胃下及腹腔动脉旁等淋巴结,而上部癌肿常转移至胰旁、贲门旁、胃上等淋巴结[10-11]。晚期胃癌可转移至主动脉周围及膈上淋巴结。由于腹腔淋巴结与胸导管直接交通,故胃癌还可转移至左锁骨上淋巴结[12]。胃癌患者随着癌肿增长,侵犯胃壁愈深愈广,转移机会就愈多。临床上根据胃癌转移的先后顺序可将胃癌转移部位分为3组:第一组距离瘤体最近,为贴于胃壁上的浅组淋巴结,一般发生在胃癌局限于黏膜下层时[13];第二组系引流浅淋巴结的深组淋巴结,当胃癌侵犯肌层时可发生第二组淋巴结转移;第三组包括腹腔动脉旁、腹主动脉、肝门、肠系膜根部及结肠中动脉周围淋巴结,也可发生远处淋巴结转移,如左锁骨上淋巴结,此组转移多为癌肿侵犯至浆膜时发生[14]。一般而言,发生第三组淋巴结转移时胃癌患者已失去了根治的机会。因此,胃癌的综合治疗已受到广泛重视,其中术前放化疗成为临床研究局部晚期胃癌治疗的一大热点。胃癌术前放化疗的目的首先是使肿瘤瘤体缩小,其次是降低胃癌肿瘤分期,再次是提高肿瘤根治性切除率和手术切除完整性,然后是降低淋巴结转移率和围术期并发症发生率,最后为提高生存率并降低残端癌发生率。
p75NTR基因属于肿瘤坏死因子家族成员之一[15],是一种拥有死亡受体的结构神经营养因子受体,现有关p75NTR的功能研究主要集中在中枢神经系统方面,主要作用是调控神经细胞的生长、发育和分化等[15]。p75NTR可以表达于多种组织、器官和肿瘤中。它在肿瘤中的确切作用机制目前研究还未完全阐明,在胃癌中的表达和作用机制亦仍然不十分清楚。研究表明p75NTR可以介导多种不同类型细胞死亡和增殖,这主要依赖于细胞所处的环境[5]。除了神经系统,它还表达于诸如乳腺癌[16]、急性淋巴细胞性白血病[17]、乳头状甲状腺癌[18]、胰腺癌[19]和前列腺癌[20]等多种肿瘤组织。p75NTR作为潜在的肿瘤抑制因子之一,有报道显示它可以有效抑制前列腺癌和膀胱癌细胞的生长和增殖[21],但也有研究报道它可以作为生存受体促进黑色素瘤细胞的脑转移[22],这一矛盾的研究结果提示p75NTR在不同环境以及不同肿瘤病灶中可能发挥不同作用[3]。肿瘤细胞增殖过程中细胞周期启动依赖于几个经典的细胞周期依赖激酶(cdks),细胞周期蛋白(Cyclin)D与增殖细胞核抗原(PCNA)的复合物已被证实可以促进细胞周期早期过程中Rb的磷酸化[23],而在细胞周期的G1/S期的结尾,cyclin E与cdk2的复合物同样可以促进Rb的磷酸化[24-25],这些都是p75NTR在部分肿瘤中抑制细胞增殖的作用机制[20]。同样,既往也有研究表明,肿瘤侵袭和转移需要肿瘤相关蛋白酶发挥作用,这些酶可以促进肿瘤细胞周围基质和基底膜的降解[26],这些酶包括尿激酶型纤维蛋白酶原激活剂(uPA)、基质金属蛋白酶(MMPs)及其抑制剂(TIMPs),它们在胃癌等肿瘤细胞的侵袭和转移过程中发挥了重要的作用[27-30]。
本研究结果显示淋巴结转移阴性组p75NTR检出阳性率显著高于淋巴结转移阳性组,病灶浸润肌层组p75NTR检出阳性率显著高于病灶浸润全层组,治疗后淋巴结转移阴性组ADL评分、躯体功能评分、心理功能评分及社会功能评分均显著高于淋巴结转移阳性组。提示在胃癌组织中p75NTR与淋巴结转移以及病灶浸润深度均有密切的相关性,可作为胃癌临床诊断与预后预测的重要依据之一,这与以往研究报道一致[22]。p75NTR是否通过调控细胞周期或者uPA和MMPs等因子参与胃癌细胞的生长和转移?其调控的信号通路又是什么?还有待于进一步的深入研究。
总之,本研究结果提示p75NTR水平检测可提示胃癌组织淋巴结转移情况以及病灶浸润深度,p75NTR水平检测可作为预测胃癌患者预后情况的依据。
[1] 蒋雨薇,饶智国.鼠双微体2与胃癌关系的研究进展[J].华南国防医学杂志,2016,30(6):415-418.
[2] Parkin D M, Pisani P, Ferlay J. Global cancer statistics[J].CA Cancer J Clin, 1999,49(1), 33-64,1.
[3] 马丽霞,宋卫东,王春英.胃癌患者血清中IL-7、GM-CSF的表达水平及其临床意义[J].西北国防医学杂志,2015,36(12):793-795.
[4] Rabizadeh S, Oh J, Zhong L T,etal. Induction of apoptosis by the low-affinity NGF receptor[J].Science, 1993,261(5119):345-348.
[5] Roux P P, Barker P A. Neurotrophin signaling through the p75 neurotrophin receptor[J].Prog Neurobiol, 2002,67(3):203-233.
[6] 黄宇珊.EpCAM和CK19在胃癌中的表达及其与胃癌转移和预后的相关性[J].现代医学,2016(3):329-333.
[7] 郭水龙,朱圣韬,程芮,等.miR-365通过靶向E2F2抑制胃癌细胞增生和肿瘤形成[J].首都医科大学学报,2016,37(1):1-5.
[8] 李波,周烂.血清VEGF、MMP及MK与胃癌术后复发转移的关系研究[J].海南医学院学报,2016,22(9):928-930.
[9] 朱婷,王琦,武希润,等.胃癌肝转移手术治疗远期疗效及预后因素的Meta分析[J].中华消化外科杂志,2016,15(3):257-265.
[10]郭红辉,王东江,李艳红,等.胃癌转移结肠癌的危险因素及其与组织学类型的相关性[J].结直肠肛门外科,2016(1):44-46.
[11]Wormald P J. The agger nasi cell: the key to understanding the anatomy of the frontal recess [J].Otolaryngol Head Neck Surg, 2003,129(5):497-507.
[12]Choi B I, Lee H J, Han J K,etal. Detection of hypervascular nodular hepatocellular carcinomas: value of triphasic helical CT compared with iodized-oil CT[J].AJR Am J Roentgenol, 1997,168(1):219-224.
[13]Khan M A, Combs C S, Brunt E M,etal. Positron emission tomography scanning in the evaluation of hepatocellular carcinoma[J].J Hepatol, 2000,32(5):792-797.
[14]Tabit C E, Chung W B, Hamburg N M,etal. Endothelial dysfunction in diabetes mellitus: molecular mechanisms and clinical implications[J].Rev Endocr Metab Disord, 2010,11(1):61-74.
[15]Liepinsh E, Ilag L L, Otting G,etal. NMR structure of the death domain of the p75 neurotrophin receptor[J].EMBO J, 1997,16(6):4999-5005.
[16]Reis Filho J S, Steele D, Di Palma S,etal. Distribution and significance of nerve growth factor receptor (NGFR/p75NTR) in normal, benign and malignant breast tissue[J].Mod Pathol, 2006,19(2):307-319.
[17]Beutel G, Meyer J, Ma L,etal. Expression of the p75 neurotrophin receptor in acute leukaemia[J].Br J Haematol, 2005,131(1):67-70.
[18]Rocha A S, Risberg B, Magalhaes J,etal. The p75 neurotrophin receptor is widely expressed in conventional papillary thyroid carcinoma[J].Hum Pathol, 2006,37(5):562-568.
[19]Dang C, Zhang Y, Ma Q,etal. Expression of nerve growth factor receptors is correlated with progression and prognosis ofhuman pancreatic cancer[J].J Gastroenterol Hepatol, 2006,21(5):850-858.
[20]Pflug B R, Onoda M, Lynch J H,etal. Reduced expression of the low affinity nerve growth factor receptor in benign and malignanthuman prostate tissue and loss of expression in four human metastatic prostate tumor cell lines[J].Cancer Res, 1992,52(19):5403-5406.
[21]Khwaja F, Allen J, Lynch J,etal. Ibuprofen inhibits survival of bladder cancer cells by induced expression of the p75NTRtumor suppressor protein[J].Cancer Res, 2004,64(17):6207-6213.
[22]Marchetti D, Aucoin R, Blust J,etal. p75 neurotrophin receptor functions as a survival receptor in brain-metastatic melanoma cells[J].J Cell Biochem, 2004,91(1):206-215.
[23]Satyanarayana A, Rudolph K L. p16 and ARF: activation of teenage proteins in old age[J].J Clin Invest, 2004,114(9):1237-1240.
[24]Perez M, Regan T, Pflug B,etal. Loss of low-affinity nerve growth factor receptor during malignant transformation of the humanprostate[J].Prostate, 1997,30(4):274-279.
[25]Geldof A A, Van Haarst E P, Newling D W. Newling, Neurotrophic factors in prostate and prostatic cancer[J].Prostate Cancer Prostatic Dis, 1998,1(5):236-241.
[26]Cho J Y, Chung H C, Noh S H,etal. High level of urokinase-type plasminogen activator is a new prognostic marker in patients with gastric carcinoma[J].Cancer, 1997,79(5):878-883.
[27]Iwamoto J, Mizokami Y, Takahashi K,etal. Expressions of urokinase-type plasminogen activator, its receptor and plasminogen activatorinhibitor-1 in gastric cancer cells and effects of Helicobacter pylori[J].Scand J Gastroenterol, 2005,40(7):783-793.
[28]Farina A R, Coppa A, Tiberio A,etal. Transforming growth factor-beta1 enhances the invasiveness of human MDA-MB-231 breastcancer cells by up-regulating urokinase activity[J].Int J Cancer, 1998,75(5):721-730.
[29]Kaneko T, Konno H, Baba M,etal. Urokinase-type plasminogen activator expression correlates with tumor angiogenesis andpoor outcome in gastric cancer[J].Cancer Sci, 2003,94(1):43-49.
[30]Matsumura S, Oue N, Nakayama H,etal. A single nucleotide polymorphism in the MMP-9 promoter affects tumor progression and invasivephenotype of gastric cancer[J].J Cancer Res Clin Oncol, 2005,131(1):19-25.
Expression and Clinical Significance of p75NTR in Gastric Cancer
JIN Hai-feng1a, ZHAO Min2, ZHAO Liang1b, WANG Li1c, WU Zheng3, ZHAO Hui-dong1d, HOU Hui-chi1e, ZHU Yan-hua1f, SUN Rong1a, YAO Xin1a, WU Xiao-yun1a, GU Jian-fang1f
(a. Department of Gastroenterology, b. Department of Cardiothoracic Surgery, c. Health Management Center, d. Editorial Department, e. Department of General Surgery, f. Department of Medical Affairs, Bethune International Peace Hospital of PLA, Shijiazhuang 050082, China; 2. Clinical Supervising Technician of Army Staff, Beijing 100042, China; 3. Department of Biotherapy, the Forth Hospital of Hebei Medical University, Shijiazhuang 050011, China)
Objective To analyze the expression and clinical significance of p75NTR in gastric cancer. Methods A total of 60 samples of gastric cancer undergoing surgical resection of gastric cancer during January 2015 and January 2016 were selected as the study subjects. The content of the study in accordance with the medical ethics will be approved and for patients to understand, signed an informed consent. Retrospective analysis of clinical data of all patients. The positive rate of p75NTR in patients with lymph node metastasis negative group, positive group and the depth of invasion of the muscle layer group, all patients were detected, the positive rate was statistically analyzed. The quality of life was compared between lymph node metastasis positive group and negative group after chemotherapy. Results The positive rate of p75NTR in lymph node metastasis negative group was significantly higher than that in lymph node metastasis positive group, and the difference was statistically significant (P<0.05). The positive rate of p75NTRin infiltration depth of muscular layer was significantly higher than that of the depth of infiltration whole layer group, and the difference was statistically significant (P<0.05). After treatment, the rating scales of viability, physical function, mental function and society function of lymph node metastasis negative patients were significantly higher than those of lymph node metastasis positive group, and the differences were statistically significant (P<0.05). Conclusion Expression of p75NTR in gastric carcinoma tissue can pretest cancerous tissue lymph node metastasis and invasion depth, and therefore clinical introduction of p75NTR index detection can basis as the effective prediction in prognosis of patients with gastric cancer.
Stomach neoplasms; p75NTR; Gene expression
全国优秀博士学位论文作者专项资金资助项目(201363)
050082 石家庄,解放军白求恩国际和平医院消化内科(靳海峰、孙蓉、姚欣、吴晓云),心胸外科(赵亮),健康管理中心(王力),编辑部(赵会懂),普通外科(侯会池),医务部(朱焱华、谷建芳);100042 北京,陆军参谋部门诊部(赵敏);050011 石家庄,河北医科大学第四医院生物治疗中心(吴峥)
R593.23
A
1002-3429(2017)05-0094-04
10.3969/j.issn.1002-3429.2017.05.029
2017-02-22 修回时间:2017-03-21)

