紫外线吸收剂PBSA与DNA相互作用的光谱研究
陈砚美, 杨 晗, 王 芳, 熊绪杰, 张万举
(黄冈师范学院 催化材料制备与应用湖北省重点实验室, 湖北 黄冈 438000)
紫外线吸收剂PBSA与DNA相互作用的光谱研究
陈砚美, 杨 晗, 王 芳, 熊绪杰, 张万举*
(黄冈师范学院 催化材料制备与应用湖北省重点实验室, 湖北 黄冈 438000)
采用荧光光谱法和紫外光谱法, 在模拟生理条件下(pH=7.23)对紫外线吸收剂2-苯基苯并咪唑-5-磺酸(PBSA)与脱氧核糖核酸(DNA)的相互作用进行了研究.结果表明PBSA能够与DNA相结合形成复合物,引起了PBSA紫外吸收的降低和荧光的猝灭;PBSA与DNA的相互作用为静态猝灭过程,两者间的结合位点数为1.11.
2-苯基苯并咪唑-5-磺酸(PBSA); DNA相互作用; 光谱法
紫外线吸收剂是一种光稳定剂,能够吸收可引起人产生急性皮炎和皮肤灼伤、变黑的紫外线,从而减轻紫外线对皮肤的损伤,广泛应用于塑料、涂料、染料、汽车挡风玻璃、化妆品、药物、防晒剂等各类产品[1].2-苯基苯并咪唑-5-磺酸(PBSA)是一种新型紫外线吸收剂,在302 nm紫外波长处吸收系数高达920~990,是普通紫外线吸收剂的3倍以上[2],由于具有良好的水溶性和较高的紫外线吸收效率,在各类水基防晒化妆品中被广泛应用.防晒剂在使用过程中,会不可避免的通过皮肤吸收进入体内,所以其安全性尤为引人重视.有研究表明,PBSA能够在UV照射下产生活性氧物质并造成DNA损伤[3],但是,PBSA在使用过程中被人体吸收,其在体内对生物体产生的可能影响目前还未见报道,有必要对其进行相应的研究.

图1 PBSA的结构式Fig.1 Scheme of PBSA
DNA是生物体内最重要的生物大分子之一,是遗传信息的携带和基因表达的物质基础,在生物的各个生命活动中具有重要的作用.很多外源性物质进入生物体内后,会和DNA发生不同类型的相互作用,从而可能对DNA的生理功能产生影响[4],因此,研究小分子化合物与DNA相互作用可以在一定程度上反映该化合物的生物安全性.本文通过紫外光谱和荧光光谱法,在模拟生理条件下研究了紫外线吸收剂PBSA与小牛胸腺DNA(CT-DNA)的相互作用,以期对PBSA的应用安全性进行初步评价.
1实验部分
1.1仪器试剂
紫外光谱采用北京谱析Tu-1901双光束紫外可见分光光度计测量;荧光光谱采用岛津RF-5301PC荧光分光光度计测定.小牛胸腺DNA(CT-DNA)购于sigma公司;PBSA由湖北宏源药业公司提供;其它试剂均为市售分析纯.
Tris-HCl缓冲液的配制:称取0.605 7 g(5 mmol)的Tris[(CH3OH)3CNH2]溶于25.0 mL水中,得到0.2 M的Tris溶液,再加入37.5 mL的0.1 M的HCl溶液,稀释至100 mL,得到pH值为7.23的Tris-HCl缓冲溶液.
1.2紫外光谱测定
CT-DNA用前没有作进一步处理,溶液由Tris-HCl缓冲溶液配制,纯度经检测符合实验要求(A260/A280=1.82),浓度通过DNA在260 nm处的紫外吸收确定(ε=6600 L·mol-1·cm-1)[5].
1.2.1DNA滴定PBSA 为了研究PBSA与DNA相互作用的模式及强度,以DNA滴定PBSA测其紫外光谱.实验中以蒸馏水为参比,在1 cm的石英比色皿中加入3.0 mL浓度为1.0×10-5mol·L-1的PBSA溶液,在220~400 nm进行波谱扫描.然后,用微量管往样品池和参比池中同时依次加入等量的DNA缓冲溶液,充分混合,静止10 min后进行波长扫描,测定PBSA与DNA相互作用后的紫外吸收光谱.实验过程中等量的DNA缓冲溶液被加入到空白池中以扣除DNA浓度对其紫外吸收的影响.
1.2.2PBSA滴定DNA 为了研究DNA与PBSA相互作用前后结构的变化,以DNA滴定PBSA测其紫外光谱.实验中以Tris-HCl缓冲液为参比,在1 cm的石英比色皿中加入3.0 mL浓度为1.5×10-4mol·L-1的DNA溶液,在220~360 nm进行波谱扫描.然后,用微量管往样品池和参比池中同时依次加入等量的PBSA水溶液,充分混合,静止10 min后进行波长扫描,测定DNA与PBSA相互作用后的紫外吸收光谱.
1.3荧光光谱测定
以240 nm作为激发波长记录PBSA的荧光.然后往样品池中逐步加入等量的DNA,测定不同浓度的PBSA-DNA系列试样在540~630 nm波长区间内的荧光强度变化.系列试样中PBSA的浓度为8 × 10-6mol·L-1,DNA的浓度分别为: (a) 0,(b) 3.95×10-6,(c) 7.90×10-6,(d) 11.85×10-6,(e) 15.80×10-6,(f) 19.75×10-6.
2结果与讨论
2.1PBSA与DNA相互作用的模式及强度
PBSA有两个较强的紫外吸收峰,分别位于240 nm和303 nm处,由图2可知,随着DNA的加入,PBSA的紫外吸收呈现一定的减色效应,但没有出现红移或者蓝移.根据Long等[6]提出的判据, 当药物分子与DNA发生嵌插作用时, 药物分子的π轨道和DNA碱基π轨道相互耦合, 最大吸收峰发生位移且存在减色或增色效应,当药物分子与DNA发生静电作用时, 峰位置不变, 只有强度改变.由此我们判断,PBSA与DNA的作用方式主要为静电作用[7].DNA加入后,PBSA在240 nm处的紫外吸收峰减色更为明显,PBSA与DNA相互作用的键合常数根据以下公式计算[8]:
[DNA]/(εA-εF)=[DNA]/(εB-εF)+1/Kb(εB-εF),
其中[DNA]代表DNA的浓度,εA,εF和εB分别代表在各DNA浓度下的、游离的和与DNA键合饱和的PBSA的摩尔吸光系数.以240 nm处紫外吸收峰为研究对象,由[DNA]/(εA-εF)对[DNA]作图,得到斜率和截距,斜率和截距之比即为PBSA与DNA相互作用的键合常数Kb=1.30×105M-1.

图2 PBSA与DNA相互作用前后的紫外光谱Fig.2 Absorption spectra of PBSA in the absence and presence of CT-DNA
2.2PBSA对DNA构象的影响
DNA分子含有碱基生色团的双螺旋结构,在260 nm附近有一强的紫外吸收,可以根据DNA与小分子化合物相互作用前后的紫外吸收光谱的变化研究二者间的相互作用.对于DNA的吸收光谱来说,如果化合物与DNA作用后导致分子的轴向变化即其构象变化,会产生减色效应及红移现象;如果DNA双螺旋结构受到破坏,则产生增色效应.由图3可知,随着PBSA的加入,DNA在260 nm处的紫外吸收光谱没有发生明显变化,说明PBSA与DNA相互作用后对DNA的结构及构象未产生明显影响[9].

图3 DNA与PBSA相互作用前后的紫外光谱Fig.3 Absorption spectra of DNA in the absence and presence of PBSA
2.3DNA对PBSA的荧光猝灭
荧光猝灭过程可分为静态猝灭和动态猝灭.静态猝灭是猝灭剂和荧光物质分子在基态时形成复合物所引起的一种猝灭过程,动态猝灭是猝灭剂和荧光物质的激发分子之间发生碰撞失去能量,以无辐射方式回到基态的荧光猝灭过程.PBSA的最大激发和发射波长分别为240 nm和339 nm.保持PBSA的浓度为5.0×10-6mol·L-1不变,向其中不断加入DNA,PBSA的荧光峰发射峰强度逐渐减小,但峰位置未发生变化(图4),DNA对PBSA的荧光产生了明显的猝灭效应.
动态荧光猝灭遵循Stern-Volmer方程[10]:
F0/F=1+Kqτ0[ DNA]=1+Ksv[DNA],
式中Kq为双分子猝灭过程速率常数,Ksv为猝灭常数,τ0为没有猝灭剂存在下荧光分子平均寿命(生物大分子荧光寿命约为10-8s),F0和F分别为未加入和加入DNA 时PBSA的荧光强度.根据Stern-Volmer方程由F0/F-1对[DNA]作图,即可求得猝灭速率常数Kq=5.81×1012L·mol-1·s-1,远大于各类猝灭剂对生物大分子最大扩散碰撞猝灭速率常数(2.0×1010L·mol-1·s-1),因此,DNA对PBSA的荧光猝灭是形成了复合物引起的静态猝灭[12],这一实验结果与紫外光谱研究结果相吻合,即DNA与PBSA相互作用形成复合物,引起了PBSA荧光的猝灭.
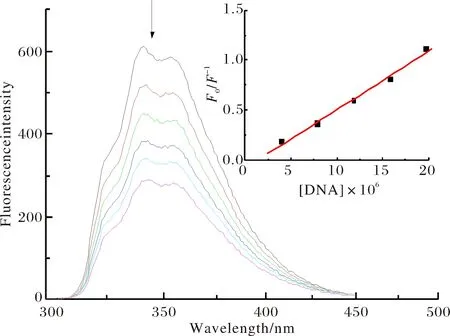
图4 DNA对PBSA的荧光猝灭Fig.4 Fluorescence change that occurs when PBSA is titrated with DNA
在静态猝灭中,静态猝灭荧光强度与猝灭剂的关系可根据以下公式推出[11]:log[(F0-F)/F]=logK+nlog[C] ,F0与F分别代表总的和游离态的PBSA的荧光强度,K为PBSA与猝灭剂DNA之间的结合常数,[C]为猝灭剂的平衡浓度,n为结合位点数.根据公式以log[(F0-F)/F]对log[C]作图(图5),可得PBSA与DNA之间的结合位点数为1.11,结合常数为1.74×105M-1.

图5 PBSA与DNA相互作用的log[(F0-F)/F]对log[C]关系图Fig.5 The plot of log[(F0-F)/F] vs log[C] of the interaction between PBSA and DNA
3小结
采用紫外光谱和荧光光谱研究了紫外线吸收剂PBSA与DNA的相互作用.紫外光谱中:DNA的加入能够使PBSA的紫外吸收呈现一定的减色效应,但没有发生位移,两者间的相互作用模式可能为静电作用;而PBSA对DNA的紫外吸收未产生明显影响,表明PBSA与DNA相互作用后不会影响DNA结构的变化.荧光猝灭实验中:DNA的加入引起了PBSA荧光的显著猝灭,其猝灭速率常数(Kq=5.81×1012L·mol-1·s-1)远大于猝灭剂对生物大分子的最大扩散碰撞猝灭速率常数,表明PBSA与DNA的相互作用为静态猝灭过程;PBSA与DNA之间的结合位点数为1.11,结合常数为1.74×105M-1.
[1] 丁著明, 刘丽湘, 周淑静. 紫外线吸收剂的研究进展[J].精细与专用化学品, 2005, 13(13):5-10.
[2] 季跃飞. 光化学及光催化降解水溶液中药物及个人护理品:阿替洛尔和2-苯基苯并咪唑-5-磺酸[D].南京:南京大学, 2014.
[3] 张思玉. 基于DFT计算预测2-苯基苯并咪唑-5-磺酸和对氨基苯甲酸的水环境光化学行为[D]. 大连:大连理工大学, 2012.
[4] 刘 炜, 刘 红. 荭草苷与DNA相互作用的机理研究[J].华中师范大学学报(自然科学版), 2014, 48(4):528-531.
[5] MARMUR J.A procedure for the isolation of deoxyribonucleic acid from microorganisms [J].J Mol Biol, 1961, 3:208-218.
[6] LONG E C, ABSALON M J, STUBBE J. Mechanism of light-induced DNA strand scission by RH(phen)2PHI3+: cleavage mediated by C3’-H abstraction[J]. J Inorg Biochem, 1991, 43(2-3): 436.
[7] 马 立, 易小艺, 张寿春. 双吡啶吡咯配合物与DNA相互作用研究[J].华中师范大学学报(自然科学版), 2016, 50(4):551-558.
[8] WOLFE A,SHIMER G H,MEEHAN T.Polycyclic aromatic hydrocarbons physically intercalate into duplex regions of denatured DNA [J].Biochemistry, 1987, 26:6392-6396.
[9] 高 婷, 张万举, 王 芳. 紫外光谱在研究金属配合物与DNA相互作用中的应用[J].广州化工, 2010, 38(5): 23-25.
[10] LAKOWICZ J R. Principles of Fluorescence Spectroscopy[M]. New York: Plenum Press, 2006:277-285.
[11] 王晓霞, 敖登高娃, 阿 娟. 荧光猝灭法研究氟比洛芬与DNA相互作用[J].分析科学学报, 2009, 25(6):702-704.
[12] XIE M X, LONG M, LIU Y. Characterization of the interaction between human serum albumin and morin [J]. Biochim Biophys Acta, 2006, 1760: 1184-1191.
Study on the interaction of ultraviolet absorbent PBSA with DNA by spectroscopic method
CHEN Yanmei, YANG Han, WANG Fang, XIONG Xujie, ZHANG Wanju
(Hubei Key Laboratory for Processing and Application of Catalytic Materials,Huanggang Normal University, Huanggang, Hubei 438000)
The interaction of ultraviolet absorbent 2-phenyl benzimidazol-5-sulfonic acid (PBSA) and DNA in physiological condition was investigated by fluorescence spectrometry and UV absorption spectrophotometry. The results showed that PBSA interacted with DNA in an electrostatic interaction mode, which resulted in the hypochromic effect as well as fluorescence quenching of PBSA. The combination reaction of them was a single static quenching process, and the binding site was 1.11.
2-phenyl benzimidazol-5-sulfonic acid (PBSA); DNA-binding; spectroscopic method
2016-12-27.
湖北省自然科学基金项目(2016CFB147).
1000-1190(2017)03-0324-04
O626.2
A
*通讯联系人. E-mail: wz@hgnu.edu.cn.

