胃癌患者围手术早期应用免疫增强型肠内营养制剂的临床观察
沈 健
胃癌患者围手术早期应用免疫增强型肠内营养制剂的临床观察
沈 健
目的 探讨围手术早期应用免疫增强型肠内营养制剂对胃癌患者营养状况、炎性反应和免疫功能的影响。方法 选择行胃癌切除术的患者78例作为研究对象。按照随机数字法将入选患者分为观察组和对照组各39例。观察组于术后第1~8 d使用免疫增强型肠内营养制剂瑞能(华瑞公司),对照组使用常规肠内营养制剂瑞素(华瑞公司)。结果 治疗后,观察组患者PA和TRF水平观察组较对照组显著升高,差异有统计学意义(P<0.05);血清IgM、IgG和IgA水平观察组显著高于对照组,差异有统计学意义(P<0.05)。观察组患者CD3和CD4细胞比例较对照组均显著升高,差异有统计学意义(P<0.05);CD8细胞比例较对照组有所下降,但是差异无统计学意义(P>0.05)。观察组TNF-α和IL-6水平显著低于对照组,差异有统计学意义(P<0.05);两组患者IL-2水平比较无统计学意义。结论 胃癌患者围手术早期应用免疫增强型肠内营养制剂能显著改善患者营养状况,降低术后炎性反应,提高患者免疫力,有利于患者术后的康复,值得临床推广使用。
胃癌;早期;免疫增强型肠内营养制剂;炎性反应;免疫功能
(ThePracticalJournalofCancer,2017,32:428~431)
胃癌是常见的消化道恶性肿瘤之一,常伴有营养不良状况的发生,手术创伤可以导致患者免疫功能的降低,加重营养不良的程度,同时手术的应激反应可导致全身炎症反应,影响患者预后。术后早期肠内营养支持可以调节机体能量代谢,增强免疫力,纠正手术创伤导致的免疫抑制,具重要意义[1]。近年来,研究发现添加谷氨酰胺、精氨酸、ω-3多不饱和脂肪酸、核苷酸等营养成分的增强型肠内营养制剂可进一步改善机体的免疫功能和营养状况,减少术后感染等并发症[2]。为探讨免疫营养在肿瘤患者营养支持上的作用,本实验以胃癌手术患者为对象,应用含特殊营养物质的免疫增强型肠内营养制剂对胃癌根治术后患者进行营养支持,以了解免疫营养对恶性肿瘤患者营养、免疫功能的影响,为临床上免疫营养的使用提供依据。
1 资料与方法
1.1 研究对象
选择2012年12月至2015年12月我院行胃癌根治术的患者78例作为研究对象。按照随机数字法将入选患者分为观察组和对照组各39例。排除内分泌、代谢性疾病患者,免疫性疾病患者,严重心、肺、肝、肾功能不全患者。本研究获得本院伦理委员会的同意,所有患者均签署知情同意书。观察组男性25例,女性14例;年龄39~69岁,平均(52.3±4.5)岁;行全胃切除术9例,近端胃切除术15例,远端胃切除术15例。对照组男性29例,女性10例;年龄42~75岁,平均(52.3±4.5)岁;行全胃切除术12例,近端胃切除术17例,远端胃切除术10例。两组患者在性别组成比、年龄、手术方式方面无显著差异(P>0.05),具有可比性。两组全部按计划完成营养支持,无死亡病例。所有患者行术后营养支持期间肝肾功能等血生化指标均在正常范围之内。
1.2 研究方法
所有患者于术后第1~8天给予肠内营养支持,维持125.5 kJ/(kg·d)热量,0.2g/(kg·d)的氮摄入量。肠内营养喂养途径为经术中安置的鼻空肠营养管。术后第1 d由肠内营养制剂提供25%热量,然后每天增加25%,以周围静脉补给不足的热量,第4 d起100%由肠内营养制剂提供,采用持续重力法滴注或使用输液泵,初始速度为20 ml/h,逐日增加30 ml/h,最大速度维持在100 ml/h,可根据患者自身情况调整滴速或给予加温。观察组使用免疫增强型肠内营养制剂瑞能(华瑞公司),对照组使用常规肠内营养制剂瑞素(华瑞公司),同时添加大豆蛋白粉补充氮源。
1.3 检测指标
所有患者于术前、术后第8 d清晨空腹抽取静脉血5 ml,检测血清白蛋白(albumin,ALB)、前白蛋白(prealbumin,PA)和转铁蛋白(transferrin,TRF);免疫散射比浊法测定外周血免疫球蛋白IgM、IgG和IgA;流式细胞仪测定T细胞亚群CD3、CD4和CD8;放射免疫分析法检测血清肿瘤坏死因子α(TNF-α)、白细胞介素-2(IL-2)和白细胞介素-6(IL-6)水平。
1.4 统计学分析
所得数据应用SPSS 17.0统计软件进行统计分析,计数资料以率表示并进行χ2检验,计量资料以均数±标准差表示并进行t检验,P<0.05表示差异有统计学意义。
2 结果
2.1 两组患者血清ALB、PA和TRF水平比较
术前两组患者ALB、PA和TRF水平比较差异无统计学意义(P>0.05),治疗后观察组患者PA和TRF水平较对照组显著升高,差异有统计学意义(P<0.05),见表1。
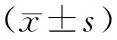
表1 两组患者血清ALB、PA和TRF水平比较
2.2 两组患者血清IgM、IgG和IgA水平比较
术前,两组患者血清IgM、IgG和IgA水平比较差异无统计学意义(P>0.05)。治疗后,观察组血清IgM、IgG和IgA水平显著高于对照组,差异有统计学意义(P<0.05),见表2。

表2 两组患者血清IgM、IgG和IgA水平比较
2.3 两组患者CD3、CD4和CD8细胞比例比较
术前,两组患者CD3、CD4和CD8细胞的比例差异无统计学意义(P>0.05)。治疗后,观察组患者CD3和CD4细胞的比例较对照组均显著升高,差异有统计学意义(P<0.05);CD8细胞的比例较对照组有所下降,但是差异无统计学意义(P>0.05),见表3。
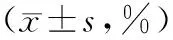
表3 两组患者CD3、CD4和CD8细胞比例比较
2.4 两组患者血清TNF-α、IL-2和IL-6水平比较
术前,两组患者血清TNF-α、IL-2和IL-6水平差异无统计学意义(P>0.05)。治疗后,观察组TNF-α和IL-6水平显著低于对照组,差异有统计学意义(P<0.05);两组患者IL-2水平差异无统计学意义。见表4。
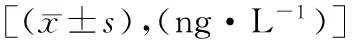
表4 两组患者血清TNF-α、IL-2和IL-6水平比较
3 讨论
胃癌是消化道常见恶性肿瘤,多见于中老年男性,但是近年来,胃癌出现了年轻化的趋势,与不良生活习惯和环境污染等因素有关。胃癌患者常会伴随着营养不良,甚至出现恶病质,体重持续下降的情况[3]。手术切除是治疗胃癌的有效手段,但是营养不良患者一些功能蛋白的缺失将导致机体对治疗的耐受性下降,甚至无法完成既定的治疗计划,严重影响患者的治疗效果及生活质量,加之手术对机体的损伤,会进一步造成免疫功能的抑制,炎性反应的增强,术后并发症发生率升高。胃癌患者术后需要长时间禁食,因此,术后给予合理的营养支持,对患者术后的恢复有积极作用。肠内营养制剂已广泛应用于恶性肿瘤患者,临床疗效显示其可以改善患者营养不良的状况。肠内营养制剂刺激肠道正常的内分泌系统,促进胃肠黏膜生长,保护肠粘膜,维持肠道正常的免疫功能,减少感染的发生,利于患者术后恢复[4]。但是常规的肠内营养制剂对于术后的应激反应和免疫功能抑制并未呈现出较好的治疗效果。
近年来,添加谷氨酰胺、精氨酸、ω-3多不饱和脂肪酸、核苷酸等营养成分的增强型肠内营养制剂被用于消化道肿瘤患者术后的营养支持。研究发现增强型肠内营养制剂具有进一步改善机体的免疫功能和营养状况,减少术后感染等并发症的优势。郑建勇等对全胃切除患者应用免疫增强型肠内营养制剂,结果显示胃癌根治性全胃切除患者术后早期免疫增强型肠内营养支持可有效改善患者的免疫功能,并减轻机体的炎症反应[5]。周荣等[6]将免疫增强型肠内营养制剂用于老年胃癌术后化疗的患者,结果显示治疗后患者血浆免疫球蛋白明显升高,CD3、CD4细胞比例显著优于对照组,而且患者的住院天数,排便时间等明显缩短,认为胃癌术后化疗通过免疫增强型肠内营养制剂能够显著改善免疫功能,缩短患者的住院时间。
本研究将免疫增强型肠内营养制剂用于胃癌患者围手术期早期,结果显示,治疗第8天后,患者的PA和TRF水平明显高于常规肠内营养制剂组患者,可见免疫增强型肠内营养制剂的应用可以显著改善术后患者的营养情况。对于术后免疫功能抑制的改善情况显示,免疫增强型肠内营养制剂治疗的患者CD3和CD4比例显著增高,CD8的水平略有下降,提示早期免疫增强型肠内营养制剂可有效改善胃癌患者术后的免疫功能,可能与其含有的谷氨酰胺、精氨酸、ω-3多不饱和脂肪酸、核苷酸等营养增强剂有关。当人体处于疾病或代谢应激时,造成谷氨酰胺、精氨酸的缺乏,机体免疫功能下降,某些代谢反应受阻。而精氨酸可以刺激T细胞增殖,提高细胞免疫功能[7]。谷氨酰胺是肠道内参与免疫反应细胞重要的能量来源,提高肠道分泌型免疫球蛋白的水平,维持肠道上皮的完整性,防止肠黏膜萎缩,减少细菌易位[8]。本研究中应用免疫增强型肠内营养制剂组患者血浆IgM、IgG和IgA免疫球蛋白的水平显著高于常规肠内营养制剂组患者。ω-3多不饱和脂肪酸能影响花生四烯酸代谢,有效的调理免疫功能,减轻机体炎症反应[9]。
另外,本研究中使用免疫增强型肠内营养制剂组患者的血清炎性因子IL-6和TNF-α水平在治疗8 d后也显著低于常规肠内营养制剂组患者。TNF-α和IL-6是机体应激反应时重要的炎性因子,其水平的下降可反映机体应激反应程度的减轻或感染并发症的改善,可见免疫增强型肠内营养制剂能有效减轻术后患者应激反应和感染并发症。
综上所述,胃癌患者围手术早期应用免疫增强型肠内营养制剂能显著改善患者营养状况,降低术后炎性反应,提高患者免疫力,有利于患者术后的康复,值得临床推广使用。
[1] Tremaroli V,Karlsson F,Werling M,et al.Roux-en-Y gastric by-pass and vertical banded gastroplasty induce long-term changeson the human gut microbiome contributing to fat mass regulation〔J〕.Cell Metab,2015,22(2):228-238.
[2] 曹节勤,石海燕,刘文瑞,等.免疫增强型肠内营养制剂在胃癌术后病人辅助化疗中的作用〔J〕.肠外与肠内营养,2015,22(1):20-22.
[3] 江志伟,李 宁,刘福坤,等.肠内免疫营养对胃癌手术病人免疫功能和急性炎症反应的调理作用〔J〕.肠外与肠内营养,2000,7(4):202-203.
[4] Braga M,Gianotti L,Gentilini 0,et al.EarIy postoperative enteral nutrition improves gut oxygenation and reduces costs compared with totaI parenteral nutrition〔J〕.Crit Care Med,2001,29(2):242-248.
[5] 郑建勇,王为忠,管文贤,等.全胃切除患者术后早期免疫增强型肠内营养的作用〔J〕.第四军医大学学报,2005,26(18):1688-1690.
[6] 周 荣,林懿丹,谭志琴.免疫增强型肠内营养制剂对老年胃癌术后化疗免疫功能的影响分析〔J〕.中华普通外科学文献(电子版):2015,9(6):467-470.
[7] Flynn NE,Meininger CJ,Haynes TE,et al.The metabolic basis of argine nutrition and pharmacotherapy〔J〕.Biomed Pharmacother,2002,56(9):427-438.
[8] Kelly D,Wischmeyer PE.Role of L-glutamine in criticaI illness:New insights〔J〕.Curr Opin Clin Nutr Metab Care,2003,6(2):217-222.
[9] Calder PC,Grimble RF.Polyunsaturated fatty acids,inflammation and immunity〔J〕.Eur Clin Nutr,2002,56(SuppI 3):S14-S19.
(编辑:吴小红)
Clinical Observation of Early Application of Immune Enhanced Enteral Nutrition inPatients with Gastric Cancer
SHEN Jian.
The Second People's Hospital of Chengdu,Chengdu,610017
Objective To investigate the effect of immune enhanced enteral nutrition on nutritional status,inflammatory response and immune function in patients with gastric cancer during perioperative period.Methods 78 patients with gastric cancer resection were selected as the study subjects.The patients were divided into the observation group and the control group according to random number method.In the observation group,the immune-enhanced enteral nutrition preparation was used at the 1st to 8th day after operation,while the control group was treated with conventional enteral nutrition preparation Ruisu (Huarui).Results After treatment,the levels of PA and TRF in the observation group were significantly higher than those in the control group (P<0.05).The serum levels of IgM,IgG and IgA were significantly higher in the observation group than those in the control group (P<0.05).The percentage of CD3 and CD4 cells in the observation group was significantly higher than that in the control group (P<0.05),but the difference was not significant (P>0.05).The levels of TNF-α and IL-6 in the observation group were significantly lower than those in the control group (P<0.05).There was no significant difference between the 2 groups.Conclusion For gastric cancer patients during perioperation,early application of immune enhanced enteral nutrition can significantly improve the nutritional status of the patients,reduce the postoperative inflammatory reaction,improve the immunity of patients,conducive to rehabilitation of patients after operation,it is worthy of clinical application.
Gastric cancer;Early;Immune enhanced enteral nutrition;Inflammatory response;Immune function
610017 四川省成都市第二人民医院
10.3969/j.issn.1001-5930.2017.03.024
R735.2
A
1001-5930(2017)03-0428-04
2016-06-07
2017-01-12)

