贝伐单抗在中低位直肠癌新辅助治疗中的有效性及安全性观察
江时建,朱代华
(1.福建医科大学附属闽东医院肿瘤外科,福建 福安 355000;2.重庆医科大学附属第二医院胃肠外科,重庆 400010)
近年来,结直肠癌不仅发病率逐年增高,而且呈现出年轻化的趋势[1-2],以氟脲嘧啶为基础的新辅助放化疗提高了中低位局部进展期直肠癌的根治性手术切除率及保肛率,但其病理完全缓解(pathological complete remission,pCR)率及降期率仍然较低。贝伐单抗抑制肿瘤血管生成的同时还可以使已形成的肿瘤血管正常化,降低肿瘤组织血管的通透性增加化疗药物在肿瘤组织中的浓度,起到与化疗协同的作用。NO16966,ATIST,AVF2017,E3200等多个多中心研究均证实了贝伐单抗在治疗晚期结直肠癌中的作用。另外,抗血管生成作用可能增加肿瘤对放疗的敏感性,加速肿瘤细胞的坏死与凋亡[3-5],本研究收集相关病例,探讨贝伐单抗在低位直肠癌新辅助治疗中的有效性及安全性。
1 资料与方法
1.1 一般资料
收集重庆医科大学附属第二医院胃肠肛肠外科自2010-11—2016-07间中低位局部进展期直肠癌行贝伐单抗联合以FOLFOX方案新辅助放化疗患者为观察组,选同一时期行FOLFOX方案新辅助放化疗患者为对照组。入选标准:(1)根据美国癌症协会(AJCC)的第7版TNM分期标准,术前分期为II期及III期中低位直肠腺癌;(2)开腹手术;(3)自愿签署术前新辅助放化疗知情同意书。排除标准:(1)年龄>65岁;(2)完全性肠梗阻;(3)原发灶巨大溃疡;(4)药物无法控制的严重高血压;(5)有活动性出血或出血倾向及具有先天性出血素质或获得性凝血病;(6)有心脑血管栓塞及动静脉血栓病史者;(7)肝肾功能不全者;(8)过度肥胖,体重指数(BMI)>30,严重营养不良(BMI)<15者;(9)1型或2型糖尿病血糖控制不满意(空腹血糖>10 mmol/L);(10)过敏体质或对多种药物(2种以上)有过敏史者。
搜集到符合上述条件患者共56例,其中观察组共25例,其中男性患者17例,女性患者8例,最小年龄33岁,最大年龄65岁。观察组共31例,其中男性患者21例,女性患者10例,最小年龄34岁,最大年龄65岁。观察组术前临床病理分期Ⅱ期患者有6例(T3N0M0 4例、T4N0M0 2例),Ⅲ期有19例(T2N1M0 1例、T3N1M0 7例、T3N2M0 2例、T4N1M0 5例、T4N2M0 4例)。对照组术前临床分期II期有9例(T3N0M0 7例、T4N0M0 2例),Ⅲ期22例(T2N1M0 1例、T3N1M0 8例、T3N2M0 3例、T4N1M0 7例、T4N2M0 4例)。两组在性别比、低位直肠癌比例、术前临床分期等方面差异均无统计学意义(P>0.05)。见表1。
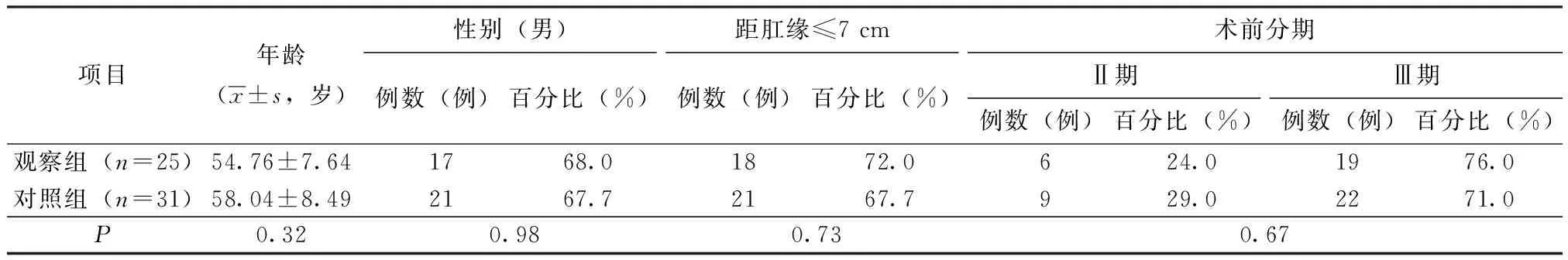
表1 一般资料情况
1.2 方法
1.2.1 新辅助放化疗:观察组患者采用贝伐单抗联合FOLFOX方案,具体如下:贝伐单抗5 mg/kg,首次输注时间不小于90 min。奥沙利铂(130 mg/m2),替加氟(3.0 g/m2),亚叶酸钙(200 mg/m2)计算出总量。其中将奥沙利铂100 mg及替加氟注射液1.0 g在介入下经超选插管至直肠上动脉实施直肠肿瘤滋养动脉局部灌注化疗(时间约5min) 。见图1、图2 。
新辅助放疗方案:化疗结束后约两周行盆腔三维适形放疗。采取长程分次放疗,总剂量均为40 Gy,均分为20次,4周完成。另外,放疗同时行口服卡培他滨(850 mg/m2),放化疗期间注意观察胃肠道毒副反应、检测血常规、肝肾功能、血压监测等。
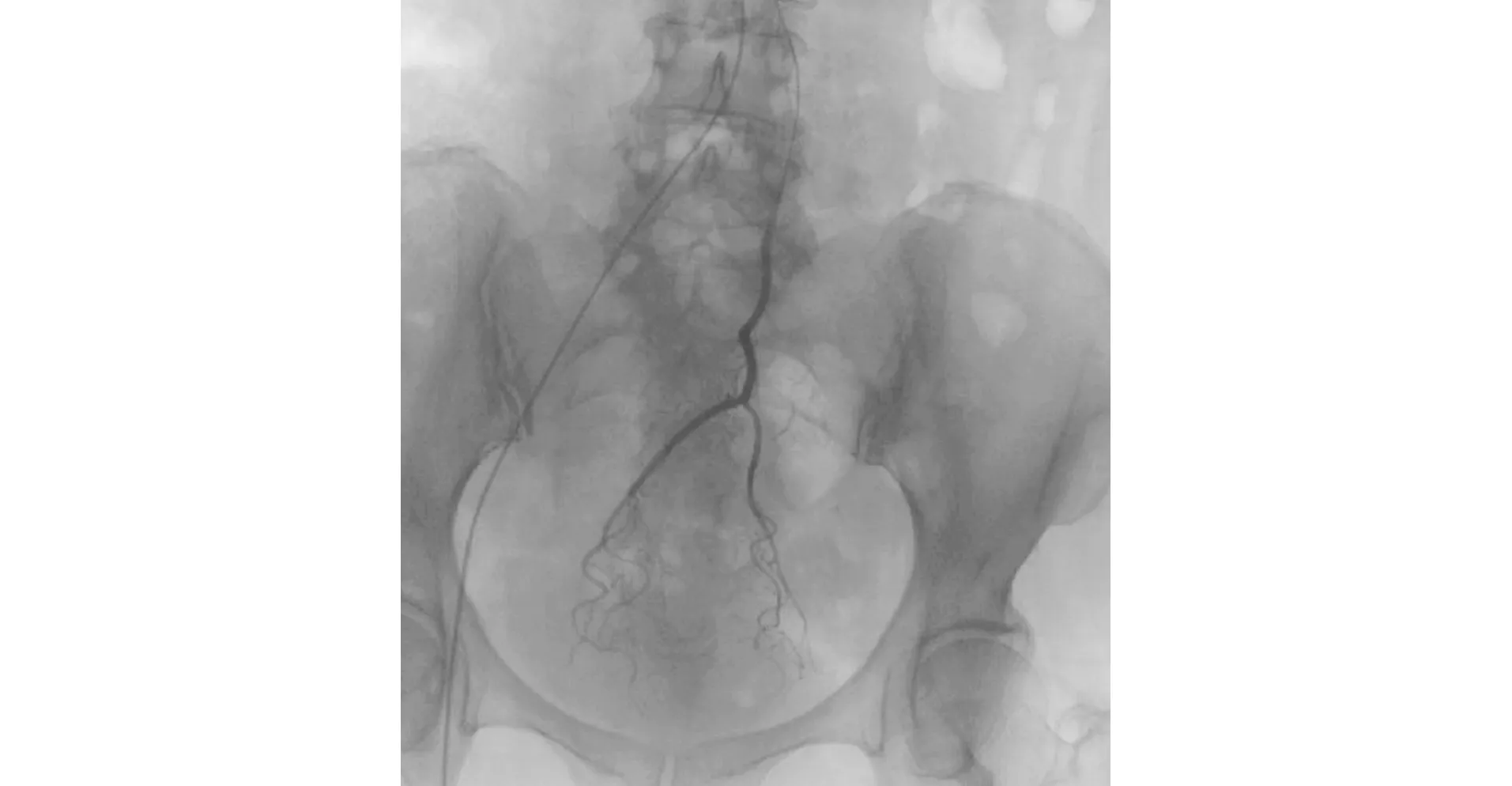
图1 肠系膜下动脉造影注:4F Yashiro 导管经右侧腹股沟动脉插管致肠系膜下动脉行肠系膜下动脉造影

图2 微插至直肠上动脉远端注:2.7F微导管选择性插至肠系膜动脉远端。患者回病房后,输注贝伐单抗及剩余剂量的化疗药物,对照组无贝伐单抗,余同上。
1.2.2 术前评估及术前准备:所有患者在放疗结束后4周左右回院,行新辅助放化疗疗效评估,判断肿瘤有无进展、新辅助放化疗后分期,完善血常规、肝肾功能等术前检查及准备。
1.2.3 手术治疗:所有患者在排除手术禁忌,且行充分术前准备后由高级职称医师主刀,严格按照TME标准实施开腹手术,根据术中动脉血气分析估算术中失血量。留置骶前引流管一根,主要观察术后出血。
1.2.4 手术标本处理:术后病理标本均送我院病理科,均需按规范多处取材,常规甲醛固定,石蜡包埋,HE染色等处理,并且行免疫组化判定肿瘤组织的来源及分类。
1.2.5 术后观察:主要观察骶前引流管量,有无吻合口漏、术后患者的理论出院时间等。其中术后理论出院时间标准为:(1)患者经口进食能满足自身能量需求,而不需静脉营养支持治疗;(2)无吻合口瘘、伤口及肺部感染等主要手术并发症;(3)体温正常3 d以上;(4)血常规、肝功、生化等实验室检查指标正常或存在异常而无需继续住院治疗;(5)患者无明显不适。
2 结果
2.1 有效性结果
两组患者经新辅助放化疗后评估均无疾病进展病例,均达到直肠癌根治性切除,根治性切除率均达100%,无死亡病例。观察组有4例达到完全病例缓解,对照组5例。完全病理缓解患者的病理标本病理检查见肿瘤周围组织不同程度纤维组织增生肿瘤、细胞变性、组织坏死,甚至空洞形成,见图3与图4,图3是新辅助放化疗治疗前肠镜检查取活组织病理检查结图;图4为该患者经贝伐单抗治疗后手术后标本病理图。完全病例缓解率、总降期率、低位直肠癌保肛率等具体情况见表2。
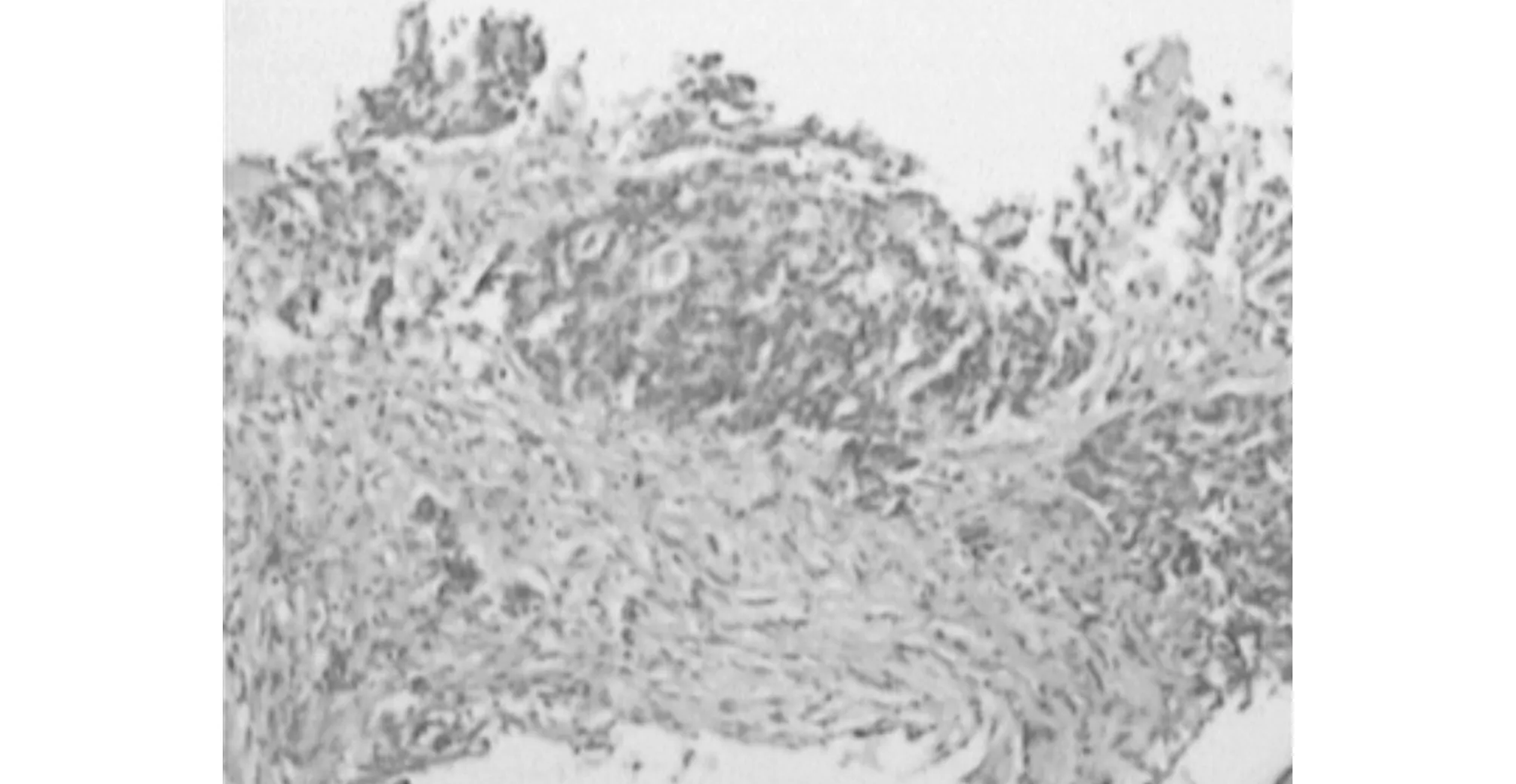
图3 新辅助治疗前的活组织病理检查
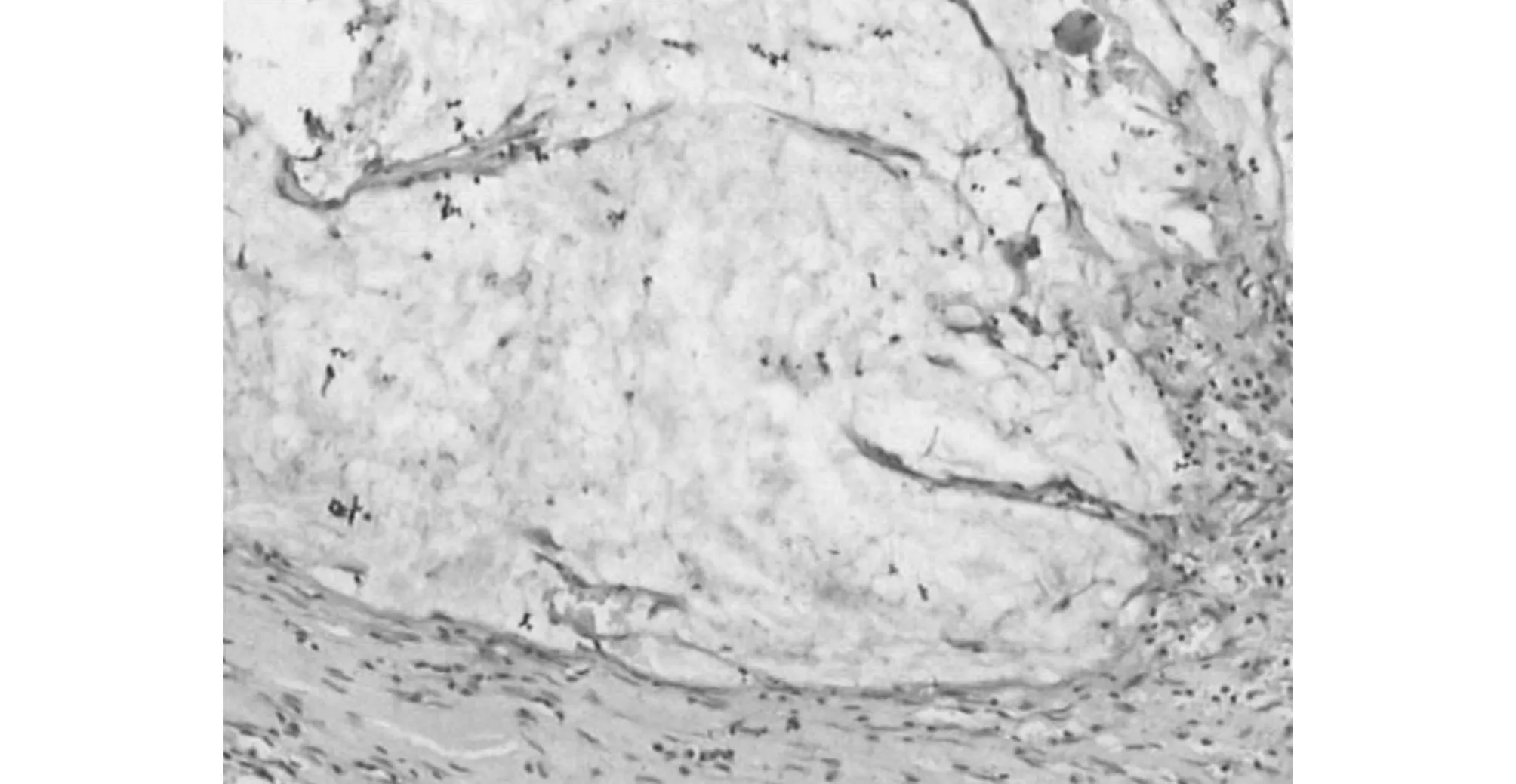
图4 含贝伐单抗新辅助治疗后标本病
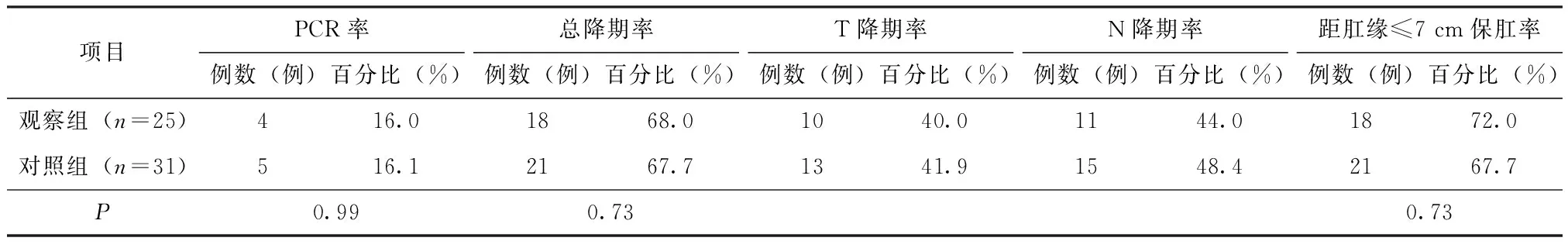
项目PCR率例数(例)百分比(%)总降期率例数(例)百分比(%)T降期率例数(例)百分比(%)N降期率例数(例)百分比(%)距肛缘≤7 cm保肛率例数(例)百分比(%)观察组(n=25)416.01868.01040.01144.01872.0对照组(n=31) 516.1 2167.7 1341.91548.4 2167.7 P0.990.730.73
2.3 常见不良反应
采用美国国立癌症研究院2009年颁布的4.0版通常见毒性标准(Nation Cancer Institute Common Toxicity Criteria 4.0,NCT-CTC 4.0),对新辅助放化疗治疗中出现的常见不良反应进行评估。两组患者放化疗期间主要不良反应为胃肠道及白细胞减少,未发生IV级不良反应,未出现消化道穿孔、输液反应、动静脉血栓及可逆性后脑部病综合征,观察组的高血压发生率高于对照组(44%:10%,P=0.03),差异有统计学意义,其他常见放化疗不良反应及围手术期的主要并发症差异无统计学意义(P>0.05)。见表3。
2.4 围手术期安全性
两组患者手术中、术后均未发生大出血,无围手术期死亡的发生。观察组术后出现1例吻合口瘘,对照组吻合口瘘2例,3例患者因症状及体征较轻,非手术治疗后痊愈。两组患者在手术时间、术中出血量、术后骶前引流量,术后理论出院时间等数据分析上均无统计学意义,见表4。
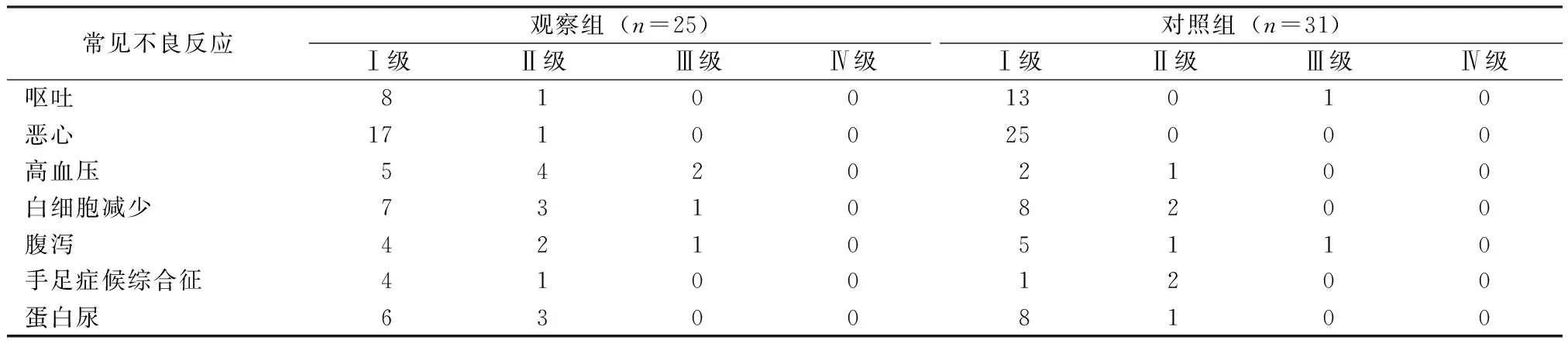
表3 常见不良反应 例

表4 两组手术情况及围手术期并发症情况±s)
3 讨论
直肠癌发病率居大肠癌首位,消化系统恶性肿瘤第二位。我国患者就诊时肿瘤多处于进展期,严重威胁人类的健康。虽然随着TME手术方式应用,吻合器械的改善及术前以氟尿嘧啶为基础的辅助放化疗一定程度上提高了低位直肠癌的保肛率[6-7]。
新辅助放化疗治疗在中低位进展期直肠癌的疗效中得到肯定,然而病理完全缓解率及降期率仍不高。自贝伐单抗在治疗转移性结直肠癌取得了较好的治疗效果后,其治疗范围扩展到实体肿瘤。Velenik等[8]人进行的一项贝伐单抗联合卡培他滨的术前新辅助放化疗中的病理完全缓解率为13.3%,T、N 和总的降期率为46.7%、65%和75%。Dipetrillo T等[9]人进行的一项25例患者行贝伐单抗联合奥沙利铂及氟尿嘧啶的术前新辅助放化疗研究,其病理完全缓解率为20%。然而,STAR-01[10]、NSABP R-04[11]及ACCORD[12]研究显示病理完全缓解率并未得到明显的提高。
本研究主要通过对比分析贝伐单抗能否提高新辅助放化疗的病理完全缓解率、病理降期率及低位直肠癌的保肛率,但本研究中有效性指标均未体现出统计学意义,这可能与术前行直肠上动脉栓塞后局部血流减少,影响了局部药物浓度有关。且由于样本量少,不能全面评价。此外,贝伐单抗的远期作用,如局部复发率、术后远处转移率以及5年生存期尚在观察统计中。
本研究中观察到贝伐单抗组发生高血压患者明显高于对照组差异有统计学意义,然而未出现IV级高血压,贝伐单抗导致高血压具体机制尚不明确。贝伐单抗未增加常见不良反应的发生率及严重程度,未增加手术出血量、吻合口瘘等发生率,显示出了其具有较高的安全性。
然而,本研究为小样本研究,仅依据病理完全缓解率、病理降期率及低位直肠癌的保肛率可能难以全面评估贝伐单抗的近期疗效,且缺乏对贝伐单抗的远期疗效的观察,论证可能存在偏倚,尚需包括远期疗效评价标准、大样本量、随机对照的临床研究进一步证实。
[1] FITZGERALD T L,LEA C S,BRINKLEY J,etal.Colorectal cancer outcome inequalities:association between population density,race,and socioeconomic status[J].Rural Remote Health,2014,14:2668.
[2] GIARDIELLO F M,ALLEN J I,AXILBUND J E,etal.Guidenlines on genetic evaluation and management of lynch syndrome:a consensus statement by the US multi-society task force on colorectal cancer[J].Gastroenterology,2014,147:502-506.
[3] SAUER R,FIETKAU R,WITTEKIND C,etal.Adjuvant vs.Neoadjuvant radiochemotherapy for locally advanced rectal cancer:the German trialCAO/ARO/AIO-94[J].Colorectal Dis,2003,5(5):406-415.
[4] SAUER R,BECKER H,HOHENBERGER W,etal.German Rectal Cancer Study Group,Preoperative versus postoperative chemoradiotherapy for rectal cancer[J].N Engl J Med,2004,351(17):1731-1740.
[5] HOFHEINZ R D,WENZ F,POST S,etal.Chemoradiotherapy with capecitabine versus fluorouracil for locally advanced rectal cancer:a randomised,multicentre,non-inferiority,phase 3 trial[J].Lancet Oncol,2012,13(6):579-588.
[6] LEE C G,HEIJN M,DI TOMASO E,etal.Anti-vascular endothelial growth factor treatment augments tumor radiation response under normoxic or hypoxic conditions[J].Cancer Res,2000,60(19):5565-5570.
[7] 杨建伟,林锦源,高炜,等.雷替曲塞/贝伐单抗联合伊立替康或奥沙利铂方案治疗晚期结直肠癌的临床观察[J].2013,18(1):70-73.
[8] WILLETT C G,BOUCHER Y,DUDA D G,etal.Surrogate markers for antiangiogenic therapy and dose-limiting toxicities for bevacizumab with radiation and chemotherapy:continued experience of a phase I trial in rectal cancer patients[J].J Clin Oncol,2005,23(31):8136-8139.
[9] CRANE C H,ENG C,FEGI B W,etal.Phase II trial of neoadjuvant bevacizumab,capecitabine,and radiotherapy for locally advanced rectal cancer[J].Int J Radiat Oncol Biol Phys,2010,76(3):824-830.
[10] RÖDEL C,LIERSCH T,BECKER H,etal.Preoperative chemoradiotherapy and postoperative chemotherapy with fluorouracil and oxaliplatin versus fluorouracil alone in locally advanced rectal cancer:initial results of the German CAO/ARO/AIO-04 randomised phase 3 trial[J].Lancet Oncol,2012,13(7):679-687.
[11] ASCHELE C,CIONINI L,LONARDI S,etal.Primary tumor response to preoperative chemoradiation with or without oxaliplatin in locally advanced rectal cancer:pathologic results of the STAR-01 randomized phase III trial[J].Clin Oncol,2011,29(20):2773-2780.
[12] ROH M S,YOTHERS G A,O’CONNELL M J,etal.The impact of capecitabine and oxaliplatin in the preoperative multimodality treatment in patients with carcinoma of the rectum:NSABP R-04 [J].Clin Oncol,2011,29:3503.

