豆油部分或全部替代饲料中鱼油对中华条颈龟肠道形态及菌群结构的影响
丁 利 李江月 薛 珊 史海涛,2 洪美玲*
(1.海南师范大学生命科学学院,海口571158;2.中国科学院成都生物研究所,成都610041)
豆油部分或全部替代饲料中鱼油对中华条颈龟肠道形态及菌群结构的影响
丁 利1李江月1薛 珊1史海涛1,2洪美玲1*
(1.海南师范大学生命科学学院,海口571158;2.中国科学院成都生物研究所,成都610041)
本试验通过组织学染色及16S rRNA V3~V4区测序研究豆油部分或全部替代饲料中鱼油对中华条颈龟(Mauremyssinensis)肠道形态及菌群结构的影响。选取中华条颈龟雌龟[4龄,平均体重(1 557±307) g]24只,随机分为4组,每组6只。Ⅰ组(对照组)饲喂含1%鱼油的配合饲料(全鱼油饲料,豆油与鱼油的比例为0∶3),3个试验组分别饲喂用豆油替代全鱼油饲料中33%(Ⅱ组,豆油与鱼油的比例为1∶2)、67%(Ⅲ组,豆油与鱼油的比例为2∶1)和100%(Ⅳ组,豆油与鱼油的比例为3∶0)鱼油的饲料。每周喂食2次,试验期为10个月。结果表明:1)Ⅰ和Ⅲ组十二指肠绒毛长/隐窝深度(VH/CD)显著高于Ⅱ和Ⅳ组(P<0.05)。2)根据序列相似性97%水平划分,Ⅰ、Ⅱ、Ⅲ和Ⅳ组操作分类单元(OTU)总数分别为396、321、347和331个,特有OTU个数分别为43、3、4和5个,分别被鉴定出139、117、128、120个属。十二肠道优势菌门主要包含拟杆菌门(Bacteroidetes)、厚壁杆菌门(Firmicutes)、梭杆菌门(Fusobacteria)和变形菌门(Proteobacteria)4个门。Ⅱ、Ⅲ和Ⅳ组梭杆菌门和变形菌门所占比例增加,拟杆菌门和厚壁菌门所占比例下降,Ⅲ组厚壁杆菌门和拟杆菌门所占比例与Ⅰ组差距最小。细菌Ace指数和香农指数表现为Ⅰ组最高,其次是Ⅲ和Ⅳ组,Ⅱ组最小;细菌辛普森指数表现为Ⅱ组最大,其次是Ⅲ和Ⅳ组,Ⅰ组最小。由此得出,饲喂用豆油替代67%鱼油的饲料的中华条颈龟的肠道细胞发育成熟度以及菌群结构与饲喂全鱼油饲料的中华条颈龟相近。
中华条颈龟;鱼油替代;肠道形态;肠道菌群结构
20世纪以来,随着分子生物学技术及测序技术的迅猛发展,肠道微生物作为机体重要的“功能器官”逐渐进入科学家的视线,这些微生物的存在与宿主免疫、营养以及其他生命活动紧密相关,其复杂度也远远超过了人们的想象。因此,很多国家相继启动了肠道微生物组计划,2006年美国基因组研究所首次对肠道微生物的基因功能进行了研究,发现肠道微生物基因组中富含参与碳水化合物、氨基酸、胆固醇等营养物质代谢的基因,其中大部分都是人体自身不具备的[1];2008年欧盟联合国际顶尖科研团队及中国华大基因公司启动“人类肠道宏基因组计划”(MetaHIT)[2]。而有“活化石”之称的龟鳖类动物的肠道微生物群落结构则少有报道,目前的研究仅集中在红耳龟的肠道微生物群群结构形态上[3-4]。
肠道菌群经长期进化与宿主形成了相对稳定的共生体系,但饲粮等环境因素能够改变肠道菌群组成及其代谢活性,进而影响机体对营养物质的消化吸收。研究表明,高脂饮食(饲粮)使肠道菌群组成和细菌丰度发生很大变化,导致肠道微生态失调[5-7]。饲喂高脂饲粮的大鼠,其肠道菌群中拟杆菌门(Bacteroidetes)所占比例减少,而厚壁菌门(Firmicutes)和变形菌门(Proteobacteria)所占比例增加[8]。饲粮中多不饱和脂肪酸(PUFAs)含量不同亦能显著影响凡纳滨对虾[9](Litopenaeusvannamei)、山麻鸭[10](Anasplatyrhynchos)等肠道菌群的组成,而肠道菌群与肠道上皮细胞之间的相互作用将导致肠道形态和功能的改变[11]。
龟类养殖作为水产养殖的新兴产业,其饲料配方的脂肪来源仍以鱼油为主。但当前鱼油资源日益短缺,产量已远远跟不上需求,加上鱼油具有极易被氧化而不利于长期保存等缺点[12],使得廉价且产量丰富的植物油尤其是豆油替代鱼油的相关营养学研究备受人们关注。我们的前期研究表明中华条颈龟(Mauremyssinensis)饲料中豆油替代鱼油后可显著影响机体对脂肪的吸收利用[13],但不同饲料对肠道形态和菌群结构影响的研究尚属空白。因此,本试验通过调节饲粮中豆油与鱼油的添加比例,利用组织学染色法和Illumina Miseq高通量测序技术从组织学和宏基因组学的角度研究豆油替代鱼油后中华条颈龟肠道形态及菌群结构的变化,旨在为豆油替代鱼油在中华条颈龟生产中应用效果的研究提供肠道方面的基础资料。
1 材料与方法
1.1 试验设计与饲料配制
以超级蒸汽鱼粉、去皮豆粕为蛋白质源,配制含1%鱼油(进口的秘鲁鱼油)的配合饲料(全鱼油饲料),然后在全鱼油饲料的基础上用豆油(益海嘉里食品营销有限公司生产的金龙鱼大豆油)分别替代33%、67%和100%的鱼油,配制成3种试验饲料,4种饲料中豆油与鱼油的比例分别为0∶3(Ⅰ组,作为对照组)、1∶2(Ⅱ组)、2∶1(Ⅲ组)、3∶0(Ⅳ组)。饲料组成及营养水平见表1。各饲料蛋白质水平控制在45%左右、脂肪水平控制在8%左右。饲料原料的选取以尽可能的降低脂类的含量为标准,各饲料原料经60目筛网过滤,经充分混匀后利用绞肉机做成湿状饲料(由佛山市顺德区均安镇源大饲料厂代加工),置于-20 ℃冰箱中保存备用。
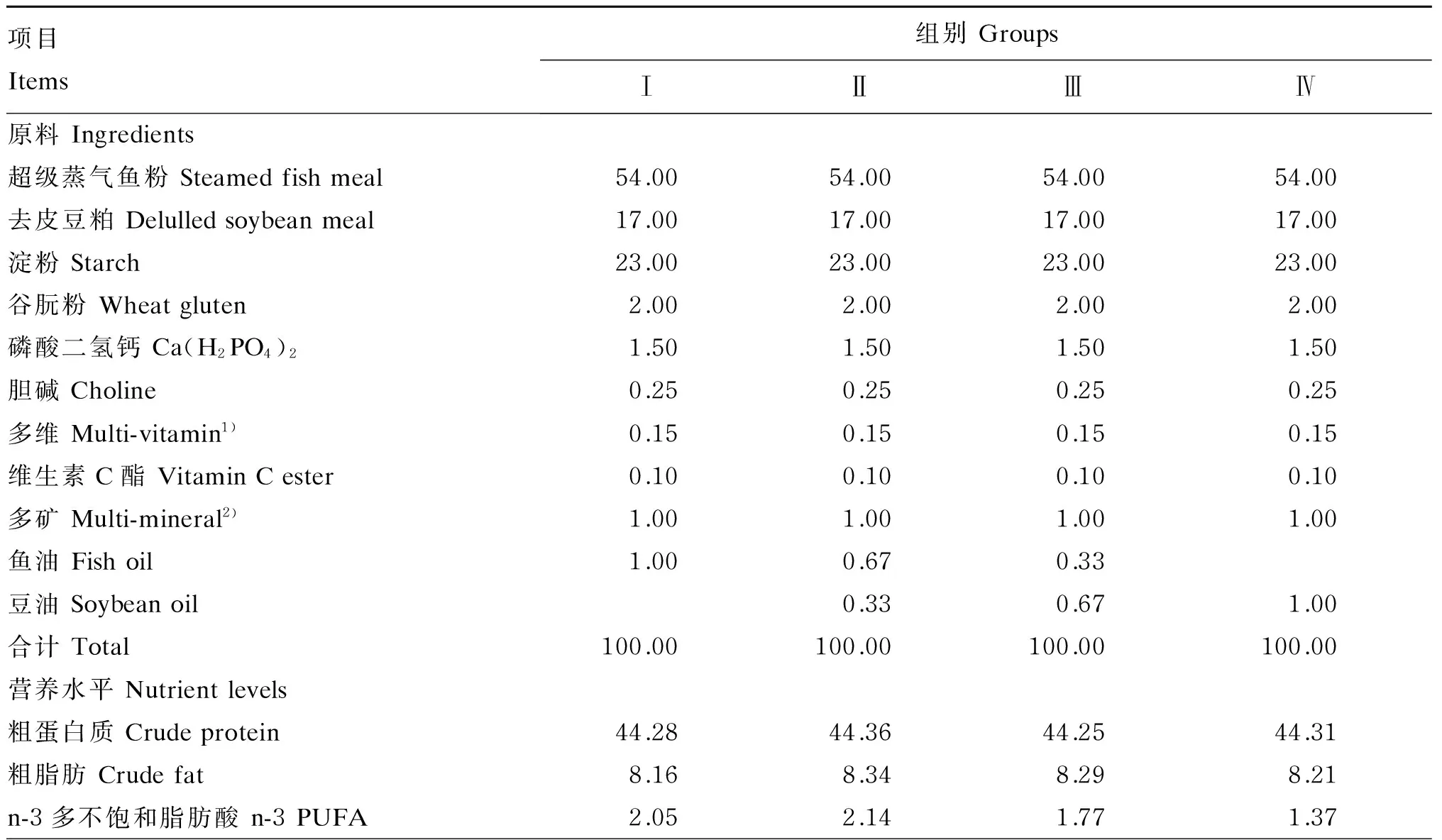
表1 饲料组成及营养水平(风干基础)Table 1 Composition and nutrient levels of diets (air-dry basis) %
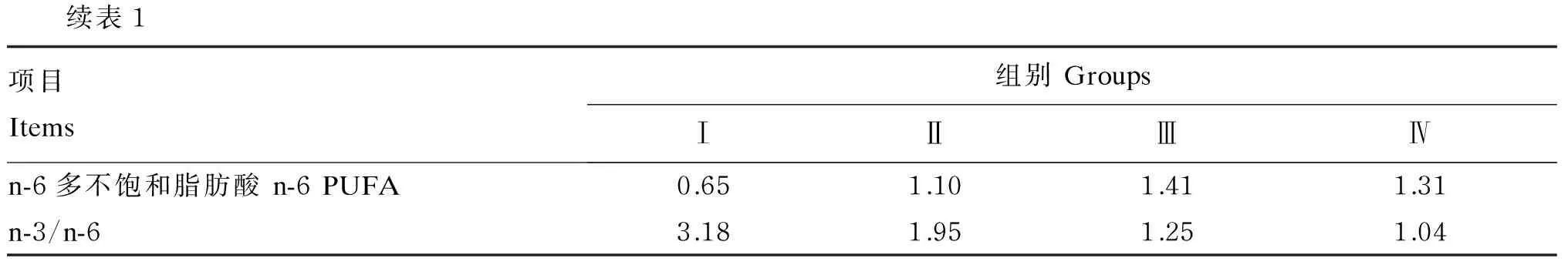
续表1项目Items组别GroupsⅠⅡⅢⅣn-6多不饱和脂肪酸n-6PUFA0.651.101.411.31n-3/n-63.181.951.251.04
1)每千克多维含有Contained the following per kg of multi-vitamin:VA 10 000 000 IU,VB120 mg,VB225 mg,VB612 mg,VB12100 mg,VD33 750 000 IU,VE 50 IU,VK312 mg,生物素 biotin 10 mg,叶酸 folic acid 2.5 mg,D-泛酸D-pantothenic acid 40 mg,烟酸 nicotinic acid 80 mg。2)每千克多矿含有Contained the following per kg of multi-mineral:K 90 g,Mg 27 g,Cu 750 mg,Fe 13.5 mg,Mn 1.2 g,Zn 38.5 g,I 120 mg,Se 50 mg,Co 100 mg。
1.2 试验动物与饲养管理
于2014年11月初从海南省文昌市泓旺农业养殖有限公司购入雌性成体中华条颈龟[4龄,平均体重(1 557±307)g],于海南师范大学生物楼6楼养殖室驯化2周后,随机分成4组,分别饲喂豆油与鱼油的比例为0∶3、1∶2、2∶1、3∶0的饲料,每组6只。4组中华条颈龟在同一饲养室不同的饲养水池饲养,各水池定期换水、消毒,消毒剂和水源均相同。每周饲喂2次,饲喂量按体重1%计算。饲喂10个月,试验结束后取样。
1.3 样品处理
试验结束后中华条颈龟低温麻醉后解剖,取十二指肠并收集大肠部分肠道内容物,分别用于组织结构观察和微生物多样性分析。
十二指肠用生理盐水洗净后,固定于4%多聚甲醛溶液中,经脱水、包埋、切片、染色等处理后,进行形态学观察。每个样本选择5张非连续切片,应用Motic数码显微镜(BA310)观察。每张切片选取正方位的上下左右4个视野计数小肠绒毛的数量;每张切片选取5处不同视野,测定肠壁肌层厚度以及5根完整绒毛的绒毛长度、隐窝深度,并计算绒毛长度/隐窝深度(VH/CD)。
大肠内容物用磷酸盐缓冲液(PBS)洗涤至50 mL EP管,以甘油∶内容物为1∶4的体积比振荡混匀后,保存于-80 ℃冰箱中,备用。保存的样品送至上海美吉生物医药科技有限公司,进行宏基因组DNA提取,并用1%琼脂糖凝胶进行电泳检测,进一步利用Nano Drop 2000超微量紫外光分光光度计测得4个DNA样品在260和280 nm处的吸光度(OD)值,计算得出OD260/280值均在1.8~2.0范围内。以提取的肠道菌群宏基因组DNA作为PCR的模板,按指定测序区域,合成带有barcode的特异引物,进行PCR扩增,构建Illumina平台文库,利用Illumina Miseq PE250测序平台对样品的16S rRNA基因的V3~V5区进行测序。
1.4 数据处理
十二指肠组织结构的相关测定指标的数据采用平均值±标准差表示,统计分析方法为单因素方差分析,若差异显著(P<0.05),则采用Duncan氏法进行多重比较,相关分析在SPSS 16.0软件上完成。
对Illumina Miseq PE250测序平台测得的原始数据进行质量控制,舍弃低质量序列(read尾部碱基质量<20,质控后的read<50 bp),以16S rRNA序列97%的相似度作为操作分类单元(operational taxonomic unit,OTU)的划分标准。定义1个OTU为不少于120个有效碱基,且碱基差异小于3%,即序列中碱基差异少于3个的序列群,1个OTU在结果分析中被视为代表1种细菌。获得的OTU与RDP数据库(Release 11.1,http://rdp.cme.msu.edu)比对,从而鉴定OTU代表性序列的微生物分类地位,丰富度指数(Ace指数)和α-多样性指数[香农(Shannon)指数、辛普森(Simpson)指数]的计算采用Mothur 1.30.1软件完成。
2 结果与分析
2.1 豆油部分或全部替代饲料中鱼油对中华条颈龟十二指肠组织结构的影响
由表2可知,中华条颈龟饲喂不同的饲料10个月后,Ⅲ组的十二指肠绒毛长度/隐窝深度与Ⅰ组差异不显著(P>0.05),而Ⅱ和Ⅳ组则显著低于Ⅰ和Ⅲ组(P<0.05)。Ⅰ、Ⅱ和Ⅲ组的十二指肠绒毛长度差异不显著(P>0.05),但Ⅳ组显著低于前3组(P<0.05)。就肌层厚度而言,Ⅰ组显著低于Ⅱ和Ⅳ组(P<0.05),但与Ⅲ组差异不显著(P>0.05)。各组的绒毛数量差异不显著(P>0.05)。
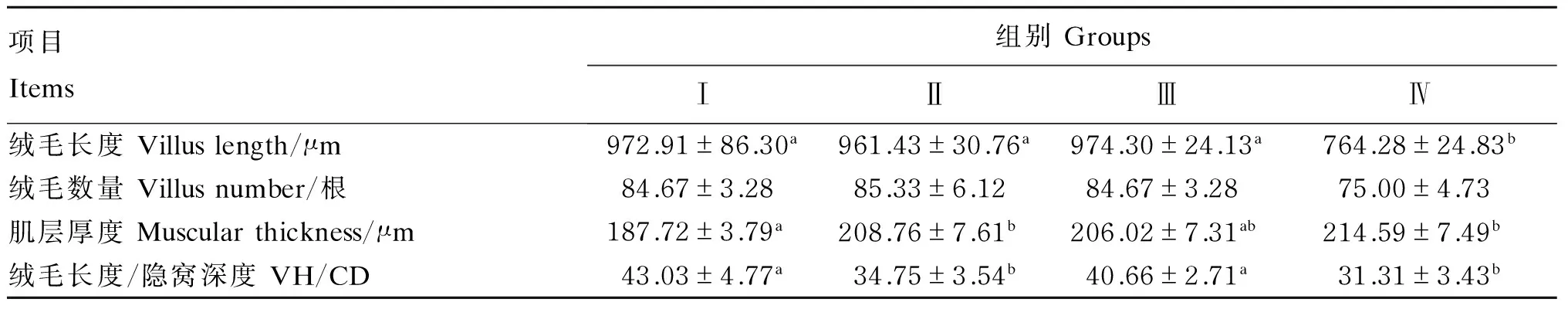
表2 4组中华条颈龟十二指肠组织结构Table 2 Histological structure of duodenum in Mauremys sinensis in four groups
同行数据肩标无字母或相同字母表示差异不显著(P>0.05),不同字母表示差异显著(P<0.05)。
In the same row, values with no letter or the same letter superscripts mean no significant difference (P>0.05), while with different letter superscripts mean significant difference (P<0.05).
2.2 豆油部分或全部替代饲料中鱼油对中华条颈龟肠道细菌多样性指数的影响
由图1可知,OTU数量对种类多样性的覆盖程度随着测序量的不断增大,各稀释曲线已趋于平缓,说明本次试验的测序量已经达到饱和,测序结果不会再随着测序量的增加而发生变化,测序结果能够反映中华条颈龟的肠道菌群组成的多样性。
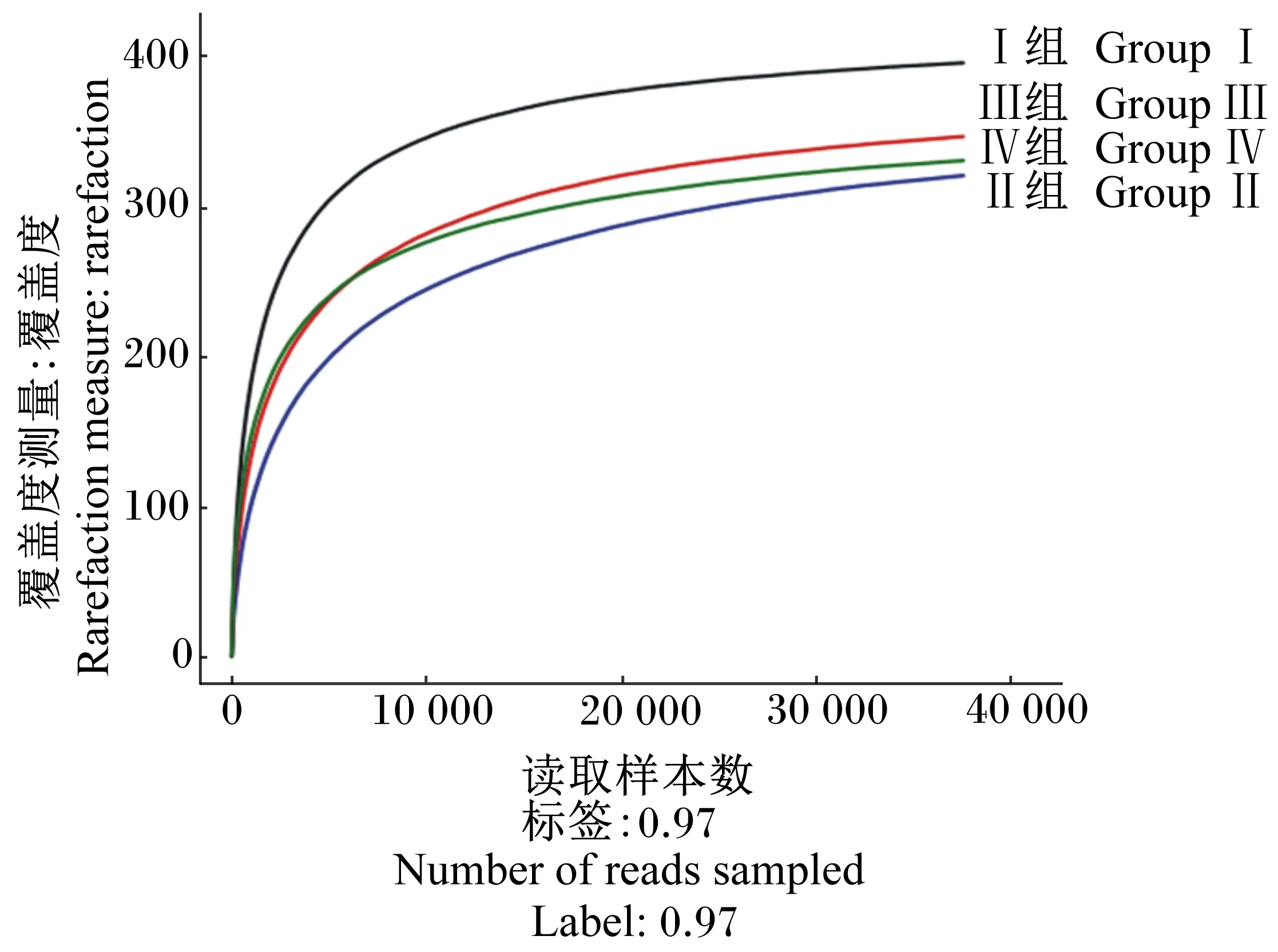
图1 不同样品稀释曲线分析Fig.1 Rarefaction curve analysis of different samples
由表3可知,将每个注释上的物种归类于不同的分类水平(界、门、科等水平),并将OTU在不同样品中的序列数按相似性97%水平划分,Ⅰ、Ⅱ、Ⅲ和Ⅳ组OTU总数分别为396、321、347和331个,主要代表厚壁杆菌门、拟杆菌门、梭杆菌门(Fusobacteria)及变形菌门4个优势门。在OTU水平,4个组的丰富度指数Ace指数以Ⅰ组最大。就α-多样性指数而言,Ⅰ组的香农指数最大(4.30)而辛普森指数最小(0.044 5),Ⅱ组的香农指数最小(2.91)而辛普森指数最大(0.236 7),这说明Ⅰ组细菌多样性最高,Ⅱ组细菌多样性最低。
2.3 豆油部分或全部替代饲料中鱼油对中华条颈龟肠道菌群结构的影响
从中华条颈龟肠道共获得了13个门117个属的菌群,且每个样本的细菌基因序列不少于15 000条,98%以上的细菌为厌氧或兼性厌氧型细菌。
2.3.1 基于门分类水平进行物种注释分析
中华条颈龟肠道细菌中有13个门被鉴定,分别为厚壁杆菌门、拟杆菌门、螺旋体门(Spirochaetes)、梭杆菌门、变形菌门、柔膜菌门(Tenericutes)、互养菌门(Synergistetes)、放线菌门(Actinobacteria)、浮霉菌(Planctomycetes)、疣微菌门(Verrucomicrobia)、黏胶球形菌门(Lentisphaerae)、蓝藻门(Cyanobacteria)、SHA-109。
由图2可知,在门水平的分布上,4个组的中华条颈龟肠道内均包含4个优势菌门——拟杆菌门、厚壁杆菌门、梭杆菌门和变形菌门,只是在各组所占的比例不同。在Ⅰ组中,拟杆菌门(38.45%)、厚壁杆菌门(30.91%)、梭杆菌门(19.79%)和变形菌门(7.51%)共同构成了肠道菌群的主要结构。豆油替代饲料中一定比例的鱼油后,梭杆菌门所占比例增加,以Ⅱ组最明显,达到51.85%,构成了绝对的优势菌群,随着豆油替代比例的进一步增大(如Ⅲ和Ⅳ组),梭杆菌门所占比例有所下降,但仍高于全鱼油的Ⅰ组,基本维持在30%左右。拟杆菌门和厚壁菌门在Ⅱ组所占比例最低,分别为21.67%和15.94%。豆油替代饲料中一定比例的鱼油后提高了变形菌门所占比例,Ⅱ、Ⅲ和Ⅳ组分别为9.51%、13.40%和10.67%。
除了主要菌群外,其他门分类的菌群所占比例都非常低,甚至有的门仅有为数不多的几条序列,所占比例不足0.01%,且蓝藻门、SHA-109仅出现在Ⅰ组中。
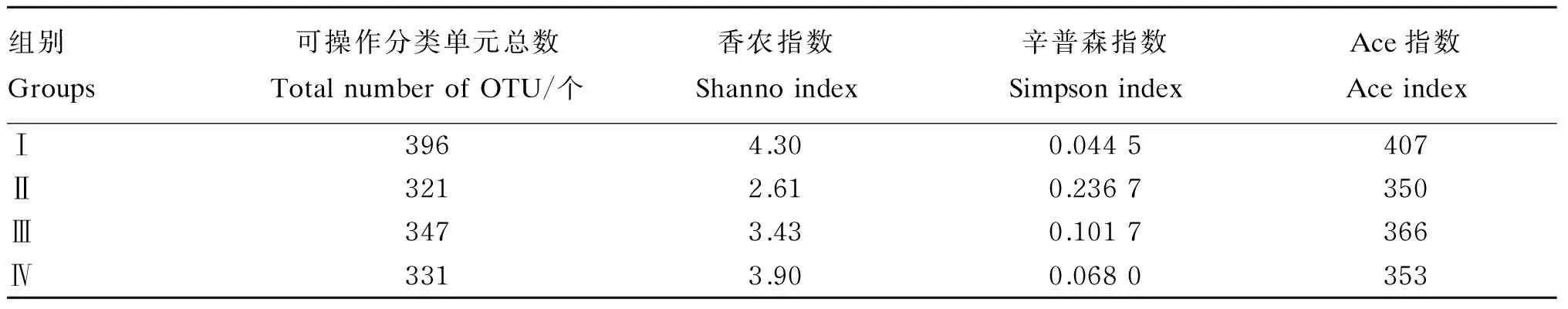
表3 基于16S rRNA基因序列的细菌多样性分析Table 3 The bacterial diversity analysis by 16S rRNA gene sequences

图2 肠道细菌在门水平上的分布Fig.2 Intestinal bacterial distribution at the phylum level
2.3.2 基于属分类水平进行分析
由图3可知,Ⅰ、Ⅱ、Ⅲ和Ⅳ组中华条颈龟肠道细菌分别被鉴定出139、117、128和120个属,Ⅰ组主要属为梭杆菌属(17.70%)和拟杆菌属(Bacteroides)(24.19%),Ⅱ组主要属为梭杆菌属(51.17%)和邻单胞菌属(Plesiomonas)(6.85%),Ⅲ组主要属为梭杆菌属(31.95%)和邻单胞菌属(9.25%),Ⅳ组主要属为梭杆菌属(32.35%)和拟杆菌属(15.01%)。
2.3.3 特有OTU分析
由图4可知,Ⅰ、Ⅱ、Ⅲ和Ⅳ组中特有OTU个数分别为43、3、4、5个,其中Ⅱ组中特有OTU只归属于厚壁杆菌门,Ⅳ组中特有OTU属于厚壁杆菌门和拟杆菌门,Ⅲ组中特有OTU分别属于厚壁杆菌门、变形菌门、柔膜菌门,Ⅰ组中特有OTU所归属的门类最多,几乎含有中华条颈龟肠道细菌的所有门类,但主要属于厚壁杆菌门和拟杆菌门。
3 讨 论
肠道细菌多样性一方面是宿主和肠道细菌之间强烈选择和协同进化的结果,另一方面受饲粮营养组成及饲粮结构的影响。在本研究中,全鱼油组(Ⅰ组)中华条颈龟肠道细菌Ace指数及香农指数均为最大,在门及属分类水平上,全鱼油组的肠道菌群所囊括的门种类数及属种类数均最多;用豆油部分或全部替代饲料中鱼油后,中华条颈龟肠道细菌多样性及丰富度均有下降趋势,3个豆油替代组中以33%豆油替代组(Ⅱ组)的Ace指数及香农指数最小。4个组的基础饲料组成相同,只是鱼油和豆油的添加比例不同,鱼油中n-3多不饱和脂肪酸含量高,豆油中n-6多不饱和脂肪酸含量高,这说明饲料中多不饱和脂肪酸的种类及n-3/n-6多不饱和脂肪酸比例不同将影响肠道细菌的多样性及丰富度。这与Zhang等[9]对脂质来源不同的脂肪酸成分对对虾肠道菌群结构影响的研究结果一致。不同的细菌对营养物质的需求不同,营养源很大程度上决定了菌群的结构和功能,当营养源发生改变时,肠道菌群的结构和数量也会随之改变。Zhang等[8]对大鼠饲喂不同脂肪含量的饲料,发现高脂饮食会降低大鼠肠道拟杆菌门和双歧杆菌门所占比例,增加厚壁杆菌门和变形菌门所占比例。厚壁杆菌门和拟杆菌门这两大类菌群作为爬行动物蛇和蜥蜴、人类及其他哺乳动物肠道的主要菌群而存在,这种优势菌群的主导地位可能与这两大类菌群所具有的功能有关,研究发现厚壁杆菌门和拟杆菌门中的大部分细菌都参与着食物的再消化和新陈代谢过程[14-16]。在本研究中,中华条颈龟肠道菌群主要为厚壁杆菌门、梭杆菌门、拟杆菌门和变形菌门,用豆油替代饲料中一定比例的鱼油后,与消化吸收密切相关的拟杆菌门和厚壁菌门所占比例均有所下降,但67%豆油替代组(Ⅲ组)下降幅度最小,与全鱼油组较为接近。

图3 肠道细菌在属水平上的分布Fig.3 Intestinal bacterial distribution at genus level
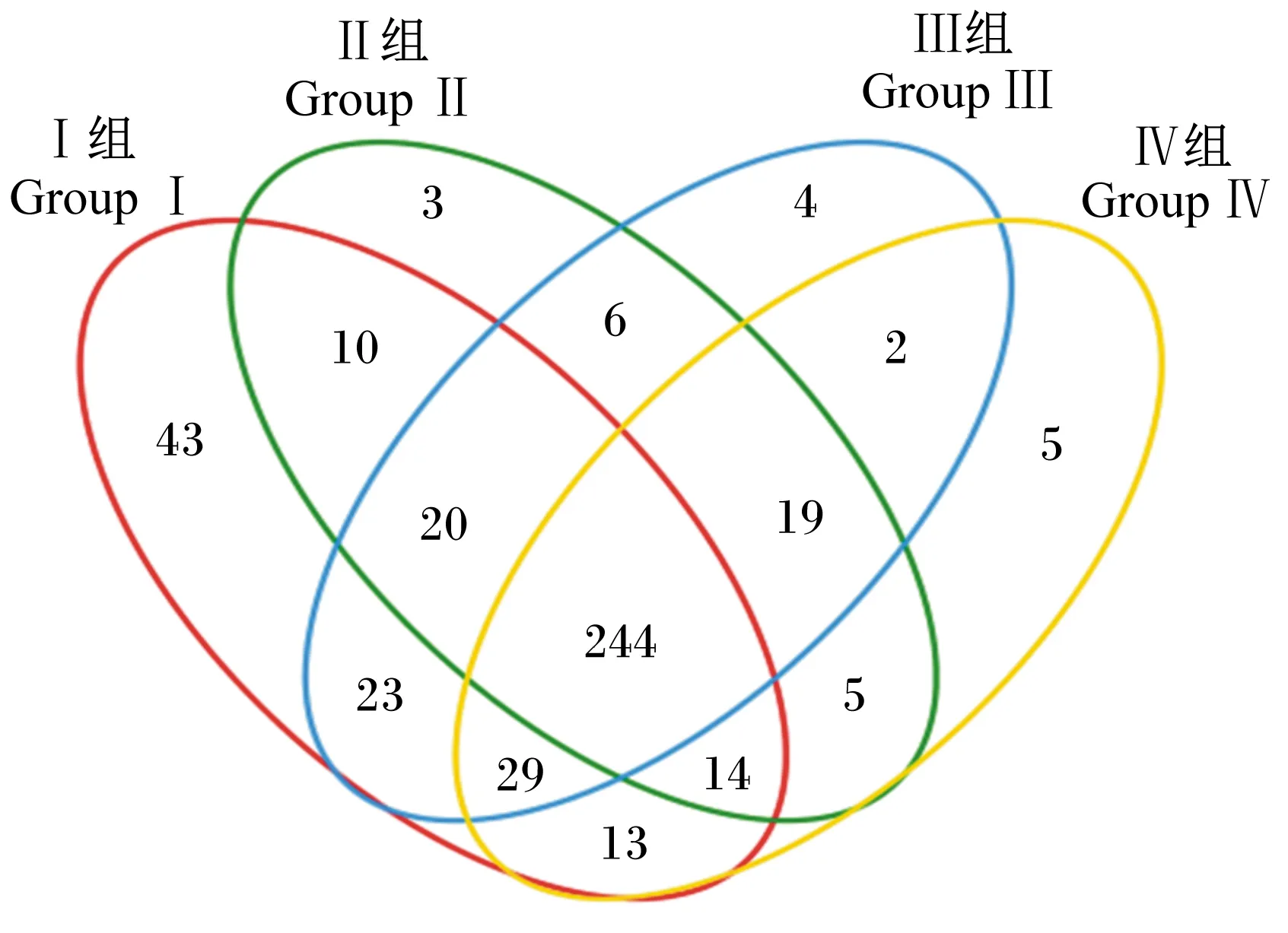
图4 不同样本的OTU venn分析Fig.4 OTU venn analysis of different samples
肠道菌群作为内化的环境因子,产生各种对机体有利或有害的代谢产物,菌群和胃肠道上皮细胞之间的相互作用导致消化道各种结构和功能的改变。肠道消化吸收功能常受其绒毛长度、隐窝深度等形态指标影响[17-18]。其中,绒毛长度决定了肠黏膜上皮细胞数量,而隐窝深度可作为衡量上皮细胞生成速率的指标,上皮细胞不断分化、迁移以补充十二指肠绒毛正常的脱落凋亡,较深的隐窝预示着细胞增殖活跃,成熟率低[17]。绒毛长度/隐窝深度则可以综合反映十二指肠的功能状态,若绒毛长度/隐窝深度上升,则说明十二指肠消化吸收功能增强[18]。关于饲粮营养物质对动物小肠形态结构影响的报道不一。Zeitz等[19]在家鸡饲粮中添加富含月桂酸和肉豆寇酸植物油后发现,肠道组织结构尤其是绒毛长度发生了显著改变;陈丛亮等[20]发现,十二指肠绒毛长度的提高可以显著促进其对营养物质的吸收;Ngoc等[21]发现,饲喂木薯渣和啤酒糟显著提高猪空肠和回肠绒毛长度,但十二指肠绒毛长度并未发生显著变化。也有研究显示饲粮纤维不会对猪小肠形态产生显著影响[22];此外,Du等[10]对山麻鸭的研究表明,在其饲粮中添加2%的鱼油,可显著降低肠道绒毛长度/隐窝深度以及杯状细胞的数量。本研究中,67%豆油替代组与全鱼油组的十二指肠绒毛长度/隐窝深度差异不显著,但均显著高于33%豆油替代组和全豆油组(Ⅳ组)。这说明全鱼油组和67%豆油替代组在肠黏膜上皮细胞数量及细胞成熟率方面均优于33%豆油替代组和全豆油组,而肠黏膜上皮细胞数量及细胞成熟率在一定程度上会影响肠道消化酶的分泌,从裘正元等[13]对这4组中华条颈龟肠道中酶活性的比较可看出全鱼油组与67%豆油替代组的酶活性要显著高于33%豆油替代组和全豆油组。
肠道菌群通过释放某些生物活性物质或间接激活肠道免疫系统,影响杯状细胞生长和肠道黏膜完整性,进而对整个机体的营养、免疫起着重要作用。因此,肠道菌群还可以影响脂肪的消化、改变蛋白质和碳水化合物的消化,增加能量和蛋白质的需要量[23]。Osborn等[24]研究表明,肠道菌群可以直接调控动物的基因表达以调控脂肪代谢,它们可以增强肝脏中脂肪酸合成酶(FAS)的活性,同时关闭肠道里抑制脂肪积累的基因禁食诱导脂肪因子(fasting-induced adipose factor)的表达。肠道菌群对中华条颈龟营养物质的消化吸收及免疫等各方面的影响还有待于进一步研究。
4 结 论
① 67%豆油替代组中华条颈龟的肠道形态与全鱼油组相近。
② 豆油部分或全部替代饲料中鱼油均可使中华条颈龟肠道细菌多样性降低。
③ 67%豆油替代组中华条颈龟肠道菌群中拟杆菌门和厚壁菌门所占比例与全鱼油组接近。
[1] ECKBURG P B,BIK E M,BERNSTEIN C N,et al.Diversity of the human intestinal microbial flora[J].Science,2005,308(5728):1635-1638.
[2] QIN J J,LI R Q,RAES J,et al.A human gut microbial gene catalogue established by metagenomic sequencing[J].Nature,2010,464(7285):59-65.
[3] SOCCINI C,FERRI V.Bacteriological screening ofTrachemysscriptaelegansandEmysorbicularisin the Po plain (Italy)[J].Biologia,Bratislava,2004,59(Suppl.14):201-207.
[4] 杜爽,张文飞,史海涛.基于16S rRNA序列分析红耳龟肠道拟杆菌和厚壁杆菌菌群多样性[J].基因组学与应用生物学,2013,32(6):700-706.
[5] 陈杏云,曾本华,魏泓,等.高脂饮食对菌群人源化小鼠肠道菌群结构的影响[J].食品科学,2013,34(17):278-283.
[6] 曹宏芳,张家超,王芳,等.高脂饮食对雄性SD大鼠肠道菌群的影响[J].中国微生态学杂志,2012,24(2):102-108.
[7] 刘雪姬,陈庆森,闫亚丽.高脂饮食对小鼠肠道菌群的影响[J].食品科学,2011,32(23):306-311.
[8] ZHANG C H,ZHANG M H,PANG X Y,et al.Structural resilience of the gut microbiota in adult mice under high-fat dietary perturbations[J].The ISME Journal,2012,6(10):1848-1857.
[9] ZHANG M L,SUN Y H,CHEN K,et al.Characterization of the intestinal microbiota in Pacific white shrimp,Litopenaeusvannamei,fed diets with different lipid sources[J].Aquaculture,2014,434:449-455.
[10] DU X,XU X Q,TIAN Y,et al.Morphology and microbiota of different section of intestines and their influences induced by dietary fish oil in Shan partridge ducks (Anasplatyrhynchos)[J].Journal of Agricultural Biotechnology,2016,24(11):1652-1663.
[11] LIU T Y,HOUGEN H,VOLLMER A C,et al.Gut bacteria profiles ofMusmusculusat the phylum and family levels are influenced by saturation of dietary fatty acids[J].Anaerobe,2012,18(3):331-337.
[12] PICKOVA J,MØRKØRE T.Alternate oils in fish feeds[J].European Journal of Lipid Science and Technology,2007,109(3):256-263.
[13] 裘正元,盛成,洪美玲,等.豆油替代鱼油对中华条颈龟血脂代谢及相关酶活的影响[J].水产科学,2015,34(7):453-458.
[14] COSTELLO E K,GORDON J I,SECOR S M,et al.Postprandial remodeling of the gut microbiota inBurmesepythons[J].The ISME Journal,2010,4(11):1375-1385.
[15] HONG P Y,WHEELER E,CANN I K O,et al.Phylogenetic analysis of the fecal microbial community in herbivorous land and marine iguanas of the Galàpagos Islands using 16S rRNA-based pyrosequencing[J].The ISME Journal,2011,5(9):1461-1470.
[16] MACKIE R I,NELSON D M,WHEELER E,et al.Fermentative digestion in herbivorous lizards:bacterial population analysis in the intestinal tract of free-living land (Conolophuspallidus) and marine iguanas (Amblyrhynchuscristatus) on the Galapagos archipelago[M]//MORRIS S,VOSLOO A.Molecules to migration:the pressures of life.Bologna:Medimond Publishing Company,2008:193-202.
[17] 刘秋东,张中文,刘凤华,等.复方白头翁胶囊对腹泻犬小肠绒毛长度和隐窝深度的影响[J].北京农学院学报,2011,26(3):38-40.
[18] 刘晓静,史彬林,赵育国,等.日粮中添加沙蒿籽粉对肉仔鸡肠绒毛形态及肠道菌群的影响[J].饲料工业,2011,32(5):13-15.
[19] ZEITZ J,FENNHOFF J,KLUGE H,et al.Effects of dietary fats rich in lauric and myristic acid on performance,intestinal morphology,gut microbes,and meat quality in broilers[J].Poultry Science,2015,94(10):2404-2413.
[20] 陈丛亮,杨洪勋,杨磊,等.半胱胺提高畜禽营养物质消化、吸收和利用率的作用机制探讨[J].饲料研究,2008(12):18-21.
[21] NGOC T T B,HONG T T T,LEN N T,et al.Effect of fibre level and fibre source on gut morphology and micro-environment in local (Mong Cai) and exotic (Landrace×Yorkshire) pigs[J].Asian-Australasian Journal of Animal Sciences,2012,25(12):1726-1733.
[22] CHEN H,MAO X B,CHE L Q,et al.Impact of fiber types on gut microbiota,gut environment and gut function in fattening pigs[J].Animal Feed Science and Technology,2014,195(9):101-111.
[23] GABRIEL I,LESSIRE M,MALLET S,et al.Microflora of the digestive tract:critical factors and consequences for poultry[J].World’s Poultry Science Journal,2006,62(3):499-511.
[24] OSBORN O,OLEFSKY J M.The cellular and signaling networks linking the immune system and metabolism in disease[J].Nature Medicine,2012,18(3):363-374.
*Corresponding author, professor, E-mail: meilinghong_ecnu@aliyun.com
(责任编辑 菅景颖)
Effects of Partial or Total Replacement of Fish Oil by Soybean Oil on Intestinal Morphology and Microbiota Structure of Chinese Striped-Neck Turtle (Mauremyssinensis)
DING Li1LI Jiangyue1XUE Shan1SHI Haitao1,2HONG Meiling1*
(1.CollegeofLifeScience,HainanNormalUniversity,Haikou571158,China; 2.ChengduInstituteofBiology,ChineseAcademyofSciences,Chengdu610041,China)
This study was conducted to investigate the effects of partial or total replacement of fish oil by soybean oil on intestinal morphology and microbiota structure of Chinese striped-neck turtle (Mauremyssinensis) by histological staining and 16S rRNA V3-V4 region sequencing. Twenty 4-year adult female Chinese striped-neck turtles [4-year-old and the initial body weight of (1 557±307) g] were randomly divided into 4 groups and each group had 6 turtles. Turtles in group Ⅰ (control group) were fed a formula feed containing 1% fish oil which was a whole fish oil diet with the ratio of soybean oil to fish oil was 0∶3, and others in three experimental groups were fed diets used soybean oil to replace 33% (groupⅡ), 67% (group Ⅲ) and 100% (group Ⅳ) fish oil based on the whole fish oil diet and the ratios of soybean oil to fish oil of them were 1∶2, 2∶1 and 3∶0, respectively. Turtles were fed 2 times per week, and the experiment lasted for 10 months. The results showed as follows: 1) the ratio of villus height to crypt depth (VH/CD) of duodenum in groups Ⅰ and Ⅲ was significantly higher than that in groups Ⅱ and Ⅳ (P<0.05). 2) According to the 97% level of sequence similarity, the total numbers of operational taxonomic unit (OTU) in groupsⅠ, Ⅱ, Ⅲ and Ⅳ were 396, 321, 347 and 331, while the specific OTU numbers were 43, 3, 4 and 5, and 139, 117, 128, 120 genus were identified, respectively. The dominant phyla in the duodenum were Bacteroidetes, Firmicutes, Fusobacteria and Proteobacteria. The proportions of Fusobacteria and Proteobacteriai were increased while the proportions of Bacteroidetes and Firmicutes were decreased in groups Ⅱ, Ⅲ and Ⅳ. However, the small gap of Firmicutes and Bacteroidetes between groups Ⅰ and Ⅲ. The bacterial Ace index and Shanno index were the highest in group Ⅰ, the middle in groups Ⅲ and Ⅳ, and the lowest in group Ⅱ. The bacterial Simpson index was the highest in group Ⅱ, the middle in groups Ⅲ and Ⅳ, and the lowest in group Ⅰ. Therefore, the development maturation degree of intestinal cells and intestinal microbiota structure of Chinese striped-neck turtle fed the diet with 67% fish oil replacement by soybean oil are similar to Chinese striped-neck turtle fed the whole fish oil diet.[ChineseJournalofAnimalNutrition, 2017, 29(6):1940-1948]
Chinese striped-neck turtle (Mauremyssinensis); replacement of fish oil; intestinal morphology; intestinal microbiota structure
10.3969/j.issn.1006-267x.2017.06.015
2016-12-01
国家自然科学基金项目(31360642,31372228);海南省大学生创新训练项目(3010151072)
丁 利(1982—),女,河南夏邑人,副教授,博士,从事动物学研究。E-mail: dingli705@163.com
*通信作者:洪美玲,教授,硕士生导师,E-mail: meilinghong_ecnu@aliyun.com
S963
A
1006-267X(2017)06-1940-09

