饲粮中添加泛酸对生长獭兔肝脏脂肪代谢的影响
刘 磊 赵 楠 张 斌 李福昌
(山东农业大学动物科技学院,泰安271018)
饲粮中添加泛酸对生长獭兔肝脏脂肪代谢的影响
刘 磊 赵 楠 张 斌 李福昌*
(山东农业大学动物科技学院,泰安271018)
本试验旨在研究饲粮中添加泛酸对生长獭兔肝脏脂肪代谢的影响。试验选用体重相似的断奶獭兔160只,随机分为4组,每组40个重复,每个重复1只。对照组獭兔饲喂基础饲粮,试验组獭兔分别饲喂在基础饲粮中添加10、20和40 mg/kg泛酸的饲粮。预试期7 d,正试期56 d。结果表明:与对照组相比,饲粮中添加40 mg/kg泛酸显著降低了生长獭兔肩胛、胃周和肾周脂肪沉积率(P<0.05);饲粮中添加10~20 mg/kg泛酸显著降低了生长獭兔肝脏中脂滴的含量(P<0.05)。饲粮中泛酸添加水平对生长獭兔血浆中总胆固醇和白蛋白的含量无显著影响(P>0.05);随着饲粮中泛酸添加水平的升高,生长獭兔血浆中甘油三酯的含量先降低后趋于稳定,20、40 mg/kg添加组显著低于对照组(P<0.05);与对照组相比,饲粮中添加20~40 mg/kg泛酸显著升高了生长獭兔血浆中极低密度脂蛋白的含量(P<0.05)。与对照组相比,饲粮中添加40 mg/kg泛酸显著增加了肝脏中激素敏感脂酶(HSL)和骨骼肌中脂肪酸转运蛋白(FATP)基因的表达量(P<0.05);饲粮中添加20~40 mg/kg泛酸显著增加了肝脏中肉毒碱棕榈酰转移酶1(CPT1)基因的表达量(P<0.05);饲粮中添加10~40 mg/kg泛酸显著增加了肝脏中脂肪酸合成酶(FAS)基因和骨骼肌中CPT1基因的表达量(P<0.05)。综上所述,饲粮中添加泛酸影响生长獭兔肝脏内脂肪代谢,泛酸添加水平为40 mg/kg时可降低肝脏内脂肪的沉积,并能降低机体脂肪沉积率,增加骨骼肌对脂肪酸的摄取和利用。
獭兔;泛酸;肝脏;脂肪代谢
肝脏是脂类代谢的重要场所,在脂类的消化、吸收、合成、分解、转运等过程中起重要作用。肝脏以乙酰辅酶A(acetyl-CoA)为原料合成脂肪酸,脂肪酸的合成过程还受到脂肪酸合成酶类[如脂肪酸合成酶(FAS)、苹果酸脱氢酶]的调节[1]。肝脏内脂类也发生脂解作用,为肝细胞提供能量。脂肪酸在肝脏内合成后需与载脂蛋白B(ApoB)结合,即由甘油三酯、胆固醇、磷脂和ApoB在内质网与高尔基体内组装成极低密度脂蛋白(VLDL),才能经血液循环系统运至肝外各组织(主要是脂肪组织,也包括骨骼肌等组织)[2]。脂肪是脂类储存的主要组织,脂肪中的甘油三酯水解生成的游离脂肪酸与血浆白蛋白结合后可经血液循环运输至各组织氧化分解供能。骨骼肌是脂肪酸氧化利用的主要器官,在脂肪酸转运蛋白(FATP)的作用下,将血液中的脂类转运到骨骼肌,在肉毒碱棕榈酰转移酶1(CPT1)的作用下,脂肪酸氧化供能[3]。
泛酸(维生素B5)是畜禽所必需的维生素之一,为水溶性维生素,是机体内多种生理和生化过程所必需的辅助因子,广泛参与多种基因的表达调控。泛酸是形成辅酶A(CoA)的前体物质,CoA是泛酸的生物学功能形式,它对肝脏中磺胺的乙酰化及脑中乙酰胆碱的合成是不可缺少的辅因子[4]。动物体内的微生物(如大肠杆菌)能够以泛酸为底物合成CoA[5]。CoA在三羧酸循环、脂肪酸合成与分解及其他一些代谢和调节过程中起重要作用。研究发现,随着饲粮泛酸添加水平(0~80 mg/kg)的升高,鹅肝脏中脂肪甘油三酯脂肪酶(ATGL)mRNA的表达量呈现先降低后升高的趋势,当饲粮泛酸添加水平为13.86 mg/kg时,ATGLmRNA的表达量最低[6]。Wittwer等[7]喂给大鼠中度缺乏泛酸的饲粮后,大鼠血清中泛酸和肝脏CoA含量显著下降,血清甘油三酯和游离脂肪酸含量显著升高。给予高血脂患者泛酸后,其血脂水平明显下降[8]。减肥病人在限食过程中常出现饥饿、虚弱感和酮症,补充泛酸后,脂肪酸氧化增加,酮体产生减少,病人的症状消失[9]。泛酸缺乏主要影响脂肪酸β-氧化过程。Youssef等[10]发现,泛酸缺乏后肝脏过氧化物酶体中的脂肪酸β-氧化过程明显受到抑制。泛酸是否能预防或治疗脂肪肝目前尚未有报道。因此,本试验拟研究饲粮中添加泛酸对生长獭兔肝脏内脂肪代谢的影响,并探讨泛酸调节脂肪代谢的机制,为家兔饲粮中泛酸的添加提供理论依据。
1 材料与方法
1.1 试验动物与饲养管理
试验选取体重相近的30日龄断奶獭兔160只,随机分为4组(每组40个重复,每个重复1只试验兔),分别饲喂在基础饲粮中添加0(对照)、10、20和40 mg/kg泛酸的饲粮(饲粮中泛酸含量实测值分别为6.68、15.16、27.32、48.80 mg/kg)。基础饲粮参照De Blas等[11]家兔饲养标准配制,其组成及营养水平见表1。试验兔单笼饲养,采用常规饲养管理和免疫程序,自然采光,自由饮水,3~5 d消毒兔舍1次。预试期7 d,正试期56 d。
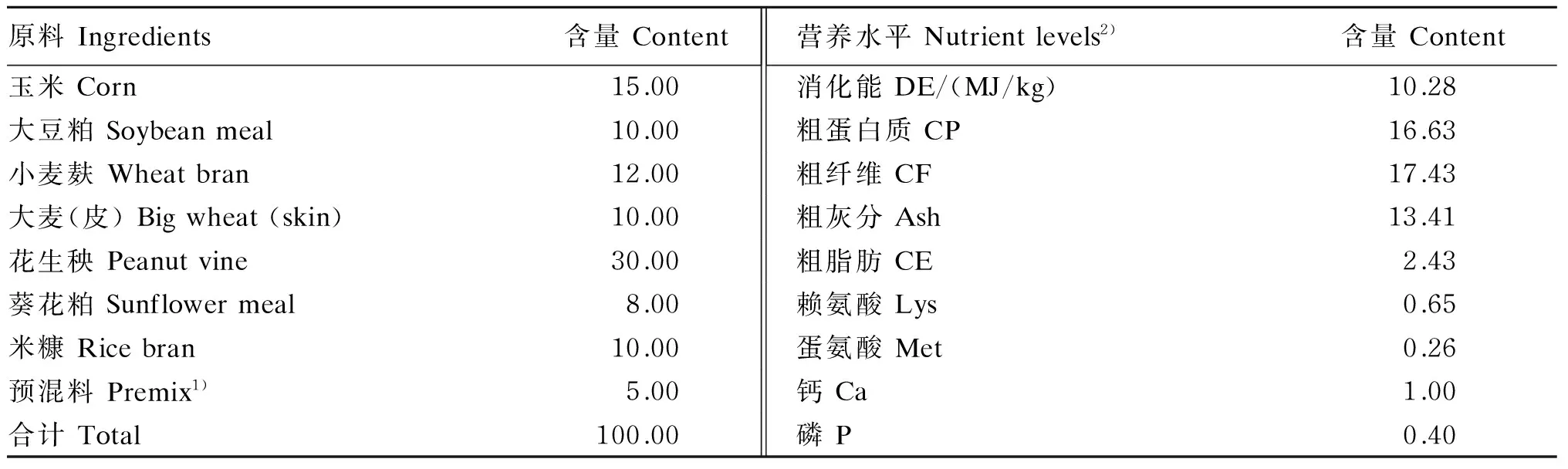
表1 基础饲粮组成及营养水平(风干基础)Table 1 Composition and nutrient levels of the basal diet (air-dry basis) %
1)预混料为每千克饲粮提供The premix provided the following per kg of the diet:VA 10 000 IU,VD32 000 IU,VE 50 mg,VK32.5 mg,VB15 mg,VB210 mg,VB350 mg,VB610 mg,VB112.5 mg,VB121 mg,氯化胆碱 choline chloride 400 mg,Fe 100 mg,Zn 50 mg,Cu 40 mg,Mn 30 mg,I 0.5 mg,Se 0.05 mg,CaHPO415 000 mg,NaCl 5 000 mg,赖氨酸 Lys 1 500 mg,蛋氨酸 Met 1 500 mg。
2)消化能为计算值,其余均为实测值。DE was a calculated value, while the others were measured values.
1.2 样品采集
试验结束后每组随机抽取8只试验兔,立即心脏采血,37 ℃水浴40 min后,3 000 r/min离心15 min,分离血浆,并置于-20 ℃冷冻保存;采用颈椎错位法致死后屠宰,分离脂肪组织并称重,采集肝脏和骨骼肌组织样品,在液氮中速冻后,置于-80 ℃保存以待分析。
1.3 指标测定
1.3.1 脂肪沉积
肩胛、胃周或肾周脂肪沉积率(%)=100×
肩胛、胃周或肾周脂肪重/
屠宰前的活兔体重。
1.3.2 肝脏内脂滴含量
将肝脏组织用冷冻切片机切成8~10 μm薄片,冷风机吹干,然后用福尔马林固定液固定15 min,50%乙醇漂洗1 min,油红O染液染色15 min,50%乙醇分化漂洗,水洗终止分化,然后苏木素复染核,自来水浸泡30 min返蓝,用甘油明胶封片,利用Weibel的油红着色点计数法来统计每张切片下脂滴的含量[12]。
1.3.3 血浆生化指标
血浆中甘油三酯、总胆固醇和白蛋白含量采用7170A全自动生化分析仪(日本日立公司)测定,试剂盒购自南京建成生物工程研究所;血浆中极低密度脂蛋白(VLDL)含量通过酶标仪采用酶联免疫吸附试验法测定,试剂盒购自南京建成生物工程研究所。
1.3.4 肝脏和骨骼肌中脂肪代谢相关基因的表达量
采用Trizol法提取组织中总RNA。将提取的总RNA反转录为cDNA,所用的试剂盒均由TaKaRa提供。使用大连宝生物工程有限公司提供的荧光定量试剂盒(DRR041A),采用SYBR Green Ⅰ荧光染料法,在美国ABI7500荧光定量RCR仪上进行实时荧光定量PCR,所用引物序列见表2。数据用2-ΔΔCT法分析。目的基因的mRNA用3-磷酸甘油醛脱氢酶(GAPDH)mRNA标准化。在CT值的基础上,GAPDHmRNA的表达在整个试验阶段是稳定的。
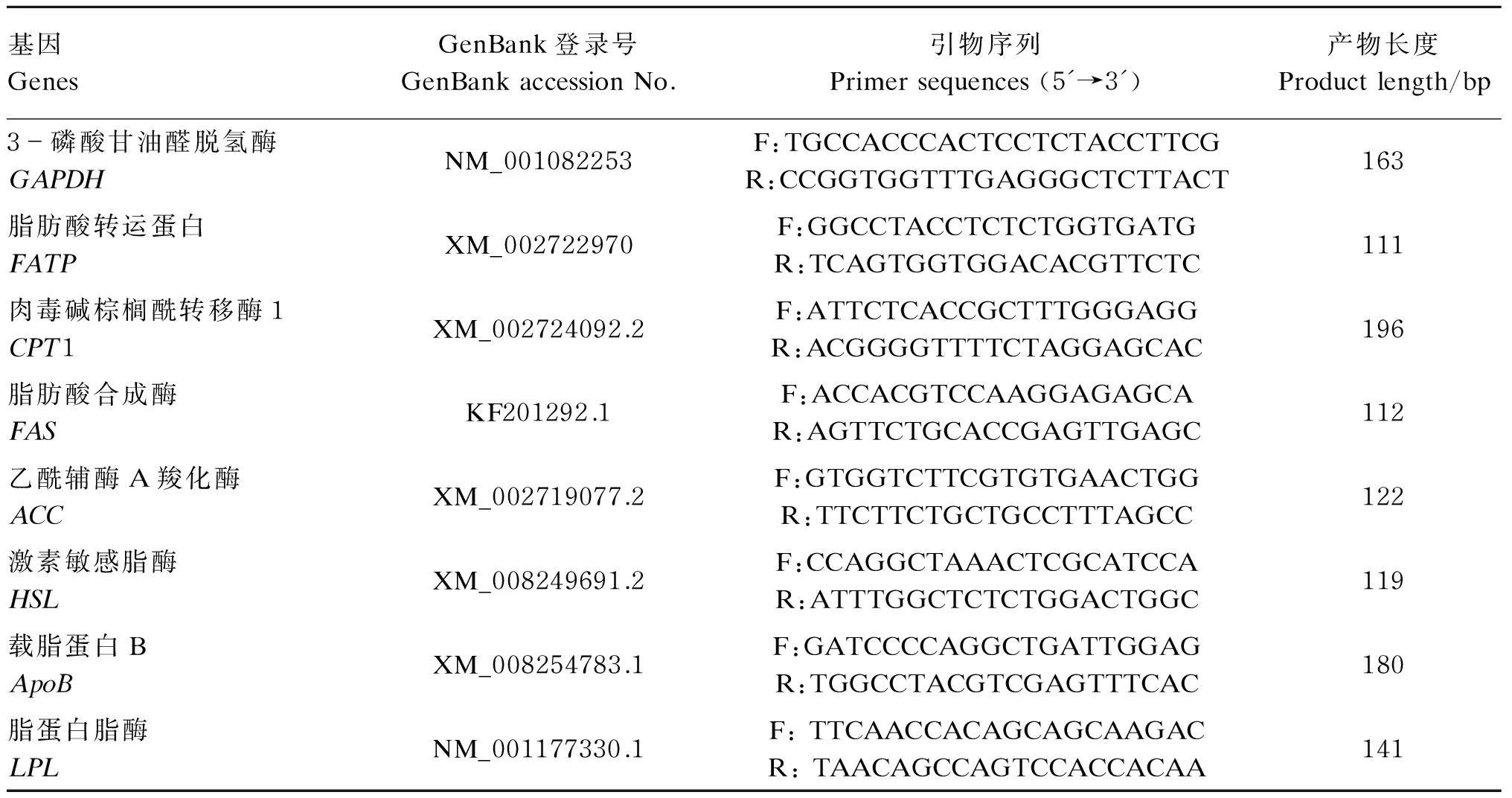
表2 实时荧光定量PCR所用引物序列Table 2 Primer sequences used for real-time fluorescent quantitative PCR
1.4 数据统计分析
试验数据采用SAS 8.0统计软件的ANOVA程序进行单因素方差分析,如果单因素效应差异显著,则采用Duncan氏法进行组间多重比较,数据用平均值±标准误表示,P<0.05为差异显著。
2 结 果
2.1 饲粮中添加泛酸对生长獭兔脂肪沉积及肝脏内脂滴含量的影响
由表3可知,随着饲粮中泛酸添加水平的升高,生长獭兔肩胛、胃周和肾周脂肪沉积率不断降低,在添加水平为40 mg/kg时与对照组的差异达到显著水平(P<0.05);与对照组相比,饲粮中添加10~40 mg/kg泛酸显著降低了生长獭兔肝脏中脂滴的含量(P<0.05)。图1为生长獭兔肝脏组织冰冻切片油红O染色图。
2.2 饲粮中添加泛酸对生长獭兔血浆生化指标的影响
由表4可知,饲粮中泛酸添加水平对生长獭兔血浆中总胆固醇的含量无显著影响(P>0.05);随着饲粮中泛酸添加水平的升高,生长獭兔血浆中甘油三酯的含量先降低后趋于稳定,20、40 mg/kg添加组显著低于对照组(P<0.05);与对照组相比,饲粮中添加20~40 mg/kg泛酸显著升高了生长獭兔血浆中极低密度脂蛋白的含量(P<0.05);与对照组相比,各泛酸添加组生长獭兔血浆中白蛋白的含量未发生显著变化(P>0.05),但40 mg/kg添加组显著高于10、20 mg/kg添加组(P<0.05)
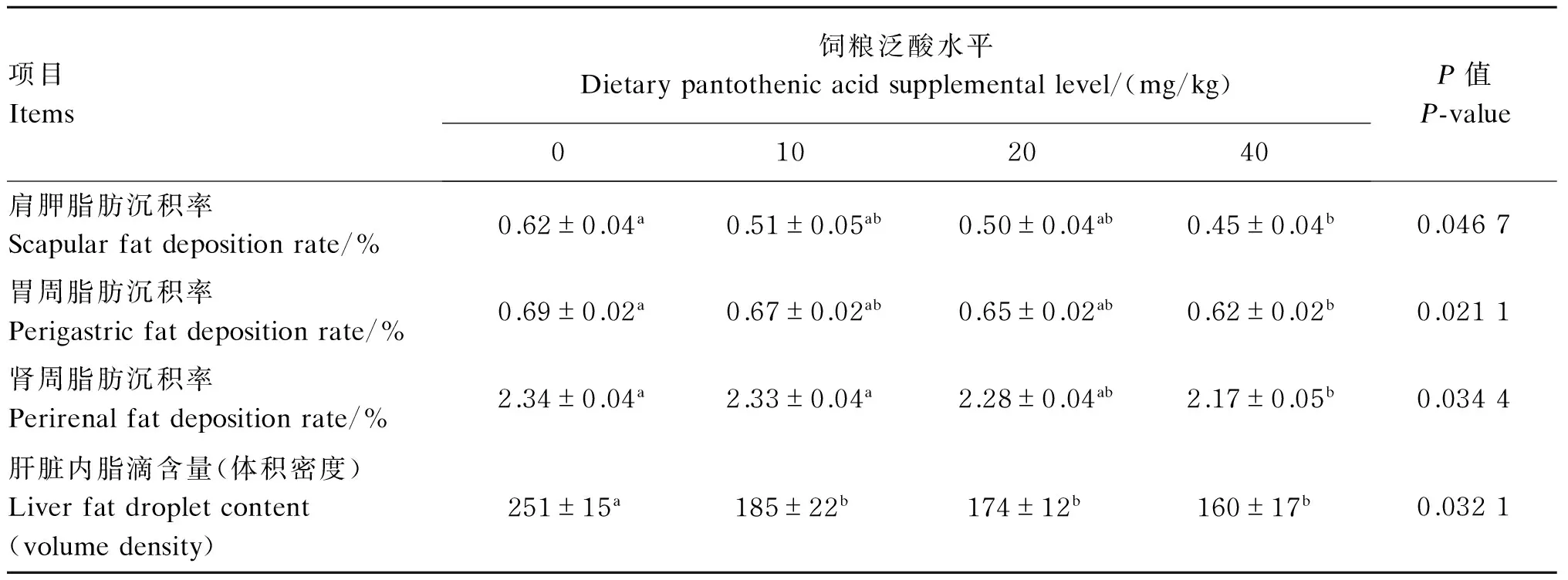
表3 饲粮添加泛酸对生长獭兔脂肪沉积及肝脏内脂滴含量的影响Table 3 Effects of pantothenic acid supplementation on fat deposition and liver fat droplet content of growing Rex rabbits (n=8)
同行数据肩标不同小写字母表示差异显著(P<0.05),相同字母或无字母表示差异不显著(P>0.05)。下表同。
In the same row, values with different small letter superscripts mean significant difference (P<0.05), while with the same or no letter superscripts mean no significant difference (P>0.05). The same as below.
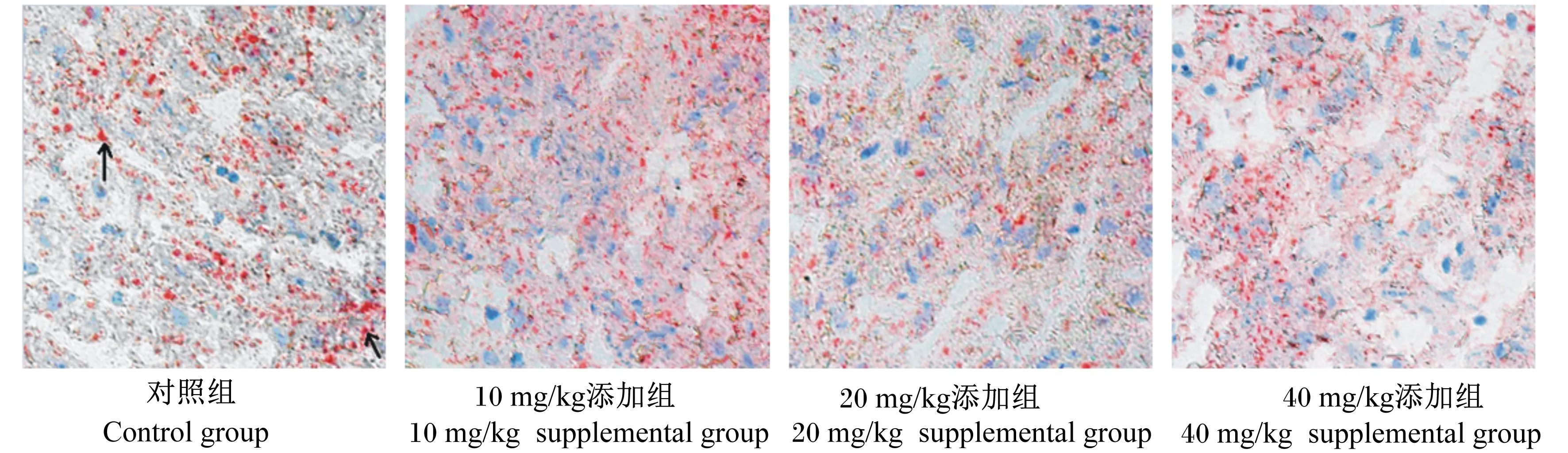
箭头所示为被着色的脂滴。The arrow showed the pigmented fat droplet.
图1 生长獭兔肝脏组织冰冻切片油红O染色图
Fig.1 Oil red O staining of liver tissue frozen section of growing Rex rabbits (200×)
2.3 饲粮中添加泛酸对生长獭兔肝脏中脂肪代谢相关基因表达量的影响
由表5可知,饲粮中泛酸添加水平对生长獭兔肝脏中乙酰辅酶A羧化酶(ACC)、脂蛋白脂酶(LPL)、ApoB基因的表达量无显著影响(P>0.05);与对照组相比,饲粮中添加40 mg/kg泛酸显著增加了生长獭兔肝脏中激素敏感脂酶(HSL)基因的表达量(P<0.05);与对照组相比,饲粮中添加20~40 mg/kg泛酸显著增加了生长獭兔肝脏中CPT1基因的表达量(P<0.05);与对照组相比,饲粮中添加10~40 mg/kg泛酸显著增加了生长獭兔肝脏中FAS基因的表达量(P<0.05)。
2.4 饲粮中添加泛酸对生长獭兔骨骼肌中脂肪代谢相关基因表达量的影响
由表6可知,与对照组相比,饲粮中添加10~40 mg/kg泛酸显著增加了骨骼肌中CPT1基因的表达量(P<0.05);与对照组相比,饲粮中添加40 mg/kg的泛酸显著增加了骨骼肌中FATP基因的表达量(P<0.05)。
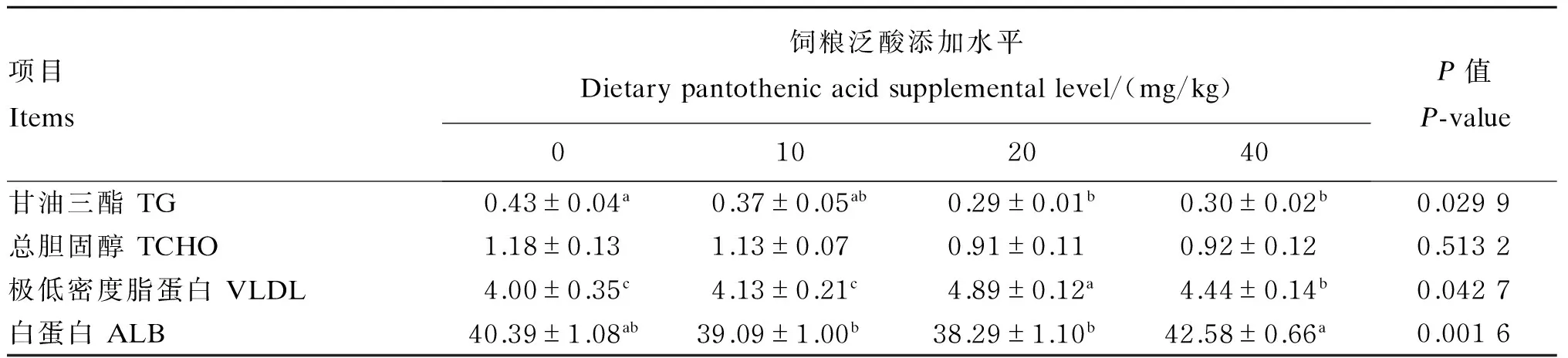
表4 饲粮中添加泛酸对生长獭兔血浆生化指标的影响Table 4 Effects of pantothenic acid supplementation on plasma biochemical parameters of growing Rex rabbits (n=8) mmol/L
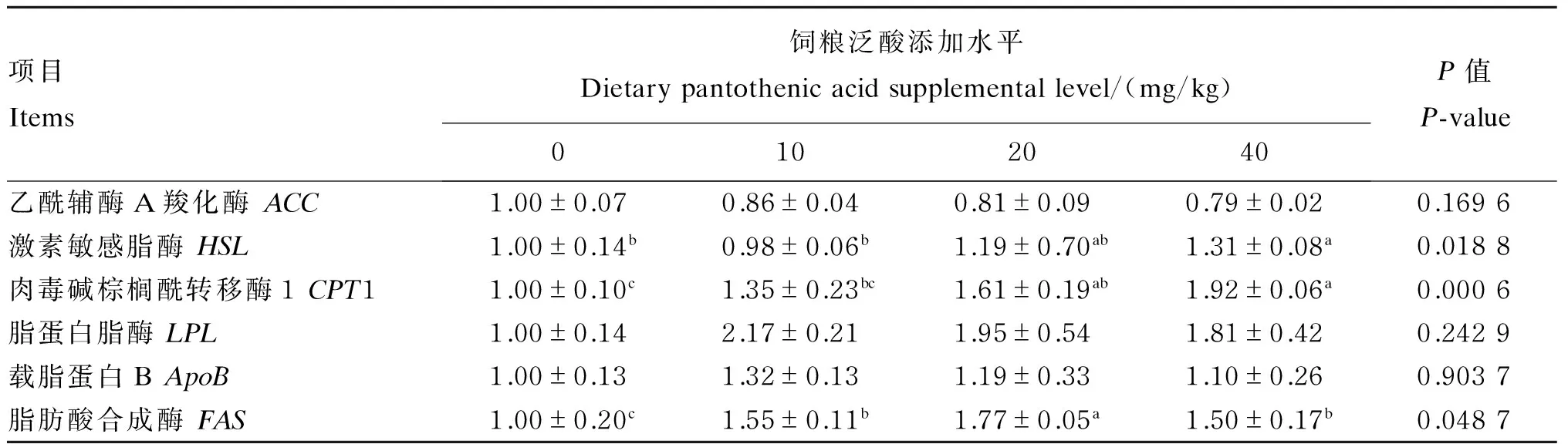
表5 饲粮中添加泛酸对生长獭兔肝脏中脂肪代谢相关基因表达量的影响Table 5 Effects of pantothenic acid supplementation on expression levels of genes related to lipid metabolism in liver of growing Rex rabbits (n=8)

表6 饲粮中添加泛酸对生长獭兔骨骼肌中脂肪代谢相关基因表达量的影响Table 6 Effects of pantothenic acid supplementation on expression levels of genes related to lipid metabolism in skeletal muscle of growing Rex rabbits (n=8)
3 讨 论
肝脏是外源性和内源性脂肪代谢途径的交汇点及调节中心,其脂肪代谢相关基因表达的变化是了解机体脂肪代谢情况的重要窗口。因此,本试验将生长獭兔肝脏作为脂肪代谢的研究对象。
3.1 泛酸降低了生长獭兔肝脏内脂肪的沉积
肝脏是脂肪酸从头合成的主要部位。FAS是脂肪酸合成的限速酶[13]。本试验发现,饲粮中添加10~40 mg/kg泛酸后显著增加了家兔肝脏中FAS基因的表达量,说明饲粮泛酸添加后獭兔的脂肪酸合成过程加强。肝脏内的脂肪细胞也能利用脂肪酸,通过β-氧化来获取能量,而CPT1是脂肪酸β-氧化的限速酶[14]。在本试验中我们发现,饲粮中添加20~40 mg/kg泛酸显著提高了肝脏中CPT1基因的表达量,说明脂肪酸的β-氧化过程也得到加强,这一结果与在其他动物[6]上的研究结果一致。LPL和HSL分别负责水解细胞外和细胞内的甘油三酯[15],饲粮中添加40 mg/kg泛酸能够增加肝脏中HSL基因的表达量,暗示泛酸增加了细胞内甘油三酯的水解过程。肝脏中合成的脂类以极低密度脂蛋白形式运送到血液中,通过血液循环供外周组织利用,极低密度脂蛋白组装、成熟及分泌的调控对肝脏脂肪含量及血脂水平有重要的影响[16]。在本试验中,饲粮中添加20~40 mg/kg泛酸后生长獭兔血浆中极低密度脂蛋白的含量显著增加,说明泛酸能够加快脂类从肝脏向外转运。极低密度脂蛋白的合成与分泌是一个很复杂的过程,受到许多因素的调控,其中ApoB可促进肝脏内极低密度脂蛋白的脂化成熟,但泛酸添加后对ApoB基因的表达无显著影响,说明泛酸加快极低密度脂蛋白的合成分泌可能不是通过ApoB这个靶点作用的。肝脏也是合成胆固醇的主要器官,在鹅上的研究发现,饲粮中添加泛酸能够降低血浆中胆固醇的含量[17],但在本试验中泛酸添加对血浆中总胆固醇的含量没有显著影响,说明泛酸对禽类和哺乳动物血浆中胆固醇的影响存在差异。
总之,饲粮中添加泛酸后生长獭兔肝脏内脂类合成、氧化和向外转运过程都加强,但从油红O染色的结果来看,泛酸的添加降低了脂滴在肝脏内的沉积,从这一结果可推断出,泛酸对肝脏内脂类的氧化和向外转运的增强程度要大于合成过程。
3.2 泛酸降低了生长獭兔脂肪组织的沉积,增加了骨骼肌对脂肪酸的摄取和利用
McNeil等[18]研究发现,饲喂缺乏B族维生素饲粮的小鼠的外周脂肪沉积量不断增加。在本试验中,饲粮中添加泛酸降低了生长獭兔脂肪组织在肩胛、胃周、肾周的沉积。这说明泛酸能够增加脂肪的分解,但本试验中泛酸的添加并未引起血浆中甘油三酯含量的增加,而是降低了血浆中甘油三酯的含量,此结果与Wittwer等[7]的结果一致。这一结果可能与血浆中白蛋白含量变化有关,来自肝脏从头合成和脂肪分解产生脂类水解后可与血浆中的白蛋白结合运输至其他组织氧化分解供能,泛酸添加后增加了血液中白蛋白的含量,加速了与脂类的结合和转运能力。乙酰辅酶A是合成胆固醇的基质[19],但在本试验中发现饲粮中添加泛酸没有显著改变生长獭兔血浆中总胆固醇的含量,这一结果与在小鼠[20]上的发现不一致,说明泛酸调节胆固醇的合成具有物种差异性。
骨骼肌是脂肪酸氧化利用的主要组织,肌肉中90%以上的脂肪酸是长链脂肪酸,主要依赖细胞外跨膜转运过程进行摄取,FATP参与了脂肪酸跨膜转运过程,具有脂酰辅酶A合成酶活性[3],通过将脂肪酸转换成脂酰辅酶A而调节脂肪酸的摄取和代谢。在本试验中,饲粮中添加40 mg/kg泛酸显著增加了骨骼肌中FATP和CPT1基因的表达量,说明泛酸能够增加骨骼肌细胞对脂肪酸的摄取和氧化利用。
4 结 论
① 饲粮中添加泛酸影响了生长獭兔肝脏内脂肪的代谢。
② 当添加水平为40 mg/kg时,泛酸能通过增加肝脏中脂肪酸的氧化和脂类外运过程,降低脂肪在肝脏内的沉积,并能降低机体脂肪的沉积率,增加骨骼肌对脂肪酸的摄取和利用。
[1] YAN S,YANG X F,LIU H L,et al.Long-chain acyl-CoA synthetase in fatty acid metabolism involved in liver and other diseases:an update[J].World Journal of Gastroenterology,2015,21(12):3492-3498.
[2] KAMANNA V S,GANJI S H,KASHYAP M L.Recent advances in niacin and lipid metabolism[J].Current Opinion in Lipidology,2013,24(3):239-245.
[3] HALL A M,SMITH A J,BERNLOHR D A.Characterization of the acyl-CoA synthetase activity of purified murine fatty acid transport protein 1[J].Journal of Biological Chemistry,2003,278(44):43008-43013.
[4] BRANCA D,SCUTARI G,SILIPRANDI N.Pantethine and pantothenate effect on the CoA content of rat liver[J].International Journal for Vitamin and Nutrition Research,1984,54(2/3):211-216.
[5] MONTEIRO D C F,PATEL V,BARTLETT C P,et al.The structure of the PanD/PanZ protein complex reveals negative feedback regulation of pantothenate biosynthesis by coenzyme A[J].Chemistry & Biology,2015,22(4):492-503.
[6] 孔敏,王宝维,葛文华,等.泛酸干预脂肪甘油三酯脂肪酶和长链脂酰辅酶A合成酶1基因表达对鹅生长和脂类代谢的反向调控[J].动物营养学报,2016,28(5):1433-1441.
[7] WITTWER C T,BECK S,PETERSON M,et al.Mild pantothenate deficiency in rats elevates serum triglyceride and free fatty acid levels[J].The Journal of Nutrition,1990,120(7):719-725.
[8] CIGALA O,PANCALLO M T,DELLA VALLE M,et al.Simvastatin in the treatment of hypercholesterolemia[J].La Clinica Terapeutica,1991,137(5):333-337.
[9] WONG E H F,CLARK R,LEUNG E,et al.The interaction of RS 25259-197,a potent and selective antagonist,with 5-HT3receptors,invitro[J].British Journal of Pharmacology,1995,114(4):851-859.
[10] YOUSSEF J A,SONG W O,BADR M Z.Mitochondrial,but not peroxisomal,β-oxidation of fatty acids is conserved in coenzyme A-deficient rat liver[J].Molecular and Cellular Biochemistry,1997,175(1/2):37-42.
[11] DE BLAS C,MATEOS G G.Feed formulation[M]//DE BLAS C,WISEMAN J.Nutrition of the rabbit.Wallingford:CAB International,1998:222-232.
[12] WEIBEL E R.Stereological techniques for electron microscopic morphometry[M]//HAYAT M A.Principles and techniques of electron microscopy:biological application.New York:Van Nostrand Rheinhold,1973:237-296.
[13] MUKHERJEE S,KATIYAR S S.Nature of O-phthalaldehyde reaction with pigeon liver fatty acid synthetase[J].Indian Journal of Biochemistry & Biophysics,1999,36(2):63-68.
[14] BRITTON C H,MACKEY D W,ESSER V,et al.Fine chromosome mapping of the genes for human liver and muscle carnitine palmitoyltransferase Ⅰ (CPT1A and CPT1B)[J].Genomics,1997,40(1):209-211.
[15] URBAN T,MIKOLSOVR,KUCIEL J,et al.A study of associations of the H-FABP genotypes with fat and meat production of pigs[J].Journal of Applied Genetics,2002,43(4):505-509.
[16] FRAYN K N,ARNER P,YKI-JRVINEN H.Fatty acid metabolism in adipose tissue,muscle and liver in health and disease[J].Essays in Biochemistry,2006,42:89-103.
[17] 张肖,王宝维,岳斌,等.泛酸对5~16周龄五龙鹅生长性能、屠宰性能、肌肉品质、营养物质利用率及血清生化指标的影响[J].动物营养学报,2015,27(11):3411-3419.
[18] MCNEIL C J,BEATTIE J H,GORDON M J,et al.Nutritional B vitamin deficiency disrupts lipid metabolism causing accumulation of proatherogenic lipoproteins in the aorta adventitia of ApoE null mice[J].Molecular Nutrition & Food Research,2012,56(7):1122-1130.
[19] RAINA V,GUPTA S,YADAV S,et al.Simvastatin induced neurite outgrowth unveils role of cell surface cholesterol and acetyl CoA carboxylase in SH-SY5Y cells[J].PLoS One,2013,8(9):e74547.
[20] LATA G F,ANDERSON E.Effect of prolonged pantothenic acid deprivation upon cholesterol synthesis in the rat[J].Archives of Biochemistry and Biophysics,1954,53(2):518-520.
*Corresponding author, professor, E-mail: chlf@sdau.edu.cn
(责任编辑 菅景颖)
Effects of Pantothenic Acid Supplementation on Lipid Metabolism in Liver of Growing Rex Rabbits
LIU Lei ZHAO Nan ZHANG Bin LI Fuchang*
(CollegeofAnimalScienceandTechnology,ShandongAgriculturalUniversity,Tai’an271018,China)
This experiment was conducted to investigate the effects of pantothenic acid supplementation on lipid metabolism in liver of growing Rex rabbits. A total of 160 weaned Rex rabbits with the similar body weight of were randomly divided into 4 groups with 40 replicates per group and 1 rabbit per replicate. Rabbits in the control group were fed a basal diet, and the others in the experimental groups were fed the basal diet supplemented with 10, 20 and 40 mg/kg pantothenic acid, respectively. The pre-test period lasted for 7 days, and the experimental period lasted for 53 days. The results showed that dietary supplemented with 40 mg/kg pantothenic acid significantly increased the scapular fat deposition rate, perigastric fat deposition rate and perirenal fat deposition rate of growing Rex rabbits (P<0.05), and dietary supplemented with 10 to 20 mg/kg pantothenic acid significantly decreased the liver fat droplet content of growing Rex rabbits compared with control group (P<0.05). Dietary pantothenic acid supplemental level had no significant effects on plasma total cholesterol and albumin contents of growing Rex rabbits (P>0.05). With the pantothenic acid supplemental level increasing, the plasma triglyceride content of growing Rex rabbits tended to reduce first and then became stable, and it in 20 and 40 mg/kg supplemental groups was significantly lower than that in control group (P<0.05). Compared with control group, dietary supplemented with 20 to 40 mg/kg pantothenic acid significantly increased the plasma very low density lipoprotein content of growing Rex rabbits (P<0.05). Compared with control group, dietary supplemented with 40 mg/kg pantothenic acid significantly increased the expression levels of hormone-sensitive lipase (HSL) gene in liver and fatty acid transport protein (FATP) gene in skeletal muscle (P<0.05), dietary supplemented with 20 to 40 mg/kg pantothenic acid significantly increased the expression level of carnitine palmityl transferase-1 (CPT1) gene in liver (P<0.05), and dietary supplemented with 10 to 40 mg/kg pantothenic acid significantly increased the expression levels of fatty acid synthase (FAS) gene andCPT1 gene in skeletal muscle (P<0.05). In conclusion, pantothenic acid supplementation affects the lipid metabolism in liver of Rex rabbits. Pantothenic acid with the supplemental level of 40 mg/kg can decrease the lipid deposition in liver and the fat deposition rate of body, and increase the uptake and utilization of fatty acids for skeletal muscle.[ChineseJournalofAnimalNutrition, 2017, 29(6):1961-1968]
Rex rabbits; pantothenic acid; liver; lipid metabolism
10.3969/j.issn.1006-267x.2017.06.017
2016-12-05
中国博士后科学基金项目(2015M58061);山东农业大学青年科技创新基金项目(2015—2016);山东农业大学博士后科学基金项目(2015—2017);现代农业产业技术体系建设专项(CARS-44-B-1)
刘 磊(1985—),男,山东潍坊人,讲师,博士,从事家兔营养与生理研究。E-mail: liusanshi1985@126.com
*通信作者:李福昌,教授,博士生导师,E-mail: chlf@sdau.edu.cn
S816
A
1006-267X(2017)06-1961-08
——水溶性维生素泛酸篇

