三阴型乳腺癌中CD47的表达及其临床意义
张 帆,张 伟,焦南林,刘 霞,曹 明,徐国祥,张伟璇
三阴型乳腺癌中CD47的表达及其临床意义
张 帆1,张 伟1,焦南林1,刘 霞1,曹 明2,徐国祥1,张伟璇1
目的 探讨CD47在三阴型乳腺癌(triple negative breast carcinoma, TNBC)中的表达及其与临床病理特征的相关性。方法 运用组织芯片结合免疫组化Bond Polymer Refine Detection法对185例TNBC及35例非三阴型乳腺癌(non-triple negative breast carcinoma, NTNBC)进行染色,观察CD47在TNBC中的表达,分析其与各临床病理特征的关系。结果 TNBC肿瘤细胞CD47的表达均高于NTNBC,差异有统计学意义(P<0.05)。TNBC肿瘤细胞CD47阳性率为52.3%,与临床分期(P<0.05)、淋巴结转移/远处转移(P<0.05)和脉管侵犯(P<0.05)密切相关。结论 CD47表达与TNBC的临床分期、淋巴结转移/远处转移和脉管侵犯有相关性,可以作为预后评判指标,也是潜在的免疫治疗靶点。
乳腺肿瘤;三阴型乳腺癌;CD47;免疫组织化学;靶向治疗
三阴型乳腺癌(triple negative breast carcinoma, TNBC)包括少数非特殊类型浸润性乳腺癌(invasive breast carcinoma of no special type)和基底细胞样乳腺癌(basal-like breast carcinoma, BLBC),其不表达ER、PR、人类上皮生长因子受体(HER-2/C-erbB-2)[1]。TNBC在治疗上,对激素治疗(三苯氧胺等)不敏感,且无法进行靶向(赫赛汀)治疗,传统的细胞毒性化疗方法对其疗效不佳。CD47主要表达于癌细胞表面,通常被认为是癌细胞免于宿主免疫系统攻击的保护性受体,定位于细胞膜或细胞质。CD47是一类“don't eat me”信号,它通过与巨噬细胞表面的SIRPα相互结合抑制巨噬细胞的吞噬功能。本文旨在观察CD47在TNBC中的表达及其与临床病理特征的关系,并探讨是否可以作为潜在的治疗靶点。
1 材料与方法
1.1 临床资料 收集2007年1月~2016年1月皖南医学院弋矶山医院临床病理科诊断为乳腺癌标本3 689例,其中193例(193/3 689,5.23%)TNBC,去除临床病理资料不完整者8例,合计185例TNBC,不包含特殊类型的乳腺癌,如腺样囊性癌、化生性癌等。临床资料包括患者年龄、肿瘤直径、有无脉管侵犯、腋窝淋巴结转移/远处转移情况(鉴于远处转移病例较少,故与淋巴结转移合并作为单一因素)等。随机选择同期非三阴型乳腺癌(non-triple negative breast carcinoma, NTNBC)标本35例作为对照。TNBC患者年龄25~86岁,中位年龄50岁。其中左侧乳腺102例,右侧乳腺86例,双侧乳腺5例。
1.2 方法 按照WHO(2012)乳腺肿瘤分类诊断标准[1]以及Perou等[2]分子分型依据、2010年美国临床肿瘤学会(ASCO)和美国病理学家协会(CAP)雌孕激素受体判读标准[3]以及2013年ASCO/CAP乳腺癌人类上皮生长因子受体判读推荐指南[4],由两位乳腺病理专科医师对185例TNBC进行复审。
1.2.1 组织芯片制作 选取目标组织石蜡标本,采用取Quick-Ray组织微阵列系统,显微镜下划定所需要区域,37~40 ℃孵育供体蜡块15~20 min,从供体蜡块中用针(孔径1.6 mm)抽取目标组织,缓慢转移至受体蜡块(事先在蜡块一角做标记)的相应孔内,保持深度为4.0 mm,并做好资料记录,蜡块切面朝下置于包埋盒中,70 ℃烤箱30~60 min,组织芯片完全透明后包埋,置于-20 ℃环境下硬化后备用。组织芯片的每孔直径为1.6 mm,每个病例采用2孔用于评价。
1.2.2 免疫组化 用正常皮肤组织内的皮脂腺作为阳性对照,而皮脂腺周围上皮组织和间质成分作为阴性对照[5]。兔抗人单克隆抗体CD47(IgG兔抗人多克隆抗体,稀释浓度1 ∶500)购自北京中杉金桥公司,使用Leica BOND-MAX全自动免疫组化仪采用免疫组化Bond Polymer Refine Detection法进行检测。
1.3 结果判断 所有免疫组化片均由两位乳腺病理专科医师采用双盲法单独判读,分别评估TNBC和NTNBC中CD47的表达。仅评判浸润性癌成分,因考虑肿瘤的异质性现象,以整张切片表达较强(>10%)的部位来评价,对表达较强的区域进行半定量判读[6]。(1)根据染色比例评分:<5%为0分,5%~24%为1分,25%~49%为2分,50%~74%为3分,≥75%为4分。(2)根据染色强度评分:无阳性着色为0分,弱阳性为1分,中等阳性为2分,强阳性为3分。两项结果相乘总分≥5分为高表达,即为阳性;≤4分为低表达,即为阴性。计算高表达病例所占的百分比。
1.4 统计学分析 应用SPSS 19.0软件进行统计学处理,CD47在TNBC和NTNBC中的表达比较,以及各临床病理特征组间表达的差异性比较均应用χ2检验,以P<0.05为差异有统计学意义,所有P值采用双侧检验。
2 结果
2.1 形态学特征 TNBC多由实性巢状、片状的癌细胞组成(图1),无或较少出现管状分化,肿瘤呈推进性生长方式;肿瘤周边或癌细胞之间有不同程度的淋巴细胞浸润;部分肿瘤呈非典型髓样癌的特征;可出现地图样坏死(图2);部分癌细胞中央出现无细胞性纤维化区;癌细胞胞质欠丰富,核/质比高,胞核呈卵圆形,呈泡状核样,核分裂象多见,可见核仁。
2.2 CD47在TNBC和NTNBC中的表达 CD47在TNBC中胞膜呈棕色颗粒分布(图3)或胞膜和胞质有棕色颗粒分布(图4),而CD47在NTNBC中表达的细胞数明显较少(图5)。CD47在TNBC和NTNBC中染色比例和染色强度详见表1,CD47在TNBC中的阳性率明显高于NTNBC中的表达(P<0.01)。
2.3 CD47表达与乳腺癌临床病理特征的相关性 CD47在临床分期为Ⅲ+Ⅳ期病例中的阳性率明显高于Ⅰ+Ⅱ期(P<0.05),有淋巴结转移/远处转移者的阳性率也明显高于无淋巴结转移/近处转移者(P<0.01);有脉管侵犯者的阳性率亦高于无脉管侵犯者(P<0.01);与患者年龄、肿瘤大小无相关性(P>0.05,表2)。
3 讨论
CD47是一种细胞膜表面分子,属于免疫球蛋白超家族成员之一;其功能是通过阻滞巨噬细胞表面信号调节蛋白α(signal regulatory protein-α, SIRPα)的表达来抑制吞噬作用[7]。CD47充当“don’t eat me”的自身信号和标记,一旦CD47缺失,易引起自体吞噬系统对老化和损伤的细胞进行吞噬[7]。虽然在正常人体细胞中始终存在低表达,研究发现CD47在许多人类肿瘤中过表达,包括白血病、淋巴瘤、多发性骨髓瘤和多种实体瘤,使其成功逃避自身免疫系统的监视[7]。最近有数据显示,肿瘤通过抗吞噬信号的表达,包括CD47逃避巨噬细胞的吞噬[8]。Akel等[9]分别对日光性皮炎(actinic keratoses, AK)、原位鳞状细胞癌(squamous cell carcinoma in situ, SCCIS)、鳞状细胞癌(squamous cell carcinoma, SCC)以及角化棘皮瘤(keratoacanthoma, KA)进行CD47免疫组化标记发现,在CD47表达的染色比例和染色强度方面,SCC与AK比较、SCC与SCCIS比较、SCCIS与AK比较均明显升高。在头颈部SCC中CD47的高表达最初发现与自然杀伤细胞数量减少有关[10]。文献报道[11-12]CD47在口咽部和食管SCC中表达升高。
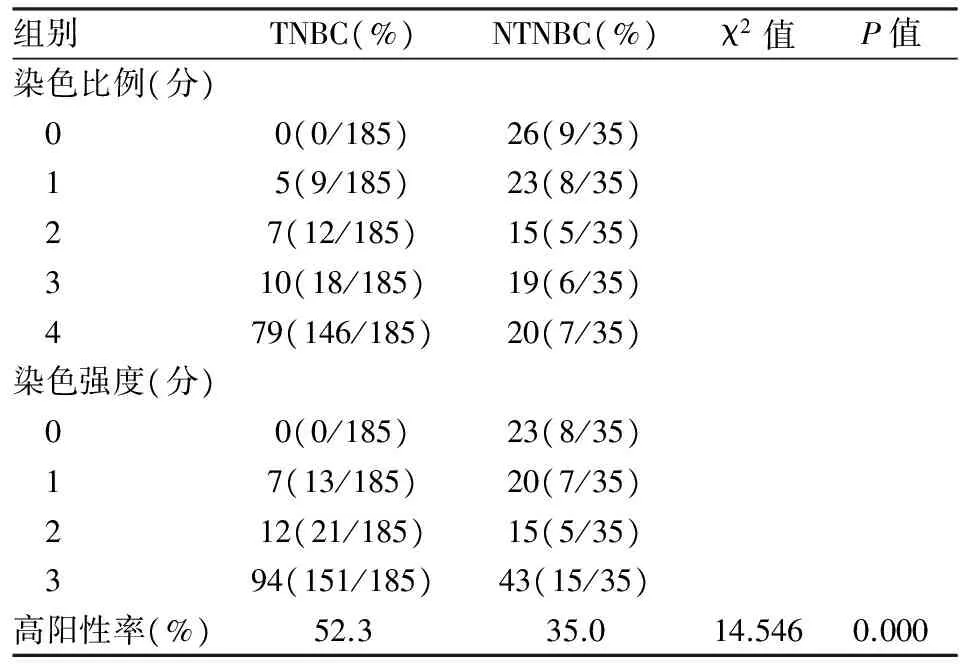
表1 CD47在TNBC和NTNBC中染色比例、强度及高阳性率
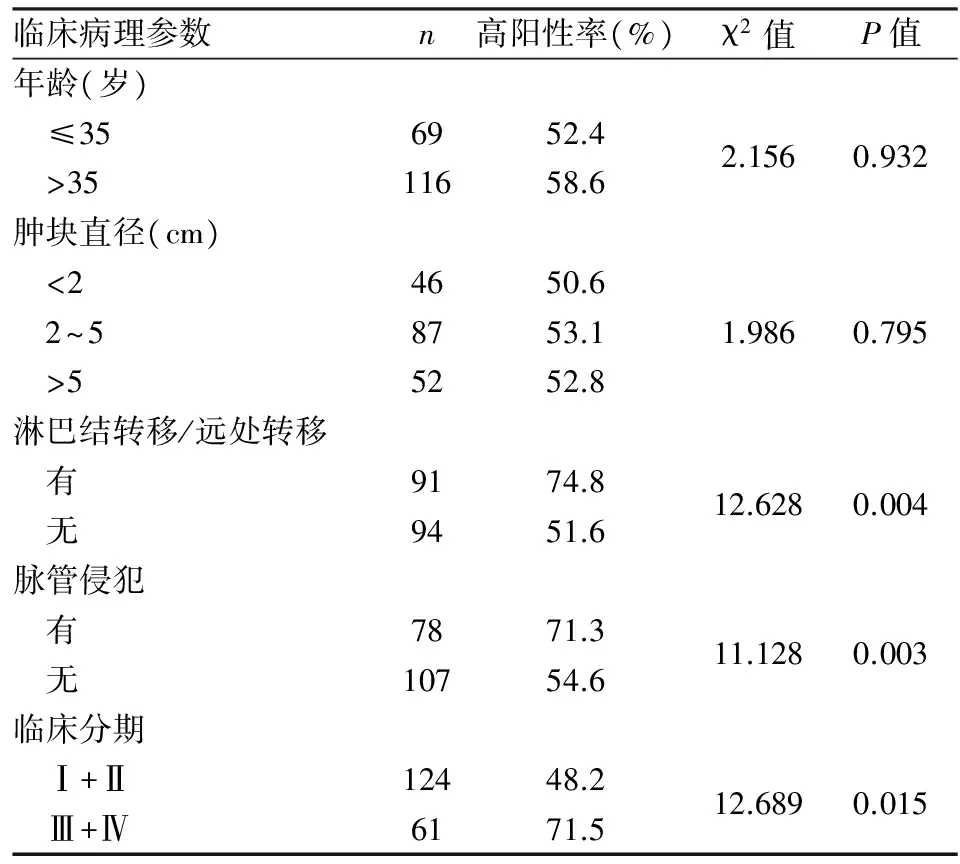
表2 CD47表达与乳腺癌临床病理特征的相关性
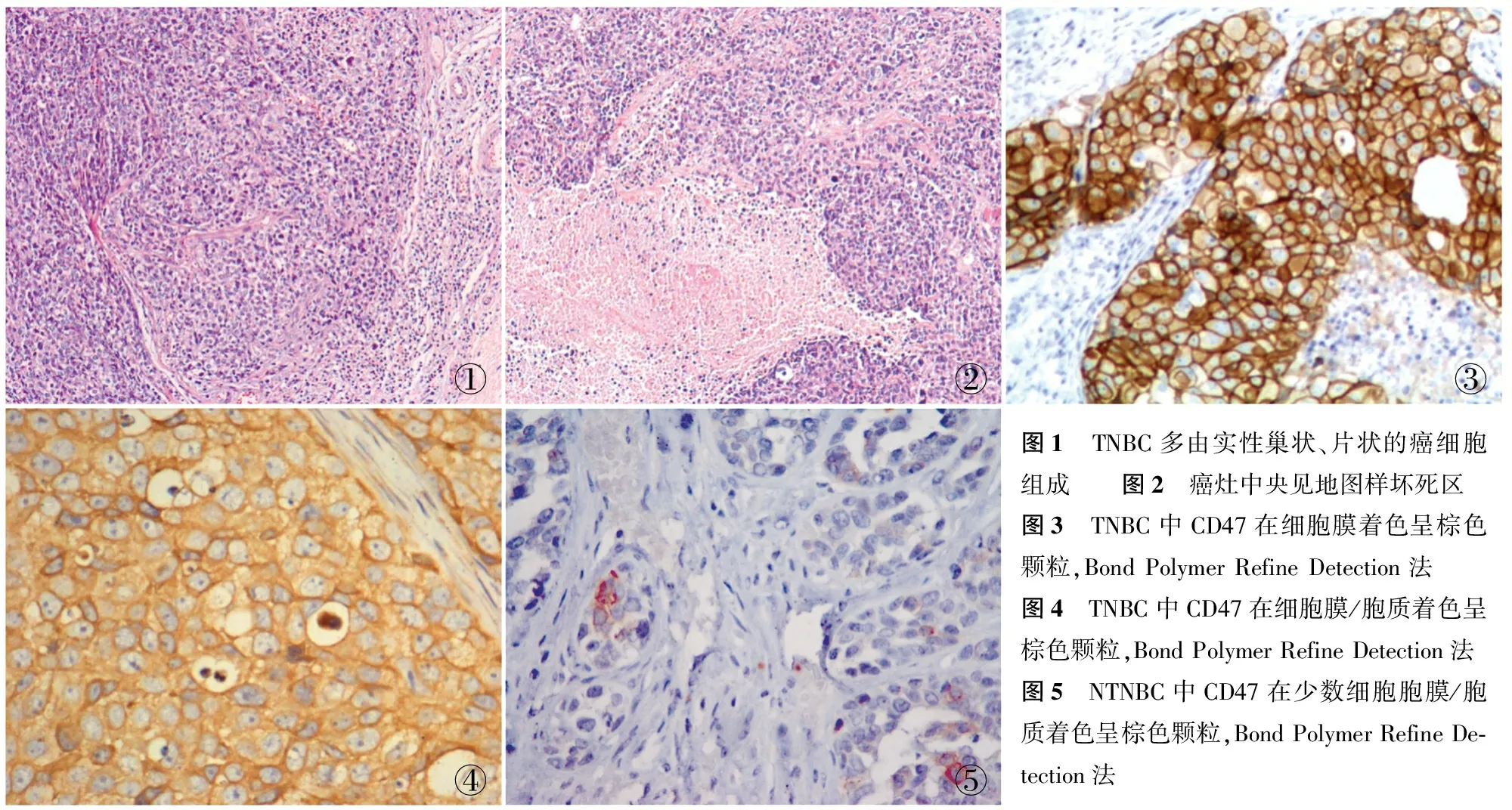
①②③④⑤图1 TNBC多由实性巢状、片状的癌细胞组成 图2 癌灶中央见地图样坏死区图3 TNBC中CD47在细胞膜着色呈棕色颗粒,BondPolymerRefineDetection法 图4 TNBC中CD47在细胞膜/胞质着色呈棕色颗粒,BondPolymerRefineDetection法图5 NTNBC中CD47在少数细胞胞膜/胞质着色呈棕色颗粒,BondPolymerRefineDe⁃tection法
本组发现TNBC中CD47的阳性率与患者年龄、肿块大小无相关性(P>0.05);与临床分期(P<0.05)、淋巴结转移/远处转移(P<0.01)和脉管侵犯(P<0.01)有明显相关性,提示CD47的高表达与临床预后有关联,可以作为预测TNBC的预后指标。CD47在肿瘤进展(tumor progress)过程中的主要作用是维持和促进肿瘤细胞的生长和侵袭,在多种类型的肿瘤中,如粒细胞性白血病[13]、非霍奇金淋巴瘤[14]、头颈部SCC[10]、膀胱癌[15]和乳腺癌[16],CD47的高表达与这些肿瘤的不良预后相关。可能的原因是在肿瘤细胞表面高表达CD47,保护这些细胞免受吞噬。Kingsley等[17]发现CD47与SIRPα的相互作用,与巨噬细胞融合有关,这是形成破骨细胞的重要步骤。破骨细胞的激活,可以促进肿瘤细胞转移至骨,这方面还需进一步分析。
CD47参与癌症的复发[18]。癌干细胞是癌细胞中具有干细胞功能的一群细胞,现已在多种恶性肿瘤中鉴定出干细胞,包括急性粒细胞性白血病、前列腺癌、Ewing肉瘤、脑肿瘤、结肠癌、肺癌、卵巢癌、肝癌和间叶肿瘤。传统的肿瘤治疗方法(放、化疗)能够抑制肿瘤生长,而无法消灭干细胞,进而干细胞重新生长形成肿块,以至于肿瘤复发。Majeti等[19]发现CD47在急性粒细胞性白血病干细胞中高表达,而CD47的水平也是鉴定白血病细胞的标志物。在细胞培养的试管中,抗CD47单克隆抗体能够提升对白血病干细胞的吞噬作用,这些结果均预示CD47能够使干细胞成功逃避免疫系统的歼灭,而导致肿瘤复发。在TNBC中,有部分病例为基底细胞样表型,表达乳腺干细胞抗体,如CK5/6、EGFR、SMA、p63等,这可能是TNBC易于复发和远处转移的原因之一,但还需进一步分析。
越来越多的证据显示单克隆抗体对于肿瘤治疗是一种有效且致命的武器,抗CD47抗体已经在恶性肿瘤治疗中获得良好的疗效,如其可以提升吞噬细胞对急性粒细胞性白血病[18]和膀胱癌[15]中癌干细胞的吞噬能力。联合抗CD47抗体和利妥昔单抗能够促进吞噬作用并杀灭非霍奇金淋巴瘤细胞[14]。Chao等[7]提出4种可能途径:(1)抗CD47抗体通过阻断CD47与SIRPα的相互作用,进而促使对肿瘤细胞的吞噬;(2)抗CD47抗体通过Fc-依赖机制消灭癌细胞,如抗体依赖性细胞毒和补体依赖性细胞毒;(3)直接诱导肿瘤细胞凋亡;(4)抗CD47抗体通过激活适当的免疫反应,促进对肿瘤细胞的吞噬。Zhao等[20]在非小细胞肺癌细胞系中运用功能获得和功能敲除的方法,发现siRNA下调CD47功能可以抑制癌细胞的侵袭和转移。同时被转染过表达的CD47能促进癌细胞侵袭和转移,CD47特异性siRNA能显著降低肿瘤的生长和转移。Casey等[21]发现MYC肿瘤基因调节肿瘤细胞表面两种免疫节点蛋白,包括CD47和程序性死亡配体-1(programmed death ligand-1, PD-L1)。通过对老鼠肿瘤和人类肿瘤细胞MYC基因的抑制,可以降低CD47和PD-L1 mRNA和蛋白的水平,MYC基因是CD47和PD-LI基因的激活剂。老鼠肿瘤细胞中MYC基因失活可下调CD47和PD-L1的表达,从而增强抗肿瘤免疫反应,抑制肿瘤的继续生长,进一步提示CD47对肿瘤的复发起一定作用。本组发现在TNBC中CD47的染色比例和染色强度均明显高于NTNBC中的表达(P<0.01),可能说明TNBC较NTNBC更多地获得CD47表面分子的保护,从而逃避机体免疫系统的监视,为其能够躲避自身杀伤细胞的歼灭提供保护,进而在临床上展示较差的预后,这一结论仍然有待进一步的基础研究证实。那么,通过抑制CD47的表达,应可以除去肿瘤细胞的“don’t eat me”的作用 ,让细胞毒性细胞能够识别,从而达到杀伤肿瘤细胞的目的,为进一步的靶向治疗打下基础。本组缺少对所有病例的随访资料,使CD47的表达在实际临床应用中缺乏强有力的说服力,有待进一步的随访。
综上所述,CD47在TNBC的发生、发展过程中扮演重要角色,可以作为临床预后判断的重要指标,也可以作为治疗TNBC的有效靶点。
[1] Lakhani S R, Ellis I O, Schitt S J,etal. WHO classification of tumours of the breast[M]. 4th ed. Lyon: IARC Press, 2012:34-75.
[2] Perou C M, Sorlie T, Eisen M B,etal. Molecular portraits of human breast tumours[J]. Nature, 2000,406(6797):747-752.
[3] Hammond M E, Hayes D F, Dowser M,etal. American society of clinical oncology/college of American pathologists guideline recommendations for immunohistochemical testing of estrogen and progesterone receptors in breast cancer[J]. J Clin Oncol, 2010,28(16):2784-2795.
[4] Wolff A C, Hammond M E, Hicks D G,etal. Recommendations for human epidermal growth factor receptor 2 testing in breast cancer: American Society of Clinical Oncology /College of American Pathologists clinical practice guideline update[J]. Arch Pathol Lab Med, 2007,131(1):18-43.
[5] Caston S S, Cooper E E, Prashanth C S,etal. CD47 expression in cryoprerved equine cutaneous masses and normal skin[J]. J Veter Diag Invest, 2016,28(4):408-413.
[6] 裴小娟,薛秀芬,朱彩玲,等. 膜突蛋白和上皮细胞钙黏蛋白在非特殊类型乳腺浸润性癌中的表达及临床病理意义[J]. 中华病理学杂志, 2016,48(8):550-555.
[7] Chao M P, Weissman I L, Majeti R. The CD47-SIRPα pathway in cancer immune evasion and potential therapeutic implications[J]. Curr Opin Immunol, 2012,24(2):225-232.
[8] Yaguchi T, Sumimoto H, Kudo-Saito C,etal. The mechanisms of cancer immunoescape and development of overcoming strategies[J]. Int J Hematol, 2011,93(3):294-300.
[9] Akel R, Kurban M, Abbas O. CD47 expression for in situ and invasive cutaneous epithelial lesions[J]. J Am Acad Dermatol, 2016,75(2):434-436.
[10] Kim M J, Lee J C, Lee J J,etal. Association of CD47 with natural killer cell-mediated cytotoxicity of head-and-neck squamous cell carcinoma lines[J]. Tumor Biol, 2008,29(1):28-34.
[11] Vermeer D W, Spanos W C, Vermeer P D,etal. Radiation-induced loss of cell surface CD47 enhances immune-mediated clearance of human papillomavirus-positve cancer[J]. Int J Cancer, 2013,133(1):120-129.
[12] Suzuki S, Yokobori T, Tanaka N,etal. CD47expression regulated by the miR-133α tumor suppressor is a novel prognostic marker in esophageal squamous cell carcinoma[J]. Oncol Rep, 2012,28(2):465-472.
[13] Jaiswal S, Jamieson C H, Pang W W,etal. CD47 is upregulated on circulating hematopoietic stem cells and leukemia cells to avoid phagocytosis[J]. Cell, 2009,138(2):271-285.
[14] Chao M P, Alizadeh A A, Tang C,etal. Anti-CD47 antibody synergizes with rituximab to promote phagocytosis and eradicate non-Hodgkin lymphoma[J]. Cell, 2010,142(5):699-713.
[15] Chan K S, Espinosa I, Chao M,etal. Identification, molecular characterization, clinical prognosis, and therapeutic targeting of human bladder tumor-initiating cells[J]. Proc Natl Acad Sci USA, 2009,106(4):14016-14021.
[16] Manna P P, Frazier W A. CD47 mediate killing of breast tumor cells via Gi-dependent inhibition of protein kinase A[J]. Cancer Res, 2004,64(3):1026-1036.
[17] Kingsley L A, Fournier P G, Chirgwin J M,etal. Molecular biology of bone metastasis[J]. Mol Cancer Ther, 2007,6(10):2609-2617.
[18] Kong F, Gao F, Li H,etal. CD47: a potential immunotherapy target for eliminating cancer cells[J]. Clin Transl Oncol, 2016,18(1):1-5.
[19] Majeti R, Chao M P, Alizadeh A A,etal. CD47 is an adverse prognosis factor and therapeutic antibody target on human acute myeloid leukemia stem cells[J]. Cell, 2009,138(2):286-299.
[20] Zhao H, Wang J X, Kong X D,etal. CD47 promotes tumor invasion and metastasis in non-small cell lung cancer[J]. Scientific Rep, 2016,7(6):1-11.
[21] Casey S C, Tong L, Li Y,etal. MYC regulates the antitumor immune response through CD47 and PD-L1[J]. Science, 2016,352(6282):1-5.
Expression and clinical significance of CD47 in triple negative breast carcinoma
ZHANG Fan1, ZHANG Wei1, JIAO Nan-lin1, LIU Xia1, CAO Ming2, XU Guo-xiang1, ZHANG Wei-xuan1
(1DepartmentofPathology,YijishanHospitalAffiliatedtoWannanMedicalCollege,Wuhu241001,China;2DepartmentofPathology,WuhuFirstHospital,Wuhu241000,China)
Purpose To explore the expression and clinical significance of CD47 in triple negative breast carcinoma (TNBC), and to analyze the relationship between CD47 expression and clinicopathologic features. Methods Immunohistochemical of Bond Polymer Refine Detection staining was performed on tissue array. It contains 185 cases of TNBC and 35 cases of non triple negative breast carcinoma (NTNBC). Then we observed the expression of CD47 in TNBC, and analyzed the relationship between the expression of CD47 and various clinical pathological characteristics. Results The expression of CD47 in tumor cells of TNBC was higher than that in NTNBC, and the difference was statistically significant (P<0.05). The CD47 expression rate in TNBC tumors was 52.3%. It was closely related to clinical stage (P<0.05), lymph node metastasis and distant metastasis (P<0.05) and vascular invasion (P<0.05). Conclusion The expression of CD47 is correlated with the clinical stage, lymph node metastasis, distant metastasis and vascular invasion of TNBC. CD47 can be used as a prognostic indicator and a potential target for immune therapy.
breast neoplasm; triple negative breast carcinoma; CD47; immunohistochemistry; targeted therapy
1皖南医学院弋矶山医院临床病理科,芜湖 2410012芜湖市第一人民医院病理科 241000
张 帆,男,硕士生导师,主任医师。Tel:(0553)5739789,E-mail: zhangfan401401@aliyun.com
时间:2017-5-17 23:53 网络出版地址:http://kns.cnki.net/kcms/detail/34.1073.R.20170517.2352.015.html
R 737.9
A
1001-7399(2017)05-0539-05
10.13315/j.cnki.cjcep.2017.05.015
接受日期:2017-02-28

