缺血预处理降低脑缺血再灌注损伤及TLR4、TNF-α mRNA的表达
张 婧,邹玉安,董晓华,马 飞,王欢欢,刘东艳,郭 姮
(1.河北北方学院,河北 张家口 075000;2.河北北方学院附属第一医院神经内科,河北 张家口 075000;3.北京中医药大学东直门医院检验科,北京 10070)
缺血预处理降低脑缺血再灌注损伤及TLR4、TNF-α mRNA的表达
张 婧1,邹玉安2,董晓华1,马 飞1,王欢欢1,刘东艳3,郭 姮3
(1.河北北方学院,河北 张家口 075000;2.河北北方学院附属第一医院神经内科,河北 张家口 075000;3.北京中医药大学东直门医院检验科,北京 10070)
目的 观察Toll样受体4(TLR4)和肿瘤坏死因子-α(TNF-α)的表达变化,探讨缺血预处理对大鼠脑缺血再灌注损伤的保护作用。方法 36只SPF级健康雄性SD大鼠随机分为缺血预处理组(CIP组)、缺血再灌注组(I/R组)和假手术组(Sham组)各12只;I/R组采用线栓法阻断大脑中动脉(MCAO)2 h建立模型,CIP组先给予MCAO阻断10 min,再灌注72 h后给予与I/R组相同的处理,假手术组仅分离血管。均于术后1 d取材,TTC染色法检测脑梗死体积,Zea Longa评分标准对神经功能评分,荧光实时定量PCR(Real-time Quantitative polymerase chain reaction)法测定TLR4和TNF-α mRNA表达水平。结果 缺血再灌注1 d后,CIP组大鼠脑梗死体积、神经功能缺损评分明显低于I/R组,差异有显著统计学意义(P<0.05);TLR4、TNF-α mRNA CIP组与I/R组表达水平明显高于Sham组,差异有显著统计学意义(P<0.05,P<0.01),CIP组表达水平明显低于I/R组(P<0.05)。结论 缺血预处理能改善由再灌注损伤引起的脑损伤与功能障碍,可能与下调促炎因子的表达、减轻炎症反应有关。
大鼠;缺血预处理;缺血再灌注损伤;Toll样受体4;肿瘤坏死因子-α
脑缺血预处理(cerebral ischemic preconditioning,CIP)能够减轻缺血再灌注对脑组织造成的损伤,是一种强有力的内源性神经保护机制[1]。炎症反应在再灌注损伤这一动态过程中起着关键性作用,减轻炎症反应是治疗缺血性脑血管病的重要环节[2-3]。脑缺血预处理对脑组织有保护作用,但机制尚未完全阐明。炎症的作用机制及信号通路极其复杂,本研究通过建立大鼠局灶性脑缺血预处理模型,采用实时荧光定量PCR法,探讨了Toll样受体4(Toll-like receptors,TLR4)和肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)在脑缺血预处理中的生物学作用与调控机制。
1 材料与方法
1.1 材料与试剂
清洁级健康雄性Sprague Dawley大鼠36只,3~4月龄,体质量(250±30)g,购于北京华阜康生物科技股份有限公司,实验动物许可证:SCXK(京)2014-0004,合格证号:NO11401300034129。
RNAiso Plus试剂(TaKaRa,Japan)、DL2000 DNA Ladder(北京索莱宝科技有限公司)、2,3,5-氯化三苯基四氮唑(Amresco,美国)、PrimeScript RT reagent Kit(TaKaRa,Japan)、DEPC水、SYBR®Premix Ex TaqTMII(TaKaRa,Japan)、引物及内参序列合成(宝生物工程大连有限公司)。
1.2 方法
1.2.1 实验动物分组 36只SD大鼠于屏障动物实验室适应性饲养观察1周,术前禁食12 h,可自由饮水。随机分为缺血预处理组(CIP组)、缺血再灌注组(I/R组)和假手术组(Sham组)各12只,每组随机选取6只用于脑梗死体积测定。
1.2.2 模型建立 采用改良Zea Longa法制备大鼠MCAO模型。CIP组:采用大脑中动脉二次线栓法[4]制备缺血预处理模型,10%水合氯醛(350 mg·kg-1)大鼠腹腔注射,麻醉成功后仰卧位固定,颈部剃毛,常规碘伏消毒,取颈正中纵向切口,钝性分离右颈总动脉、右颈内动脉、右颈外动脉及迷走神经,右颈总动脉下方穿一根引线,结扎右颈外动脉并离断为近心端及远心端,动脉夹夹闭颈总动脉,在颈内动脉上打一活结暂时阻断血流,在右颈外动脉近心端距颈总动脉分叉4~5 mm处用眼科剪剪一约0.2 mm小口,将颈外动脉近心端拉至与颈内动脉成一条直线,将直径0.26 mm尼龙栓线通过上述小口缓慢插入右颈外动脉,经右颈总动脉分叉处进入右颈内动脉,插入深度约18 mm,稍感阻力时停止,以免阻塞大脑前动脉。将右颈外动脉近心端及栓线一并结扎,小心松开右颈内动脉处的活结及动脉夹,10 min后轻轻将尼龙栓线拔出至右颈外动脉断端,完成缺血预处理。缝合切口,给予抗生素预防性处理。术后3 d相同时间点再次向右颈内动脉插入尼龙栓线,2 h后轻轻拔出尼龙栓线,将右颈外动脉近心端及尼龙栓线一并结扎,切口消毒缝合。I/R组:仅向右颈内动脉插入尼龙栓线2 h后轻轻拔出尼龙栓线,具体操作步骤见CIP组。Sham组仅分离颈总动脉,不给予栓塞处理。
1.2.3 脑梗死体积测定方法 再灌注1 d后,CIP组、I/R组及Sham组各取6只大鼠,深度麻醉后迅速断头取脑,立即在-20 ℃冰箱冷冻约15~20 min,切除额极及枕极,放入冠状位脑切片模具中,切成5片厚度均匀的脑片,置于2% TTC磷酸盐缓冲溶液中,37 ℃水浴箱避光孵育30 min,4%多聚甲醛中4 ℃固定24 h。染色后脑组织非梗死区为红色,梗死区为白色,数码相机拍照后采用图像分析脑梗死体积。
1.2.4 神经功能行为缺陷评分/神经功能学评价方法 按照Zea Longa 5级评分标准[5]采取双盲法进行评分,评分标准:0分:未观察到神经功能缺损症状;1分:不能完全伸展左前肢(轻度局灶性神经功能缺损);2分:向左侧转圈,出现追尾现象(中度神经功能缺损);3分:行走时向左侧倾倒或打滚(重度神经功能缺损);4分:不能自发行走,重度意识障碍。1~3分者为手术成功,0分和4分均剔除。
1.2.5 大鼠大脑皮层TLR4和TNF-α mRNA表达检测方法 采用SYBR®GREENⅠ荧光嵌合实时荧光定量PCR法检测大鼠大脑皮层TLR4和TNF-α mRNA的表达。分别于术后1 d断头处死动物,快速分离并取出右侧大脑皮层,约100 mg,Triozl法提取总RNA,紫外分光光度计测定A260/A280比值、RNA浓度值,1%琼脂糖凝胶电泳分析RNA的完整性,并对总RNA进行去gDNA纯化处理。引物合成:TLR4上游:GCCGGAAAGTTATTGTGGTGGT,下游:ATGGGTTTTAGGCGCAGAGTTT;TNF-α上游:ACCGCAGAA AGAAGCCGTGG,下游:TGCCCCGCTTACAGTTCCTC;内参(β-actin)上游:GGAGATTACTGCCCTGGCTCCTA,下游:GACTCATCGTACTCCTGCTTGCTG。反应体系均为20 μL,其中SYBR Premix Ex Taq II 10 μL,上下游引物各0.8 μL,ROX Reference Dye 0.4 μL,cDNA 2μL,加RNase Free水至20 μL,反应条件为:95 ℃预变性30 s;95 ℃ 5 s,60 ℃ 31 s,40个循环。目的基因与β-actin基因同时进行Real-time PCR反应,每个样本均设3个平行对照反应孔,对所得CT值取均值,并通过分析溶解曲线,排除非特异扩增。TLR4和TNF-α mRNA相对表达量的计算方法采用相对定量2-△△CT法[6]。
1.3 统计学方法

2 结 果
2.1 脑梗死体积测定
再灌注后1 d的大鼠,Sham组未见梗死灶,CIP组与I/R组均出现白色不规则梗死灶,脑梗死体积分别为(19.04±1.65)mm3和(34.55±4.78)mm3。I/R组脑梗死体积高于Sham组(P<0.01);CIP组脑梗死体积与I/R组比较显著减小(P<0.05)(见图1)。
2.2 神经功能学评价
术后1 d评价神经功能行为缺陷,Sham组大鼠无神经功能障碍,评分为0分;CIP组与I/R组大鼠均出现不同程度的手术对侧肢体瘫痪,CIP组神经功能评分(1.8±0.4)低于I/R组(2.8±0.4),差异有统计学意义(P<0.05)。
2.3 大鼠大脑皮层TLR4、TNF-α mRNA的表达
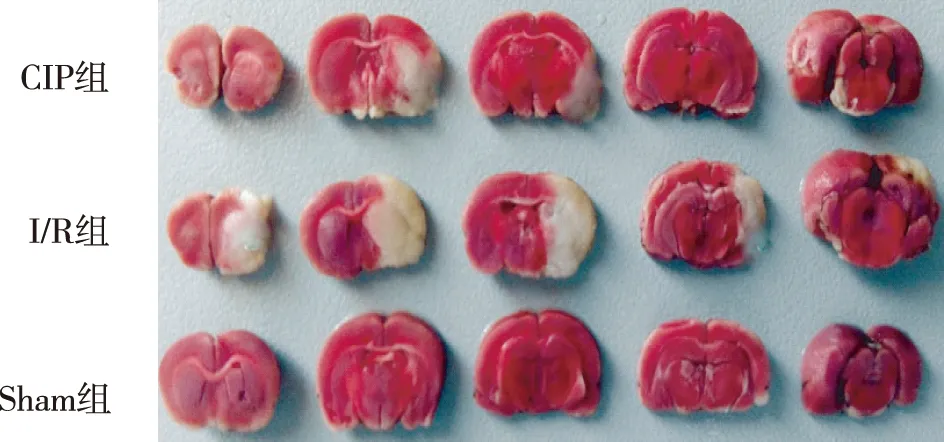
图1 脑梗死体积比较
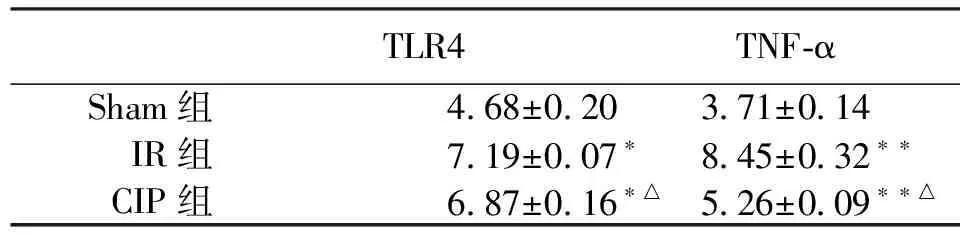
TLR4TNF⁃α Sham组4 68±0 203 71±0 14 IR组7 19±0 07∗8 45±0 32∗∗ CIP组6 87±0 16∗△5 26±0 09∗∗△
注:与sham组比较*P<0.05,**P<0.01;与I/R组比较△P<0.05。
CIP组与I/R组TLR4、TNF-α mRNA表达水平明显高于Sham组,差异有统计学意义(P<0.05,P<0.01);CIP组表达水平明显低于I/R组(P<0.05)。
3 讨 论
近年来,对于缺血预处理对脑缺血再灌注损伤的保护作用已有一定程度的认识[7]。急性脑梗死在时间窗(发病后3~4.5 h)内给予药物溶栓或者急诊机械取栓是治疗脑梗死的有效治疗方案[8],而再灌注损伤作为一种应激状态,本身可导致细胞坏死及组织的不可逆损伤,是脑缺血的恶性延续,炎症反应在这一过程发挥的作用近年来关注较多[8]。研究发现,TLR4参与了脑缺血再灌注损伤的发病过程,且发挥着重要作用,TLR4/核因子κB信号传导通路的激活,可导致其下游炎症细胞因子表达上调[9]。TNF-α作为重要的初级炎症因子之一,在中枢神经系统内的神经元和胶质细胞中表达,可激活中性粒细胞并使其聚集于缺血脑组织,激发炎症级联反应,还可直接损伤血管内皮细胞及毛细血管,改变其通透性,加重脑组织水肿[10-12]。因此减轻炎症反应已成为缺血性脑血管病治疗的重要组成部分。
本实验在成功制备大鼠MCAO模型的基础上,采用了实时定量PCR技术,通过检测荧光信号,可快速对目的基因及内参基因进行定量分析,较半定量PCR技术更为精准。本研究发现TLR4、TNF-α mRNA在CIP组与I/R组的表达水平明显高于Sham组,而二者在CIP组的表达水平明显低于I/R组,提示TLR4和TNF-α与再灌注损伤关系密切,缺血预处理可能通过下调促炎因子的表达减轻脑组织缺血再灌注损伤,从而减轻炎症反应。
综上,缺血预处理能改善由再灌注损伤引起的功能障碍,可能通过下调TLR4和TNF-α的表达从而起到脑保护作用。然而缺血预处理的相关机制及通路之间关系复杂,调控二者表达的确切机制仍待进一步研究。
[1]Thushara V N,Sangwan A,Sharma B,et al.Cerebral ischemic preconditioning:The Road So Far…[J].Mol neurobiol,2016,53(4):2579-2593.
[2]Danton G H,Dietrich W D.Inflammatory mechanisms after ischemia and stroke[J].J Neuropathol Exp Neurol,2003,62(2):127-136.
[3]Tobin M K,Bonds J A,Minshall R D,et al.Neurogenesis and inflammation after ischemic stroke:What is known and where we go from here[J].J Cereb Blood Flow Metab,2014,34(10):1573-1584.
[4]郝玉曼,罗祖明,周东.局灶预缺血诱导脑缺血耐受的动物模型[J].中风与神经疾病杂志,2003,20(2):129-130.
[5]Longa E Z, Weinstein P R,Carlson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20(1):84-91.
[6]Livak K J,Schmittgen T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T))Method[J].Methods,2001,25(4):402-408.
[7]Sirotkina O V,Laskovets A B,Goldobin V V,et al.The molecular mechanisms of platelets activation in patients with cerebrovascular disease[J].Biomed Khim,2015,61(5):606-12.
[8]Sorkin G C,Dumont T M,Mokin M,et al.Hyperacute carotid stent thrombosis during emergent revascularization treated with intraarterial eptifibatide after systemic administration of recombinant tissue plasminogen activator[J].J Vasc Interv Neurol,2015,8(3):50-55.
[9]Murray K N,Girard S,Holmes W M,et al.Systemic inflammation impairs tissue reperfusion through endothelin-dependent mechanisms in cerebral ischemia[J].Stroke,2014,45(11):3412-3419.
[10]Lan L,Tao J,Chen A,et al.Electroacupuncture exerts anti-inflammatory effects in cerebral ischemia-reperfusion-injured rats via suppression of the TLR4/NF-κB pathway[J].Int J Mol Med,2013,31(1):75-80.
[11]Halladin N L.Oxidative and inflammatory biomakers of ischemia and reperfusion injuries[J].Dan Med J,2015,62(4):B5054.
[12]Wang H,Zhang K,Zhao L,et al.Anti-inflammatory effects of vinpocetine on the functional expression of nuclear factor-kappa B and tumor necrosis factor-alpha in a rat model of cerebral ischemia-reperfusion injury[J].Neurosci Lett,2014,566:247-251.
[责任编辑:李蓟龙 英文编辑:刘彦哲]
Alleviation of Ischemic Preconditioning on Ischemia-Reperfusion Injury and Expressions of TLR4 and TNF-α mRNA
ZHANG Jing1,ZOU Yu-an2,DONG Xiao-hua1,MA Fei1,WANG Huan-huan1,LIU Dong-yan3,GUO Heng3
(1.Graduate School,Hebei North University,Zhangjiakou,Hebei 075000,China;2.Department of Neurology,The First Affiliated Hospital of Hebei North University,Zhangjiakou,Hebei 075000,China;3.Department of Laboratory Medicine,Dongzhimen Hospital of Beijing University of Chinese Medicine,Beijing 100700,China)
Objective To explore the protection of cerebral ischemic preconditioning on ischemia-reperfusion injury by observing the expression changes of TLR4 and TNF-α in cerebral cortex of rats.Methods 36 SPF healthy male SD rats were randomized into three groups:cerebral ischemic preconditioning group(CIP group,n=12),ischemia-reperfusion group(I/R group,n=12),and sham group(Sham group,n=12).The I/R group were subjected to 2 hours of right middle cerebral artery occlusion(MCAO) with suture-occluded method to establish focal cerebral ischemia-reperfusion injury model.The CIP group were given ten-minute suture-occluded MCAO,then the same treatment as the I/R group 72 hours after reperfusion.The Sham group were only given the carotid artery separation.On one day after surgery,the animals were sacrificed.The infarction volume was evaluated by the method of TTC staining,the neural behavioral score were measured by Zea Longa assessment criteria and the expression levels of TLR4 and TNF-α mRNA were assessed by the method of real-time quantitative PCR(polymerase chain reaction).Results On one day after ischemia,the infarct volume and neural behavioral scores of the CIP group were lower than those of the I/R group,with statistically significant difference(P<0.05).The mRNA expression of TLR4 and TNF-α in the CIP group and the I/R group were both significantly higher than those of the sham group(P<0.05,P<0.01),and the expressions of both in the CIP group were significantly lower than those of the I/R group(P<0.05).Conclusion Cerebral ischemic preconditioning can ameliorate the dysfunction produced by ischemia-reperfusion injury,which may be associated with down-regulated expression of proinflammatory factors and alleviate inflammatory response.
rat;ischemic preconditioning;ischemia-reperfusion injury;Toll-like receptors 4;tumor necrosis factor-α
河北省医学科学研究重点课题计划(No.20150054);河北省高等学校科学技术研究重点项目(No.ZD2014065)
张婧(1989-),女,河北北方学院2014级硕士研究生,主要从事缺血性脑血管病方向研究。
邹玉安(1957-),男,主任医师,硕士生导师。
R 541
A
10.3969/j.issn.1673-1492.2017.04.002
来稿日期:2016-08-29

