基于声化学效应探究低频超声处理对温州蜜柑汁杀菌及其品质的影响
李申,马亚琴,李楠楠,张震
(西南大学 柑桔研究所,国家柑桔工程技术中心,重庆,400712)
基于声化学效应探究低频超声处理对温州蜜柑汁杀菌及其品质的影响
李申,马亚琴*,李楠楠,张震
(西南大学 柑桔研究所,国家柑桔工程技术中心,重庆,400712)
应用低频超声波(25 kHz)处理宽皮柑橘(温州蜜柑)汁,考察其对特征微生物菌群(细菌、霉菌、酵母、大肠菌群)的灭活效果,同时分析了低频超声波对橘汁品质的影响。研究结果表明,超声时间、超声温度、超声功率均对杀菌率具有极显著影响(P<0.01),超声杀菌处理最佳工艺条件为超声温度50 ℃,超声时间40 min,超声功率720 W;低频超声处理对橘汁糖酸成分无显著性影响(P>0.05),同时橘汁抗坏血酸、总酚,以及抗氧化能力均显著高于巴氏杀菌橘汁(P<0.05)。低频超声技术具有提升橘汁品质的潜在作用。
温州蜜柑;低频超声;杀菌;品质
柑橘是世界第一大贸易水果,我国的柑橘产量以及种植面积均居世界首位,其中宽皮柑橘产量最高,2015年产量高达1 850万t,占世界宽皮柑橘总产量的三分之二以上,出口量超过世界出口量的三分之一[1]。我国宽皮柑橘以鲜食为主,贮藏期短,易造成严重的资源浪费[2]。
柑橘汁富含膳食纤维、矿物质等营养物质,以及黄酮、酚酸、香豆素、类胡萝卜素、抗坏血酸等多种活性成分,对心脑血管疾病等慢性和退行性疾病具有潜在的预防与治疗作用[3-4]。尤其是非浓缩还原汁,因其较好的保留了水果原有的营养与风味,日益受到消费者的青睐。柑橘汁作为一种热敏性食品,传统热杀菌虽能有效地杀灭微生物并抑制酶活,但高温处理对果汁色泽、味道、营养成分以及活性物质造成不同程度的破坏,加速色素降解,产生蒸煮异味,加剧褐变反应,降低果汁新鲜度,甚至产生醛和环氧化合物,对果汁的安全性造成极大的危害和隐患[5-6]。因此,超声波、辐照、超高压、脉冲电泳、真空渗透脱水等非热技术在果汁加工领域应用的潜在可能性受到广泛关注。
超声波是指频率为 20 kHz~500 MHz的声波,超声波的引入可引起介质发生交替压缩和伸张的机械震动,当液体分子间的距离超过保持液体作用的临界分子间距时会形成空穴气泡,在超声波的连续作用下,部分空穴气泡会瞬间绝热收缩至爆破,产生局部高温、高压(5 000~500 000 kPa)、强烈的剪切力等超声波特有的声化学效应,同时引起质点线性和非线性的交变震动,并伴随机械剪切力以及自由基的产生[7]。空穴气泡的大小与超声频率的高低呈负相关,因此低频超声波(20 kHz~100 kHz)能产生较大的空穴气泡,气泡崩塌时比高频超声波(100 kHz~1 MHz)更为剧烈,具有更高的超声能量,有利于促进声化学效应的产生。当超声波应用于果汁杀菌时,其能量可瞬间分布于果汁中,空穴气泡绝热收缩至爆破的瞬间过程,产生“热点”效应,导致细胞膜在变化的压强条件下拉伸,破裂,并伴有膜电位的改变,因而在中低温条件下具有显著的杀菌效力,达到减缓热效应(降低热杀菌温度/缩短热杀菌时间)和降低能耗的效果[8-9]。国内外学者基于模拟体系和真实体系开展了众多关于超声技术的杀菌效力及其机理的研究[10-16]。超声作为一种新的杀菌技术,与传统热杀菌相比,能减少热效应,降低能耗,有效地减少营养成分和风味物质的损失,尤其在糖度较高的果汁中,兼具良好的均质效果,有潜力成为辅助甚至替代热杀菌的新技术。
本研究选取温州蜜柑为原料,考察低频超声处理对温州蜜柑汁中主要微生物菌群(细菌、霉菌、酵母菌、大肠菌群)的灭活效果,探究不同超声参数对超声介质物理效应和化学效用的影响,并综合评价该技术对温州蜜柑汁品质的影响。
1 材料与方法
1.1 材料与试剂
细菌测试片、霉菌/酵母菌测试片、大肠菌群测试片,3M中国有限公司;NaOH(分析纯),天津市风船试剂有限公司;福林酚试剂(分析纯),北京鼎国昌盛生物技术有限公司;草酸(分析纯),重庆川东化工试剂厂;乙醇、H3PO4、冰乙酸(分析纯),成都市科龙化工试剂厂;抗坏血酸(标准品),国药集团化学试剂有限公司;KH2PO3(色谱级),阿拉丁试剂(上海)有限公司;1,1-二苯基-2-三硝基苯肼(1,1-Diphenyl-2-picrylhydrazyl radical 2,2-Diphenyl-1-(2,4,6-trinitrophenyl)hydrazyl, DPPH)、2,4,6-反式-2-吡啶基三嗪(2,4,6-tri-2-pyridinyl-1,3,5-triazine; TPTZ)、甲醇(色谱级),西格玛奥德里奇(上海)有限公司。
1.2 仪器与设备
DP-800超声波清洗器,上海生析超声仪器有限公司;恒温槽,宁波天恒仪器厂;4161榨汁机,美国Brown公司;Milli-Q Advantage A10超纯水仪,美国Millipore公司;WAY-2S阿贝折射仪,上海精密科学仪器有限公司;FE20实验室PH计,梅特勒-托利多(上海)有限公司;TU-1901紫外可见分光光度计,北京普析通用仪器有限责任公司;UniCen MR高速离心机,德国Herolab公司;Color i5色差仪,瑞士Gretag Macbech公司;Ultimate 3000高效液相色谱,美国ThermoFisher公司;BT224S电子天平,赛多利斯科学仪器(北京)有限公司。
1.3 试验方法
1.3.1 宽皮柑橘(温州蜜柑)汁制备
选取商业成熟度的温州蜜柑(产自重庆市北碚区歇马镇)为试验原料,洗净、擦干并切半,用Brown手动榨汁机榨汁,经80目无菌双层纱布过滤后装于无菌真空封装袋,并用真空封装机密封后待处理。
1.3.2 超声处理
1.3.2.1 超声位点选择
选用实验室规模超声清洗设备,并与恒温水域槽链接,以实现在超声处理过程中对介质温度的调控。超声换能器均匀分布于清洗槽底部。超声场能量分布具有不均匀性以及动态变化性,参照朱攀攀等人[17]对超声局部效应的研究,选取距离超声水域槽底部垂直距离为6 cm超声辐射面,横截面的中心位置,为样品超声处理位点,液面高度为12 cm(见图1)。

图1 超声波设备示意图Fig.1 Schematic diagram of ultrasonic irradiation at 25 kHz
1.3.2.2 低频超声技术参数试验
超声参数的选定是决定介质化学和物理效应产生与强弱的直接因素,选取超声时间、超声温度、超声强度、样品处理量为考察参数,探究低频高能超声波(25 kHz)不同超声参数对杀菌效果的影响及其作用机制,明确不同微生物菌群对低频超声波的敏感性及耐受度。(1)超声温度水平:10、20、30、40、50 ℃;(2)超声功率水平:160、320、480、640、800 W;(3)样品处理量:50、100、150、250 mL;(4)超声联合中温效应的杀菌效力探究。每组样品重复处理3次。
1.3.3 微生物测定
1.3.3.1 细菌总数测定
用无菌水将超声处理后的温州蜜柑汁样品稀释到适当浓度并混合均匀,精确吸取1 mL稀释液,垂直滴加于细菌总数测试片中央,利用压板模具使稀释液均匀覆盖于圆形培养皿面积上,静置lmin使培养基凝固。将测试片置于35 ℃恒温培养箱中培养48 h后计数。精确量取1 mL无菌水按以上操作步骤制作空白对照。测定方法参照《3M细菌总数测试片判读手册》。
1.3.3.2 霉菌/酵母菌测定
用无菌水将超声处理后的温州蜜柑汁样品稀释到适当浓度并混合均匀,精确吸取1 mL稀释液,垂直滴加在霉菌和酵母菌测试片中央,利用压板模具使稀释液均匀覆盖于圆形培养皿面积上,静置1 min使培养基凝固。将测试片置于25 ℃恒温培养箱中培养5 d后计数。精确量取1 mL无菌水按以上操作步骤制作空白对照。测定方法参照《3M霉菌和酵母菌测试片判读手册》。
1.3.3.3 大肠菌群测定
用无菌水将超声处理后的温州蜜柑汁样品稀释到适当浓度并混合均匀,精确吸取1 mL稀释液,垂直滴加在大肠菌群测试片中央,利用压板模具使稀释液均匀覆盖于圆形培养皿面积上,静置1 min使培养基凝固。将测试片置于32 ℃恒温培养箱中培养24 h后计数。精确量取1 mL无菌水按以上操作步骤制作空白对照。测定方法参照《3M大肠菌群测试片判读手册》。
1.3.3.4 杀菌率计算
低频超声处理后细菌、霉菌、酵母菌、大肠菌群的灭活效果用杀菌率(sterilizing rate,SR)表示,方程式如(1)所示。
(1)
式中:N0,超声处理前样品中目标微生物菌群(细菌、霉菌、酵母菌、大肠菌群)菌落数,CFU/mL;NR:超声处理后样品中目标微生物菌群(细菌、霉菌、酵母菌、大肠菌群)菌落数,CFU/mL。
1.3.4 可滴定酸测定
参照GB/T8210—2011《柑桔鲜果检验方法》中指示剂法测定[18]。精确吸取温州蜜柑汁样品25 mL,用蒸馏水稀释至250 mL,摇匀。吸取稀释后果汁10 mL,置于150 mL锥形瓶中,加1%酚酞2~3滴。用已标定的氢氧化钠标准溶液滴定至微红色,30 s不褪色为终点。
1.3.5 pH值测定
使用梅特勒-托利多FE20型实验室pH计测定。
1.3.6 可溶性固形物测定
依照GB/T8210—2011《柑桔鲜果检验方法》[18]中阿贝折射仪测法测定,测定结果统一校正到20 ℃条件下的数值。
1.3.7 光学性质指标测定
1.3.7.1 色值测定
使用Color i5色差仪测定宽皮柑橘汁L*、a*、b*值,各项指标具体含义见参考文献[19]。
1.3.7.2 总色差计算
通过L*、a*、b*计算得宽皮柑橘汁总色差值(ΔE)。ΔE表示温州蜜柑汁总体色泽差异,值越大,差异程度越大,根据ΔE数值大小可分为:基本无差异(0~0.5)、细微差异(0.5~1.5)、易辨别的差异(1.5~3)、显著差异(3.0~6.0)、极显著差异(6.0~12.0)、不同颜色(12.0以上),用于表示温州蜜柑汁的颜色变化程度及褐变程度[20]。其计算公式如下:
(2)
1.3.7.3 褐变度(A420)测定
参照MEYDAV等人[21]的方法并加以改进。准确量取4 mL温州蜜柑汁样品,加入等体积95%乙醇,并混合均匀,于4 ℃下以10 000 r/min的转速离心15 min测定420 nm处的吸光度,所得吸光度即为该样品的A420。
1.3.7.4 浊度(A660)测定
参照应洁琦[16]的方法并加以改进。准确量取5 mL温州蜜柑汁样品,于4 ℃下以8 000 r/min的转速离心10 min测定660 nm处的吸光度,所得吸光度即为该样品的A660。
1.3.8 抗坏血酸(ascorbic acid; Vc)测定
参照SHINODA等人[22]的方法并加以改进。采用高效液相色谱(high performance liquid chromatography,HPLC)法测定。检测条件:色谱柱:Waters C18(250 mm×4.6 mm,5 μm,美国Dionex);流动相:0.05 mol/LKH2PO4(H3PO4调pH至3.5);流速:1.0 mL/min;检测波长:245 nm;柱温:30 ℃;进样量:25 μL。
Vc工作曲线绘制:精确称取5 mg Vc标准品,用1 g/L草酸溶液定容至250 mL,摇匀,配制成20 mg/L标准溶液,经0.22 μm水系滤膜过滤后备用。设定体积为0、10、20、30、40、60、80、100 μL的梯度进样序列,并在上述液相色谱条件下测定。以峰面积为横坐标,VC质量为纵坐标,制作标准曲线,见表1。
温州蜜柑汁样品测定:精确量取1 mL样品,用1 g/1 000 mL草酸溶液稀释至5 mL。于4 ℃下以10 000 r/min的转速离心10 min,取上清液过0.22 μm水系滤膜后待测。按上述液相条件测定样品中VC含量(以mg/100 mL计算)。
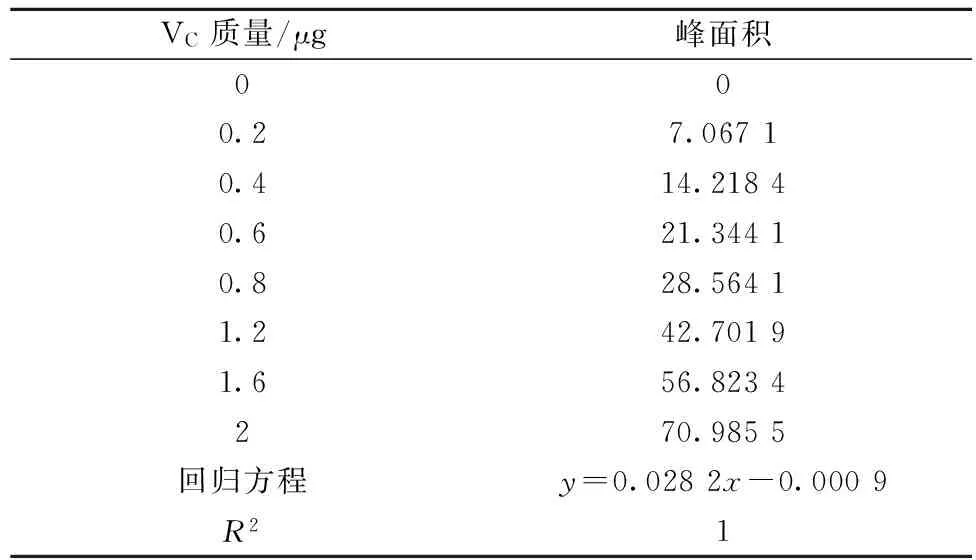
表1 VC标准曲线和相关系数
1.3.9 总酚含量测定
参照Folin-Ciocalteu法测定[23],并加以改进。将温州蜜柑汁样品于10 000 r/min离心20 min,精确量取上清液500 μL于25 mL具塞试管,蒸馏水稀释至10 mL。加入0.5 mL 2 mol/L Foline-phenol试剂并充分震荡,静置5 min后加入5 mL浓度为5 g/100 mL的Na2CO3溶液,定容至25 mL,充分震荡后暗室反应30 min,在760 nm处测定最大吸光值。精确量取500 μL蒸馏水加入具塞试管,按以上操作步骤制作空白对照。
总酚工作曲线绘制:选取没食子酸为标准品,精确称量50 mg,用蒸馏定容至25 mL,配制成2 mg/mL标准溶液,备用。用移液枪准确移取0、20、40、80、100 μL没食子酸标准溶液于25 ml具塞试管,用蒸馏水稀释至10 mL。加入0.5 mL 2 mol/L Foline-phenol试剂并充分震荡,静置5 min后加入5 mL浓度为5 g/100 mL的Na2CO3溶液,定容至25 mL,充分震荡后暗室反应30 min,在760 nm处测定最大吸光值。以760 nm处吸光度为横坐标,没食子酸质量为纵坐标制作标准曲线,得到总酚含量标准曲线:y=328.38x+1.115 8(R2=0.995),总酚含量以没食子酸当量表示(mg GAE/100 ml)。
1.3.10 抗氧化性测定
1.3.10.1 DPPH自由基清除能力
参照朱攀攀等人[17]的测定方法并加以修改。精确称取39 mg DPPH标准品,用甲醇定容于100 mL容量瓶,配制成0.1 mmol/L DPPH工作液,备用。将温州蜜柑汁于10 000 r/min离心20 min,精确量取50 μL上清液,与1.95 mL DPPH(0.1 mmol/L)工作液均匀混合后暗室反应10 min,在517 nm处测定最大吸光值,记为A样品。精确量取50 μL蒸馏水按以上操作步骤制作空白对照,记为A空白。DPPH自由基清除能力以下述公式表示:
(3)
1.3.10.2 铁离子还原能力(ferric-reducing antioxidant power, FRAP)
参照朱攀攀等人[17]的测定方法并加以修改。将温州蜜柑汁样品于10 000 r/min离心20 min备用。精确量取50 μL样品与2.45 mL FRAP工作液均匀混合后暗室反应30 min,在593 nm处测定最大吸光值。精确量取50 μL蒸馏水按以上操作步骤制作空白对照。其中,FRAP工作液配制方法为:0.1 mol/L醋酸缓冲液(pH 3.6)∶ 10 mmol/L TPTZ(溶于40 mmol/L HCl)∶20 mmol/LFeCl3=10 ∶ 1 ∶ 1(HCl体积比)。
FRAP工作曲线绘制:选取Trolox为标准品,精确称量100 mg,用蒸馏水定容至250 mL,配制成400 mg/L标准溶液,备用。用移液枪准确移取0、25、50、75、100 μL Trolox标准溶液,并用蒸馏水稀释至100 μL,与4.9 mL FRAP工作液均匀混合后暗室反应30 min,在593 nm处测定最大吸光值。以593 nm处吸光度为横坐标,Trolox质量为纵坐标制作标准曲线,得到FRAP标准工作曲线:y=29.802x-4.106 2(R2=0.997),抗氧化能力以Trolox当量表示(mg TEAC/100 mL)。
1.4 数据分析
2 结果与分析
2.1 低频超声处理对温州蜜柑汁中微生物灭活效果的影响
2.1.1 超声温度对不同微生物灭活效果的影响
超声温度对霉菌、酵母菌、大肠菌群以及细菌4种目标微生物群体的灭活率均具有极显著影响(P<0.01),同时霉菌、酵母菌的失活率随超声温度的变化趋势呈现出相似性,见图2。大肠菌群的灭活率随超声温度的升高而增加,且在同等温度水平下其灭活率均高于霉菌和酵母菌,并在超声温度为40 ℃时,实现全部灭活。霉菌与酵母菌的临界杀菌温度均接近30 ℃,超声温度为30 ℃时,细菌总数仅下降4.44%,霉菌与酵母菌的灭活率分别为14.28%、18.93%,杀菌效果不理想,该结果与CHENG研究发现超声在室温条件下杀菌效果微弱具有一致性[15]。当超声温度从30 ℃增加至40 ℃,杀菌效果显著上升,细菌总数下降66.45%,同时霉菌、酵母菌的灭活率也分别达到85.71%和95.37%,为30 ℃超声温度条件下的5倍。3种菌群对超声温度敏感程度不同,可能由于其不同的细胞结构导致,霉菌与酵母菌细胞壁的主要成分分别为几丁质和葡聚糖,均表现出较好的机械强度。大肠菌群属G-细菌,细胞壁结构中缺乏磷壁酸,构成细胞壁的肽聚糖网结构疏松,机械强度差,导致其较低的抗逆性[24]。
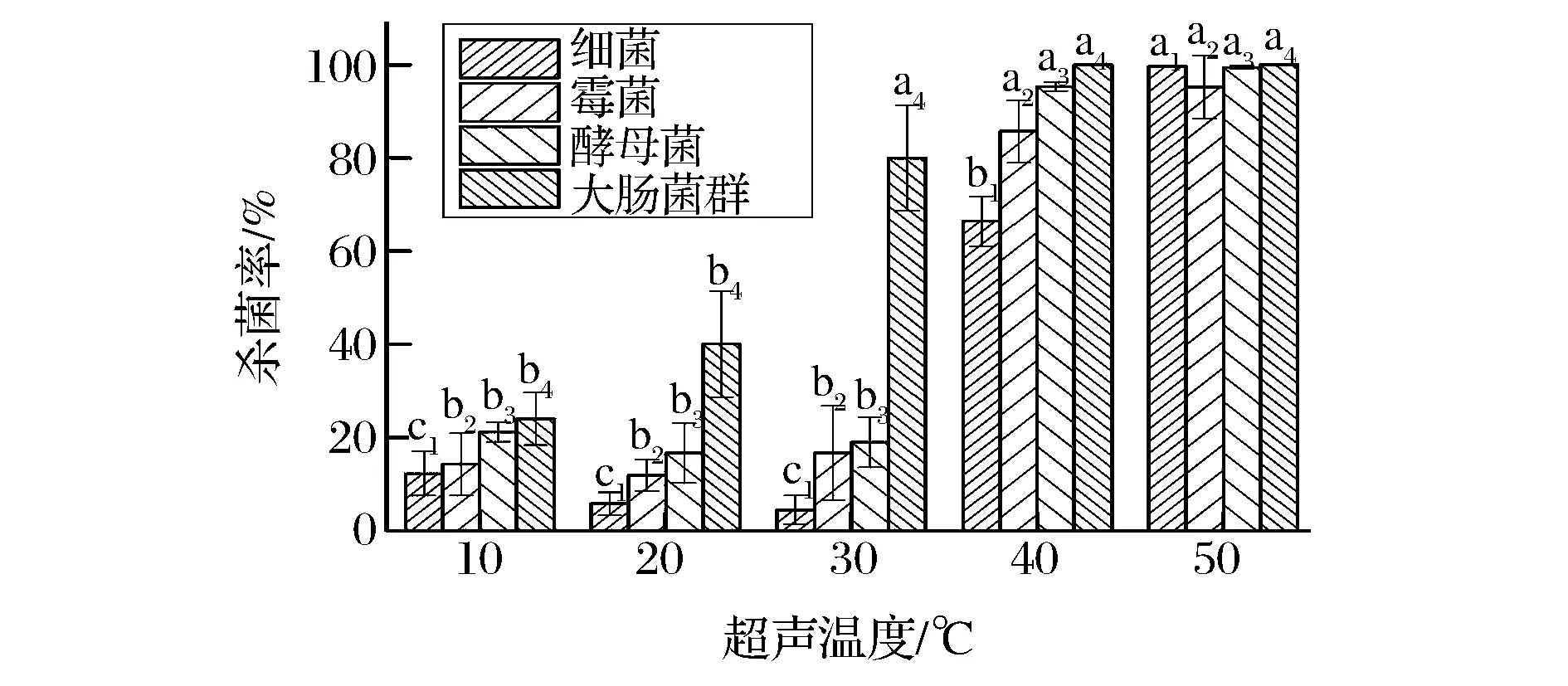
图2 超声温度对温州蜜柑汁杀菌效果的影响Fig.2 Effect of ultrasonic temperature on sterilizing rate of mandarin juice at 25 kHz注:同种菌群标注不同字母表示差异显著,相同下标数字表示同种菌群(P<0.05)。
2.1.2 超声功率对目标微生物灭活效果的影响
超声功率直接决定声场中的能量密度,是影响超声场中物理和化学效应的重要因素,亦是影响杀菌效果的最重要的因素之一。超声功率对不同目标微生物菌群杀菌率的影响见图3A。结果表明,超声功率较低时,酵母菌比大肠菌群和霉菌耐受力更强。四种目标菌群的灭活率随着超声功率的增大均曾上升趋势,其中细菌、霉菌、酵母菌在超声功率为800 W时达到最高灭活率分别为95.66%、83.01%、46.94%,而大肠菌群在超声功率为640 W时,已实现全部灭活,同时,VALERO等人[13]研究发现超声环境中,嗜温需氧菌致死率显著高于霉菌和酵母菌。由于酵母菌细胞壁厚度可达25 nm,能更好地抵御超声场中的机械破坏力,从而需要更高的钝化临界场强,G-比G+更易受到超声波的影响也已被证实[11]。
分别对3种目标菌群在不同超声功率下的灭活效果进行拟合,如图3B所示,可得到3种目标菌群的临界灭活功率分别为:275、263、3 W。霉菌与酵母菌的临界灭活功率相近,这可能源于二者均属真菌均属,具有相似的细胞机构与灭活机制。FURUTA等[25]学者研究强调了超声场中杀菌效力对空穴效应引起的局部压力、温度的骤变以及剪切力与冲击力的依赖性[26];羟基自由基(·OH)的产生以及对细胞膜的破坏作用是高频超声具有杀菌效力的主要原因。与霉菌和酵母菌相比,大肠菌群对化学效应有较高的耐受力,而对机械作用相对敏感[25],其更低的临界功率可能是由于低频超声波的杀菌机理更多依赖于压力交变、局部高温高压等物理力效应而非化学效应,同时温州蜜柑汁中抗氧化活性成分对超声声场中由·OH引起的化学效应具有削弱作用,该现象是凸显物理杀菌作用的另一个原因。

A:超声功率对杀菌率的影响;B:超声功率杀菌效果线性拟合图3 超声功率对温州蜜柑汁杀菌效果的影响Fig.3 Effect of ultrasonic power on microbial inactivation of mandarin juice at 25 kHz注:同种微生物菌群标注不同字母表示差异显著,相同下标数字表示同种菌群 (P<0.05)。
2.1.3 样品处理量对目标微生物灭活效果的影响
由图4可知,样品处理量对大肠菌群的杀菌率无影响,而对霉菌、酵母菌以及细菌总数的灭活率影响显著(P<0.05),3者的杀菌率随处理量的上升呈下降趋势,当样品处理量由50 mL增长至250 mL时,霉菌、酵母菌以及菌落总数的灭活率分别下降了17.06%、23.23%、15.25%。超声场的不均匀性以及动态变化性应该是导致该现象产生的主要原因,栗星等人[27]的研究也得到相似结论。样品量的增加使得橘汁分布于不同强度的场强中,可能造成杀菌效果不均一现象的产生。
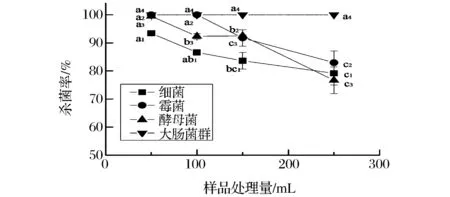
图4 样品处理量对温州蜜柑汁杀菌效果的影响Fig.4 Effect of sample volumes on sterilizing rate of mandarin juice at 25 kHz注:同种微生物菌群标注不同字母表示差异显著,相同下标数字表示同种菌群 (P<0.05)。
2.2 超声联合中温技术的杀菌效力探究
图5、图6分别为在4 ℃与40 ℃的超声温度条件下,超声时间对细菌、霉菌、酵母菌、大肠菌群灭活率的影响。在4 ℃的超声条件下,4种目标菌群杀菌率在超声初期均呈现出滞后现象,并在处理时间达到30 min后,存活率急剧下降,超声处理50 min后霉菌、酵母菌、大肠菌群与细菌总数的杀菌率分别达到54.54%、53.04%、47.50%、42.5%,该结果与王文宗、CHO等人[12, 28]的研究结果呈现出相似趋势,但滞后时间相对较长,差异可能是由于杀菌体系不同导致,相较于模拟体系,橘汁成分的复杂性以粘滞阻力的差异,对超声效果产生了一定的消减作用,超声联合中温(40 ℃)技术的杀菌效果如图6A所示。结果表明,超声杀菌效力的滞后得以显著改善,超声处理30 min后,大肠菌群实现全部灭活,霉菌与酵母菌的杀菌率也分别达到84.76%和96.57%。在此基础上,分别对4 ℃、40 ℃条件下杀菌效力进行拟合(见图5B、图6B),以探究中温条件对超声杀菌技术的辅助作用。相较于4 ℃,3种微生物菌群在40 ℃的超声条件下,临界杀菌分缩短了5.8、3.0和9.9 min,试验证实中温环境能有效的缓解超声处理的滞后效应,同时,超声杀菌的滞后现象可联合超高压,脉冲电泳等技术得以缓解[29]。
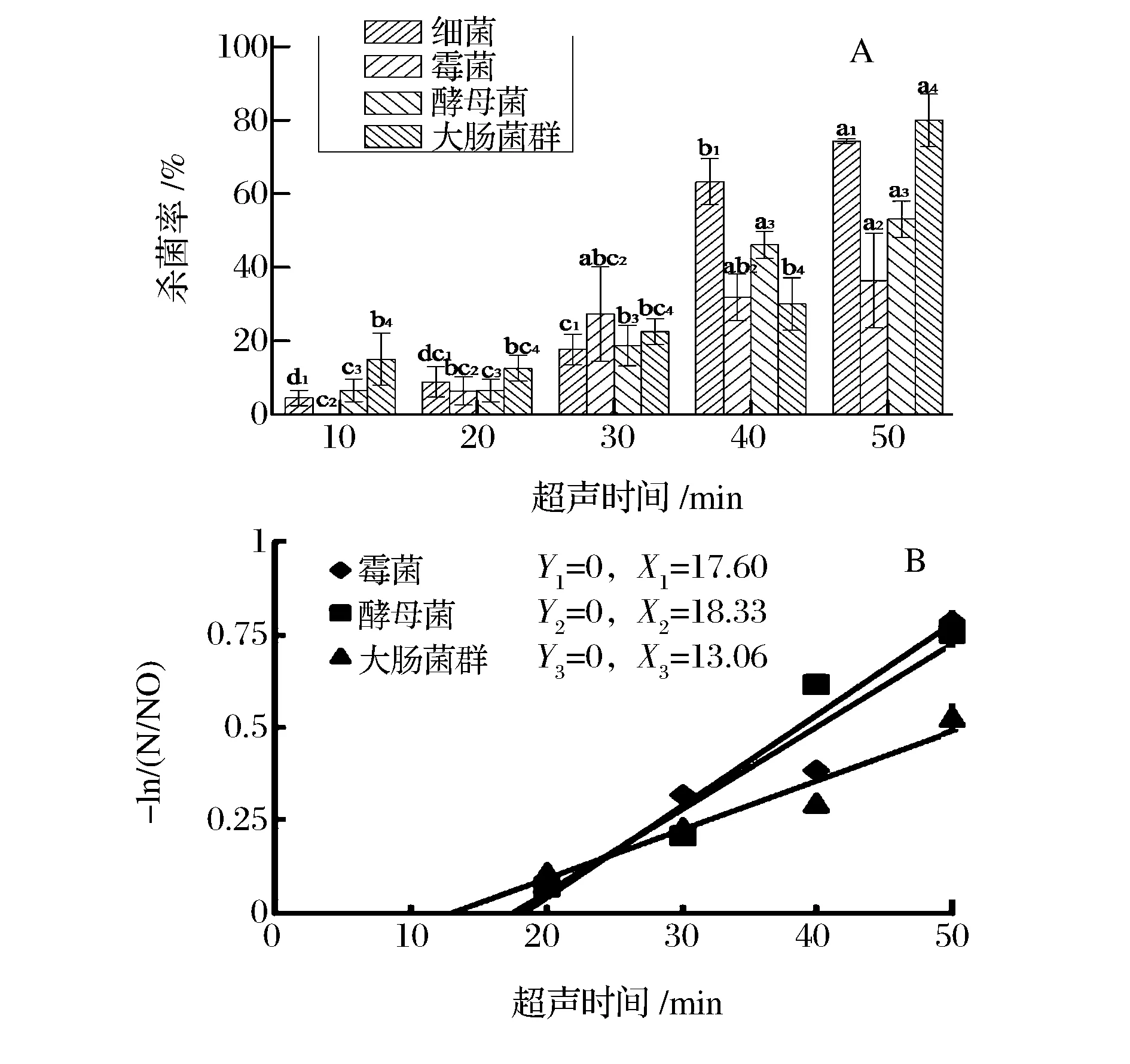
A:超声时间对杀菌率的影响;B:超声时间杀菌效果线性拟合图5 4 ℃时超声时间对温州蜜柑汁杀菌效果的影响Fig.5 Effect of ultrasonic time on microbial inactivation of mandarin juice at 25 kHz and 4 ℃注:同种微生物菌群标注不同字母表示差异显著,相同下标数字表示同种菌群(P<0.05)。
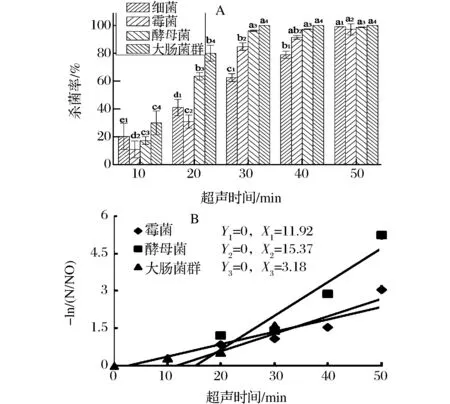
A:超声时间对杀菌率的影响;B:超声时间杀菌效果线性拟合图6 40 ℃时超声时间对温州蜜柑汁杀菌效果的影响Fig.6 Effect of ultrasonic time on microbial inactivation of mandarin juice at 25 kHz and 40 ℃注:同种微生物菌群标注不同字母表示差异显著,相同下标数字表示同种菌群(P<0.05)。
2.3 低频超声技术对温州蜜柑汁品质的影响
2.3.1 杀菌方式对糖酸成分的影响
基于单因素试验结果,选取超声频率25 kHz,超声温度为50 ℃,超声功率为720 W,超声时间为40 min,样品处理量为150 mL的工艺条件处理温州蜜柑汁,并比较分析低频超声波对橘汁品质的影响。由表2可知,与巴氏杀菌橘汁相比,超声处理后橘汁中可滴定酸、可溶性固形物、pH值没有显著差异(P>0.05),表明超声处理技术不会影响橘汁的基本酸甜口感,CHENG,应洁琦等人[15-16]的研究与本文的研究结果具有一致性。

表2 杀菌方式对温州蜜柑汁糖酸含量的影响
注:同列肩标不同字母表示列组间有显著差异(P<0.05)。
2.3.2 杀菌方式对温州蜜柑汁光学性质的影响
色泽是消费者衡量果汁整体品质的重要标准,亦是影响消费者购买欲的最重要的因素之一,同时也是反映果汁新鲜度以及卫生状况的重要指标。色泽取决于果汁中天然色素的种类和含量,同时酶活、微生物活动均对其具有影响,感官评价法是评定果汁色泽最直观的方法,但通常利用仪器设备能更客观的评价果汁的光学性质,常见评价指标有色值、总色差、褐变度、浊度等。低频超声技术对温州蜜柑汁光学特性的影响见表3。实验结果表明,相较于巴氏杀菌,低频超声波能显著改善橘汁亮度水平,进而提升橘汁的商业价值。与之同时,低频超声技术对橘汁黄色色泽的保留与提升作用更为显著(P<0.05),超声波产生的·OH引发呈色物质的氧化还原反应与异构化可能是导致该变化的原因,空穴效应对果汁色泽改变的影响作用已被证实[30]。低频超声处理对橘汁悬浮稳定性体现出显著的改善作用,温州蜜柑汁浊度水平显著提升,橘汁平均粒径的降低是导致该现象产生的重要原因,同时超声处理可达到抑制果胶甲酯酶的活性效果,有效抑制果胶的降解反应,使温州蜜柑汁稳定性得以提升[31]。粒径减小引起温州蜜柑汁对光的吸收与折射性能的改变,是引发总色差显著增加的潜在因素,同时超声处理灭活酶和去除溶解氧的作用可抑制酶促褐变的发生,保持橘汁色泽的稳定性,BHAT等[32]学者研究表明,超声波技术引发的柠檬汁、橙汁色泽的微小改变不能被肉眼分辨。

表3 杀菌方式对温州蜜柑汁光学性质的影响
注:同列肩标不同字母表示列组间有显著差异(P<0.05)。
2.3.3 杀菌方式对温州蜜柑汁活性成分及抗氧化性的影响
柑橘作物富含VC、酚酸、黄酮、黄酮醇等多种活性成分,被证实具有抗肿瘤、抗衰老、抗病毒、预防心脑血管疾病以及消炎的作用[33],酚类化合物是柑橘中主要抗氧化成分,VC也具有潜在抗氧化性[34]。低频超声波对橘汁活性成分与抗氧化性的影响如表4所示,低频超声波作为一种非热加工技术,对热敏性营养成分具有更好的保留效果,超声处理橘汁VC含量显著高于巴氏杀菌橘汁。超声波产生的空穴效应具有消除溶解氧的作用,能有效的抑制VC的有氧降解,降低脱氢抗坏血酸的积累水平,以脱氢抗坏血酸为底物的VC的无氧降解也受到间接抑制[35]。低频超声技术具有提升橘汁抗氧化能力的潜力, DPPH自由基清除能力比热杀菌橘汁提高了9.7%,声化学效应产生的·OH在酚类等活性物质的苯环结构上已有羟基基团的临位或者对位添加,对该物质抗氧化能力的增强作用已有报道[36],同时低频超声技术的提取效应引发的细胞内含物流出以及束缚态酚类物质的释放是引起总酚含量显著上升的重要原因[10]。抗氧化活性成分含量的提升与活性的增强是橘汁营养价值提升的重要体现。

表4 杀菌方式对温州蜜柑汁营活性成分及抗氧化性的影响
注:同列肩标不同字母表示列组间有显著差异(P<0.05)。
3 结论
低频超声波基于声化学效应,应用于果汁加工领域产生有效的杀菌效果,超声温度和超声功率均为影响效果的主要因素。不同微生物菌群对低频超声波具有不同的敏感度,在超声温度为40 ℃超声时间为30 min的处理条件下,霉菌、酵母菌、与大肠菌群的临界灭活功功率分别为 275、263、3 W,在该超声温度下,3种目标菌群的临界灭活时间分别为11.92、15.37、3.18 min,霉菌和酵母菌在超声处理过程中表现出相近的耐受程度与变化趋势,而大肠菌群对超声最为敏感。温州蜜柑汁经超声温度50 ℃,超声功率720 W,样品处理量为150 mL,处理40min后,霉菌、酵母菌、大肠菌群灭活率分别达到99.43%、99.29%、100%、同时总杀菌率为99.65%,符合国标中关于果蔬汁菌落总数安全限量(<100 CFU/100 mL)的要求。与传统热杀菌相比,低频超声技术在达到理想杀菌效果的同时,对温州蜜柑汁的综合品质表现出一定的提升作用:悬浮稳定性提升3倍;VC保留水平及总酚含量分别提高5.2%、3.3%;抗氧化能力提升9.7%;亮度以及黄色色值显著提升。本研究结果证实了低频超声波技术在宽皮柑橘汁加工领域具有适用性及可行性,可以实现商业杀菌要求以及提升活性成分与营养成分保留率的需求。但处理时间较长是超声技术在实际生产应用中的技术瓶颈,超声与中温技术及其他非热技术联合运用可能有助于提高杀菌效果,解决该技术问题,也为超声技术产业化应用于果汁杀菌领域提供了研究思路。在此研究基础上,对不同种类微生物失活机制的系统研究也是非常必要和迫切。同时,探索超声与其他杀菌技术如高压脉冲、超高压、紫外辐照等联合杀菌的效果及对果汁品质和贮藏特性的影响,通过考察关键技术参数,建立完善可靠的品质预测模型对指导果蔬汁加工具有实际的指导意义。
[1] CHRIS F, TONG W. China-People Rrepublic of Citrus Annual[R].America:USDA,2015.
[2] 沈兆敏.我国柑橘业在世界柑橘业中的优势和差距[J].果农之友,2015(7):3-5.
[3] 叶兴乾,徐贵华,方忠祥,等.柑橘属类黄酮及其生理活性[J].中国食品学报,2008,8(5):1-7.
[4] 李申,马亚琴,韩智,等.氨基酸在柑橘汁非酶褐变过程中的影响和作用[J].食品与发酵工业,2015,41(11):249-255.
[5] 焦宇知.冷杀菌技术在果汁饮料生产中的应用研究[J].食品科技,2006,31(9):8-11.
[6] BHARATE S S,BHARATE S B.Non-enzymatic browning in citrus juice: chemical markers, their detection and ways to improve product quality[J].J Food Sci Technol,2014,51(10):2 271-2 288.
[7] PIYASENA P,MOHAREB E,MCKELLAR R C.Inactivation of microbes using ultrasound: a review[J].Int J Food Microbiol,2003,87(3):207-216.
[8] MASON T J, LORIMER J P. Theory, Applications and Uses of Ultrasound in Chemistry[M]. England: Ellis Horword Limited, 1989: 252.
[9] ZENKER M,HEINZ V, KNORR D.Application of ultrasound-assisted thermal processing for preservation and quality retention of liquid foods[J].Journal of Food Protection,2003,66(9):2-9.
[10] FERRARIO M,ALZAMORA S M,GUERRERO S.Study of the inactivation of spoilage microorganisms in apple juice by pulsed light and ultrasound[J].Food Microbiology,2015,46(6):35-42.
[11] VILLAMIEL M,JONG P D.Inactivation ofPseudomonasfluorescensandStreptococcusthermophilusin TrypticaseSoy Broth and total bacteria in milk by continuous-flow ultrasonic treatment and conventional heating[J].Journal of Food Engineering,2000,45(3):171-179.
[12] 王文宗.超声—低热联合处理对胡萝卜汁的杀菌效果及超声对其主要酶影响的机理研究[D].广州:华南理工大学,2011.
[13] VALERO M,RECROSIO N,SAURA D,et al.Effects of ultrasonic treatments in orange juice processing[J].Journal of Food Engineering,2007,80(2):509-516.
[14] PATIL S,BOURKE P,KELLY B,et al.The effects of acid adaptation onEscherichiacoli, inactivation using power ultrasound[J].Innovative Food Science & Emerging Technologies,2009,10(4):486-490.
[15] CHENG L H,SOH C Y,LIEW S C,et al.Effects of sonication and carbonation on guava juice quality[J].Food Chemistry,2007,104(4):1 396-1 401.
[16] 应洁琦.超声处理对鲜榨橙汁品质影响的研究[D].杭州:浙江大学, 2014.
[17] 朱攀攀,马亚琴,窦华亭,等.超声局部效应对咖啡酸稳定性及抗氧化性的影响[J].食品科学,2015,36(23):12-17.
[18] 中华人民共和国国家质量监督检验检疫总局. GB/T 8210-2011 柑桔鲜果检验方法[S]. 北京: 中国标准出版社, 2011.
[19] ZULUETA A,BARBA F J,ESTEVE M J,et al.Changes in quality and nutritional parameters during refrigerated storage of an orange juice-milk beverage treated by equivalent thermal and non-thermal processes for mild pasteurization[J].Food and Bioprocess Technology,2013,6(8):2 018-2 030.
[20] PATHARE P B,OPARA U L,AL-SAID F A.Colour measurement and analysis in fresh and processed foods: A review[J].Food and Bioprocess Technology,2013,6(1):36-60.
[21] MEYDAY S,SAGUY I,KOPELMAN I J.Browning determination in citrus products[J].Immunology Letters, 2008,120(s 1-2):108-116.
[22] SHINODA Y,MURATA M,HOMMA S,et al.Browning and decomposed products of model orange Juice[J].Bioscience Biotechnology & Biochemistry,2004,68(3):529-536.
[23] CAI Y, LUO Q,SUN M,et al.Antioxidant activity and phenolic compounds of 112 traditional Chinese medicinal plants associated with anticancer[J].Life Sciences,2004,74(17):2 157-2 184.
[24] GOULD G W.New processing technologies: an overview[J].Proceedings of the Nutrition Society,2001,60(4):463-474.
[25] FURUTA M,YAMAGUCHI M,TSUKAMOTO T,et al.Inactivation ofEscherichiacoliby ultrasonic irradiation[J].Ultrasonics Sonochemistry,2004,11(2):57-60.
[26] KODA S,MIYAMOTO M,TOMA M,et al.Inactivation ofEscherichiacoliandStreptococcusmutansby ultrasound at 500 kHz[J].Ultrasonics Sonochemistry,2009,16(5):655-659.
[27] 栗星,包海蓉.超声波对橙汁的杀菌特性研究[J].食品科学,2008,29(8):346-350.
[28] CHO M,CHUNG H,CHOI W,et al.Linear correlation between inactivation ofE.coliand OH radical concentration in TiO2photocatalytic disinfection[J].Water Res,2004,38(4):1 069-1 077.
[29] SALLEH M S Z,ROBERTS J S.Ultrasound pasteurization: The effects of temperature, soluble solids, organic acids and pH on the inactivation ofEscherichiacoliATCC 25922[J].Ultrasonics Sonochemistry,2007,14(3):323-329.
[30] TIWARI B K,MUTHUKUMARAPPAN K,O'DONNELL C P,et al.Colour degradation and quality parameters of sonicated orange juice using response surface methodology[J].LWT-Food Science and Technology,2008,41(10):1 876-1 883.
[31] TIWARI B K,MUTHUKUMARAPPAN K,O'DONNELL C P,et al.Inactivation kinetics of pectin methylesterase and cloud retention in sonicated orange juice[J].Innovative Food Science & Emerging Technologies,2009,10(2):166-171.
[32] BHAT R,KAMARUDDIN N S B C,LONG M T,et al.Sonication improves kasturi lime(Citrusmicrocarpa) juice quality[J].Ultrasonics Sonochemistry,2011,18(6):1 295-1 300.
[33] XU G,LIU D,CHEN J,et al.Juice components and antioxidant capacity of citrus varieties cultivated in China[J].Food Chemistry,2008,106(2):545-551.
[35] REMINI H,MERTZ C,BELBAHI A,et al.Degradation kinetic modelling of ascorbic acid and colour intensity in pasteurised blood orange juice during storage[J].Food Chem,2015,173(15):665-673.
[36] ASHOKKUMAR M,SUNARTIO D,KENTISH S,et al.Modification of food ingredients by ultrasound to improve functionality: A preliminary study on a model system[J].Innovative Food Science & Emerging Technologies,2008,9(2):155-160.
Effect of ultrasound treatment on microbial inactivation and mandarin (Citrusunshiu) juice quality at 25 kHz based on sonochemistry
LI Shen,MA Ya-qin*,LI Nan-nan,ZHANG Zhen
(Citrus Research Institute, Southwest University, National Citrus Engineering Research Center, Chongqing 400712, China)
The effect of ultrasound with 25 kHz frequency on inactivation of characteristic microorganism (germs, mold, yeast, coliform) and quality of mandarin (Citrusunshiu) juice was systematically studied. The results showed that ultrasonic time, ultrasonic temperature and ultrasonic power had highly significant effects (P<0.01) on microbial inactivation in mandarin juice based on single-factor experiment. The optimum ultrasonic sterilization condition was treatment with 720 W of ultrasonic power at 50 ℃ for 40 min. The effects of pasteurization and ultrasound on the quality of mandarin juice were comparatively analyzed. The yields of sugar and acids in juice treated by ultrasound showed non-significant changes (P>0.05). The yields of ascorbic acid and total phenolics, as well as antioxidant capacity in mandarin juice were higher (P<0.05) after ultrasonic treatment compared with pasteurization. The results exhibited that low frequent ultrasound had a potential effect on the improvements of qualities of mandarin juice.
Citrusunshiu; low frequency ultrasound; microbial inactivation; quality
10.13995/j.cnki.11-1802/ts.201705018
硕士研究生(马亚琴博士为通讯作者,E-mail:myaya211@163.com)。
国家现代农业柑橘产业技术体系(CARS-27-05B);中央高校基本科研业务费专项(XDJK2015B004)
2016-08-14,改回日期:2016-09-21

