血清Cys C及其+73、-82位点基因多态性与广西壮族人群代谢综合征发病的关系
俞开敏,杨兰,陆俊佳
(1广西壮族自治区人民医院,南宁530021;2南宁市第二人民医院)
血清Cys C及其+73、-82位点基因多态性与广西壮族人群代谢综合征发病的关系
俞开敏1,杨兰2,陆俊佳2
(1广西壮族自治区人民医院,南宁530021;2南宁市第二人民医院)
目的 探讨血清胱抑素C(Cys C)及其+73和-82位点基因多态性与广西壮族人群代谢综合征(MS)发病的关系。方法 选择壮族MS患者和汉族MS患者各100例(分别为壮族MS组和汉族MS组),同期体检健康的壮族和汉族志愿者各100例(分别为壮族健康组和汉族健康组)。采用免疫比浊法检测各组血清Cys C、肌酐(Cr),聚合酶链反应-限制性片段长度多态性法检测Cys C+73、-82位点基因多态性。结果 血清Cys C、Cr水平:壮族MS组均高于壮族健康组,汉族MS组均高于汉族健康组(P均<0.01);壮族MS组与汉族MS组比较、壮族健康组与汉族健康组比较差异均无统计学意义(P均>0.05)。血清Cys C与Cr水平呈正相关(r=0.634,P<0.01)。四组Cys C +73、-82位点等位基因频率两两比较差异均无统计学意义(P均>0.05)。结论 广西壮族MS患者血清Cys C水平升高,可反映患者的肾功能状态;Cys C +73、-82位点基因多态性可能与MS的发病及民族情况均无关。
代谢综合征;胱抑素C;基因多态性;肾功能;壮族;广西地区
代谢综合征(MS)是一组多种代谢异常聚集的病理状态和临床症侯群,MS患者多伴有高血压、血脂升高、糖耐量降低以及肥胖,是心血管疾病的主要危险因素。胱抑素C(Cys C)是反映肾小球滤过功能的内源性标志物,可调节特异性组织蛋白酶的活性,影响细胞外基质产生、降解的动态平衡以及粒细胞的吞噬、趋化作用,也与心血管疾病的发生密切相关,其基因突变位点及其频率分布受人种、地域等因素的影响较大。本研究探讨广西壮族MS发病与患者血清Cys C及其+73、-82位点基因多态性的关系。
1 资料与方法
1.1 临床资料 选取2013年6月~2015年1月广西壮族自治区人民医院收治的壮族MS患者和汉族MS患者各100例(分别为壮族MS组和汉族MS组),同期体检健康的壮族和汉族志愿者各100例(分别为壮族健康组和汉族健康组)。MS的诊断标准参照《中国成人血脂异常防治指南》[3]。壮族MS组及壮族健康组要求至少三代以上未与外族通婚,各组均无遗传性疾病家族史及其他急慢性病史,各组间均无血缘关系。壮族MS组男52例、女48例,年龄46~75岁、中位年龄53.1岁;壮族健康组男55例、女45例,年龄50~71岁、中位年龄53.9岁;汉族MS组男55例、女45例,年龄47~78岁、中位年龄54.3岁;汉族健康组男53例、女47例,年龄49~72岁、中位年龄54.4岁。各组性别、年龄均具有可比性。本研究获得医院伦理委员会审核,受试者均知情同意。
1.2 血清Cys C和肌酐(Cr)水平检测 抽取各组空腹静脉血3 mL,注入干燥管中。静置30 min后,低速(3 000 r/min)离心10 min,分离血清后-20 ℃冰箱保存。应用日立7600全自动生化仪,采用免疫比浊法检测血清Cys C和Cr。
1.3 Cys C +73、-82位点基因多态性检测 采用聚合酶链反应-限制性片段长度多态性法。取各组空腹静脉血2 mL于EDTA抗凝管,充分混匀,严格按照DNA抽提试剂盒(北京天根生化科技有限公司)说明书操作制备全血DNA,-20 ℃保存备用。根据GenBank提供的Cys C基因启动子序列,采用Primer5.0软件设计引物:Cys C +73上游引物:5′-TCTATCTAGCTCCAGCCTCTCG-3′,下游引物:5′-TGCTGGCTTTGTTGTACTCG-3′,引物长度254 bp;Cys C-82上游引物:5′-GATGGATGGGGAAGGACAG-3′,下游引物:5′-CAGGATGGCCAGCAGGAG-3′,引物长度379 bp。PCR反应体系共50 μL:PCR混合反应液8 μL(含dNTP、buffer)、Taq酶 0.5 μL、无菌水37.5 μL、DNA模版2 μL,上、下游引物各1 μL。扩增条件:94 ℃预变性5 min;94 ℃变性1 min,62 ℃退火45 s,72 ℃延伸45 s,共35个循环;72 ℃延伸5 min。进行基因位点限制性片段长度多态性分析:①Cys C +73位点:PCR后产物20 μL、NgoMⅣ内切酶1 μL,buffer 3 μL,无菌水6 μL,37 ℃酶切1 h。PCR产物长度为254 bp(A等位基因),酶切后为63和191 bp的两个片段(G等位基因)。②Cys C-82位点:PCR后产物20 μL、SacⅡ内切酶1 μL,buffer 3 μL,无菌水6 μL,37 ℃酶切1 h。PCR产物长度为379 bp(C等位基因) ,酶切后为179和200 bp的两个片段(G等位基因)。将5 μL酶切后产物在2%琼脂糖凝胶上点样,电压100 V,电泳30 min后凝胶图象分析仪下观察电泳结果并摄像保存,记录Cys C +73、-82位点基因型,并计算等位基因频率。

2 结果
2.1 四组血清Cys C、Cr水平比较 血清Cys C、Cr水平:壮族MS组均高于壮族健康组,汉族MS组均高于汉族健康组(P均<0.01);壮族MS组与汉族MS组比较、壮族健康组与汉族健康组比较差异均无统计学意义(P均>0.05);见表1。直线相关性分析结果显示,血清Cys C与Cr水平呈正相关(r=0.634,P<0.01)。

表1 四组血清Cys C、Cr水平比较
注:与壮族健康组比较,*P<0.01;与汉族健康组比较,#P<0.01。
2.2 四组Cys C +73、-82位点基因型及等位基因频率比较 Hardy-Weinberg平衡检验结果显示,Cys C +73、-82位点基因分布符合群体遗传平衡法则,具有群体代表性(P均>0.05)。四组Cys C +73、-82位点等位基因频率比较差异无统计学意义(P>0.05)。见表2。
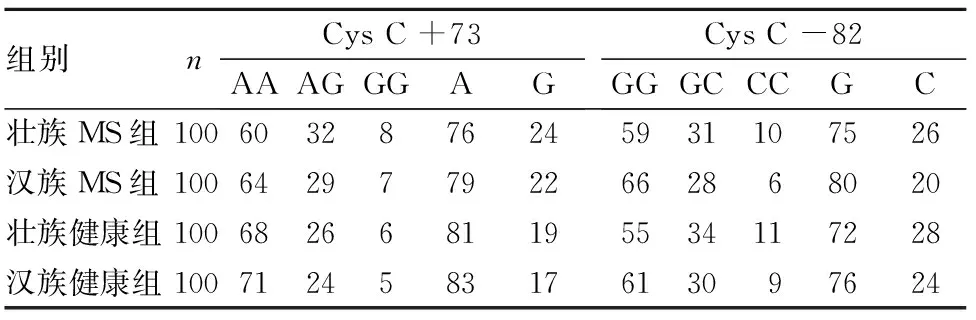
表2 四组Cys C +73、-82位点基因型及等位基因频率
3 讨论
MS是环境因素、多基因遗传因素和不良生活习惯综合作用而引起的综合征[1], 其引发的多种代谢异常均为心血管疾病的重要危险因素。Cys C表达于所有有核细胞,参与机体许多生理和病理过程,除了作为评价肾小球滤过功能的一个重要指标外[2],还可与组织蛋白酶等胱抑素酶形成紧密复合物,从而抑制组织蛋白酶的活性,影响细胞外基质产生和降解的动态平衡,以及粒细胞的吞噬及趋化作用,参与AS和炎症反应的病理过程[3,4]。Cys C是心血管事件的一个独立预测因子,也是心血管事件发生及死亡的潜在预测因子[5~7]。因此推测Cys C可能与MS有关。本研究结果显示,壮族MS组血清Cys C及Cr水平均明显高于壮族健康组,汉族MS组均明显高于汉族健康组,与以往研究[8,9]结果相似。直线相关性分析显示,血清Cys C与Cr水平呈正相关,进一步证明Cys C是评价肾滤过功能的一项可靠指标。但本研究部分研究对象临床信息不全,不能进一步分层,故血清Cys C水平能否作为MS患者发生心血管事件的预测因子仍需进一步完善。
Cys C编码基因位于染色体20p11.2,是cystatin超家族的成员之一[10]。有前瞻性队列研究发现,Cys C基因突变可能引起其合成和分泌降低,使Cys C酶的抑制功能减弱,导致机体发生一系列生理、病理改变[11,12]。Cys C基因突变主要在基因启动子处,且基因突变及其频率分布受人种、地域等因素的影响较大[13]。国内关于Cys C基因多态性与MS的关系研究较少。有研究发现,Cys C+73位点的A/G突变导致了信号肽倒数第2位的丙氨酸被苏氨酸替换,而这种替换改变了Cys C向内质网和高尔基复合体的输运,通过中断信号肽与成熟蛋白的断裂来修饰Cys C的分泌加工途径,从而引起Cys C分泌减少或活性降低[14,15]。本研究结果显示,四组Cys C +73、-82位点等位基因频率比较差异无统计学意义。分析原因:①Cys C +73、-82位点基因多态性不是广西地区MS发病的候选基因位点;②Cys C +73、-82位点G等位基因可能与广西地区MS的发生、发展有关,但因本研究观察的样本例数较少,研究人群代表性还不够强,不足以检测出其相关性。
综上所述,广西壮族MS患者血清Cys C水平升高,血清Cys C水平可反映患者的肾功能状态; Cys C +73、-82位点基因多态性在汉族与壮族人群中比较无明显统计学差异,其是否是壮族MS发病的易感基因,还需进一步研究。
[1] 王雅琴,曹霞,杨聘婷,等.体检人群代谢综合征与血清胱抑素C水平的相关性[J].中南大学学报(医学版),2015,40(7):742-747.
[2] Ayub S, Zafar MN, Aziz T, et al. Evaluation of renal function by cystatin C in renal transplant recipients[J]. Exp C lin Transplant, 2014,12(1):37-40.
[3] 杨松,蒋颖,吴坚.缺血性脑卒中患者胱抑素C与颈动脉粥样硬化的关系[J].2013,15(10):1021-1023.
[4] Akgul O, Uyarel H, Ergelen M, et al. Predictive value of elevated cystatin C in patients undergoing primary angioplasty for ST-elevation myocardial infarction[J]. J Crit Care, 2013,28(5):13-20.
[5] Lee SH, Park SA, Ko SH, et al. Insulin resistance and inflammation may have an additional role in the link between cystatin C and cardiovascular disease in type 2 diabetes mellitus patients[J]. Metabolism, 2010,59(2):241-246.
[6] Abid L, Charfeddine S, Kammoun S, et al. Cystatin C: a prognostic marker after myocardial infarction in patients without chronic kidney disease[J]. J Saudi Heart Assoc, 2016,28(3):144-151.
[7] Vieira C, Nabais S, Ramos V, et al. Multimarker approach with cystatin C,N-terminal pro-brain natriuretic peptide ,C-reactive protein and red blood cell distribution width in risk stratification of patients with acute coronary syndromes[J]. Rev Port Cardiol, 2014,33(3):127-136.
[8] 迟玥,唐玲丽,于庭.代谢综合征患者血清同型半胱氨酸与胱抑素C水平检测的临床意义[J].标记免疫分析与临床,2012,19(1):25-27.
[9] 刘平,隋树建,徐冬玲,等.胱抑素C与代谢综合征的相关性分析[J].中华医学杂志,2013,93(40):3207-3209.
[10] Perlenfein TJ, Murphy RM. Expression, purification, and characterization of human cystatin C monomers and oligomers[J]. Protein Expr Purif, 2016,117:35-43.
[11] Nquyen A, Hullenman JD. Evidence of alternative cystatin c signal sequence cleavage which is influenced by the A25T polymorphism[J]. PLoS One, 2016,11(2):147684.
[12] Pérez-Calvo JI, Castiella Muruzábal T, Búcar Barjud M, et al. Absence of cystatin C involvement in ventricular remodelling and heart failure[J]. Rev Clin Esp, 2016,216(2):55-61.
[13] Mori J, Tanikawa C, Funauchi Y, et al. Cystatin C as a p53-inducible apoptotic mediator that regulates cathepsin L activity[J]. Cancer Sci, 2016,107(3):298-306.
[14] Osk Snorradottir A, Isaksson HJ, Kaeser SA. Parenchymal cystatin C focal deposits and glial scar formation around brain arteries in Hereditary Cystatin C Amyloid Angiopathy[J]. Brain Res, 2015,(1622):149-162.
[15] Butler JM, Sharif U, Ali M, et al. A missense variant in CST3 exerts a recessive effect on susceptibility to age-related macular degeneration resembling its association with Alzheimer′s disease[J]. Hum Genet, 2015,134(7):705-715.
广西壮族自治区卫生厅自筹经费科研课题(Z2013677);南宁市科学研究与技术开发计划(ZC20133005)。
10.3969/j.issn.1002-266X.2017.16.027
R589
B
1002-266X(2017)16-0080-03
2016-08-18)

