淹水胁迫对杭菊花色苷及合成相关酶和基因的影响
汪涛+陈璐+郭巧生+张晓明+宋玲珊

[摘要] 测定不同开放程度杭菊头状花序花色苷含量及其相关基因表达量和相关酶活性和含量,分析淹水胁迫对杭菊头状花序开放过程中花色苷合成的影响。结果发现杭菊CHS基因表达量和CHS酶含量随杭菊头状花序开放程度的增加呈現先上升后下降的趋势,而花色苷含量、DFR基因表达量和DFR酶活性均随杭菊头状花序开放程度的增加而呈现先下降后上升的趋势,花色苷与DFR基因和DFR酶呈显著正相关,而与CHS基因和CHS酶无显著相关性。说明淹水胁迫对杭菊花色苷的合成及其相关酶和基因有显著影响,但不改变它们在杭菊头状花序开放过程中的变化规律,DFR基因和DFR酶的变化规律与花色苷一致,确实为花色苷合成的关键基因和关键酶,而CHS基因和CHS酶含量与花色苷的含量无显著相关性,CHS基因和CHS酶是否为杭菊花色苷合成关键基因和关键酶还有待进一步研究。
[关键词] 杭菊; 二氢黄酮醇还原酶; 查尔酮合成酶; 花色苷
[Abstract] The study is aimed at determine the content of anthocyanins and expressions of relative genes and activity of relative enzymes. The effects of flood stress on anthocyanins synthesis with relative genes and enzymes of Chrysanthemum morifolium cv. ′Hangju′ were analyzed. The expression of CHS and the content of CHS presented the trend of first rising and after downward with the increase of flowering degree. The content of anthocyanins、the expression of DFR and the activity of DFR presented the trend of first downward and after rising with the increase of flowering degree. There was a positive correlation among anthocyanins,DFR gene and DFR. However there was no significant correlation among anthocyanins,CHS gene and CHS. Flood stress has significant effects on anthocyanins synthesis with relative genes and enzymes of Ch. morifolium cv. ′Hangju′,but don′t change the patterns of genes expression and anthocyanins and enzymes accumulation. DFR and DFR are the key gene and key enzyme of anthocyanins synthesis.
[Key words] Chrysanthemum morifolium cv.′Hangju′; DFR; CHS; anthocyanins
药用菊花为菊科植物菊花Chrysanthemum morifolium Ramat.的干燥头状花序,按照药材产地和加工方法不同,分为“亳菊”、“滁菊”、“贡菊”、“杭菊”、“怀菊”[1]。杭菊Ch. morifolium cv.′Hangju′作为传统药用菊花,具有散风,清热,平肝明目,清热解毒的功效,主要化学成分包括黄酮类、挥发油类、绿原酸类等[2]。其花色苷作为黄酮类化合物的一种,多被研究其对植物花、果实颜色的形成的影响。近年来,花色苷的药理作用逐渐受到关注。丁乐等[3]研究发现桑葚花色苷对小鼠常的压缺氧和心肌缺血的实验具有保护作用。有研究证明花色苷能够通过降低血糖、增加胰岛素分泌,改善胰岛功能起到治疗多种糖尿病的作用[4-5]。花色苷的合成是由多基因调控、多种酶参与、多步骤完成的[6-8]。通常花色苷合成相关基因可分为结构基因和调控基因两大类,查尔酮合成酶(chalcone synthase,CHS)、二氢黄酮醇还原酶 (dihydroflavonol 4-reductase,DFR)是花色苷合成途径上的结构基因[9-10]。结构基因的表达模式通常会随着植物的生长发育而改变,通常伴随着开花、叶片伸展、果实成熟等生理过程而变化。
药用菊花是一种对水淹非常敏感、缺乏有效耐涝机制的物种[11],而受亚热带季风气候的影响,长江流7—8月份阴雨的天气多发,往往造成杭菊阶段性淹水灾害,对杭菊的产量和品质都有影响。本实验通过研究淹水胁迫对杭菊花色苷合及其合成相关基因和酶的影响,为进一步研究杭菊花色苷合成机制和调控机制提供依据。
1 材料
实验材料采自于浙江桐乡药用菊花种质圃,于2014年6月定植于南京农业大学药用菊花种质圃,经南京农业大学中药材研究所郭巧生教授鉴定为杭菊Ch. morifolium cv.′Hangju′;8月25日花芽开始分化对材料进行淹水胁迫处理,具体方法如下:将盆栽杭菊放入塑料桶内,加水使水面没过盆栽土壤表面5 cm,处理组和对照组各设6个重复。3 d后解除胁迫,设置空白对照组。参照郭巧生等[12]药用菊花头状花序开放程度标准见表1,图1。将杭菊开花期分为5个时期,分别采摘各时期头状花序,-80 ℃保存备用。
2 方法
2.1 RNA提取与cDNA合成 利用Trizol法提取总RNA。提取后用琼脂糖胶电泳检测RNA的质量,并使用核酸检测仪检测所提RNA的浓度和纯度。取10 μL RNA作为模板,按照反转录试剂盒说明书进行反轉录得到cDNA第一链。
2.2 引物特异性检测 根据杭菊CHS,DFR基因设计荧光定量PCR引物CHSq-F:5′-TCGTTGGTCAAGCTTTGTTC-3′和CHSq-R:5′-CTCCCTCCGAGTCTGGTAAG-3′;DFRq-F:5′-GACATTATGGAAGGCGGATT-3′和DFRq-R:5′-GTGGCAACATGAAACACTC-3′;内参基因引物为actin-F:5′-ACAACTGCTGAACGGGAAAT-3′和actin-R:5′-TCATAGACGGCTGGAAAAGG-3′。反应体系如下:cDNA 2 μL;10×Taq buffer 2 μL;ExTaq 0.2 μL;Mg2+ (25 mmol·L-1) 2 μL;dNTP(2.5 mmol·L-1)2 μL;引物,各0.5 μL;ddH2O 15.8 μL;总体积25 μL。反应条件为:预变性94 ℃ 3 min,94 ℃变性,30 s 58 ℃退火,1 min,72 ℃延伸,1 min 30 s,循环30次,72 ℃补充延伸,5 min。PCR扩增产物经1.0%琼脂糖凝胶电泳检测后回收和纯化。
2.3 杭菊CHS,DFR基因表达量的测定 用SYBRPremix Ex TaqTMⅡ(Tli RNaseH Plus)试剂盒进行qPCR;PCR反应体系为:SYBR Premix Ex TaqTM(2×)10 μL;primer-F和primer-R均为(10 μmol·L-1)0.4 μL(10 μmol·L-1);cDNA模版2 μL;ROX Reference Dye(50×)0.4 μL;ddH2O(灭菌蒸馏水)6.8 μL。设3个重复,以ROX作为荧光校正;预变性95 ℃,30 s后95 ℃,5 s,59 ℃,30 s,40个循环;熔解曲线为95 ℃,15 s,60 ℃,60 s,95 ℃,15 s,每升高0.3 ℃,采集1次荧光信号,重复3次。
2.4 花色苷的提取与测定 参照Mehrtens[13]的方法进行杭菊花色苷的提取。取300 mg杭菊头状花序,加入4 mL盐酸-甲醇溶液(1∶99),室温条件下温和振荡24 h后,12 000 r·min-1离心10 min,取上清即为花色苷。取上清液分别在波长530,657 nm处测定吸光度,并计算花色苷含量,做3个生物重复。
2.5 CHS酶的提取和含量的测定 分别取对照组和处理组不同开放程度的新鲜的杭菊头状花序加入5 mL PBS缓冲液(pH 7.2~7.4,浓度为0.01 mol·L-1)研磨充分,冷冻离心20 min,上清液即为粗酶液。采用植物物查尔酮合酶(CHS)酶联免疫分析(ELISA)试剂盒测定CHS酶含量,做3个生物重复。
2.6 DFR酶的提取和活性测定 取0.3 g杭菊头状花序于液氮中研磨成粉末,加入1.8 mL预冷的丙酮,4 ℃,13 000 r·min-1,离心15 min。弃上清,再加入1.8 mL 预冷的丙酮,4 ℃,13 000 r·min-1,离心15 min。弃上清,加入1.5 mL,硼酸盐缓冲液(内含8 μL抗坏血酸),4 ℃,12 000 r·min-1,离心15 min。取上清液,即为DFR酶提取液。每个样品设置1个对照品,各加入酶提液600 μL,1 mmol·L-1的二氢槲皮素20 μL,0.3 mmol·L-1的 NADPH 40 μL,pH 7.4 的Tris-HCl 340 μL。样品管30 ℃水浴加热1 h;对照管沸水中煮10 min。所有离心管冷却至室温,加入1 mL乙酸乙酯,涡旋振荡器振荡20 s静置分层。上清液再加入1 mL乙酸乙酯,重复3次,合并上清液在真空干燥器中干燥后加入3 mL正丁醇-HCl,95 ℃水浴加热15 min,以对照管为空白对照,550 nm下测定吸光度,做3个生物重复。
3 结果与分析
3.1 RNA提取质量 利用Trizol法从杭菊头状花序中提取总RNA,经凝胶电泳检测结果显示28S rRNA和18S rRNA条带清晰,见图2。且前者亮度约为后者2倍,说明所提取RNA完整性较好;经吸光度A检测显示A260/A280=1.96,A260/A230=2.04,说明RNA纯度较高,已达到RT-PCR扩增和qPCR要求。
3.2 引物特性检测 对杭菊不同开放程度头状花序的cDNA进行CHS,DFR及内参actin的目的片段扩增,并通过琼脂糖凝胶电泳检测。结果显示3条基因均呈现单一条带且条带明亮、边缘整齐。说明物特异性良好且不含有二聚体,达到做荧光定量PCR的要求,见图3。
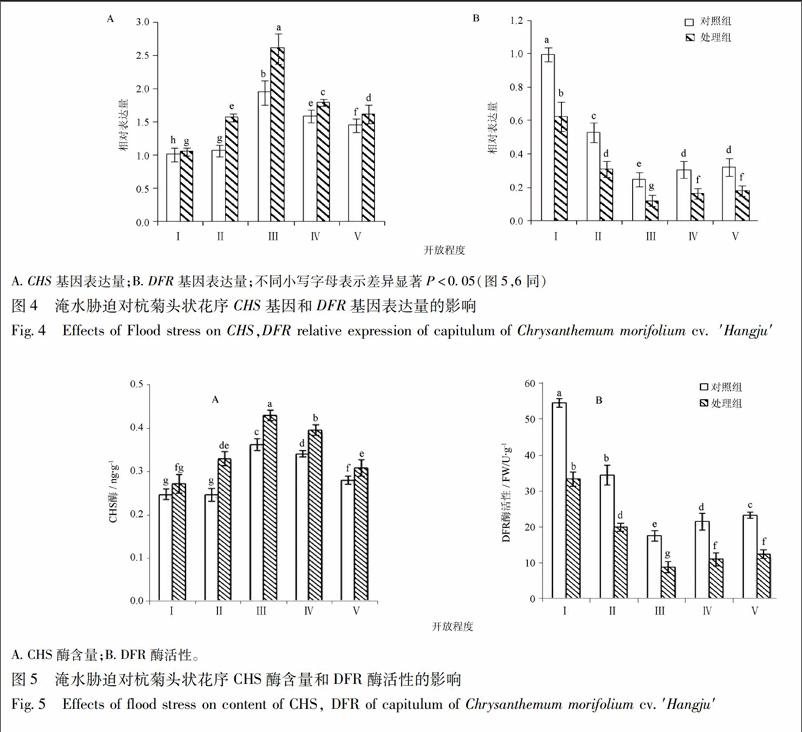
3.3 淹水胁迫对杭菊头状花序CHS基因和DFR基因表达量的影响 对照组和处理组杭菊头状花序
CHS表达量均随花序开放程度的增加而呈现先增高后降低的趋势,增高的趋势大于降低的趋势。处理组各时期表达量均明显高于对照组。时期Ⅰ CHS表达量均达到最低值,时期Ⅲ CHS表达量均为最高值,见图4。由图4(b)可看出对照组和处理组杭菊头状花序DFR基因表达量随头状花序开放程度的增加均出现先下降再上升的趋势,下降的幅度大于上升的幅度,时期Ⅴ较时期Ⅳ表达量出现微量上升,但差异不显著。处理组各时期表达量均显著低于对照组。时期Ⅰ DFR表达量均达到最高值,时期Ⅲ DFR表达量均为最低值。
3.4 淹水胁迫对杭菊头状花序CHS酶含量及DFR酶活性的影响 对照组和处理组杭菊头状花序CHS酶含量均随花序开放程度的增加而呈现先增高后降低的趋势,且处理组各时期CHS酶含量均显著高于对照组,见图5。对照组和处理组CHS酶含量在时期Ⅲ达到最高值0.36,0.43 ng·g-1,而在时期Ⅰ为最低值0.25,0.27 ng·g-1。对照组时期Ⅱ 较时期Ⅰ CHS酶含量无显著变化,而处理组同时期CHS酶含量明显增加。由图5(b)可看出对照组和处理组杭菊头状花序DFR酶活性随头状花序开放程度的增加均出现先显著下降,再缓慢上升的趋势,且各时期处理组DFR酶活性均显著低于对照组。时期Ⅰ对照组和处理组DFR酶活性均达到最高值,分别为54.5,33.3 U·g-1(FW);时期Ⅲ DFR酶活性均为最低值,分别为17.5,8.8 U·g-1(FW)。对照组和处理组DFR酶活性下降的幅度均大于升高的幅度,期时Ⅴ对照组DFR酶活性明显增加,而处理组增加不显著。
3.5 淹水胁迫对杭菊头状花序花色苷含量的影响 对照组和处理组杭菊头状花序花色苷含量随头状花序开放程度的增加均出现先下降再上升的趋势,时期I花色苷含量均达到最高值,质量分数分别为5.5,3.1 mg·g-1,时期Ⅲ花色苷含量均为最低值,质量分数分别为1.9,1.0 mg·g-1。处理组各时期花色苷含量均显著低于对照组。对照组和处理组花色苷含量下降的幅度均大于上升的幅度。时期Ⅳ和时期Ⅴ花色苷含量逐渐升高,对照组时期Ⅴ较时期Ⅲ花色苷含量显著增加,而处理组时期Ⅲ、时期Ⅳ和时期Ⅴ花色苷含量无显著差异,见图6。
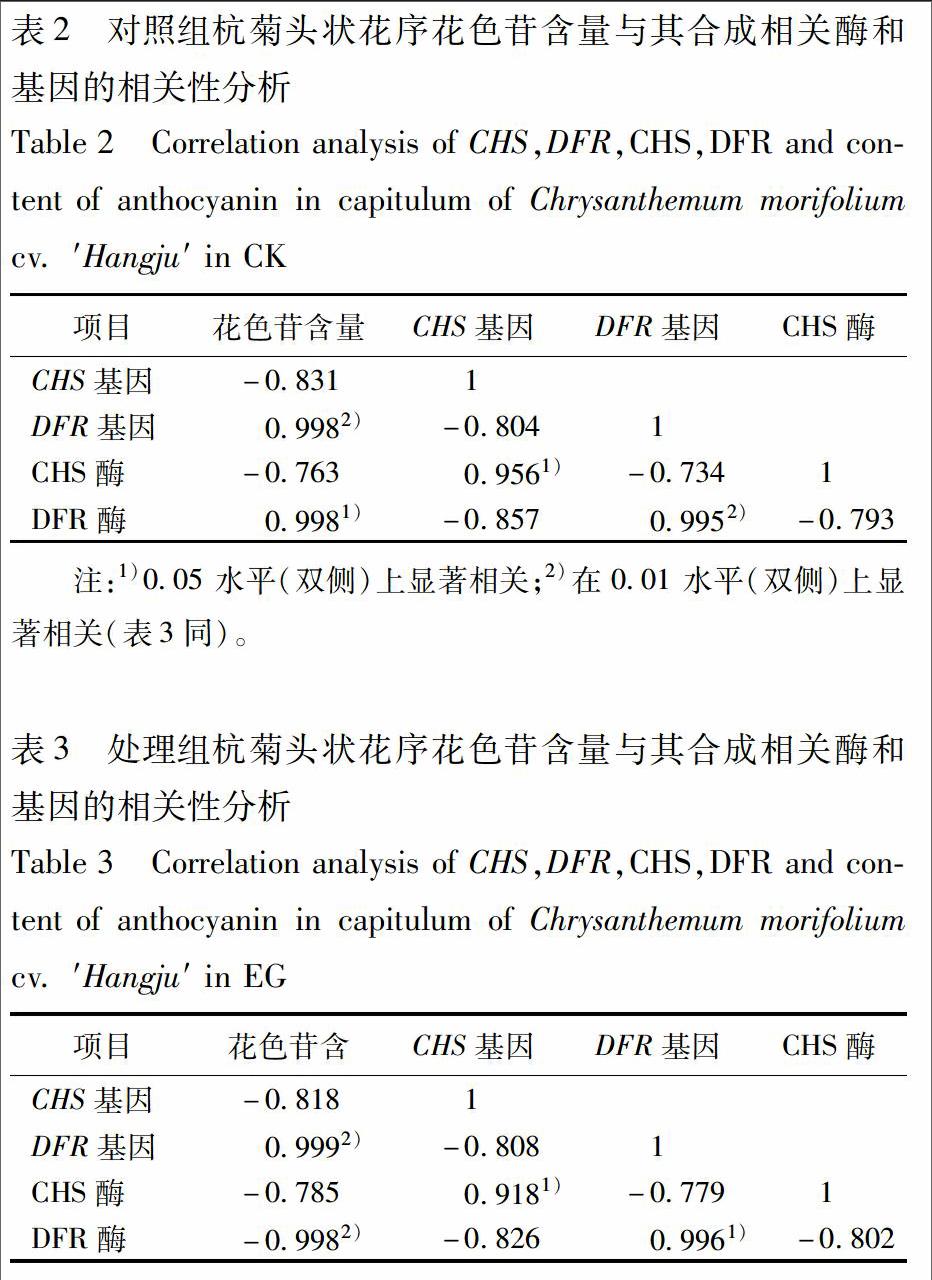
3.6 花色苷与其合成相关基因和酶的相关性分析 对照组杭菊花色苷含量与DFR基因和DFR酶呈极显著和显著正相关,而与CHS基因和CHS酶无显著相关性。CHS基因与DFR基因、CHS酶与DFR酶也无显著相关性。处理组杭菊花色苷含量与DFR基因和DFR酶呈极显著正相关,而与CHS基因和CHS酶无显著相关性。说明淹水胁迫不改变花色苷与其合成相关基因和酶的相关性,见表2,3。
4 讨论
花色苷是植物在次生代谢过程中产生的一类类黄酮物质,它是一类水溶性的天然植物色素[14],广泛存在于植物的花、果实、种子、茎、叶和根的细胞液中[15]。花色苷不仅能够控制植物花、果实等的颜色,还有一定的药理作用,对人体有保健租用。花色苷的合成是一个复杂的过程,受到多种因素的調控。内部因素主要是受到一些花色苷合成相关基因和酶的调控。外部因素主要有光照、温度、水分等。而这些因素对花色苷的影响大多也是通过影响花色苷合成途径关键酶和基因来调控花色苷的合成。
CHS基因最早是从欧芹中分离获得的[16],是花色苷合成途径中的第一个酶,它催化合成查尔酮,然后通过不同分支途径转变成为各种黄酮类化合物,而花色苷途径正是其中的一条途径。DFR是花色苷合成后期的关键酶,不同物种中或者相同物种中不同DFR成员往往催化不同的二氢黄酮醇生成不同的花青素苷并决定3种花色苷的含量和比例[17-19]。第一个DFR基因是从玉米和金鱼草中采用转座子标签法分离到的[20]。
实验结果表明杭菊头状花序CHS基因和DFR基因的表达量均随头状花序开放程度的增加而改变,说明杭菊CHS基因和DFR基因的表达量存在时间上的差异性。这可能是因为花色苷合成相关基因的表达模式会随花瓣的生长发育有所改变[21]。胡可[22]研究菊花花色苷合成途径的结构基因发现舌状花中大部分结构基因在花朵开放的初期表达量最高;随着花朵开放程度的增加,表达量逐渐降低;开放末期表达量显著上调。孟祥春[23]研究非洲菊时发现CHS基因在非洲菊花发育后期表达丰富。而在对苹果的研究中发现CHS基因在花发育早期达到表达高峰[24]。本实验中杭菊头状花序CHS基因表达量随开放程度的增加呈现先上升后下降的趋势,这可能是因为CHS基因的表达受到某些转录子等的调控以及外在条件的影响,如光照、温度、激素等。胡可等[25]研究发现瓜叶菊花中DFR的表达量随花序开放程度不同而改变,开放初期,DFR表达量丰度最高,随着开放程度的增加DFR表达量逐渐下降,后期又有明显上调。这与本实验研究结果一致,实验结果表明杭菊未开放时头状花序DFR表达量最高,开放初期头状花序DFR表达量显著下降,后期又缓慢回升,头状花序完全开放时,表达量仍显著低于未开放时期。开放前期DFR表达量下降可能某些转录因子受到抑制有关,后期DFR表达量又出现上升,很可能是由于DFR基因是光诱导基因,后期头状花序开放程度增大,接受光照面积增大,从而诱导DFR基因表达量的升高。
实验发现DFR基因、DFR酶和花色苷三者呈显著正相关,说明DFR酶确实为杭菊花色苷合成的关键酶,DFR基因确实为杭菊花色苷合成的关键基因。Honda等[26]在对3种不同品种苹果的DFR花青苷积累关系的研究中发现,花青苷含量与DFR基因表达水平有一定的相关性。这与本实验研究结果一致。实验发现CHS基因和CHS酶虽然参与了花色苷的合成,但与花色苷含量并无显著相关性,CHS基因和CHS酶是否为杭菊花色苷合成的关键基因和关键酶还有待进一步研究。
淹水胁迫是植物遭受的主要的非生物胁迫之一,它和干盐碱、干旱、极端天气等胁迫一样都会引起植物生理生态和化学成分的改变。淹水胁迫下杭菊头状花序花色苷含量显著降低,各时期均低于对照组,但随开放成增加而变化的趋势并没有改变。淹水胁迫同样使杭菊头状花序DFR基因的表达量和DFR酶活性显著低于对照组,但随开放程度而变化的趋势没有改变。相反,CHS基因表达量和CHS酶含量在淹水胁迫下显著高于对照组,而随开放程度增加而变化的趋势不变。这表明淹水胁迫对杭菊花色苷含量及其合成相关酶活性好含量以及基因的表达量的均有显著的影响,但并不改变它们在头状花序开放过程中的合成和表达模式。CHS基因表达量和CHS酶含量在淹水胁迫下显著升高很可能是因为植物在受到逆境胁迫下会产生更多的次生代谢物,例如黄酮类化合物,CHS基因作为黄酮类化合物合成的关键基因可能受到某些次生代谢物的诱导或某些转录因子的诱导而大量表达,从而催化生成更多的次生代谢产物。而DFR基因表达量和DFR酶活性以及花色苷含量在淹水胁迫下均显著降低很可能是由于淹水胁迫抑制了某些转录因子的表达从而抑制DFR基因的表达,使DFR酶活性受到抑制并最终导致了花色苷含量的降低。
[參考文献]
[1] 中国药典.一部[S].2015: 310.
[2] 王亮,汪涛,郭巧生,等.昆仑雪菊与杭菊、贡菊主要活性成分比较[J].中国中药杂志,2013,38(20): 3442.
[3] 丁乐,杨人泽,温庆明,等.桑葚花色苷抗氧化药理作用研究[J].时珍国医国药,2015,27(1): 67.
[4] Sancho R A S, Pastore G M. Evaluation of the effects of anthocyanins in type 2 diabetes[J]. Food Res Int, 2012, 46(1): 378.
[5] Guo H H, Guo J B, Jiang X W, et al. Cyanidin-3-O-β-glucoside, a typical anthocyanin, exhibits antilipolytic effects in 3T3 - L1 adipocytes during hyperglycemia: involvement of FoxO1-mediated transcription of adipose triglyceride lipase[J]. Food Chem Toxicol, 2012, 50(1): 3040.
[6] Springob K, Nakajima J, Yamazaki M, et al. Recent advances in the biosynthesis and accumulation of anthocyanins[J]. Nat Prod Rep, 2003, 20(3): 288.
[7] Grotewold E. The genetics and biochemistry of floral pigments[J]. Annu Rev Plant Biol, 2006, 57: 761.
[8] Tanaka Y, Ohmiya A. Seeing is believing: engineering anthocyanin and carotenoid biosynthetic pathways[J]. Curr Opin Biotech, 2008, 19(2): 190.
[9] 郭凤丹,夏晗,袁美,等.花生二氢黄酮醇还原酶基因(DFR)的克隆及表达分析[J].农业生物技术学报,2011,19(5): 816.
[10] 程水源,顾曼如,束怀瑞.银杏叶黄酮研究进展[J].林业科学,2000,36(6): 110.
[11] 张志远,郭巧生,邵清松.淹水胁迫对药用菊花苗期生理生化指标的影响[J].中国中药杂志,2009,34(18): 2285.
[12] 郭巧生,汪涛,程俐陶,等.药用菊花不同栽培类型总黄酮动态积累研究[J].中国中药杂志,2008,33(11): 1237.
[13] Mehrtens F, Kranz H, Bednarek P, et al. The Arabidopsis transcription factor MYB12 is a flavonol-specific regulator of phenylpropanoid biosynthesis[J]. Plant Physiol, 2005, 138(2): 1083.
[14] 卢钰,董现义,杜景平,等.花色苷研究进展[J].山东农业大学学报:自然科学版,2004,35(2): 315.
[15] Winkel-Shirley B. Flavonoid biosynthesis. A colorful model for genetics, biochemistry, cell biology, and biotechnology[J]. Plant Physiol, 2001, 126(2): 485.
[16] Reimold U, Kr′ger M, Kreuzaler F, et al. Coding and 3′non-coding nucleotide sequence of chalcone synthase messenger RNA and assignment of amino acid sequence of the enzyme[J]. EMBO J, 1983, 2(10): 1801.
[17] Martens S, Teeri T, Forkmann G. Heterologous expression of dihydroflavonol-4-reductases from various plants[J]. FEBS Lett, 2002, 531(3): 453.
[18] Xie D Y, Jackson L A, Cooper J D, et al. Molecular and biochemical analysis of two cDNA clones encoding dihydroflavonol-4-reductase from Medicago truncatula[J]. Plant Physiol, 2004, 134(3): 979.
[19] Shimada N, Sasaki R, Sato S, et al. A comprehensive analysis of six dihydroflavonol 4-reductases encoded by a gene cluster of the Lotus japonicus genome[J]. J Exp Bot, 2005, 56(419): 2573.
[20] O′Reilly C, Shepherd N S, Pereira A, et al. Molecular cloning of the a1 locus of Zea mays using the transposable elements En and Mu1[J]. EMBO J, 1985, 4(4): 877.
[21] Nakatsuka T, Nishihara M, Mishiba K, et al. Temporal expression of flavonoid biosynthesisrelated genes regulates flower pigmentation in gentian plants[J]. Plant Sci, 2005, 168(5): 1309.
[22] 胡可,孟丽,韩科厅,等.瓜叶菊花青素合成关键结构基因的分离及表达分析[J].园艺学报,2009, 36 (7): 1013.
[23] 孟祥春,彭建宗,王小菁.光和糖对非洲菊花色素苷积累及CHS,DFR基因表达的影响[J].园艺学报,2007, 34 (1): 227.
[24] Dong Y H, Beuning L, Davies K, et al. Expression of pigmentation genes and photo-regulation of anthocyanin biosynthesis in developing Royal Gala apple flowers[J]. Funct Plant Biol, 1998, 25(2): 245.
[25] 胡可,孟麗,韩科厅,等.瓜叶菊花青素合成关键结构基因的分离及表达分析[J].园艺学报,2009,36(7): 1013.
[26] Honda C, Kotoda N, Wada M, et al. Anthocyanin biosynthetic genes are coordinately expressed during red coloration in apple skin[J]. Plant Physiol Bioch, 2002, 40(11): 955.
[责任编辑 吕冬梅]

