肝硬化患者肝脏局灶性病变的超声造影分析
徐 健 吴庆梅 袁 艳 洪丽莉 穆晓荣
肝硬化患者肝脏局灶性病变的超声造影分析
徐 健 吴庆梅 袁 艳 洪丽莉 穆晓荣
目的 探讨肝硬化患者肝脏局灶性病变的超声造影特征。方法回顾性分析经穿刺活检或手术病理证实的53例肝硬化背景下肝脏局灶性病变患者的超声造影表现,采用Fisher确切概率法比较不同分化程度(高分化和中-低分化)肝细胞肝癌(HCC)的廓清时相和不同大小(≤3 cm、3~5 cm、≥5 cm)HCC的动脉相增强模式的差异。结果53例肝硬化背景下肝脏局灶性病变患者中,共42例HCC,不同分化程度的HCC在动脉相、门脉相及延迟相的廓清例数比较,差异均有统计学意义(均P<0.05)。病灶直径≤3 cm与>5 cm的HCC动脉相的增强模式比较,差异有统计学意义(P=0.01)。10例肝硬化结节患者中7例与周围肝实质三期均呈等增强,2例动脉相呈低增强,门脉相和延迟相呈等增强,另1例动脉相和门脉相呈等增强,而延迟相呈低增强。1例胆管细胞癌动脉相出现周边不均匀增强,肿块中间增强不明显,门脉相开始廓清。结论不同分化程度的HCC廓清时相存在差异,不同大小的HCC动脉相的增强模式也存在差异,超声造影对于鉴别肝硬化背景下局灶性病变的良恶性具有较高的特异性。
超声检查;造影剂;肝硬化;局灶性病变
肝硬化是一种常见的慢性肝病,有70%~90%的肝细胞肝癌(hepatocellular carcinoma,HCC)发生在肝硬化基础上[1]。肝硬化背景下的局灶性病变性质多样,及时发现病灶并判定其性质,对恶性病灶患者制定治疗方案有重要的临床意义。超声造影对鉴别肝脏局灶性病变,尤其是判定小结节的性质有至关重要的作用[2]。
资料与方法
一、研究对象
选取2013年6月至2016年10月经我院穿刺活检或手术病理确诊的肝脏局灶性病变患者53例(共53个病灶),其中男34例,女19例,年龄38~78岁,平均(54.3±8.5)岁。病灶均为单发,直径1.2~14.2 cm,平均(4.9±2.1)cm。所有患者均行超声造影和增强CT检查。入选标准:均有肝硬化病史,病程2~11年,平均(4.2±1.9)年,肝硬化均经局灶性病变旁肝组织病理活检确诊,肝硬化结节直径均<2 cm。
53例入选病例经病理确诊,HCC 42例,肝硬化增生结节10例,胆管细胞癌1例。其中HCC病例中高分化者14例,中-低分化者28例;病灶≤3 cm者10例,3~5 cm者19例,≥5 cm者13例。
二、仪器与方法
使用GE Logiq E 9彩色多普勒超声诊断仪,C1-5探头,频率3.0~4.0 MHz,机械指数0.05~0.08,配备实时谐波成像技术。造影剂采用SoneVue(意大利博莱科公司),使用时先用5.0 ml 0.9%生理盐水稀释六氟化硫干粉剂,然后充分振荡,取2.4 ml微泡悬浮液经肘部浅静脉团注。受检者取平卧位或左侧卧位,首先行常规超声扫查全肝,确定病灶的数目、大小、位置、内部回声及血供情况,然后将病灶置于最清晰的显示状态后进入造影模式,注入造影剂后连续观察5 min肝脏及病变的增强情况。造影结束后,由高年资超声医师协同评估后做出诊断。回放视频仔细观察病灶动脉相的增强特征,分析其与周围肝组织回声强度的关系,如病变动脉相增强后回声开始低于周围肝组织回声,则说明出现了廓清现象,记录开始出现廓清的时间。
三、统计学处理
应用SPSS 13.0统计软件,计数资料以百分率表示,不同分化程度HCC廓清模式和不同大小HCC动脉相增强模式的比较采用Fisher确切概率法。P<0.05为差异有统计学意义。
结果
一、常规超声表现
42例HCC均呈类圆形或分叶形,20例呈混合回声,13例呈高回声,9例呈低回声;CDFI示>2 cm的HCC内可探及较丰富的树枝状血流,≤2 cm的HCC血供较稀疏。10例肝硬化结节呈类圆形,7例呈低回声,3例呈高回声;CDFI均未探及明显血流信号。1例胆管细胞癌呈类圆形,中强回声;CDFI示病灶周边可见中等丰富的条索状血流。
二、超声造影表现
1.HCC患者超声造影表现
14例高分化HCC中,5例动脉相呈高增强,门脉相呈等增强,延迟相呈低增强;3例动脉相呈高增强,门脉相与延迟相均呈低增强;2例动脉相呈高增强,门脉相与延迟相均呈等增强;2例动脉相与门脉相均呈高增强,延迟相呈低增强;2例三期均呈等增强。28例中-低分化HCC中,24例动脉相呈高增强,门脉相与延迟相均呈低增强;4例动脉相呈高增强,门脉相呈等增强,延迟相呈低增强。
不同大小的HCC动脉相增强模式也存在差异,见表1。≤3cm病灶动脉相以均匀高增强为主,3~5 cm病灶不均匀高增强比例明显升高,≥5 cm病灶以不均匀高增强为主。共有4例动脉相呈均匀等增强。其中≤3cm与≥5 cm病灶的动脉相增强模式比较,差异有统计学意义(P=0.01)。见图1。
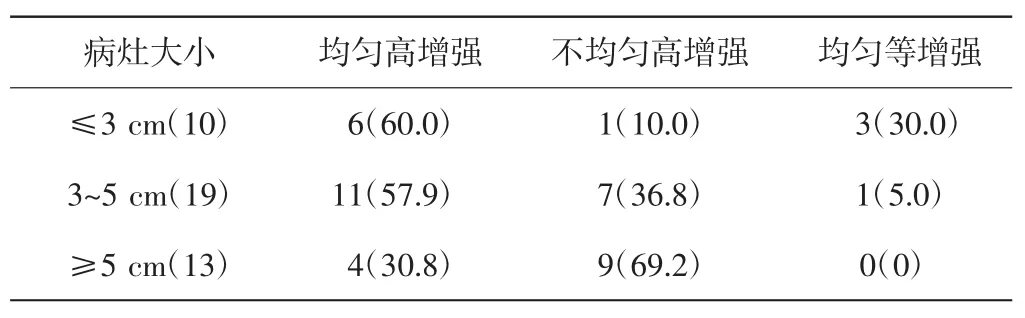
表1 不同大小HCC病灶动脉相增强模式比较 个(%)
不同分化程度HCC病灶的廓清时间存在差异,见表2。其中10例高分化HCC的病灶廓清,4例延迟相未出现廓清;28例中分化和低分化HCC患者的病灶均廓清。不同分化程度的HCC在动脉相、门脉相及延迟相开始廓清和不廓清的比例比较,差异均有统计学意义(均P<0.05)。见图2~4。
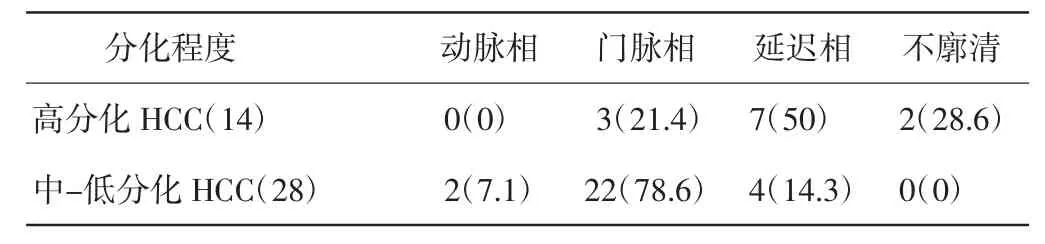
表2 不同分化程度HCC病灶廓清时相比较 个(%)
2.肝硬化结节患者超声造影表现
10例肝硬化结节患者中7例与周围肝实质三期均呈等增强;2例动脉相呈低增强,门脉相和延迟相呈等增强;1例动脉相和门脉相呈等增强,延迟相呈低增强,见图5。
3.胆管细胞癌患者超声造影表现
1例胆管细胞癌病灶动脉相出现肿块周边不均匀增强而中间增强不明显,门脉相开始廓清。
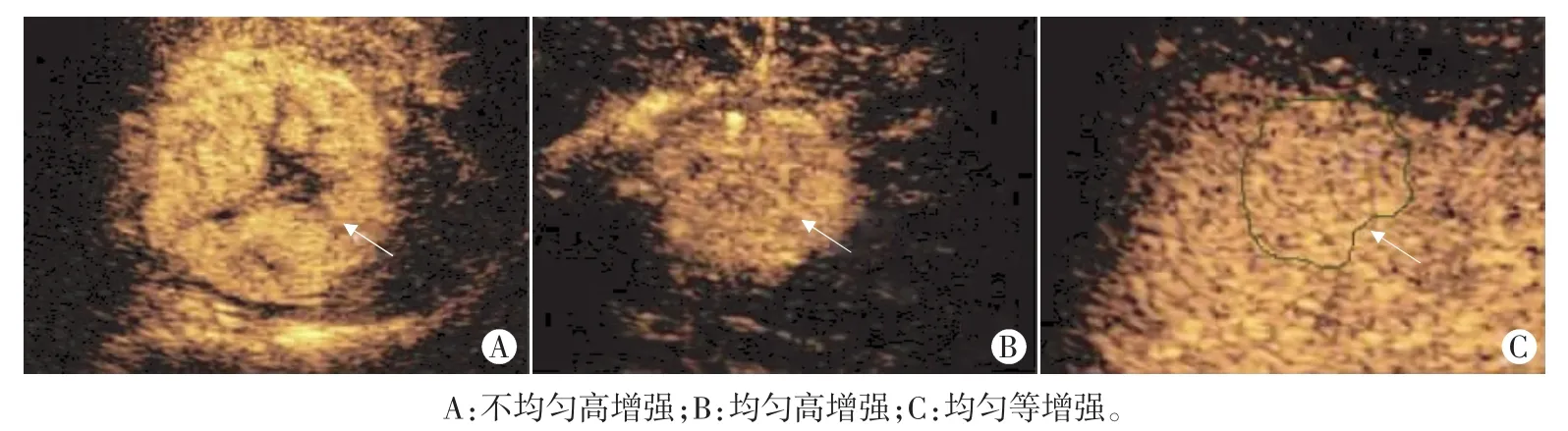
图1 HCC病灶动脉相三种不同增强模式(箭头示)声像图

图2 高分化HCC病灶(箭头示)超声造影图,三期均未出现廓清

图3 中分化HCC病灶(箭头示)超声造影图,门脉相出现廓清

图4 低分化HCC病灶(箭头示)超声造影图,动脉相还未结束即出现廓清

图5 肝硬化增生结节(箭头示)的超声造影图
讨论
肝硬化结节是正常肝细胞破坏后,肝脏对血供改变及其他刺激出现的反应性增生,主要成分为分化良好的肝实质组织,且无肿瘤新生血管出现,通常和正常肝细胞拥有相似的血供模式[3],所以肝硬化结节主要的增强模式为三期等增强。本研究中大多数肝硬化结节即是这种增强模式,与文献[4]报道一致。研究[5]认为,部分增生结节内正常肝动脉及门静脉系统分布比例可以出现差异,当门脉血供占明显优势时,动脉相可呈低增强,本研究中有2例肝硬化增生结节在动脉相即呈低增强。
HCC的发生是一系列动态的病理改变,一般认为最早为肝硬化增生结节,逐渐发展为不典型增生结节,最后发展为HCC[6],其中肝硬化增生结节和不典型增生主要由门静脉供血,随着结节的去分化发展,血管生成途径被激活,肿瘤新生血管逐渐形成,正常门静脉血供减少[7],血供逐渐从门静脉为主过渡到以肝动脉为主,使得大多数的HCC都以动脉供血为主。本研究中大部分的HCC均出现了廓清现象,正好印证了这种变化。但是,癌变过程中的微循环变化极为复杂,会出现几种状态的重叠和交叉[8],故本研究中1例肝硬化增生结节因延迟相出现廓清而被误诊为肝细胞癌,另有4例HCC因延迟相未出现廓清现象,给诊断带来了困扰,因为延迟相不出现廓清通常考虑为良性病灶[9]。本研究中高分化HCC三期不廓清率高于中-低分化HCC,这是因为高分化HCC有类似于正常肝脏的肝血窦,导致了造影剂滞留,而中-低分化HCC的廓清时间主要位于门脉相,分析其原因,这是因为随着肝脏肿瘤恶性程度的增加,肿瘤异常动脉血供不断增加,而门脉血供不断减少[10]。
本研究中,不同大小的HCC在动脉相有着不同的增强模式,5cm以下的HCC以均匀高增强为主,而5cm以上的HCC则以不均匀高增强为主,部分病灶中心出现造影剂充盈缺损,HCC动脉相的增强模式反映了病灶内以动脉为主的新生微血管的分布方式,新生微血管的密度会随肿瘤大小改变而发生变化,当HCC病灶大小为3~5 cm时的新生微血管密度最高,此后开始下降,而病灶新生微血管主要分布在边缘,特别是其周边2 cm以内[11],这很好地解释了本研究中不均匀高增强的HCC主要以周边增强为主,而充盈缺损区主要位于肿块中心部位的现象。本研究中有4例HCC动脉相呈均匀等增强,且其中有2例延迟相未见廓清,超声造影误诊为肝硬化结节,病理结果均为高分化HCC,分析其原因,可能部分高分化HCC的新生肿瘤血管较其他类型HCC较少,故动脉相增强强度与周围肝实质相似。
本研究中仅有的1例胆管细胞癌动脉相增强方式与典型的HCC容易区别,且廓清时间明显早于大多数HCC,易于诊断。有研究[12]表明,肝硬化也是胆管细胞癌的发病危险因素之一。因此,虽然肝硬化背景下的胆管细胞癌发生率较低,但值得进一步总结和研究。
超声造影通过观察HCC的廓清情况可以一定程度上评估肿瘤的分化程度[13]。评估HCC的增强模式有助于了解肿瘤内微血管的分布情况,肿瘤内的造影剂充盈缺损区可能存坏死组织,在肝穿活检时,应尽量避免穿刺这样的区域,而应该选择造影剂充盈较好的区域才能提高穿刺成功率。需要注意的是,肝硬化增生结节和部分高分化HCC的超声造影可能表现相同或相似,容易出现误诊,这提示超声医师不能忽略延迟相的观察,有个别高分化HCC在4 min以后才出现廓清现象,所以延迟相最好观察到5 min以后。对于三期呈等增强的病灶,不能武断地认为一定是肝硬化结节,需结合血清甲胎蛋白及其他影像学资料综合分析,如血清甲胎蛋白升高应建议穿刺活检或密切随访。
综上所述,不同分化程度的HCC廓清时相存在差异,不同大小的HCC动脉相的增强模式也存在差异,超声造影对于鉴别肝硬化背景下局灶性病变的良恶性具有较高的特异性。
[1]雷蕾,李良平,李琴,等.乙型肝炎肝硬化患者肝脏病变的相关因素研究[J].中国现代医学杂志,2016,26(4):54-57.
[2]Jang HJ,Kim TK,Burns PN,et al.CEUS:an essential component in a multimodality approach to small nodules in patients at high-risk for hepatocellular carcinoma[J].Eur J Radiol,2015,84(9):1623-1635.
[3]Saffioti F,Pinzani M.Development and regression of cirrhosis[J]. Dig Dis,2016,34(4):374-381.
[4]周小英,杨晓霞,叶春媚.超声造影诊断原发性小肝癌与肝硬化再生结节的价值[J/CD].中国肝脏病杂志(电子版),2016,8(2):24-28.
[5]Moribata K,Tamai H,Shingaki N,et al.Assessment of malignant potential of small hypervascular hepatocellular carcinoma using B-mode ultrasonography[J].Hepatol Res,2011,41(3):233-239.
[6]de Sio L,ladevaia MD,Vitale LM,et al.Optimized contrast-enhanced ultrasonography for characterization of focal liver lesions in cirrhosis:a single-centerretrospectivestudy[J].UnitedEurGastroenterol J,2014,2(4):279-287.
[7]杨丹,李锐,郭燕丽,等.肝细胞癌分化程度、病灶大小及肝病背景对超声造影廓清过程的影响[J/CD].中华医学超声杂志(电子版),2016,13(4):286-292.
[8]王文平.实用肝脏疾病超声造影图谱[M].北京:人民卫生出版社,2012:81.
[9]D’Onofrio M,Crosara S,De Robertis R,et al.Contrast-enhanced ultrasound of focal liver lesions[J].AJR,2015,205(1):56-66.
[10]Loria F,Loria G,Basile S,et al.Contrast-enhanced ultrasound of hepatocellular carcinoma:correlation between enhancement pattern and cellular differentiation on histopathlogy[J].Updates Surg,2012,64(4):247-255.
[11]赖江琼,徐超丽,刘国安,等.肝细胞癌超声造影特征与其分化程度的关系[J/CD].中华医学超声杂志(电子版),2016,13(4):281-285.
[12]Lin XH,Luo JC.The risk factors and prognostic factors of intrahepatic cholangiocarcinoma[J].J Chin Med Assoc,2017,80(3):121-122.
[13]Feng Y,Qin XC,Luo Y,et al.Efficacy of contrast-enhanced ultrasound washout rate in predicting hepatocellular carcinoma differentiation[J].Ultrasound Med Biol,2015,41(6):1553-1560.
Analysis on focal liver lesions in patients with cirrhosis by contrast-enhanced ultrasound
XU Jian,WU Qingmei,YUAN Yan,HONG Lili,MU Xiaorong
Department of Ultrasound,the People’s Hospital of Ba’nan District,Chongqing 401320,China
Objective To investigate the features of focal liver lesions in patients with cirrhosis by contrast-enhanced ultrasound(CEUS).MethodsData of the CEUS features of 53 cases of pathologiclly confirmed focal liver lesions with cirrhosis were enrolled and retrospectively analyzed.The difference of washout phase of hepatocellular carcinoma(HCC)with different degree and the differences of enhancement patterns of HCC in arterial phase in different size(≤3 cm,3~5 cm,≥5 cm)were compared by Fisher’s exact test.ResultsIn 53 cases,there were 42 cases of HCC.The washout ratio of HCC with differentiation in arterial phase,portal venous phase and late phase was statistically significant(all P<0.05).There was significant difference in enhancement patterns between two groups(the diameter≤3 cm HCC and the diameter≥5 cm,P=0.01).In 10 cases of cirrhosis nodules,7 cases presented iso-enhancing with the surrounding liver parenchyma in three phases,2 cases presented hypoenhancing in arterial phase and iso-enhancing in portal venous phase and delayed phase,the rest 1 case presented iso-enhancing in arterial phase and portal venous phase,hypo-enhancing in delayed phase.One case of cholangiocellular carcinoma presented heterogeneous peripheral enhancement and unconspicuous central enhancement in arterial phase,and washout occurred in portal venous phase.ConclusionThe washout phase is different in HCC with different differentiation degree.The enhancement patterns in arterial phase of HCC with different size was either different.Contrast-enhanced ultrasound has high specificity in distinguishing focal liver lesions with cirrhosis between benign and malignant ones.
Ultrasonograph;Contrast agent;Cirrhosis;Focal liver lesions
R735.7;R445.1
A
2017-01-22)
401320 重庆市巴南区人民医院超声科
穆晓荣,Email:muxiaoxiao88@163.com

