强化供氧对巴氏醋杆菌醋酸发酵及胞内ATP浓度的影响
殷海松,张仁宽,白晓磊,郑宇,王敏*
(1.天津科技大学 生物工程学院 工业发酵微生物教育部重点实验室,天津 300457;2.天津现代职业技术学院 生物工程学院,天津 300350)
强化供氧对巴氏醋杆菌醋酸发酵及胞内ATP浓度的影响
殷海松1,2,张仁宽1,白晓磊1,郑宇1,王敏1*
(1.天津科技大学 生物工程学院 工业发酵微生物教育部重点实验室,天津 300457;2.天津现代职业技术学院 生物工程学院,天津 300350)
溶氧对巴氏醋杆菌醋酸发酵有显著影响,但是目前溶氧对醋酸发酵影响的机理尚不十分清楚,文章通过提高搅拌转速,探讨强化供氧对巴氏醋杆菌醋酸发酵影响的机理。研究结果显示:搅拌转速从500 r/min增加到700 r/min后,胞内ATP浓度提高了302%;乙醇氧化偶联呼吸链产能途径关键酶ADH,ALDH和ATPase 酶活性分别提高了40%,60%和56%。当发酵28 h时,转速700 r/min与500 r/min相比菌体浓度提高了37%,产酸量提高了150%,单位菌体产酸提高了84%。由此可知,巴氏醋杆菌菌体生长和醋化乙醇过程中需要消耗大量的溶氧,尤其在16~28 h产酸高峰期对溶氧的消耗更大。提高搅拌转速强化供氧可显著提高巴氏醋杆菌乙醇氧化偶联呼吸链产能途径关键酶的活性,强化乙醇氧化产酸和乙醇呼吸链途径产能,为巴氏醋杆菌菌体生长和产酸提供更多的能量,满足菌体快速生长和适应高酸生存环境对能量的需求,提高菌体对醋酸的耐受性,从而提高菌体浓度和产酸速率。
巴氏醋杆菌;供氧;转速;醋酸;ATP浓度
食醋是一种常见的酸味调味品,醋酸是其主要组分。醋酸菌是能将乙醇氧化成醋酸的一类微生物的总称,其中Acetobacter属由于具有很强的乙醇氧化能力,被广泛应用于食醋发酵[1-3]。醋酸对普通微生物具有较强的毒性,醋酸菌具有特殊的机制,能够耐受较高浓度的醋酸。在醋酸发酵过程中,胞内能量的高低对菌体的醋酸耐受性有重要影响。Nakano S等研究表明,醋酸分子的泵出机制和ATP依赖型的转运蛋白,如AatA和ClpB均与菌体的能量代谢直接相关[4-7],因此,能量供应对于保障巴氏醋酸杆菌在高酸环境下的正常代谢非常重要[8]。所以,强化ATP的供应是提高代谢产物的产量和抵御不良生存环境的重要手段[9-11]。醋酸菌是好氧菌,在其醋酸发酵过程中需要消耗大量的溶氧,醋酸发酵过程的耗氧主要由菌体生长耗氧和乙醇的醋化耗氧两部分组成,因此在醋酸发酵过程中必须不断供氧[12]。在有氧的条件下,微生物主要通过氧化磷酸化途径产生ATP[13]。在醋酸发酵过程中,菌体需要有氧呼吸来提供抵御高酸环境的能量[14]。巴氏醋杆菌有氧呼吸产能途径主要有乙醇呼吸链产能途径和TCA循环偶联呼吸链产能途径。
本文通过提高搅拌转速,探讨强化供氧对巴氏醋杆菌醋酸发酵影响的机理,研究成果将有助于通过控制氧气的供应控制胞内ATP浓度,指导醋酸发酵工艺优化与调控。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种
巴氏醋杆菌(Acetobacterpasteurianus)AC2005,由中国普通微生物菌种保藏管理中心(China General Microbiological Culture Collection Center, CGMCC)保藏(保藏编号:CGMCC3089)。
1.1.2 培养基
斜面培养基(g/L):葡萄糖20,酵母膏15,碳酸钙20,琼脂17,pH自然,121 ℃灭菌20 min,冷却至60 ℃左右,加入无水乙醇至28,摇匀后分装斜面。
种子培养基(g/L):葡萄糖20,酵母膏15,pH自然,121 ℃灭菌20 min,接种前加入无水乙醇至28。
发酵培养基(g/L):葡萄糖20,蛋白胨5,天冬氨酸0.2,pH自然,121 ℃灭菌20 min,接种前加入无水乙醇至56。
1.1.3 试剂
无水葡萄糖(分析纯) 天津福晨化学试剂厂;蛋白胨生化试剂 英国Oxiod公司;酵母膏生化试剂 北京奥博星生物技术有限责任公司;天冬氨酸生化试剂 美国Biotopped进口分装。
1.2 仪器与设备
UVmini-1250紫外/可见分光光度计 日本岛津公司;HYG-W1摇床 上海欣蕊自动化设备有限公司;YJ-875S医用超净台 苏州净化设备厂;Multiskan Ascent酶标仪 Thermo 公司;TGL-16B 高速离心机 上海安亭科学仪器厂;Multifors Bacteria四联平行发酵罐 瑞士INFORS公司。
1.3 方法
1.3.1 培养方法
1.3.1.1 种子培养
将斜面保藏的菌种接种1环至盛有40 mL种子培养基的250 mL三角摇瓶中,置于30 ℃摇床中,在180 r/min下震荡培养约27 h,当OD610=1.38±0.12时,转接入发酵罐中。
1.3.1.2 四联平行发酵罐发酵培养
将OD610=1.38±0.12的种子液以10%的接种量接种于发酵培养基(1 L四联平行发酵罐,700 mL装液量)中,培养温度30 ℃,发酵罐转速分别为500,600,700 r/min,通气量0.7 vvm条件下培养,检测发酵过程菌体浓度和醋酸浓度,当发酵液中酒精浓度低于0.5%(V/V)时,发酵结束。
1.3.2 提高搅拌转速对巴氏醋杆菌醋酸发酵的影响
按10%的接种量将种子液转接到发酵培养基中,控制四联平行发酵罐转速500,600,700 r/min,进行醋酸发酵,检测发酵过程中菌体和醋酸浓度。
1.3.3 提高搅拌转速对巴氏醋杆菌乙醇呼吸链途径产能的强化及对关键酶活性的影响
按10%的接种量将种子液转接到发酵培养基中,控制四联平行发酵罐转速500,600,700 r/min,进行醋酸发酵。收集菌体,分析其胞内ATP浓度和乙醇呼吸链关键酶ADH,ALDH和ATPase酶活性。
1.3.4 分析检测方法
1.3.4.1 菌体干重
将发酵液于6000 r/min离心10 min,除去上清液,将菌体细胞置于干燥箱中,37 ℃恒温烘干至恒重,称量,根据标准曲线计算菌体干重。
1.3.4.2 醋酸浓度
酸碱滴定法:取1 mL发酵液于250 mL三角瓶中,加入蒸馏水15 mL,以酚酞作指示剂,用0.1 mol/L的氢氧化钠溶液将发酵液滴定至粉红色,测得总酸含量。
1.3.4.3 ADH和ALDH酶活的测定
参照Wood法[15],取Mcllains缓冲液0.5 mL,10% Triton X-100溶液0.1 mL,1 mol/L乙醇(乙醛)溶液0.1 mL,发酵液0.2 mL,0.1 mol/L铁氰化钾溶液0.1 mL,置于25 mL比色管中,25 ℃下保温5 min,然后加入硫酸铁-Dupanol溶液0.5 mL,加入3.5 mL蒸馏水混合后,在25 ℃条件下放置20 min(同时做空白对照),在660 nm下测定吸光度值。
1.3.4.4 ATPase 酶活测定方法
透性细胞制备:25 mL培养液冷冻离心,加75 mmol的Tris-HCl buffer(pH 7.0,含10 mmol/L MgSO4),加入甲苯,之后在预冷的乙醇中(-80 ℃)进行2次循环冷冻,之后30 ℃解冻。离心收集,之后在1 mL的75 mmol/L的Tris-HCl buffer(pH 7.0,含10 mmol/L MgSO4)中重悬,在预冷的乙醇中冷冻,-70 ℃保存待测。
ATPase酶活测定参考Matsumoto等[16]的方法。0.1 mL ATP(30 mmol/L)+0.4 mL反应液(3.75 mmol/L MgCl2,100 mmol/L KCl,100 mmol/L NaCl,50 mmol/L Tris-HCl,pH 7.2)置于试管中,30 ℃保温5 min,加入透性细胞悬浮液0.5 mL,再保温30 min,加入0.2 mL 三氯乙酸(20%,W/V)中止反应,6000×g离心10 min,取上清液0.5 mL,加入0.5 mL硫酸亚铁-钼酸铵。反应10 min,颜色变蓝后,在660 nm处测吸光值。根据磷(Pi)标准曲线求出其含量,酶的活性单位为μmol(Pi)/[g (cells)·min]。
1.3.4.5 菌体胞内ATP浓度的测定
收集菌体,用空培养基洗涤3次,利用BacTiter-GloTM微生物细胞活性检测试剂盒(G8230)(Promega公司)测定菌体胞内ATP浓度,检测方法参照说明书。
1.3.4.6 溶解氧浓度的测定
采用溶解氧电极测定发酵过程的溶解氧浓度(DO)。电极的标定程序:室温、1个标准大气压下饱和亚硫酸钠溶液中的溶解氧浓度(DO)标定为零点;灭菌后、接种前, pH自然,温度30 ℃,在一定氧分压及通气量下,当搅拌转速增加到某一数值后,再增加搅拌转速溶解氧浓度不再发生变化下的DO值标定为100%。文中测定的DO为相对值。
1.3.5 数据处理
每个实验共设3个平行实验,图中的数据为3个独立实验的平均值。图表生成采用Origin 7.5软件进行数据分析,显著性分析采用SPSS软件进行数据分析,P≤0.01。
2 结果与讨论
2.1 搅拌转速对巴氏醋杆菌醋酸发酵的影响
在恒定通气量的条件下,增大搅拌转速可以提高KLa,强化供氧,是发酵过程中提高溶氧的重要手段[17,18]。
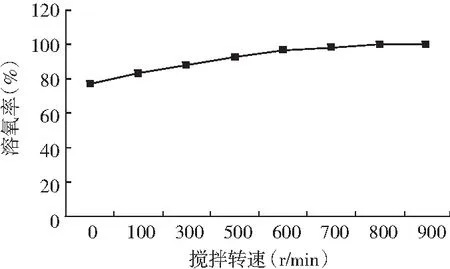
图1 接种前不同搅拌转速条件下的溶氧变化曲线
由图1可知,DO电极校正后、接种前,通气量0.7 vvm条件下,提高搅拌转速能提高氧气的溶解,提高发酵液的溶氧浓度。醋酸发酵过程中不同搅拌转速条件下的溶氧变化曲线见图2。不同搅拌转速对巴氏醋杆菌菌体生长、产酸、单位菌体产酸的影响见图3。
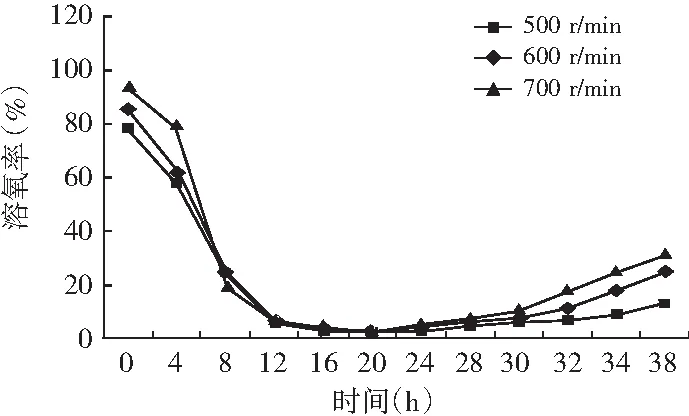
图2 醋酸发酵过程中不同搅拌转速条件下的溶氧变化曲线
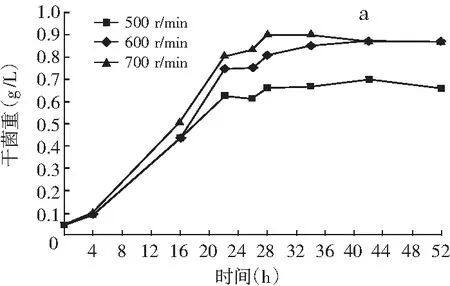
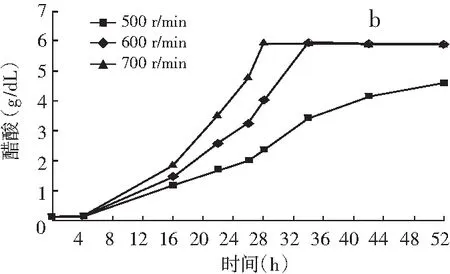
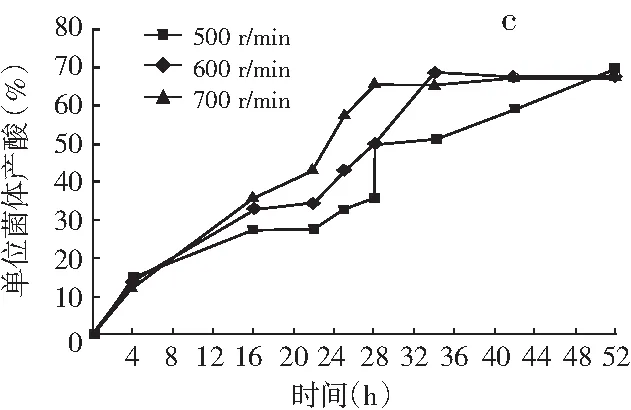
图3 搅拌转速对巴氏醋杆菌菌体生长(a)、产酸(b)和单位菌体产酸(c)的影响
由图2和图3可知,在醋酸发酵中前期菌体快速生长,发酵液溶氧浓度快速下降;发酵16 h时,溶氧浓度下降到3%左右,菌体进入产酸高峰期,低溶氧水平维持一段时间;发酵28 h后,搅拌转速700 r/min和600 r/min时菌体生长和产酸进入尾声,耗氧量迅速下降,发酵液溶氧浓度快速上升。搅拌转速500 r/min时,由于供氧不足醋酸发酵周期延长,发酵28 h后溶氧水平仍维持较低水平。结果表明:巴氏醋杆菌菌体生长和醋化乙醇过程中需要消耗大量的溶氧,尤其在16~28 h产酸高峰期对溶氧的需求更大,因此提高搅拌转速增加供氧,能显著促进菌体生长、产酸和单位菌体产酸。发酵28 h时,700 r/min时的巴氏醋杆菌菌体浓度比500 r/min时的菌体浓度提高了37%,菌体产酸提高了150%,单位菌体产酸提高了84%。推测原因是在醋酸发酵过程中增加供氧可能促进葡萄糖氧化和TCA循环偶联呼吸链途径产能,尤其是乙醇氧化和乙醇呼吸链途径产能,为巴氏醋杆菌菌体生长和产酸提供更多的能量。
2.2 搅拌转速对巴氏醋杆菌胞内ATP浓度及产能途径关键酶活性的影响
提高搅拌转速强化供氧对巴氏醋杆菌胞内ATP浓度的影响见图4。
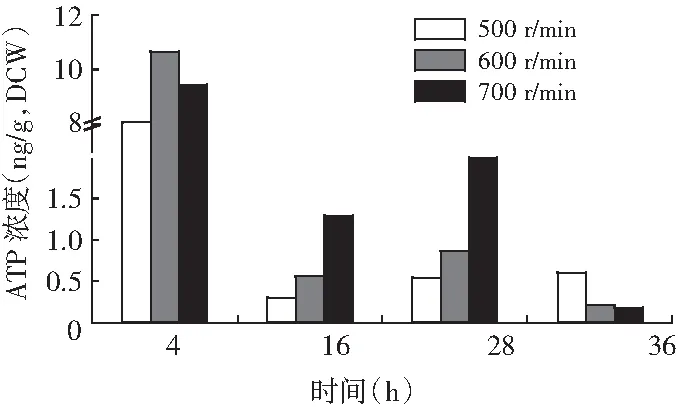
图4 搅拌转速对巴氏醋杆菌胞内ATP浓度的影响
由图4可知,与搅拌转速500 r/min时相比,600,和700 r/min时胞内ATP浓度分别提高了91%和302%。结果表明:提高转速强化供氧能显著提高巴氏醋杆菌菌体产能,尤其在发酵16~28 h的产酸高峰期影响更显著。推测其原因是在发酵过程中强化供氧能促进菌体TCA循环偶联呼吸链产能和乙醇氧化偶联呼吸链产能。尤其是在发酵16~28 h的产酸高峰期,更多的乙醇氧化脱氢,电子通过乙醇呼吸链,经辅酶PQQ、血红素c,进而经辅酶Q把电子传递到末端氧化酶,最终传递给电子受体氧,产生大量的能量ATP[19-21],见图5。
进一步分析菌体乙醇氧化偶联呼吸链产能途径关键酶活性(见图6)发现,发酵16 h时,与搅拌转速500 r/min时相比,700 r/min时胞内ADH,ALDH和ATPase 酶活性分别提高了40%,60%和56%。实验结果表明:提高转速强化供氧可显著提高巴氏醋杆菌乙醇氧化偶联呼吸链产能途径关键酶的活性,强化乙醇氧化产酸和乙醇呼吸链途径产能,为巴氏醋杆菌菌体生长和产酸提供更多的能量,满足菌体快速生长和适应高酸生存环境对能量的需求,提高菌体对醋酸的耐受性[22],从而提高菌体浓度和产酸速率,有助于通过调控能量代谢来指导醋酸发酵工艺优化与调控。
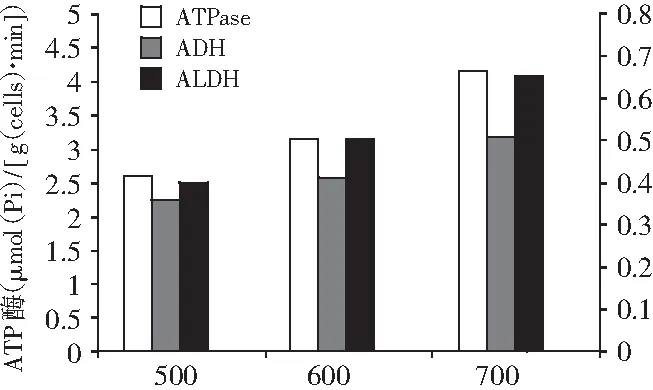
图6 搅拌转速对巴氏醋杆菌乙醇呼吸链产能途径关键酶活性的影响
3 结论
本文通过提高搅拌转速,探讨强化供氧对巴氏醋杆菌醋酸发酵影响的机理。研究结果显示:巴氏醋杆菌菌体生长和醋化乙醇过程中需要消耗大量的溶氧,尤其在16~28 h产酸高峰期对溶氧的消耗更大。搅拌转速从500 r/min增加到 700 r/min后,胞内ATP浓度提高了302%;乙醇氧化偶联呼吸链产能途径关键酶ADH,ALDH和ATPase 酶活性分别提高了40%,60%和56%。提高搅拌转速强化供氧可显著提高巴氏醋杆菌乙醇氧化偶联呼吸链产能途径关键酶的活性,强化乙醇氧化产酸和乙醇呼吸链途径产能,为巴氏醋杆菌菌体生长和产酸提供更多的能量,满足菌体快速生长和适应高酸生存环境对能量的需求,提高菌体对醋酸的耐受性,从而提高菌体浓度和产酸速率。发酵28 h时,700 r/min时的菌体浓度比转速为500 r/min时提高了37%,菌体产酸提高了150%,单位菌体产酸提高了84%。通过控制氧气的供应控制胞内ATP浓度,为醋酸发酵代谢调控提供一个新的手段。
[1]Zheng Y, Zhang K P, Wang C X, et al. Improving acetic acid production ofAcetobacterpasteurianusAC2005 in hawthorn vinegar fermentation by using beer for seed culture[J].International Journal of Food Science and Technology,2010,45(11):2394-2399.
[2]郑宇,董爱静,殷海松,等.苹果醋发酵营养盐的开发及应用[J].中国食品学报,2014,15(3):74-80.
[3]Sengun I Y, Karabiyikli S. Importance of acetic acid bacteria in food industry [J].Food Control,2011,22(5):647-656.
[4]Saeki A, Taniguchi M, Matsushita K, et al. Microbiological aspects of acetate oxidation by acetic acid bacteria, unfavorable phenomena in vinegar fermentation[J].Bioscience Biotechnology and Biochemistry,1997,61(9):317-323.
[5]郑宇,姜春悦,陈兴京,等.醋酸对巴氏醋杆菌生长和代谢活性的影响[J].现代食品科技,2014,30(9):149-153.
[6]Nakano S, Fukaya M, Horinouchi S. Putative ABC transporter responsible for acetic acid resistance inAcetobacteraceti[J]. Appl Environ Microbiol,2006,72(1):497-505.
[7]王金丹,张宝善,李亚武,等.醋酸菌耐酸机制的研究进展[J].中国酿造,2014,33(11):10-14.
[8]亓正良,杨海麟,夏小乐,等.巴氏醋杆菌高酸度醋发酵过程的能量代谢分析[J].微生物学通报,2013,40(12):2171-2181.
[9]Candela T, Fouet A. Poly-gamma-glutamate in bacteria[J].Mol Microbiol,2006,60:1091-1098.
[10]Sheng J Y, Marquis R E. Enhanced acid resistance of oral streptococci at lethal pH values associated with acid-tolerant catabolism and with ATP synthase activity[J].FEMS Microbiol Lett,2006,262:93-98.
[11]Shima J, Ando A, Takagi H.Possible roles of vacuolar H+-ATPase and mitochondrial function in tolerance to air-drying stress revealed by genome-wide screening ofSaccharomycescerevisiaedeletion strains[J].Yeast,2008,25:179-190.
[12]何志刚,李维新,林晓姿,等.枇杷酒醋化过程醋酸菌的生长、产酸及耗氧的关系[J].食品与发酵工业,2008,34(12):22-25.
[13]Zhou J, Liu L, Shi Z, et al. ATP in current biotechnology: regulation, applications and perspectives[J].Biotechnology Advances,2009,27(1):94-101.
[14]Adams M, Moss M. Food microbiology(2nd edn).[M]:UK:Royal Society of Chemistry,2000:395-438.
[15]Wood W A, Fetting R A, Hertlein B C. Gluconic dehydrogenase fromPseudomonasfluorescens[J].Methods in Enzymology,1962(5):287-291.
[16]Matsumoto M, Ohishi H, Benno Y. H+-ATPase activity inBifidobacteriumwith special reference to acid tolerance[J].Int J Food Microbiol,2004,93(1):109-113.
[17]俞俊棠,唐孝宣.生物工艺学[M].上海:华东化工学院出版社,2003:139.
[18]杨利,张旭,谭文松.溶氧水平与搅拌转速对发酵生产透明质酸分子量的影响[J].华东理工大学学报(自然科学版),2008,34(6):805-808.
[19]S Gómez-Manzo,L Chavez-Pacheco,M Contreras-Zentella,et al. Molecular and catalytic properties of the aldehyde dehydrogenase ofGluconoacetobacterdiazotrophicus, a quinoheme protein containing pyrroloquinoline quinone, cytochrome b, and cytochrome c[J].J Bacteriol,2010,192(21):5718-5724.
[20]Hirohide Toyama, F Scott Mathews, Osao Adachi, et al.Quinohemoprotein alcohol dehydrogenases:structure,function,and physiology[J].Archives of Biochemistry and Biophysics,2004,428:10-21.
[21]亓正良.酸激复合紫外诱变提高醋杆菌产酸能力及耐酸机理的研究[D].无锡:江南大学,2013.
[22]Fukaya M,Takemura H,Okumura H,et al.Cloning of genes responsible for acetic acid resistance inAcetobacteraceti[J].J Bacteriol,1990,172(4):2096-2104.
Effects of Strengthening Oxygen Supply on Acetic Acid Fermentation and ATP Concentration ofAcetobacterpasteurianus
YIN Hai-song1,2, ZHANG Ren-kuan1, BAI Xiao-lei1, ZHENG Yu1, WANG Min1*
(1.Key Laboratory of Industrial Fermentation Microbiology,Ministry of Education,College of Biotechnology,Tianjin University of Science and Technology, Tianjin 300457,China;2.School of Bioengineering,Tianjin Modern Vocational Technology College,Tianjin 300350,China)
The effects of dissolved oxygen on acetic acid fermentation ofAcetobacterpasteurianusis significant. But the mechanism of effects of dissolved oxygen on acetic acid fermentation is not very clear.By improving the agitation speed, the mechanism of effects of strengthening oxygen supply on acetic acid fermentation ofAcetobacterpasteurianusis researched in this paper. The experimental results show that the intracellular ATP concentration is increased by 302% and the enzyme activities of ADH,ALDH and ATPase in alcohol respiratory chain energy metabolism are increased by 40%,60% and 56% respectively when the agitation speed increases from 500 r/min to 700 r/min.Moreover,compared with the agitation speed of 500 r/min to 700 r/min, the bacteria concentration, acetic acid concentration and acetic acid production of unit cell are increased by 37%, 150% and 84% respectively when fermentation time is 28 h.From this we can know that large amount of dissolved oxygen is consumed in the process of bacterial growth and acetic acid production ofAcetobacterpasteurianus, especially when the acetic acid production reaches the maximum in 16~28 h.When strengthening the oxygen supply by increasing the agitation speed, the enzyme activities of key enzymes in alcohol respiratory chain energy metabolism ofAcetobacterpasteurianusare significantly improved. Also the acid production of ethanol oxidation and the energy production by alcohol respiratory chain are strengthened. Therefore, it can provide more energy for bacterial growth and acetic acid production ofAcetobacterpasteurianus,it also meets the energy needs for the rapid growth of bacteria and adapts to the high acetic acid living environment, and it improves the tolerance of bacteria to acetic acid.So the bacteria concentration and acetic acid production rate are increased.
Acetobacterpasteurianus; oxygen supply; agitation speed; acetic acid; ATP concentration
2017-01-03 *通讯作者
国家高技术研究发展计划(863计划)课题(2013AA102106);国家自然科学基金资助项目(31201406);天津市应用基础及前沿技术研究计划项目(13JCQNJC10000)
殷海松(1980-),男,河北任丘人,副教授,博士,研究方向:食品发酵技术; 王敏(1971-),女,教授,博士生导师,研究方向:食品发酵微生物功能分析与发酵技术等。
TS201.3
A
10.3969/j.issn.1000-9973.2017.06.002
1000-9973(2017)06-0005-05

