TNF-在妊娠高血压患者体内的表达及对胎儿的影响情况分析
王 英,朱 峰,王家美,鄢 玲
(十堰市中医医院妇产科,湖北 十堰 442000)
TNF-在妊娠高血压患者体内的表达及对胎儿的影响情况分析
王 英,朱 峰,王家美,鄢 玲
(十堰市中医医院妇产科,湖北 十堰 442000)
目的 探讨肿瘤坏死因子-(TNF-)在妊娠高血压综合征患者血清中的表达及对胎儿的影响。方法 选取2012年4月至2016年9月在十堰市中医医院妇产科住院分娩的妊娠高血压综合征产妇400例,其中轻度132例,中度140例,重度128例,同时选取150例健康产妇作为对照组,采用ELISA法检测母血及脐血血清中TNF-的含量。结果 对照组母血及脐血TNF-水平明显低于其他组(t值分别为5.432、6.921、6.722、8.122、7.034、9.116,均P<0.05);重度组母血及脐血TNF-水平均显著高于轻度组和中度组(t值分别为7.921、8.055、9.032、10.215,均P<0.05)。重度组Apgar评分明显低于其他组(t值分别为5.832、9.821、12.042,均P<0.05);中度组Apgar评分明显低于对照组(t=8.372,P<0.05);轻度组与对照组Apgar评分比较差异无统计学意义(t=2.104,P>0.05)。母血及脐血TNF-水平与新生儿Apgar评分呈显著负相关(r值分别为-0.322、-0.411,均P<0.05)。结论 妊娠期高血压患者血液中TNF-α呈现出高表达趋势,TNF-的表达与妊高症患者的严重程度和胎儿的状态有一定的相关性。
肿瘤坏死因子-;妊娠高血压;胎儿;母血;脐静脉血
妊娠期高血压疾病是临床上较为常见的妊娠合并症,相关研究显示妊娠期高血压疾病的发病率可达0.5‰以上,且近年来呈现出了明显的上升趋势[1]。临床上妊娠期高血压的发生发展可以导致不良妊娠结局的发生,增加母儿病死率[2]。对于妊娠期高血压疾病的评估具有重要的意义,病情的评估可以为早期临床干预提供有效的参考。血清学指标在妊娠合并症的诊断以及临床预后评估中均具有重要的意义。
肿瘤坏死因子-α(tumor necrosis factor α,TNF-α)可以通过加剧血管内皮细胞的损伤,导致胎盘血管的继发性病理改变的发生,进而加剧妊娠期高血压的病情进展[3]。本研究通过选取2012年4月至2016年9月在十堰市中医医院住院分娩的妊娠高血压综合征产妇400例,探讨了其血清及脐带血中TNF-α的表达变化,报道如下。
1资料与方法
1.1研究对象
选取2012年4月至2016年9月在十堰市中医医院妇产科住院分娩的妊娠高血压综合征产妇400例,其中轻度132例,中度140例,重度128例,纳入标准:①符合中华医学会关于妊娠期高血压的诊断标准[2];②均为单胎初产妇;③患者及家属知情同意并签署同意书。排除标准:①有糖尿病、原发性高血压及肝肾慢性疾病史;②有胎膜早破、早产及感染迹象。 同时选取150例妊娠晚期健康妇女作为对照组,各组孕妇年龄、孕周比较差异无统计学意义(均P>0.05),见表1。
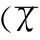


组别例数(n)年龄(y)孕周(w)对照组15027.01±8.7338.41±1.40轻度组13226.87±9.1038.51±1.73中度组14027.11±7.9937.62±1.80重度组12826.98±9.4037.43±1.58F3.1022.087P>0.05>0.05
1.2检测方法
采用低温高速离心机进行离心,1 000r/min(离心半径为15cm),获得血清后抽取50μL样品加入96孔板内,采用去离子水作为阴性对照,采用50μL cryab作为阳性对照,平衡摇晃20s混匀,室温下孵育2h,采用TBSP缓冲液清洗3次,每次5min,加入100μL底物,平衡摇晃30~45s,25摄氏度室温下孵育40min,加入250μL终止物,直到96孔板中每孔的颜色变黄,最后已空白对照为基准,采用分光光度计进行读数。TNF-α抗体购自罗氏检测公司,相关配套试剂购自南京凯基生物科技有限公司,严格按照说明书的要求进行操作。
1.3统计学方法
2结果
2.1各组母血及脐血TNF-水平比较
对照组母血及脐血TNF-水平明显低于其他组(t值分别为5.432、6.921、6.722、8.122、7.034、9.116,均P<0.05);重度组母血及脐血TNF-水平均显著高于轻度组和中度组(t值分别为7.921、8.055、9.032、10.215,均P<0.05),见表2。
2.2各组新生儿Apgar评分比较
重度组Apgar评分明显低于其他组(t值分别为5.832、9.821、12.042,均P<0.05);中度组Apgar评分明显低于对照组(t=8.372,P<0.05);轻度组与对照组Apgar评分比较差异无统计学意义(t=2.104,P>0.05),见表3。
2.3相关性分析
将妊娠高血压综合征产妇母血及脐血TNF-水平与新生儿Apgar评分进行相关性分析,母血及脐血TNF-水平与新生儿Apgar评分呈显著负相关(r值分别为-0.322、-0.411,均P<0.05)。
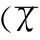

Table 2 Comparison of TNF-levels in maternal and umbilical cord blood among each ±S)
注:a与对照组比较P<0.05;b与轻度组比较P<0.05;c与中度组比较P<0.05。



组别例数(n)Apgar评分(分)FP对照组1508.09±1.0681.601<0.05轻度组1327.91±0.90中度组1407.22±0.82a重度组1286.60±0.91abc
注:a与对照组比较P<0.05;b与轻度组比较P<0.05;c与中度组比较P<0.05。
3讨论
3.1妊娠期高血压疾病的临床预后评估指标
自身免疫性因素、高血脂症及高龄初产妇等,均为妊娠期高血压的独立风险因素,特别是在年龄大于30岁的孕产妇中,妊高症的发病率可较普通对照人群上升3~4倍[4]。临床上妊高症的发生发展,可以导致孕产妇产后出血的发生,并增加胎儿宫内窘迫或者新生儿窒息的风险。通过检测血压或者尿蛋白可以评估妊高症的病情严重程度,但一项汇集了173例样本量的临床回顾性分析研究显示,单纯血压或者尿蛋白检测评估妊高症临床预后的灵敏度和特异度均不足45%,其评估一致性较差,临床应用仍然具有一定的局限性[5-6]。血清学指标的检测较为方便、经济,短期内可反复测量,在妊娠期特有疾病的诊断以及临床预后评估中均发挥了重要的参考价值。
3.2 TNF-α在妊娠期高血压疾病中的作用机制
TNF-α作为血清中的细胞炎症因子,可以通过加剧下游细胞炎症因子如白细胞介素-6(interleukin-6,IL-6)、白细胞介素-10(interleukin-10,IL-10)等的激活或者富集,进而促进炎症细胞对于胎盘组织的浸润,导致胎盘血流动力学的紊乱,加剧胎儿宫内缺氧表现。相关基础研究也显示, TNF-α可以通过加剧氧化应激损伤,进而促进胎盘血管微循环的障碍,导致胎儿宫内生长受限,并增加新生儿窒息的风险[7-8]。已有的研究探讨了 TNF-α在妊高症患者血清中的异常表达,认为高表达的 TNF-α与患者的远期不良临床预后具有密切的关系[9],但相关研究的样本量不足,临床资料的收集偏移较为严重,可信性不高。本研究的创新点主要在于分析了不同严重程度的新生儿窒息与血清TNF-α的关系,且总体样本量达400例以上,样本量较为丰富,研究结论的可靠性较高。
3.3 TNF-α在妊高症中的异常表达及其与患者临床预后的关系
本研究发现,妊高症组患者血清及脐带血中的TNF-α均明显高于正常对照组,差异具有统计学意义,提示TNF-α可能参与到了妊高症的发生发展过程中。TNF-α可以通过加剧血管内皮细胞的氧化损伤,促进胎盘血流阻力系数的上升,进而导致孕产妇不良妊娠结局的发生。Limoges等[10]研究者通过回顾性分析了73例样本量的临床资料,发现妊娠期高血压患者血清中的TNF-α可较正常对照人群上升25%以上,这与本研究的结论较为一致。在不同病情严重程度的孕产妇中,TNF-α的表达同样具有明显的差异,妊高症患者的病情越为严重,其血清或者脐带血中的TNF-α表达浓度越高,趋势较为明显,提示TNF-α的表达可以作为评估妊高症病情的重要参考[10]。但需要注意的是,Maru等[11]研究者的研究中并未发现血清中TNF-α的表达与妊高症患者病情间的关系,这与本研究的结论存在一定的差别,考虑到样本量的不足、临床资料的收集偏移等,均可能导致了最终结论的差别。重度组及中度组患者的Apgar评分较低,低于正常对照组,Apgar评分是评估新生儿临床结局的重要指标,而在轻度、中度及重度组患者血清中,TNF-α的表达逐渐上升,提示TNF-α与新生儿不良临床结局具有密切的关系,临床上可以通过妊娠中晚期采集孕产妇的血清TNF-α,进而评估新生儿不良结局风险,据此有利于早期进行新生儿复苏急救。但本研究并未发现轻度组及正常对照组间的TNF-α表达差异,考虑TNF-α的表达主要参与到了较为严重的新生儿窒息的发生发展过程中。而通过相关关系分析可以发现,母血及脐血TNF-α水平与新生儿Apgar评分呈负相关,TNF-α的表达越高,孕产妇新生儿窒息的风险越高,进一步提示TNF-α的表达可以作为评估新生儿宫内缺氧或者窒息风险的重要依据。
综上所述,在妊娠期高血压患者血清及脐带血中,TNF-α呈现出了明显的高表达趋势,TNF-α的表达越高,妊高症患者的病情往往越为严重。但本研究对于TNF-α的表达与妊高症孕产妇不良临床结局的关系研究不足,存在一定的局限性。
[1]林彤,陈丽红,胡继芬,等.妊娠期高血压的危险因素[J].中华高血压杂志,2015,23(1):83-85.
[2]刘晓莉,阮炎,刘亚君,等.14省、市、自治区妇女妊娠年龄与妊娠期高血压疾病关系的探讨[J].中华医学杂志,2015,95(1):19-22.
[3]冯俐平,李景平,吴利玲,等.妊娠期高血压疾病患者血清TNF-α、IL-6与ET的水平变化及临床意义[J].海南医学,2013,24(5):705-707.
[4]Castleman J S,Ganapathy R,Taki F,etal.Echocardiographic structure and function in hypertensive disorders of pregnancy:a systematic review[J].Circ Cardiovasc Imaging,2016,9(9):e004888.
[5]Rosenzweig E B,Biscotti M,Cleary K,etal.Chronic thromboembolic pulmonary hypertension, pregnancy, and a pulmonary endarterectomy:a rare challenge[J].Pulm Circ,2016,6(3):384-388.
[6]Umesawa M,Kobashi G.Epidemiology of hypertensive disorders in pregnancy: prevalence,risk factors,predictors and prognosis[J].Hypertens Res,2017,40(3):213-220.
[7]王益群.妊娠期高血压疾病相关影响因素及对妊娠结局影响的研究[J].中华全科医学,2015,13(4):602-604.
[8]石军,罗利飞.妊娠高血压疾病患者治疗前后血浆炎症因子的变化[J].中国现代医生,2012,50(23):16-17.
[9]王茜,袁晓洁,赵丽,等.IL-1β、NO、TNF-α、瘦素对妊娠期高血压疾病的临床研究[J].中国优生与遗传杂志,2012,20(5):35-36.
[10]Limoges M,Langleben D,Fox B D,etal.Pregnancy as a possible trigger for heritable pulmonary arterial hypertension[J].Pulm Circ,2016,6(3):381-383.
[11]Maru L,Verma M,Jinsiwale N.Homocysteine as predictive marker for pregnancy-induced hypertension-A comparative study of homocysteine levels in normal versus patients of PIH and its complications[J].J Obstet Gynaecol India,2016,66(Suppl 1):167-171.
[专业责任编辑:于学文]
Expression of TNF- in pregnancy-induced hypertension patients and its effect on fetus
WANG Ying, ZHU Feng, WANG Jia-mei, YAN Ling
(DepartmentofObstetricsandGynecology,ShiyanHospitalofTraditionalChineseMedicine,HubeiShiyan442000,China)
Objective To investigate the expression of tumor necrosis factor- (TNF-) in pregnancy-induced hypertension patients and its effect on fetus. Methods From April 2012 to September 2016, totally 400 cases of pregnancy-induced hypertension delivering in Shiyan Hospital of Traditional Chinese Medicine were selected, including 132 mild cases, 140 moderate cases and 128 severe cases. At the same period 150 healthy pregnant women were selected in control group. Content of TNF- in maternal and umbilical cord blood was detected by ELISA. Results In the control group TNF- levels in maternal and umbilical cord blood were significantly lower than those in the other groups (tvalue was 5.432, 6.921, 6.722, 8.122, 7.034 and 9.116, respectively, allP<0.05). In severe group TNF- levels in maternal and umbilical cord blood were significantly higher than those in mild group and moderate group (tvalue was 7.921, 8.055, 9.032 and 10.215, respectively, allP<0.05), and Apgar score was significantly lower than the other groups (tvalue was 5.832, 9.821 and 12.042, respectively, allP<0.05). Apgar score in moderate group was significantly lower than in the control group (t=8.372,P<0.05). There was no significant difference in Apgar score between mild group and control group (t=2.104,P>0.05). TNF- level in maternal and umbilical cord blood was negatively correlated with neonatal Apgar score (rvalue was -0.322 and -0.411, respectively, bothP<0.05). Conclusion TNF- is highly expressed in pregnancy-induced hypertension patients. The expression of TNF- is correlated with the severity of patients with pregnancy-induced hypertension and fetal situation.
tumor necrosis factor- (TNF-); pregnancy-induced hypertension; fetus; maternal blood; umbilical vein blood
2017-03-10
王 英(1980-),女,主治医师,主要从事产科临床工作。
鄢 玲,副主任医师。
10.3969/j.issn.1673-5293.2017.05.019
R714.246
A
1673-5293(2017)05-0544-03

