CARS显微成像系统的空间分辨率标定
刘 伟,刘双龙,陈丹妮,牛憨笨
深圳大学光电工程学院,光电子器件与系统教育部/广东省重点实验室, 广东深圳 518060

【光电工程 / Optoelectronic Engineering】
CARS显微成像系统的空间分辨率标定
刘 伟,刘双龙,陈丹妮,牛憨笨
深圳大学光电工程学院,光电子器件与系统教育部/广东省重点实验室, 广东深圳 518060
空间分辨率是衡量相干反斯托克斯拉曼散射(coherent anti-stokes Raman scattering,CARS)显微成像系统性能的一个重要指标. 选择直径为110 nm的聚苯乙烯微球进行三维成像,根据各个点的位置数据与光谱数据形成的二维数组分别重构了系统x-y平面和x-z平面的点扩展函数,准确测试了自行搭建的CARS显微成像系统的横向空间分辨率约为484nm,轴向空间分辨率约为3.17μm.
光学工程;相干反斯托克斯拉曼散射;图像重构;点扩展函数;空间分辨率;非线性光学;拉曼散射;信息光学

1965年, Terhune等[14]发现了CARS现象.1982年,Maker等[15]将该现象与光学显微镜结合起来发展了CARS显微技术.1999年,谢晓亮课题组将CARS系统的激发光布局从非共线转为共线,简化了CARS显微成像系统,此后该技术迎来了快速发展并逐步走向实用[16-17].CARS显微成像技术将单点分析扩展到对一定空间范围内具有结构的样品研究.该技术依靠逐点扫描获得图像,通过聚焦光斑与样品间的相对运动,将样品上每个点的强度信息与位置信息一一对应,可在无需标记的前提下获得反映分子某一特征化学键的空间分布信息,为人类提供了远超人眼所能看到的内容,现已广泛用于生物学、医学对脂类和蛋白质分子成像等领域.空间分辨率是衡量CARS成像系统性能的一个重要指标[18],本研究选取直径为110 nm的聚苯乙烯微球进行三维成像,重构系统的点扩展函数.根据点扩展函数的半高全宽,获得CARS显微成像系统的三维空间分辨率.
1 CARS显微成像系统搭建
CARS为非线性过程,当中心频率为ωL的泵浦光与中心频率为ωS的斯托克斯光的频率差恰好等于分子某一化学键的振动频率ΩR时[19],即ωL-ωS=ΩR, 共振激发产生频率为ωA=ωP+ΩR的反斯托克斯信号,ωP为探测光中心频率[20],能级图如图1[21].其中,g为振动基态;v为振动激发态.

图1 CARS过程能级图[21]Fig.1 Energy level diagram of CARS process[21]
CARS信号的产生至少需要两束脉冲激光,其中一束既是泵浦光又是探测光[22-23]. 利用飞秒脉冲泵浦光学参量放大器(opticalparametricoscillator,OPO)作为波长调谐的关键装置[24].脉冲激光器产生的光束一分为二,一路作为CARS系统的斯托克斯光,另一路泵浦OPO产生两束与泵浦光脉冲时序完全一致、波长可调谐的信号光与闲频光, 通常只采用信号光作为CARS系统的泵浦光,与斯托克斯光共同激发样品[25].本研究采用美国Spectra-Physics公司的钛宝石飞秒激光脉冲泵浦OPO.中心波长为820nm,重复频率为80MHz的飞秒脉冲倍频后(中心波长为410nm)作为OPO的泵浦源,产生的信号光波长范围为490~750nm,作为CARS成像系统的泵浦光.泵浦光与斯托克斯光的脉冲序列同步,通过光学时间延迟线可使脉冲精确重合,并通过显微物镜聚焦后共同作用于样品.
选择具有结构的聚苯乙烯分子,泵浦光与斯托克斯光频差满足聚苯乙烯分子苯环内碳原子间非对称伸缩振动引起的1 603cm-1振动频率,共振激发产生相应波长的CARS信号.钛宝石飞秒激光泵浦OPO尚未耗尽的部分,即中心波长为820nm的光作为斯托克斯光,调整OPO的信号光波长至724nm,并同时作为泵浦光与探测光,产生的CARS信号中心波长为648nm.飞秒激光光源的脉宽很窄,因此调节两路脉冲精确重合的难度较大.本研究选择由精密线性平台和两块呈90°摆放的反射镜组成的光学时间延迟线精确控制脉冲之间的延迟,控制精度可达7fs.同步后的两束飞秒脉冲光经特殊设计的双色镜合束后共线输入显微物镜,并调整激发光光轴与物镜中心轴重合,以此保证在相同激发光功率下能够获得最大的信号强度.激光束通过数值孔径为0.95的消色差显微物镜聚焦到样品上,信号只产生于光功率密度较高的焦点处,并具有良好的方向性,可通过一个数值孔径为0.85的聚光镜收集,并通过一根单模光纤输入至光谱仪中,系统示意如图2.
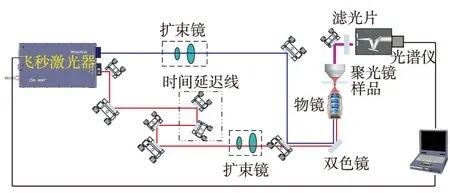
图2 CARS显微成像系统示意图Fig.2 Diagram of the CARS microscopy system
CARS信号通过大数值孔径聚光镜收集后由光纤输入至光谱仪.通过聚焦光斑与样品之间的相对运动,对样品进行逐点扫描,通过软件进行图像重构后获取一幅完整的CARS显微图像.聚焦光斑与样品之间的相对运动由三维纳米位移台完成(型号为PI,P-545.3C7),位移台的移动与光谱仪的数据采集需紧密配合方能完成样品扫描过程.扫描过程中,当纳米位移台沿x轴(假设x方向为快轴)正方向每移动一步,并停留在此位置时,光谱仪马上对该点的光谱数据进行采集并保存.纳米位移台继续沿着x方向移动至下一个采样点,光谱仪再次完成数据采集,直至x方向上所有采样点数据采集完毕.然后,纳米位移台沿y轴(假设y方向为慢轴)移动一步并采集该位置的光谱强度数据,随后,纳米位移台沿x轴负方向逐步移动并记录每一位置处的光谱强度信息,依次循环直至完成整个样品扫描和数据采集.样品二维点扫描示意如图3.其中蓝点代表每1个位移台驻留的每个位置;红色虚线的箭头方向代表位移台的运动方向.按照上述扫描方式完成x-y平面的二维图像扫描后,如需完成三维空间层析成像,纳米位移台沿z轴方向每运动1步,就在此面上扫描完成1幅x-y平面的二维二维图像,直至扫描完成像区域的整个三维空间.CARS显微成像系统可以获得任意维度的二维图像及三维层析图像[26-27].
扫描过程中,纳米位移台每移动1步,光谱仪需要记录1次光谱数据,两者之间的联动决定了扫描过程能否完成.本研究根据厂家提供的开发包编写了基于LabView虚拟仪器开发软件,实现了纳米位移台与光谱仪的自动控制,使两台独立运行的仪器配合成一个整体实现自动扫描.当纳米位移台配合光谱仪完成一定空间范围内样品的自动扫描后,每个采样点的位置数据与光谱数据将形成1个二维数组并存放于相同的路径中,扫描过程记录了每个采样点的位置数据以及光谱数据.图像重构过程是一个卷积过程,即将具有一定空间结构的样品上的每个采样点均以爱里斑来代替,而每个点采集的光谱数据做归一化处理后对应为灰度值.每个采样位置点的光谱强度值作为整个爱里斑覆盖区域(以图3中虚线框范围表示)平均强度.采用Matlab软件编写了成像代码,依次打开指定路径下保存的位置数据与光谱数据文件,读取每个采样点的位置和光谱数据,可重构具有一定灰度等级的CARS显微图像.
基于以上CARS显微成像系统的搭建及控制程序、图像重构程序的编写,针对聚苯乙烯分子1 603cm-1的拉曼峰,采用泵浦光与斯托克斯光功率分别为2.3和0.5mW,完成直径为1.37和4.60μm的聚苯乙烯微球的CARS显微成像,结果如图4.其中,图4(a)为直径1.37μm的聚苯乙烯微球的CARS显微图像,扫描的单步步长为50nm,步数为70×70,幅面尺寸为3.5μm×3.5μm,成像耗时约12min;图5(b)为直径4.60μm聚苯乙烯微球的CARS显微图像,扫描步长为0.2μm,扫描步数为100×100,幅面尺寸为20μm×20μm成像耗时约25min.

图4 直径分别为1.37和4.60 μm的聚苯乙烯微球CARS显微图像Fig.4 CARS images of polystyrene microballs with diameters of 1.37 and 4.60 μm respectively
3 CARS显微成像系统空间分辨率
CARS属于3阶非线性过程,信号强度与激发光强度呈正比,且只产生于光功率密度较高的焦点处.通过扫描一个尺寸远小于光波波长的聚苯乙烯微球,根据扫描过程记录的每个采样点的位置数据、光谱数据重构系统的点扩展函数,及该函数的半高全宽,得到CARS显微成像系统的分辨率.实验中泵浦光中心波长为724nm,斯托克斯光中心波长为820nm,两者频差满足聚苯乙烯分子1 603cm-1的振动频率,平均功率分别为1.5与7.5mW.
为重构系统点扩展函数,选择尺寸远小于光波长的110nm且单独分布的聚苯乙烯微球进行成像.110nm远小于光学显微镜的分辨率,目镜下肉眼很难观察到此微球分布状态,因此,实验过程中首先通过大步长粗略扫描,采用图像重构方法得到一幅较大范围内微球排布状况的CARS显微图像,然后根据此图像选择扫描起始位置和范围,确定物镜聚焦的位置是否需要调整.此外,为尽可能获得呈单独分布的微球,避免大量微球堆聚现象,样品制备过程中需使少量微球平铺到载玻片表面.在载玻片表面滴入纯水,将聚苯乙烯球样品滴到水面,依靠液体表面张力使微球呈单层分布,待水自然风干后,聚苯乙烯球将贴在载玻片表面.
通过大步长粗略扫描可确定扫描的起始位置以及范围.纳米位移台移动步长为50nm,光纤光谱仪单点积分时间为100ms.对目标样品进行x-y二维方向扫描,完成步长为50nm,幅面步数为50×50,幅面尺寸为2.5μm×2.5μm的二维空间x-y范围的CARS显微图像扫描.图5(a)为用Matlab软件重构后获得的直径为110nm聚苯乙烯微球的CARS图像,图5(b)为经高斯拟合后的系统点扩展函数,其半高全宽约为484nm.
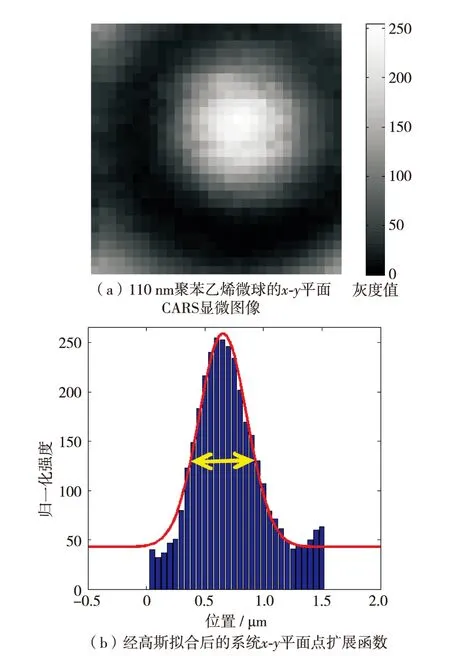
图5 110 nm聚苯乙烯微球的x-y平面CARS显微图像及高斯拟合后的x-y平面点扩展函数Fig.5 The x-y dimensional CARS microscopic images of the 110 nm polystyrene balls and point spread function of the CARS system in x-y plane via Gaussian fitting
根据110nm微球的二维显微图像,确定该球在x-y空间的中心位置后,进行x-z方向的逐点扫描,则可获得显微系统的轴向空间分辨率.扫描过程中,以x轴为快轴,z轴为慢轴,完成二维空间x-z范围的CARS显微图像扫描.图6(a)为重构获得的110nm聚苯乙烯微球x-z方向的CARS显微图像,图6(b)为经高斯拟合后的的系统点扩展函数,其半高全宽约为3.17μm.

图6 110 nm聚苯乙烯微球的x-z平面CARS显微图像及高拟合后的x-z平面点扩展函数Fig.6 The x-z dimensional CARS microscopic images of the 110 nm polystyrene balls and point spread function of the CARS system in x-z plane via Gaussian fitting
本研究搭建的CARS显微成像系统的横向和轴向空间分辨率均高于由阿贝衍射极限决定的理论空间分辨率.横向空间分辨率下降是由于周围环境空气流动及光学平台振动等原因导致的爱里斑漂移,经测试得到成像时间内爱里斑相对运动在x和y方向的标准差分别为σx=94 nm和σy=286 nm.轴向空间分辨率下降则主要是由于泵浦光和斯托克斯光发散角不同及中心波长为820 nm的斯托克斯光经过OPO的倍频晶体后像散严重所致.为提高CARS显微成像系统的空间分辨率,可采取以下措施:① 将系统与周围环境隔离,更换具有主动隔振功能的光学平台,尽量降低爱里斑的相对运动,提高横向空间分辨率;② 为提高轴向空间分辨率,测试并控制两束激发光的发散角,使其尽可能接近,并在飞秒激光脉冲泵浦OPO前先将其分光,一束泵浦OPO,一束直接作为斯托克斯光,不再采用尚未耗尽的820 nm激光脉冲作为斯托克斯光来降低像散;③ 根据激发光波长定制消色差显微物镜,提高CARS显微成像系统空间分辨率.
结 语
CARS显微成像技术可在无需标记前提下获取样品分子某一特征振动模式的空间分布信息.通过逐点扫描的方法获得成像物体上每一点的光谱数据和相应的空间位置信息,每一点的光谱数据对应一个txt文件,将其映射为灰度值,通过Matlab软件重构获得样品的伪彩色图像.空间分辨率是衡量CARS显微成像系统性能的一个重要指标,本研究通过三维扫描一个直径远小于入射光波长的聚苯乙烯微球,得到CARS显微成像系统的横向和轴向空间分辨率.结果表明,CARS显微成像系统的横向和轴向空间分辨率均高于由阿贝衍射极限所决定的理论空间分辨率.横向空间分辨率下降是由于周围环境空气流动以及光学平台振动等因素导致的爱里斑漂移,轴向空间分辨率下降主要是由于泵浦光和斯托克斯光发散角不同,以及斯托克斯的像散所致.以后将针对以上几点进行改进,以期提高CARS系统的空间分辨率.
致谢:衷心感谢屈军乐教授的悉心指导!
/ References:
[1] 刘立新,屈军乐,林子扬,等. 荧光寿命成像及其在生物医学中的应用[J].深圳大学学报理工版,2005,22(2):133-141. Liu Lixin, Qu Junle, Lin Ziyang, et al. Fluorescence lifetime imaging and its biomedical applications[J]. Journal of Shenzhen University Science and Engineering, 2005, 22(2): 133-141.(in Chinese)
[2] 邵永红,李 恒,王 岩,等.基于同步扫描相机的荧光寿命测量系统研究[J].深圳大学学报理工版,2009,26(4):331-336. Shao Yonghong, Li Heng, Wang Yan, et al. A fluorescence lifetime spectrometer based on a synchroscan streak camera[J]. Journal of Shenzhen University Science and Engineering, 2009, 26(4): 331-336.(in Chinese)
[3] 牛憨笨,陈丹妮,尹 君.细胞内分子检测及成像技术研究[J].深圳大学学报理工版,2011,28(1):1-16. Niu Hanben, Chen Danni, Yin Jun. Advances in approaches of molecules detecting and imaging in cells[J]. Journal of Shenzhen University Science and Engineering, 2011, 28(1): 1-16.(in Chinese)
[4] Lichtman J W, Conchello J A. Fluorescence microscopy[J]. Nature Methods, 2005, 2(12): 910-919.
[5] Mukamel S. Principles of nonlinear optical spectroscopy[M]. New York, USA: Oxford University Press, 1999.
[6] Jalbert I, Stapleton F, Papas E, et al. In vivo confocal microscopy of the human cornea[J]. British Journal of Ophthalmology, 2003, 87(2): 225-236.
[7] Kiesslich R, Burg J, Vieth M, et al. Confocal laser endoscopy for diagnosing intraepithelial neoplasias and colorectal cancer in vivo[J]. Gastroenterology, 2004, 127(3): 706-713.
[8] Freudiger C W, Min W, Saar B G, et al. Label-free biomedical imaging with high sensitivity by stimulated Raman scattering microscopy[J]. Science, 2008, 322(5909): 1857-1861.
[9] Wang Hui, Sun Yubing, Yi Jinhui, et al. Fluorescent porous carbon nanocapsules for two-photon imaging, NIR/pH dual-responsive drug carrier, and photothermal therapy[J]. Biomaterials, 2015, 53: 117-126.
[10] Karuna A, Masia F, Borri P, et al. Hyperspectral volumetric coherent anti-Stokes Raman scattering microscopy: quantitative volume determination and NaCl as non-resonant standard[J]. Journal of Raman Spectroscopy, 2016, 47(9): 1167-1173.
[11] Lee Y J, Vega S L, Patel P J, et al. Quantitative, label-free characterization of stem cell differentiation at the single-cell level by broadband coherent anti-Stokes Raman scattering microscopy[J]. Tissue Engineering Part C: Methods, 2014, 20(7): 562-569.
[12] Krafft C, Dietzek B, Schmitt M, et al. Raman and coherent anti-Stokes Raman scattering microspectroscopy for biomedical applications[J]. Journal of Biomedical Optics, 2012, 17(4): 040801.
[13] Goodhead R M, Moger J, Galloway T S, et al. Tracing engineered nanomaterials in biological tissues using coherent anti-Stokes Raman scattering (CARS) micro-scopy: a critical review[J]. Nanotoxicology, 2015, 9(7): 928-939.
[14] Slipchenko M N, Cheng Jixin. Nonlinear Raman spectroscopy: coherent anti-Stokes Raman scattering (CARS)[M]// Encyclopedia of Biophysics. Berlin: Springer Berlin Heidelberg.,2013: 1744-1750.
[15] Maker P D, Terhune R W. Study of optical effects due to an induced polarization third order in the electric field strength[J]. Physical Review, 1965, 137(3A): A801-A818.
[16] Duncan M D, Reintjes J, Manuccia T J. Scanning coherent anti-Stokes Raman microscope[J]. Optics Letters, 1982, 7(8): 350-352.
[17] Zumbusch A, Holtom G R, Xie X S. Three-dimensional vibrational imaging by coherent anti-Stokes Raman scattering[J]. Physical Review Letters, 1999, 82(20): 4142-4145.
[18] Cheng Jixin, Volkmer A, Xie X S. Theoretical and experimental characterization of coherent anti-Stokes Raman scattering microscopy[J]. Journal of the Optical Society of America B, 2002, 19(6): 1363-1375.
[19] Cheng Jixin, Jia Y K, Zheng Gengfeng, et al. Laser-scanning coherent anti-Stokes Raman scattering microscopy and applications to cell biology[J]. Biophysical Journal, 2002, 83(1): 502-509.
[20] Hellerer T, Axäng C, Brackmann C, et al. Monitoring of lipid storage in Caenorhabditis elegans using coherent anti-Stokes Raman scattering (CARS) microscopy[J]. Proceedings of the National Academy of Sciences, 2007, 104(37): 14658-14663.
[21] Moura C C, Tare R S, Oreffo R O C, et al. Raman spectroscopy and coherent anti-Stokes Raman scattering imaging: prospective tools for monitoring skeletal cells and skeletal regeneration[J]. Journal of The Royal Society Interface, 2016, 13(118): 20160182.
[22] Ganikhanov F, Evans C L, Saar B G, et al. High-sensitivity vibrational imaging with frequency modulation coherent anti-Stokes Raman scattering (FM CARS) microscopy[J]. Optics Letters, 2006, 31(12): 1872-1874.
[23] Evans C L, Potma E O, Xie X S. Coherent anti-Stokes Raman scattering spectral interferometry: determination of the real and imaginary components of nonlinear susceptibilityχ(3)forvibrationalmicroscopy[J].OpticsLetters, 2004, 29(24): 2923-2925.
[24]BreunigHG,WeinigelM,BückleR,etal.Clinicalcoherentanti-StokesRamanscatteringandmultiphotontomographyofhumanskinwithafemtosecondlaserandphotoniccrystalfiber[J].LaserPhysicsLetters, 2013, 10(2): 025604.
[25]ChemnitzM,BaumgartlM,MeyerT,etal.Widelytuneablefiberopticalparametricamplifierforcoherentanti-StokesRamanscatteringmicroscopy[J].OpticsExpress, 2012, 20(24): 26583-26595.
[26]ZumbuschA,HoltomGR,XieXS.Three-dimensionalvibrationalimagingbycoherentanti-StokesRamanscattering[J].PhysicalReviewLetters, 1999, 82(20): 4142.
[27]NanX,ChengJX,XieXS.Vibrationalimagingoflipiddropletsinlivefibroblastcellswithcoherentanti-StokesRamanscatteringmicroscopy[J].JournalofLipidResearch, 2003, 44(11): 2202-2208.
【中文责编:英 子;英文责编:木 南】
2016-12-21;Accepted:2017-02-11
Associate professor Chen Danni.E-mail: dannyc007@163.com
Three-dimensional spatial resolution calibration of the coherent anti-Stokes Raman scattering microscopy
Liu Wei, Liu Shuanglong, Chen Danni, and Niu Hanben
College of Optoelectronic Engineering, Key Laboratory of Optoelectronic Devices and Systems of Ministry of Education and Guangdong Province, Shenzhen University, Shenzhen 518060, Guangdong Province, P.R.China
The spatial resolution is one of the most important indices for measuring the performance of coherent anti-stokes Raman scattering (CARS) microscopy system. Accordingly, we acquire the three dimensional images of the polystyrene micro-balls with 110 nm diameter in order to reconstruct the point spread function of the system onx-yandx-zplanesbasedonthetwodimensionalarrayconsistingofpositiondataofeachpointandspectraldata.TheresultsshowthatlateralandaxialspatialresolutionsofthehomemadeCARSmicroscopyareabout484nmand3.17μm,respectively.
optical engineering; coherent anti-Stokes Raman scattering microscopy;imaging reconstruction; point spread function;resolution; nonlinear optics; Raman scattering; information optics
:Liu Wei, Liu Shuanglong, Chen Danni, et al.Three-dimensional spatial resolution calibration of the coherent anti-Stokes Raman scattering microscopy[J]. Journal of Shenzhen University Science and Engineering, 2017, 34(3): 272-277.(in Chinese)
国家重大科学仪器设备开发专项资助项目(2012YQ 15009203)
刘 伟(1980—),女,深圳大学博士后研究人员.研究方向:非线性光学.E-mail:liuwei616029@163.com
Q631;O
A
10.3724/SP.J.1249.2017.03272
Foundation:The Special Funds of the Major Scientific Instruments Equipment Development of China (2012YQ15009203)
引 文:刘 伟,刘双龙,陈丹妮,等.CARS显微成像系统的空间分辨率标定[J]. 深圳大学学报理工版,2017,34(3):272-277.

