电针调节血脑屏障通透性的P-糖蛋白调控机制探讨
张异 沈攀攀 宋瑶 林咸明
浙江中医药大学第三临床医学院 杭州 310053
电针调节血脑屏障通透性的P-糖蛋白调控机制探讨
张异 沈攀攀 宋瑶 林咸明
浙江中医药大学第三临床医学院 杭州 310053
[目的]探讨电针对血脑屏障(blood brain barrier,BBB)通过P-糖蛋白(P-glycoporotein,P-gp)路径调控的可能性。[方法]根据BBB结构与功能特点,立足于电针对BBB的促透效应的现有研究报道,通过探讨P-gp相关调控路径及电针对此通路部分相关物质的影响,分析电针通过P-gp路径实现BBB促透效应的可能性。[结果]电针可以调节一氧化氮(nitric oxide,NO)、一氧化氮合酶(nitric oxide synthase,NOS)水平,降低促炎细胞因子肿瘤坏死因子(tumor necrosis factor-α,TNF-α)含量,抑制核转录因子κB(nuclear factor kappa B,NF-kB)水平;提高血管内皮生长因子(vascular endothelial growth factor,VEGF)水平,调节VEGF信使单链核糖核酸(messenger Ribonucleic Acid,mRNA)、质膜结合血管内皮生长因子受体(fetal Liver Kinase 1, flk-1)、磷酸化微囊蛋白1(caveolin-1)。[结论]电针可能通过调节促炎细胞因子肿瘤坏死因子/蛋白激酶Cβ1/1-磷酸鞘氨醇受体1(tumor necrosis factor-α/protein kinase c β1/sphingosine 1-phosphatereceptor,TNF-α/PKCβ1/S1PR1)信号通路和血管内皮生长因子信号通路中的相关分子水平来调控P-gp来影响BBB通透性。
电针;BBB;P-gp;TNF-α/PKCβ1/S1PR1信号通路;血管内皮生长因子信号通路;机制;综述
血脑屏障(blood brain barrier,BBB)是维持中枢神经系统内环境稳定的重要结构。中枢神经重塑和功能修复是目前神经康复领域的研究热点,受BBB的影响,诸如神经生长因子等绝大部分治疗药难以在脑组织内到达有效血药浓度,而失去其应用价值。对BBB结构及其“屏障”功能的影响因素,特别是如何改变其“屏障”通透性,诱导治疗药物在脑内达到有效浓度是研究的关键。针灸特别是“醒脑开窍”针法治疗中风病的有效性已达成共识,针灸在脑血管病后遗症期应用在神经康复领域相比急性期的价值更大。有研究发现,电针在BBB完整状态下具有促BBB一定程度开放的效应[1],其中药物外排系统是研究中的重点。本文通过对P-糖蛋白调控机制以及电针调节BBB相关文献的整理综述,为电针影响BBB的“屏障”效应协助某些神经营养药透过BBB的可能机制提供思路。
1 BBB结构与功能特点
BBB是中枢神经系统和血液的分界面,生理状态下它阻止血液中某些物质进入中枢神经系统,从而维持中枢神经系统内环境的稳定[2],在电镜下观察,其结构由脑毛细血管内皮细胞、周细胞、基膜及星形细胞足突组成[3]。BBB独特的组织结构决定了其屏障作用:①紧密连接:存在于相邻的内皮细胞之间,由跨膜蛋白及胞质蛋白共同组成,具有阻止大分子物质从细胞间隙通过的作用;②BBB内皮细胞胞膜结构特殊:没有孔窗和胞内吞饮小泡,防止大分子物质转运;③各种转运蛋白:位于内皮细胞胞膜,包括转入蛋白和外排蛋白,转入蛋白如葡萄糖载体、氨基酸载体等,外排蛋白如P-gp、多药耐药相关蛋白等;④平滑肌肌动蛋白:位于周细胞内,可以通过收缩功能来调节BBB的通透性[4]。
2 电针具有BBB促透效应
近年来,除了电针对BBB的保护作用之外[5],还具有促大分子物质透过BBB效应,现将相关报道作如下阐述。林咸明[6]等在哑门穴注射“冰片液”并与电针组比较,观察其对伊文思蓝(Even’s Blue,EB)透过BBB的影响,发现不同浓度冰片液穴位注射和电针刺激均可使脑组织EB含量增加,说明冰片液穴位注射及电针刺激是可改变BBB通透性的有效方法,同时,高频电针刺激具醒脑开窍功效的哑门、百会穴,可促进EB透过BBB,而且电针的这种促透作用可能与电针的刺激参数和刺激次数有关,提示电针醒脑开窍针法可使BBB在生理情况下实行一定程度的可逆性开放。林咸明[7]等观察电针“哑门”“百会”诱导外源性神经生长因子(nerve growth factor,NGF)透过BBB的效应,发现高频电针结合神经生长因子治疗脑缺血再灌注大鼠,大鼠学习、记忆能力比单纯使用NGF组提高明显,结果表明,一定频率的电针具有诱导NGF透BBB的作用。喻斌[8]等观察电针配合冰片对小鼠BBB通透性的影响,发现电针和中药冰片均能提高BBB通透性,冰片的促透作用与其对P-gp的抑制以及BBB紧密连接减少有关,而电针的促透作用可能仅与P-gp相关,对BBB紧密连接未见显著改变。喻斌[9]等观察电针处理对不同状态大鼠大脑皮层ATP结合盒式蛋白和基因表达的影响,发现电针开放 BBB的作用可能仅与抑制皮层P-gp的表达有关,编码该蛋白的多药耐药-1a基因显著降低,电针对其它腺苷三磷酸结合盒式蛋白的表达和相关基因转录未见显著影响。
下面就电针调节P-糖蛋白功能的可能机制作进一步探讨。
3 电针调节BBB P-糖蛋白表达与转运功能的相关信号通路分子水平
P-糖蛋白属腺苷三磷酸(adenosine triphosphate, ATP)结合盒式蛋白(ATP-bindingcassettetransporter, ABC),由MDR(multidrug resistance,MDR)基因编码,是BBB的重要组成部分[10]。目前已发现的P-gp成员有MDR1和MDR2[11]。P-gp在BBB脑毛细血管内皮细胞表达丰富,介导多种药物的外排转运[12]。P-gp利用ATP分解的能量,将BBB中的外源性物质外排,造成多药耐药[13]。BBB中P-gp表达由一系列信号通路调控,外来物质引起细胞内外环境稳态的改变,通过生化反应,最终调控P-gp转运活性。
3.1 调控P-糖蛋白相关信号通路 目前,已明确两条信号通路可以迅速降低P-gp的活动,即TNF-α/ PKCβ1/S1PR1信号通路(图1)和血管内皮生长因子信号通路(图2)[14]。
3.1.1 TNF-α/PKCβ1/S1PR1信号通路 该信号通路是由内皮细胞的固有免疫系统激活的一个庞大而复杂的炎症反应。低浓度的细菌内毒素(lipopolysaccharide,LPS)短时间作用于体外培养的大鼠脑毛细血管,诱导Toll样受体4(Toll-like receptors, TLR4)释放TNF-α,以旁分泌方式激活肿瘤坏死因子受体1(tumor necrosis factorreceptor 1,TNFR1)受体;导致细胞释放大内皮素,经内皮素转换酶(endothelinconverting enzyme,ECE)裂解产生内皮素-1(endothelin-1,ET-1),通过B型内皮素受体(B-endothelinreceptor, ETB-R)激活诱导型一氧化氮合酶 (inducible nitric oxide synthase,iNOS),从而激活蛋白激酶C(protein kinase c,PKC),抑制P-gp活性[15-16];在体实验证实PKCβ1为临界PKC亚型,表明PKCβ1在不影响紧密连接功能的情况下抑制P-gp,增加P-gp底物的脑内含量[17]。结合体外培养与体内实验的方法,在PKCβ1下游发现鞘脂信号体,使用 1-磷酸鞘氨醇(sphingosine 1-phosphate,S1P)、1-磷酸鞘氨醇受体1((sphingosine 1-phosphatereceptor,S1PR1)激动剂可以抑制P-gp活性,鞘氨醇激酶和S1PR1拮抗剂可阻断该效应;P-gp的抑制过程非常迅速且是可逆的并会在15~30分钟内消失[18]。大脑毛细血管内皮细胞长时间暴露于TNF-α或ET-1反而会增加P-糖蛋白转运活性和蛋白表达,该现象可能与NF-kB有关[19]。见图1。
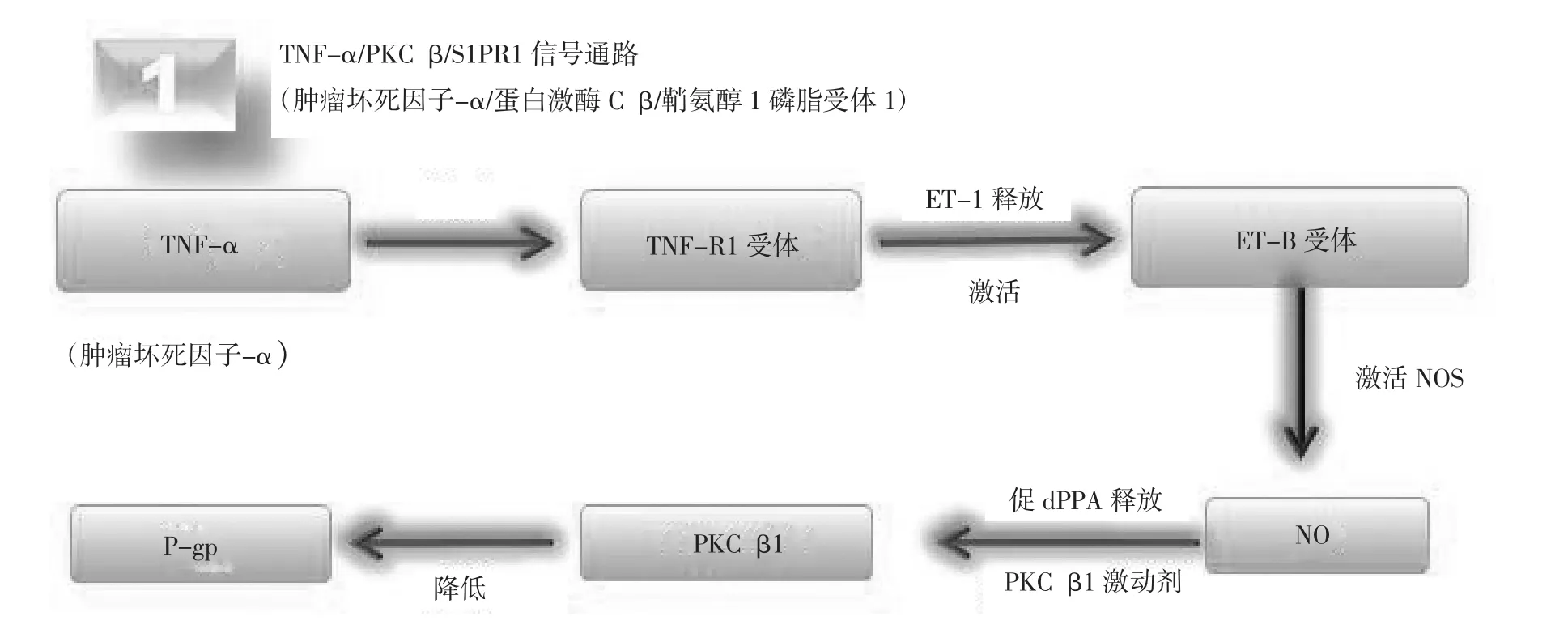
图1 TNF-α/PKCβ1/S1PR1信号通路示意图
3.1.2 血管内皮生长因子信号通路 血管内皮生长因子是一种很强的血管通透因子,具有增加血管内皮细胞钙离子内流、促NO释放、激活蛋白激酶G、增加胞吞转运等作用,其通透性比组胺强5000倍[20]。体外培养的大鼠脑毛细血管内皮细胞暴露于VEGF,可快速可逆地降低P-gp活性,而不改变P-gp表达也不开放紧密连接。相同条件下,多药耐药相关蛋白(multidrug resistance-associated protein,Mrp2)的转运活性也不会受到影响,由此证明VEGF信号通路调控P-gp具有特异性[21]。该作用通过激活flk-1和下游的肉瘤基因(sarcoma gene,Src)激酶,增加了caveolin-1的磷酸化,降低P-gp活性。该作用可通过Src激酶抑制剂PP2来阻断[22]。见图2。
3.2 电针调控P-糖蛋白相关机制
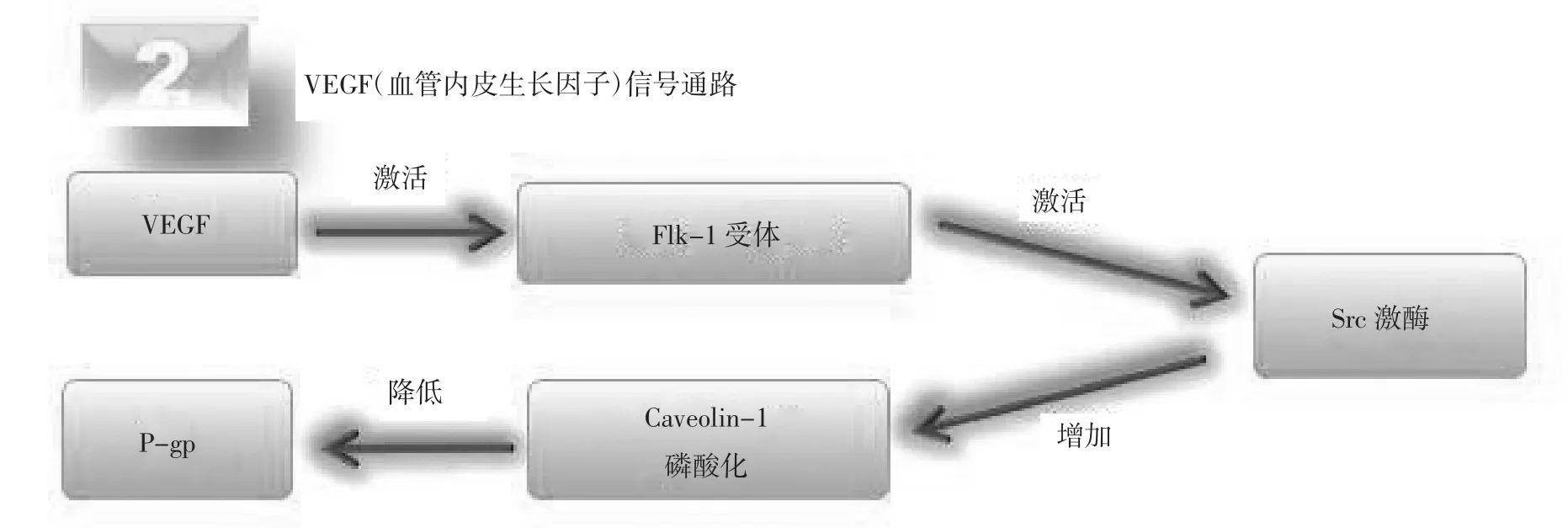
图2 VEGF信号通路示意图
3.2.1 电针对TNF-α/PKCβ1/S1PR1信号通路相关分子的调控 电针可以调控脑组织中NO的水平,增强一氧化氮合酶(nitric oxide synthase,NOS)的活性与表达,降低体内TNF-α含量,抑制NF-kb核转位。姜元辉[23]等发现针刺百会、腰奇穴可以延长癫痫模型大鼠惊厥潜伏期,增加酚噻嗪(phenothiazine,PTZ)致痫大鼠海马区NO含量,提高海马区NOS、超氧化物歧化酶(sodomite,SOD)活性;孔素平[24]等发现电针内关穴能促进急性心肌缺血大鼠血清中NO的释放;胥虹贝[25]发现电针可以上调局灶脑缺血/再灌注大鼠脑缺血皮质区内皮型一氧化氮合酶(endothelial nitric oxide synthase,eNOS)表达;朱艳含[26]等发现电针可以增加局灶性大脑中动脉缺血再灌注(middle cerebral artery occlusion/reperfusion,MCAO/R)大鼠骨髓及外周血中内皮祖细胞数量,促进脑内血管再生,其机制与eNOS激活相关,该作用在eNOS被抑制后减弱;王吉锡[27]等发现针刺阿尔茨海默病(Alzheimer's disease,AD)模型大鼠足三里穴能够升高海马齿状回组织内NOS活力;刘红[28]发现电针能够显著升高MCAO大鼠海马神经细胞NOS mRNA表达;俞坤强[29]发现电针百会、神庭可以下调 MCAO大鼠脑组织白介素 1β(interleukin1β,IL-1β)和TNF-α水平,减少梗死灶面积,提高学习记忆能力;王鲜[30]发现电针可以改善大鼠神经功能缺损症状,减轻缺血周围区皮质神经细胞损伤,降低TNF-α、IL-1β和白介素6(interleukin6,IL-6)的表达;孔立红[31]等发现电针治疗脑缺血大鼠,其缺血侧海马组织CA1区TNF-α水平显著降低;洪银珠[32]等发现电针治疗可对高脂血合并脑缺血损伤大鼠TNF-α的过度表达产生抑制作用;刑东[33]等发现电针预处理能够抑制脑缺血再灌注大鼠NF-kb核转位;乔云英[34]等发现电针能抑制活化的NF-KB在下丘脑的表达,调节NF-KB活性。
3.2.2 电针对血管内皮生长因子信号通路相关分子的调控 电针能够显著提高VEGF浓度,调节VEGF信使单链核糖核酸 (messenger Ribonucleic Acid,mRNA)及Flk-1、磷酸化caveolin-1在脑内的信号表达。尤艳利[35]发现电针水沟穴可以增加脑缺血再灌注大鼠脑组织VEGF表达,促进神经功能恢复,缩小梗死灶面积;林咸明[36]发现不同时程电针预处理可以增加脑缺血损伤区VEGF水平;王储蓄[37]等使用电针督脉组穴干预血管性痴呆大鼠,海马VEGF mRNA表达明显升高,可以调节VEGF及其受体、Flk-1在脑内的信号表达;蔡荣林[38]等发现电针能显著提高血管性认知障碍大鼠学习记忆成绩,上调海马内VEGF、Flk-1 mRNA的表达;毛庆菊[39]等发现电针作用于局灶性脑缺血再灌注大鼠可促进缺血脑区血管内皮细胞VEGF mRNA的表达,调控血管新生;张彤[40]等发现电针预处理可以提高脑缺血再灌注大鼠骨髓和外周血中VEGF的浓度;邹蓉[41]发现电针预处理能够调节脑缺血-再灌注损伤时增加的脑微血管区内皮细胞磷酸化caveolin-1的表达。
4 小结
电针具有改变BBB通透性的作用,且该作用对BBB结构未见明显改变,可能仅仅与药物外排系统,特别是P-糖蛋白有关。笔者对电针P-糖蛋白调控机制相关文献进行探讨,发现电针可能可以通过调节NO、NOS水平,从而激活PKC抑制P-gp活性,降低TNF-α含量,抑制NF-kb核转位,影响TNF-α/ PKCβ1/S1PR1信号通路,进而防止P-gp表达与活性增加,抑制药物外排系统功能;提高VEGF水平,调节VEGF mRNA、Flk-1、磷酸化caveolin-1在脑内的信号表达,影响血管内皮生长因子信号通路,从而快速降低P-gp的活性,改变通透性。今后电针对BBB通透性影响的研究,应在进一步明确其透过效应的基础上,对实现该效应的电针参数、作用时间做针对性研究,同时深入探索相关机制,明确电针改变BBB通透性的作用机理,为更好的指导临床应用提供理论基础。
[1]张珉,张俊钰,钟武.血脑屏障开放方法研究进展[J].国际药学研究杂志,2016,43(1):126-133.
[2]许兵,张俞,杜久林.血脑屏障的研究进展[J].生理学报, 2016,68(3):306-322.
[3]Liebner S,Czupalla C J,Wolburg H.Current concepts of blood-brain barrier development[J].IntJ Dev Biol,2011,55 (4-5):467-476.
[4]Zhao Z,NelsonAR,BetsholtzC,etc.Establishmentand dysfunction of the blood-brain barrier[J].Cell,2015,163(5): 1064-1078.
[5]沈梅红,李忠仁,项晓人,等.电针对脑缺血再灌注大鼠大脑皮层超微结构的影响[J].针刺研究,2009,34(3):167-170.
[6]陈媛媛,周慧,张江松,等.从“通玄府”法与“醒脑开窍”针刺法的相关性探讨中风病的临床证治[J].针刺研究,2015,38 (4):38-40.
[7]林咸明,谭克平,张爱军,等.电针诱导神经生长因子透血脑屏障效应及其机制分析[J].针刺研究,2009,34(2):110-113.
[8]喻斌,吕高红,孙永,等.电针配合冰片对小鼠血脑屏障通透性的影响[J].针刺研究,2011,36(5):335-340.
[9]喻斌,阮鸣,孙永,等.电针对抑郁大鼠大脑皮层ATP结合盒式蛋白表达的影响[J].针刺研究,2013,38(4):286-190.
[10]Zhong Y,Hennig B,and Michal Toborek.Intact lipid rafts regulate HIV-1 Tat protein-induced activation of the Rho signaling and upregulation of P-glycoprotein in brain endothelial cells[J].J Cereb Blood Flow Metab,2010,30(3): 522-533.
[11]Dong XZ,BiMG.Research progress on regulation of P-glycoprotein by reactive oxygen specices[J].Chin Pharmacol Bull,2010,26(10):1386-1390.
[12]Robey RW,Massey PR,Amiri-Kordestani L,et al.ABC Transporters:Unvalidated Therapeutic Targets in Cancer and the CNS[J].Anticancer Agents Med Chem,2010,10 (8):625-633.
[13]Miller DS.Regulation of P-glycoprotein and other ABC drug transporters at theblood-brain barrier[J].Trends PharmacolSci,2010,31:246-254.
[14]Miller DS.Regulation of ABC Transporters Blood–Brain Barrier:The Good,the Bad,and the Ugly[J].Adv Cancer Res,2015,125:43-70.
[15]Miller DS,Cannon RE.Signaling pathways that regulate basal ABC transporter activity at the blood-brain barrier. [J].Curr Pharm Des,2013,20(10):1463-1471.
[16]Miller DS.Regulation of ABC Transporters Blood–BrainBarrier:The Good,the Bad,and the Ugly[J].Adv Cancer Res,2015,125:43-70.
[17]Rigor RR,Hawkins BT,Miller DS.Activation of PKC isoform βI at the blood-brain barrier rapidly decreases P-glycoprotein activity and enhances drug delivery to the brain[J].J Cereb Blood Flow Metab,2010,30(7):1373-1383.
[18]CannonRE,Peart JC,Hawkins BT,et al.Targeting bloodbrain barrier sphingolipid signaling reduces basal P-glycoprotein activity and improves drug delivery to the brain [J].Proc Natl AcadSci U S A,2012,109:15930-15935.
[19]Bauer B,Hartz AM,Miller DS.Tumor Necrosis Factor and Endothelin-1 Increase P-Glycoprotein Expression and Transport Activity at the Blood-Brain Barrier[J].MolPharmacol,2007,71(3):667-675.
[20]谢振伟,臧彦楠,赵立波.调控血脑屏障ABC转运体信号转导通路的研究现状[J].中国临床药理学杂志,2014,30 (11):1057-1059.
[21]Miller DS,Cannon RE.Signaling pathways that regulate basal ABC transporter activity at the blood-brain barrier. [J].Curr Pharm Des,2013,20(10):1463-1471.
[22]Hawkins BT,Sykes DB,Miller DS.Rapid,reversible modulation of blood-brain barrier P-glycoprotein transport activity by vascular endothelial growth factor[J].J Neurosci, 2010,30(4):1417-1425.
[23]姜元辉,石岚,姚远,等.针刺百会、腰奇穴对癫痫大鼠惊厥潜伏期及海马区NO、NOS、SOD影响的实验研究[J].慢性病学杂志,2016,17(3):259-266.
[24]孔素平,谭奇纹,于慧娟,等.电针夹脊穴对急性心肌缺血大鼠血清NO、ET及IL-1β的影响[J].世界中西医结合杂志,2011,6(4):333-334.
[25]胥虹贝,罗勇,朱艳含,等.电针通过eNOS促进局灶脑缺血/再灌注大鼠脑缺血皮质区血管再生[J].中国组织化学与细胞化学杂志,2015,24(5):381-387.
[26]朱艳含,罗勇,胥虹贝,等.电针介导eNOS动员内源性EPCs促MCAO/R大鼠脑内皮血管再生[J].中国实验动物学报, 2015,23(3):291-296.
[27]王吉锡,张宏男,张玉瑶,等.针刺“百会”、“大椎”、“足三里”穴对AD模型大鼠学习记忆能力及脑组织内MAO、NOS表达的影响[J].中医药信息,2012,29(3):94-96.
[28]刘红,宋修涛,卢岩,等.电针对MCAO模型大鼠海马CA1区P-GP表达的影响[J].山东中医药大学学报,2010,34(3): 260-262.
[29]俞坤强,李晓洁,彭洪卫,等.电针百会、神庭穴对MCAO大鼠学习记忆能力及IL-1β、TNF-α表达的影响[J].中国中医急症,2015,24(11):1891-1894.
[30]王鲜,黄佳,柳维林,等.电针对缺血再灌注损伤大鼠缺血周围区皮质小胶质细胞活化的影响[J].中国康复理论与实践, 2015,21(11):1251-1255.
[31]孔立红,刘胜洪,毛娟娟,等.电针对脑缺血大鼠NF-κB及TNF-α表达的影响[J].中国康复医学杂志,2009,24(8):711-714.
[32]洪银珠,任秀君,施昱丞,等.电针干预对高血脂合并脑缺血大鼠血脂四项及TNF-α含量的影响[J].针灸临床杂志, 2007,23(4):51-55.
[33]刑东.针刺预处理通过MMP9调节TJP诱导大鼠脑缺血耐受的研究[D].第四军医大学硕士学位论文,2015:12.
[34]乔云英,吴富东,王健,等.电针对佐剂性关节炎大鼠下丘脑中NF-KB表达的影响[J].中华中医药学刊,2011,29(6): 1260-1262.
[35]尤艳利,徐晓明,舒适,等.电针水沟穴对MCAO模型大鼠缺血半暗带VEGF及arresten表达的影响[J].上海中医药大学学报,2014,28(6):80-84.
[36]林咸明,陈丽萍,姚旭.不同时程电针预处理对脑缺血再灌注大鼠血脑屏障基质金属蛋白酶-9、血管内皮生长因子的影响[J].针刺研究,2015,40(1):40-44.
[37]王储蓄.电针督脉组穴对血管性痴呆大鼠学习记忆与海马VEGF及其受体Flt-1、Flk-1mRNA表达的影响[D].安徽中医药大学硕士学位论文,2015:45.
[38]蔡荣林,程红亮,周婷,等.电针对血管性认知障碍大鼠学习记忆与海马内血管内皮生长因子及其受体1、2 mRNA表达的影响[J].针刺研究,2015,40(1):25-29.
[39]毛庆菊,陈邦国.电针对局灶性脑缺血再灌注大鼠大脑皮层微血管超微结构及血管内皮生长因子表达的影响[J].针刺研究,2012,37(6):476-481.
[40]张彤,林涛,王秀志,等.电针预处理对脑缺血再灌注大鼠骨髓和血浆中EPCs及VEGF的影响[J].中国康复医学杂志,2009,24(5):428-432.
[41]邹蓉.电针预处理对脑缺血再灌注大鼠脑内小窝蛋白-1以及血脑屏障通透性的影响[D].南京中医药大学,2014:33.
Discussion of the Mechanisms of Electroacupuncture Effect on Blood-brain Barrier Permeability through P-glyco Protein
ZHANG Yi,SHENG Panpan,SONG Yao,et al
The Third Clinical Medical College,Zhejiang Chinese Medical University,Hangzhou(310053),China
[Objective]Discuss the possibility of electroacupuncture influencing the permeability of BBB which was suspected by the regulation of P-glycoprotein.[Methods]According to the structure of BBB,the reports about electroacupuncture help permeate BBB through the material related with P-gp, analysing the possibility of electroacupuncture through the P-gp related methods influencing the permeability of BBB.[Results]Electroacupuncture can adjust the content of NO and NOS,reduce TNF-α,suppress NF-kb;In another way,it can increase the content of VEGF,influence VEGF mRNA,Flt-1,Flk-1,pcaveolin-1.[Conclusion]There is a great possibility of electroacupuncture influencing the permeability of BBB through two main signal pathways and regulating P-glycoprotein are TNF-α/PKCβ/S1PR1 signaling and vascular endothelial growth factor signaling.
electroacupuncture;blood-brain barrier;P-glycoprotein;TNF-α/S1PR1/S1PR1 signal pathway;flk-1;mechanism;review
R245.9
:A
:1005-5509(2017)05-0432-05
10.16466/j.issn1005-5509.2017.05.021
2016-09-30)
国家自然科学基金项目(81373758)
Fund project:Chinese National Natural Science Foundation(81373758)
林咸明,E-mail:linxianming66@126.com

