TAP及联合肺癌三项肿瘤标记物检测对肺癌的诊断价值
姚梦醒 赵卉 陆友金
TAP及联合肺癌三项肿瘤标记物检测对肺癌的诊断价值
姚梦醒 赵卉 陆友金
目的 探讨单独检测血清TAP及联合肺癌三项肿瘤标记物检测对肺癌的诊断价值。方法 选取2015年5月-2017年2月于安徽医科大学第二附属医院呼吸内科住院的229例经组织病理学或细胞学确诊为肺癌的患者为肺癌组,选取同期在我科住院的肺部良性疾病患者125例为对照组,分别检测两组患者血清TAP、肺癌三项水平,比较TAP在两组人群中的变化,并通过比较TAP、肺癌三项及联合检测对肺癌诊断的灵敏度、特异度、阳性预计值、阴性预计值,来判断TAP单独及联合检测肺癌三项肿瘤标志物的价值。结果 (1) 肺癌组患者血清TAP阳性率明显高于对照组,差异有统计学意义(P<0.05);(2) 小细胞肺癌组患者血清TAP凝集颗粒面积与鳞癌组、腺癌组比较明显增大,(P<0.05),但在鳞癌组与腺癌组之间比较无明显差异(P>0.05);(3) TAP、肺癌三项单独检测对肺癌诊断灵敏度无明显差异(P>0.05);(4) 联合TAP、肺癌三项检测可提高肺癌诊断灵敏度(P<0.05)。结论 肺癌患者血清TAP检测明显呈阳性,与肺癌三项联合检测可提高肺癌诊断的灵敏度。
TAP;CEA;NSE;Cyfra21-1;肺癌
肺癌是临床上常见的恶性肿瘤,新发肺癌例数及死亡例数增长迅速,调查结果显示,肺癌已成为最常见的新发癌症类型和首位癌症死亡原因[1-2]。肺癌患者生存时间短,预后差,美国国家综合癌症网络指南中提到,对于肺癌高危人群及拟诊肺癌的患者进行筛查可降低死亡率[3]。血清肿瘤标志物检测对肿瘤具有重要辅助诊断及筛查价值,癌胚抗原(carcinoembryonic antigen,CEA)、非小细胞肺癌相关抗原(cytokeratin 19 fragment 21-1,Cyfra21-1)及神经元特异性烯醇化酶(neuron-specific enolase,NSE)被合称为肺癌三项,是目前临床中常用肺癌诊断肿瘤标志物。肿瘤异常蛋白(tumor abnormal protein,TAP),又称异常糖链糖蛋白,是肿瘤细胞在新陈代谢过程中分泌的一种糖蛋白和钙-组蛋白复合物,TAP在外周血的变化可发生在肿瘤的早期阶段,可被用于恶性肿瘤的早期筛查或临床治疗后效果评估[4]。目前,TAP检测尚未被常规应用于肺癌筛查,本研究旨在观察单独检测血清TAP及联合检测肺癌三项CEA、NSE、Cyfra21-1对肺癌诊断的意义。
资料与方法
一、研究对象
随机选取2015年5月-2017年2月于安徽医科大学第二附属医院呼吸内科住院的229例经病理组织学或细胞学确诊为肺癌的患者为研究对象。男性181例,女性48例,年龄29-94岁,平均(63.17±10.8)岁,依据2015年世界卫生组织(WHO)肺癌组织学分类标准:鳞癌47例,腺癌86例,小细胞肺癌40例,未分型56例。随机选取同期住院肺部良性疾病患者125例为对照组,男性83例,女性42例,年龄18-88岁,平均(63.1±15.0)岁,其中:AECOPD 35例,肺炎32例,肺结核20例,肺脓肿4例,支气管扩张5例,慢性支气管炎6例,间质性肺炎3例,其他20例,对照组需排除合并其他部位恶性肿瘤。两组研究对象在性别、年龄构成比上差异无统计学意义(P>0.05)。
二、试剂与仪器
TAP检测采用浙江瑞生医疗科技有限公司提供的TAP检测试剂盒(凝集法)及瑞生TAP检测图文系统标准版。肺癌三项检测所用仪器Cobas6000和试剂盒由罗氏诊断产品有限公司提供。
三、方法
所有研究对象均采集晨空腹静脉抗凝血3mL,分别进行TAP、肺癌三项检测。TAP检测采用凝集法[5],具体过程:取25uL静脉抗凝全血,在载玻片上推至厚薄均匀的血片2张,干燥后移置操作水平净化台内(温度18-25℃;相对湿度45-60%)约10-15分钟。将凝聚助剂充分摇匀滴加3滴(每滴约50uL,液滴斑点直径10-15mm)。约2小时待血片上凝聚助剂自然干燥后,在滴过试剂的地方可形成圆形“斑点”标本。将标本置于图像分析仪之专用显微镜下,用绿色滤光镜以10×物镜寻找TAP凝聚颗粒,用40×物镜鉴定。TAP凝聚物为不规则类圆形晶体颗粒,颗粒呈淡绿色、淡黄色或棕色,四周因混合物较多而呈棕黑色或墨绿色,检出为阳性,无上述颗粒检出为阴性。将有可疑图像的斑点转用40×物镜观察,在瑞生 TAP 检测图文系统中采集>80μm2以上的特异凝集物为有效凝集颗粒,若有效凝集颗粒只有1颗,则结果为该颗粒实际面积大小;若有效凝集颗粒为2颗或以上,则所有颗粒面积总和×0.62所得数值为检测特异凝集物的最终数值。肺癌三项检测应用电化学发光法测定患者血清中CEA、NSE、Cyfra21-1数值。
四、结果判读[6]
TAP结果:无明显凝集物:1-121μm2,提示TAP正常;凝集物较小:121-225μm2,凝集物较大:≥225μm2,均提示TAP异常为阳性。肺癌三项结果:CEA正常参考值:0-3.4ng/mL,NSE正常参考值:1-15.2ng/mL,Cyfra21-1正常参考值:0-3.3ng/mL,肺癌三项检测以其中任何一项指标高于临界值者判定为阳性。TAP异常和/或肺癌三项阳性即为联合检测异常。
五、数据分析
采用SPSS17.0软件进行统计分析,计量资料采用U检验和SNK方差分析,计数资料采用χ2检验,P<0.05表示存在统计学上的差异。
结 果
一、两组血清TAP凝集颗粒面积比较
肺癌组血清TAP凝集颗粒面积明显大于对照组,差异有统计学意义(u检验,U=-8.670,P<0.001)。在不同病理类型肺癌患者中血清TAP凝集颗粒面积存在统计学差异(SNK方差分析,F=6.896),TAP在小细胞肺癌组明显大于鳞癌组、腺癌组(P=0.001),但在鳞癌组与腺癌组之间差异无统计学意义,P=0.997,(见表1)。
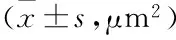
表1 两组血清TAP检测结果
与对照组比较:*P<0.001;与鳞癌组比较:#P>0.05;与鳞癌组、腺癌组比较:△P=0.001
二、两组血清TAP检测阳性结果比较
229例肺癌组中192例TAP异常,37例TAP正常,其中鳞癌组47例,39例TAP异常,腺癌组86例,73例TAP异常,小细胞肺癌组40例,35例TAP异常;血清TAP异常对肺癌诊断的阳性率为83.8%,在不同病理类型肺癌中,血清TAP异常对鳞癌、腺癌、小细胞肺癌诊断的阳性率分别为83.0%、84.9%,87.5%,差异无统计学意义(χ2检验,P=0.841),对照组125例中有50例TAP异常,阳性率为40%,与肺癌各组比较有统计学差异,P<0.05,(见表2)。
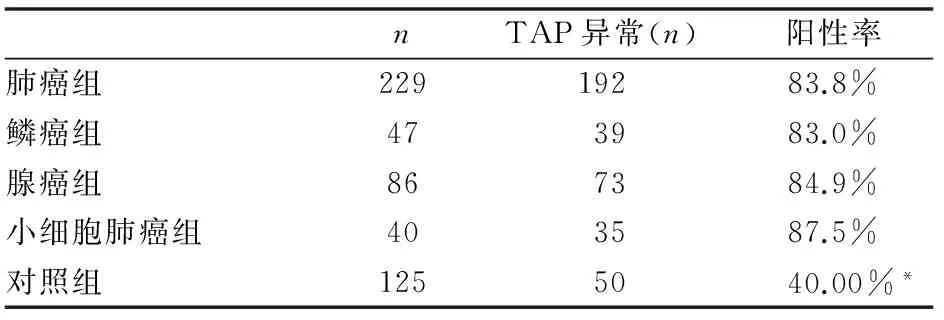
表2 血清TAP检测在两组及不同类型肺癌组结果比较
与总肺癌组及不同类型肺癌组比较:*P<0.05
三、单独血清TAP、肺癌三项检测及联合检测对肺癌诊断的灵敏度、特异度、阳性预计值、阴性预计值及准确度
229例肺癌组中192例TAP异常,190例肺癌三项阳性,216例联合检测异常,分别计算TAP、肺癌三项及联合检测对肺癌诊断的灵敏度、特异度、阳性预计值、阴性预计值、准确度,结果(见表3)。单独TAP、肺癌三项检测对肺癌诊断的灵敏度分别为83.8%、83.0%,差异无统计学意义(配对χ2检验,P=0.900),(见表4);联合检测对肺癌诊断的灵敏度为94.3%,与单独TAP、肺癌三项检测比较存在统计学差异(配对c2检验,P<0.001),(见表5)。

表3 血清TAP、肺癌三项及联合检测对肺癌的灵敏度、特异度、阳性预计值、阴性预计值及准确度
灵敏度=真阳性/(真阳性+假阴性);特异度=真阴性/(真阴性+假阳性);阳性预测值=真阳性/(真阳性+假阳性);阴性预测值=真阴性/(真阴性+假阴性);准确度=(真阳性+真阴性)/总例数

表4 单独TAP与肺癌三项检测对肺癌诊断灵敏度的比较

表5 联合检测与单独TAP、肺癌三项检测对肺癌诊断灵敏度的比较
讨 论
肿瘤标志物是肿瘤细胞在生长、增殖过程中分泌产生并释放至细胞组织中的生物活性物质,可表现为抗原、代谢产物及激素等多种形式,属于肿瘤特有物质,可准确反映肿瘤的存在、性质,并对肿瘤的早期诊断、疗效评估及预后判断提供指导,因其检测方便,现已逐渐在临床普及[7]。
研究表明,细胞致癌性转化可导致细胞表面糖基化紊乱,糖基化异常又是诱导肿瘤侵袭和转移的关键事件,两者互相促进[8]。TAP是细胞中癌基因和抑癌基因突变后产生的异常糖蛋白、钙组蛋白和基因表达的普通物质的复合体,已被发现在各种上皮性恶性肿瘤中(如乳腺癌,结肠癌,卵巢癌,子宫内膜癌,胃癌和肺癌)[9]。TAP的出现间接表示细胞癌变的数量和程度,随着肿瘤细胞的增殖,血液中的TAP含量增加是早期发现癌症的重要线索。TAP检测技术是在同一反应体系中将AFP、CA、CEA系列糖类抗原等几十种异常糖链糖蛋白高度聚集,放大了肿瘤信号,可以检测到更多的肿瘤标志物,包括一些已标记但不能单独检测的肿瘤标志物,其对肿瘤检测更敏感,可以有效地减少漏诊率[10-11]。
肺癌诊断标志物种类较多,单一肿瘤标志物检测对肺癌诊断的灵敏度与特异度不高,肺癌三项检测是目前常用的联合标志物,并被广泛应用,较单一肿瘤标志物检测的灵敏度提高,继续寻找新的肺癌相关肿瘤标志物,并进行联合检测对提高肺癌诊断率有重要意义[12]。TAP检测在肺癌诊断中的应用及研究仍较少,本研究检测肺癌患者血清TAP的水平,以肺部良性疾病患者为对照组,同时与肺癌三项检测结果比较,进一步探讨TAP的临床应用价值。
本研究结果显示肺癌组患者血清TAP水平相对于肺部良性病变对照组明显升高,差异具有统计学意义,在肺癌组不同病理类型中检测发现TAP水平在鳞癌组、腺癌组中无明显差异,在小细胞肺癌组明显升高,提示小细胞肺癌患者体内恶性细胞数量更多、疾病恶性程度更高,符合小细胞肺癌的临床特点。
肺癌组中有37例TAP检测结果为正常,其原因可能为:① 患者通过外科手术或放化疗等治疗手段,肿瘤细胞的生长受到抑制,导致体内TAP分泌减少;② 终末期肺癌患者体内蛋白水平相对较低,致使TAP的分泌低于检出量;③ 肺癌患者在检测期间体内的癌细胞处于相对静止期,肿瘤细胞增殖不够活跃,导致TAP分泌低[10]。
125例对照组中50例TAP检测异常,提示这50例对照组患者体内存在异常糖链糖蛋白。糖蛋白是蛋白质和糖链的共价复合物,当糖链结构或糖基转移酶活性出现变化时,即可形成异常糖链糖蛋白,导致TAP检测异常。正常细胞恶变、免疫功能低下、风湿性关节炎、糖尿病(糖化血红蛋白升高)、自身免疫性疾病、骨折未愈、怀孕、胃炎/肝炎/结核活动期、良性肿瘤等因素均可能导致TAP水平异常[6]。本研究对照组已排除恶性肿瘤患者,但对照组部分患者存在免疫异常、糖代谢紊乱、结核活动等因素可能导致异常糖链糖蛋白的表达,亦或与患者可能处在癌前病变、癌变早期的细胞异常增生状态相关,目前检测手段尚无法发现,需要临床密切随访排查恶性肿瘤。进一步分析发现,对照组中AECOPD患者TAP阳性率较高,可能与慢阻肺患者自身免疫功能低下有关,另外GOLD指南[13]中肺癌被列为慢阻肺的常见合并疾病,肺癌是轻度慢阻肺患者最常见的死亡原因,提示两种疾病存在关联,那么检测慢阻肺患者体内TAP的变化可能为易合并肺癌患者的早期诊断提供更大的价值。
本研究显示TAP及肺癌三项检测对肺癌组患者诊断的灵敏度、特异度、阳性预计值、阴性预计值、准确度均相近,比较灵敏度无明显差异,提示两种肿瘤标志物检测对肺癌诊断阳性率无明显差异。联合TAP、肺癌三项检测后对肺癌诊断的灵敏度、阴性预计值提高,准确度近似;联合检测后灵敏度提高至94.3%,与单独检测TAP、肺癌三项比较,均存在统计学差异;灵敏度升高表明通过联合检测这两组肿瘤标记物可诊断更多的肺癌患者,阴性预测值升高表明联合检测阴性的患者肺癌诊断可能性小,因此联合检测更具临床应用价值。联合检测后诊断特异度降低,考虑与联合检测后假阳性患者人数增加有关,另外考虑与本实验对照组选取对象有关,因TAP、肺癌三项的正常参考范围均为正常人群检测结果,而本研究对照组均患有肺部相关疾病,多数为感染性疾病患者,可能与正常人群检测结果存在差异,导致联合检测后出现特异度下降。
综上所述, TAP是一种新型的肿瘤标记物,在肺癌患者血清中有一定的表达, TAP和肺癌三项联合检测可提高肺癌诊断的灵敏度,因此,TAP在肺癌辅助诊断中可作为肿瘤标记物的有益补充。
[1] Chen W,Zheng R,Baade PD,et al.Cancer statistics in China,2015[J].CA Cancer J Clin,2016,66(2):115-116.
[2] Didkowska J,Wojciechowska U,MańczukM,et al.Lung cancer epidemiology:contemporary and future challenges worldwide[J].Ann Transl Med,2016,4(8):150-150.
[3] Wood DE.National Comprehensive Cancer Network(NCCN) Clinical Practice Guidelines for Lung Cancer Screening[J].Thorac Surg Clin,2015,25(2):185-197.
[4] Lan F,Zhu M,Qi Q,et al.Prognostic value of serum tumor abnormal protein in gastric cancer patients[J].Mol Clin Onco,2016,5(1):216-220.
[5] Hakomori S.Tumor malignancy defined by aberrant glycosylation and sphingo(glyco)lipid metabolism[J].Cancer Res,1996,56(23):5309-5318.
[6] Senitiroh Hakomori.Glycosylation defining cancer malignancy: New wine in an old bottle[J].Proc Natl Acad Sci USA,2002,99(16):10718-10723.
[7] Yang Z,Chevolot Y,Géhin T.Improvement of protein immobilization for the elaboration of tumor-associated antigen microarrays: application to the sensitive and specific detection of tumor markers from breast cancer sera[J].Biosens Bioelectron,2013,40(1):385-392.
[8] Thakkar V, Patel P, Prajapati N,et al.Serum Levels of Glycoproteins are Elevated in Patients with Ovarian Cancer[J].Indian J Clin Biochem,2014,29(3):345-350.
[9] Liu J,Huang XE.Clinical Application of Serum Tumor Abnormal Protein from Patients with Gastric Cancer[J].Asian Pac J Cancer Prev,2015,16(9):4041-4044.
[10] Zhang LQ,Guo XX,Yongzheng Min,et al.Tumor abnormal protein (TAP) examination contributes to primary diagnosis of bladder cancer[J].Int J Clin Exp Med 2015,8(10):18528-18532.
[11] Wu XY,Huang XE.Clinical application of serum tumor abnormal protein (TAP) in colorectal cancer patients[J].Asian Pac J Cancer Prev,2015,16(8):3425-3428.
[12] 倪军,郭子健,张力. 单独与联合检测四项肺癌血清肿瘤标志物在肺癌诊断中的价值[J].中华内科杂志,2016,55(1):25-30.
[13] Vestbo J, Hurd SS, Rodriguez-Roisin R, et al. An overview of Global Strategy for the Diagnosis, Management and Prevention of Chronic Obstructive Pulmonary Disease (GOLD) (revised 2011)[J]. Zhonghua Yi Xue Za Zhi, 2012, 92(14): 937-938.
Diagnostic significance of separate and joint detection of TAP and three tumor biomarkers in lung cancer
YAOMeng-xing,ZHAOHui,LUYou-jin
DepartmentofRespiratoryMedicine,theSecondAffiliatedHospitalofAnhuiMedicalUniversity,Hefei,Anhui230601,China
Objective To investigate the clinical value of separate and joint detection of TAP and three tumor biomarkers (CEA, NSE, Cyfra21-1) in the diagnosis of lung cancer patients. Methods 229 cases of lung cancer confirmed by pathology were enrolled in the second affiliated hospital of Anhui Medical University from June 2015 to February 2017, which were considered as the lung cancer group, and 125 cases of benign pulmonary diseases were enrolled into the control group. The serum levels of tumor markers (TAP,CEA,NSE and Cyfra21-1) were detected and compared in the two groups. The sensitivity, specificity, positive predictive value (PPV), and negative predictive value (NPV) of single TAP and combination of CEA, NSE and Cyfra21-1 tumor biomarkers were analyzed in the diagnosis of lung cancer. Results The levels of TAP in lung cancer group were significantly higher than those in the control group (P<0.05). The particle agglutination area of TAP in the small cell lung cancer group were significantly larger than that in the squamous cell carcinoma and adenocarcinoma group (P<0.05), but there was no significant difference between the squamous cell carcinoma and adenocarcinoma group (P>0.05). The separate detect of TAP or CEA, NSE, Cyfra21-1 had no significant difference between the two groups (P>0.05). The combined detection of TAP and lung cancer three tumor biomarkers could improve the sensitivity of lung cancer diagnosis (P<0.05). Conclusion The serum TAP of lung cancer patients is obviously positive. The joint detection of TAP and CEA, NSE and Cyfra21-1 can improve the diagnostic rate of lung cancer.
TAP; CEA; NSE; Cyfra21-1; lung cancer
10.3969/j.issn.1009-6663.2017.06.005
230601 安徽 合肥,安徽医科大第二附属医院呼吸内科
2017-03-07]

