笼状纳米CaO基吸附剂碳酸化反应动力学研究
平浩梁,刘 昊,吴素芳
浙江大学化学工程与生物工程学院,浙江 杭州 310027
碳捕集封存(CCS)是控制温室气体排放的一个重要手段。利用CaO基吸附剂碳酸化反应来进行CO2的高温捕集技术被广泛应用于烟道气脱碳和反应吸附强化的甲烷蒸汽重整制氢(ReSER)制氢等工艺中[1-4]。由于应用在快速流化床反应器中吸附剂的停留时间较短[5-7],要求CaO吸附剂拥有较快的碳酸化速率。
已有的研究表明,CaO基吸附剂的碳酸化反应过程分为两个阶段,分别为由表面反应控制的快速反应段和由CO2在孔隙或固体产物层内扩散控制的慢速反应段[8,9]。针对微米CaO基吸附剂的碳酸化反应过程已经提出了许多动力学模型,如晶粒模型[10],收缩核模型[11],随机孔模型[12]等。但微米级CaO基吸附剂的吸附性能与纳米级的CaO基吸附剂吸附曲线有很大差异,纳米CaO在快速段几分钟内有高的碳酸化反应速率[13],并且在快速段内的吸附容量贡献度占整个吸附容量的 80%~90%左右。因此,微米CaO基吸附剂的动力学模型不再适用于描述纳米级CaO的碳酸化反应过程[14-16]。需要研究纳米CaO在快速段几分钟时间内的反应动力学方程,才能满足流化床体系内对反应动力学方程的要求[17-19]。Wu等[20]根据离子反应机理,提出了适用于商用纳米氧化钙的快、慢反应段判别方法,并得出了纳米氧化钙快速反应段的动力学方程。作者近期制备了一种笼状纳米CaO基二氧化碳吸附剂[21,22],中空的结构和笼状的形貌使得其具有更高的快速段碳酸化反应速率和更大的吸附容量[21],特别是添加了锆改性的笼状结构纳米CaO基二氧化碳吸附剂[22],增加了吸附-再生循环使用的稳定性。同时还发现,笼状结构吸附剂的吸附曲线与Wu等[20]提出的吸附曲线不同,Wu等提出的碳酸化反应快、慢段判别方法不能适用于描述笼状纳米钙基吸附剂,该判据需要进行调整。
本工作在前期对笼状吸附剂研究的基础上,对比研究了笼状吸附剂与商用纳米 CaO在快速反应段的反应特性,提出了一个更适合笼状结构吸附剂的新判据,用来区分其碳酸化快、慢反应段。基于此判别方法,建立了笼状纳米CaO基吸附剂在快速反应段的碳酸化动力学模型。
1 实验部分
1.1 笼状纳米CaO基吸附剂的制备及表征
笼状纳米CaO基吸附剂的制备方法参见文献[22]。吸附剂的形貌表征采用场发射扫描电子显微镜(SEM, SU8010, Hitachi, Japan)。测试时取少量样品均匀分散在粘有导电胶的台上,喷金3 min后放置于仪器真空室中3.0 kV下进行观测。
1.2 吸附剂的碳酸化反应
吸附剂反应吸附CO2的性能在热重分析仪(美国Pyris1型)上进行。根据热重实验的特点,反应坩埚每次填料量约为2 mg。通入22 mL/min的N2以保证系统在N2气氛下,以20 K/min的升温速率将样品升温至1 073 K,保持10 min,然后将温度降至碳酸化反应温度(813~933 K)。碳酸化反应过程中CO2分压(PCO2)控制在0.01~0.02 MPa,使体系内CO2浓度保持为10%~30%,实时记录样品在循环吸附过程中的质量变化。反应温度与CO2分压的选择参考工业需求及先前的研究结果[2-4]。
2 结果与讨论
2.1 区分CO2吸附反应快、慢速段的新判据
典型笼状纳米氧化钙吸附剂(CN-CaO)碳酸化反应结果如图1所示。可以看出,反应初期CN-CaO的反应速率很快,碳酸化转化率(X)迅速提升,而到了1 min左右时反应速率急剧降低,直至趋近于0,碳酸化转化率也稳定在85%左右不再升高。由图1可知,CN-CaO在最大反应速率时的碳酸化转化率已接近50%,后续难以达到其转化率的二倍,因此Wu等[20]提出的区分碳酸化反应快、慢反应段的判据难以适用于笼状纳米氧化钙吸附剂,需要提出适合CN-CaO这类碳酸化反应“效率高”的吸附剂的新快慢段划分判据。将CN-CaO碳酸化反应速率曲线对时间求导(drcarb/dt)可发现(见图1),在碳酸化反应的初期,drcarb/dt值先随时间逐渐上升,到达峰值后下降至负值,最后再逐渐上升至0,并长时间维持在0值,即当反应进行到某个时间点以后,碳酸化反应速率恒定不变,该点被定义为临界点(drcarb/dt=0),用于区分 CN-CaO碳酸化反应的快速反应段和慢速反应段。临界点所对应的氧化钙转化率为临界转化率Xc,当X小于Xc时反应为快速吸附段,当X大于Xc时反应进入慢速吸附段。
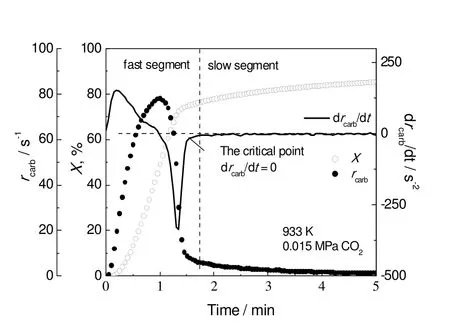
图1 CN-CaO碳酸化反应的快、慢反应段新判别方法Fig.1 A new criterion for the fast and slow reaction segment division of the cage-like nano-CaO based sorbents
2.2 快反应段CO2吸附性能
图2为笼状纳米氧化钙吸附剂(a)和商业纳米氧化钙吸附剂(b)的扫描电镜结果。可以看出,CN-CaO具有发达的纳米级孔隙和中空结构,这有利于CO2在吸附剂内的扩散,从而提高了碳酸化反应速率。

图2 吸附剂的扫描电镜结果Fig.2 SEM images of sorbents
为了更直观地体现笼状结构的优势,在上述新判据的基础上对比了不同温度下 CN-CaO和N-CaO快速段CO2碳酸化反应速率的大小,结果见图3。可以看出在PCO2为 0.015 MPa,T为813~933 K的条件下,CN-CaO快速段内的反应速率rcarb均高于N-CaO,而且CN-CaO的最大反应速率rmax比N-CaO高出44%。两者详细的吸附性能参数列于表1,可以看出CN-CaO的临界转化率Xc均高于N-CaO。另外,CN-CaO快速反应段对总碳酸化转化率(Xtot)的贡献度Xc/Xtot更高,并且其快速段的持续时间更短。

图3 CN-CaO和N-CaO的快速段碳酸化反应速率对比Fig.3 Comparison of the carbonation rates of CN-CaO based sorbents and commercial N-CaO sorbents during the fast sorption segment

表1 两种吸附剂CO2吸附性能的对比Table 1 Comparison of the CO2 sorption behavior between two sorbents
2.3 笼状纳米CaO基吸附剂快速反应段动力学模型
不同反应条件下,笼状纳米CaO基吸附剂的碳酸化反应结果如图4所示。从图4可以看出,随着反应温度的提高,吸附剂能达到的最高转化率显著提升,而体系内CO2的浓度则对快速段的持续时长有着较大的影响,CO2分压的升高可以使快速段提前结束。笼状吸附剂的碳酸化曲线趋势都类似,且在反应初期均表现出“S”型的特性。采用简化的Boltzmann方程(式1)对其快速反应段动力学方程进行拟合。

其中,X为氧化钙碳酸化转化率;t为反应时间;a,b和c为未知参数,需通过实验值拟合得到。

图4 不同CO2分压下CN-CaO和N-CaO碳酸化反应转化率曲线Fig.4 Conversion curve of cage-like nano-CaO based adsorbents and commercial nano-CaO sorbents under different CO2 partial pressure
根据前面提出的碳酸化反应快、慢段判别标准,将图4中的实验数据进行判定快速反应段,并用式(1)对其拟合,结果如图5所示。

图5 不同CO2浓度下快速反应段数据拟合Fig.5 Data fitting of fast sorption segment under different CO2 concentration
从图5可以看出,反应温度和CO2浓度对碳酸化转化率X影响明显。参数a主要受反应温度的影响,可以通过Arrhenius方程进行关联,作图如图6所示。参数b和c主要受CO2浓度的影响。通过拟合得到了不同碳酸化反应条件下的参数a,b和c。笼状纳米氧化钙基吸附剂碳酸化反应快速段的动力学方程如下所示:

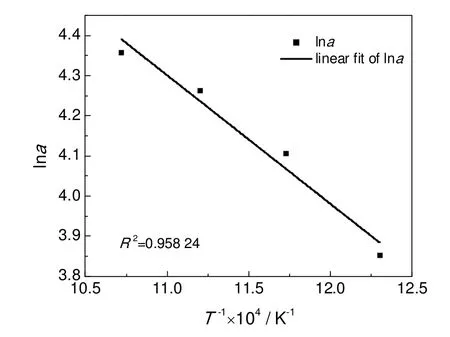
图6 lna 和T -1的关系Fig.6 The fitting diagram of the relationship between lna and T -1
其中:

2.4 动力学模型检验
所得动力学计算的CaO转化率与实验得到的转化率的比较如图7所示。结果表明,两者的平均相对误差小于 5.78%,说明此模型能较好地描述笼状纳米氧化钙碳酸化反应快速段的反应动力学情况。

图7 动力学模型计算值与实验值的比较Fig.7 Comparison between calculated and experimental data of kinetic models
3 结 论
通过研究笼状纳米氧化钙吸附剂在 813~933K、以及10%~30%CO2气氛(0.01~0.02 MPa CO2分压)条件下的碳酸化反应,提出了适用于该吸附剂区分其碳酸化反应快、慢段的新判据,并与商用纳米氧化钙在快速段的反应特性作对比,得到以下结论:
a)笼状吸附剂碳酸化反应的快、慢段可以根据临界点来判别,当反应处于临界点时,drcarb/dt为0且在此之后维持不变;当转化率小于临界点转化率时反应为快速反应段,其后反应进入慢速反应段。
b)结合氧化钙碳酸化反应转化率曲线与函数特点,采用 Boltzmann方程拟合得到笼状吸附剂在快速反应段的动力学方程,模型计算结果与实验值比较的平均相对误差小于5.78%。得到的反应活化能为26.66 kJ/mol,较商用纳米氧化钙低3.54 kJ/mol[20]。
c)笼状纳米氧化钙的临界转化率Xc较商用纳米氧化钙高,同时笼状吸附剂在快速反应段的氧化钙转化率占总转化率的比例(Xc/Xtot)较商用纳米氧化钙高,且笼状纳米钙基吸附剂的最大反应速率是商用纳米氧化钙的1.44倍。
[1]Martínez I, Grasa G, Parkkinen J, et al.Review and research needs of Ca-looping systems modelling for post-combustion CO2capture applications [J].Int J Greenh Gas Control, 2016, 50:271-304.
[2]Barelli L, Bidini G, Gallorini F, et al.Hydrogen production through sorption-enhanced steam methane reforming and membrane technology: A review [J].Energy, 2008, 33:554-570.
[3]Harrison D P.Sorption-enhanced hydrogen production: A review [J].Ind Eng Chem Res, 2008, 47:6486-6501.
[4]Udomsirichakorn J, Salam P A.Review of hydrogen-enriched gas production from steam gasification of biomass: The prospect of CaO-based chemical looping gasification, Renew [J].Sust Energ Rev, 2014, 30:565-579.
[5]Lindborg H, Jakobsen H A.Sorption enhanced steam methane reforming process performance and bubbling fluidized bed reactor design analysis by use of a two-fluid model [J].Ind Eng Chem Res, 2009, 48:1332-1342.
[6]Ortiz C, Chacartegui R, Valverde J M, et al.A new integration model of the calcium looping technology into coal fired power plants for CO2capture [J].Appl Energy, 2016, 169:408-420.
[7]Wu R, Wu S F.The ReSER-COG process for hydrogen production on a Ni-CaO/Al2O3complex catalyst [J].Int J Hydrogen Energy,2013, 38:11818-11825.
[8]Dennis J S, Pacciani R.The rate and extent of uptake of CO2by a synthetic, CaO-containing sorbent [J].Chem Eng Sci, 2009,64:2147-2157.
[9]Liu W, Dennis J S, Sultan D S, et al.An investigation of the kinetics of CO2uptake by a synthetic calcium based sorbent [J].Chem Eng Sci, 2012, 69:644-658.
[10]Sun P, Grace J R, Lim C J, Anthony E J.Determination of intrinsic rate constants of the CaO-CO2reaction [J].Chem Eng Sci, 2008,63:47-56.
[11]Blamey J, Zhao M, Manovic V, et al.A shrinking core model for steam hydration of CaO-based sorbents cycled for CO2capture [J].Chem Eng J, 2016, 291:298-305.
[12]Moshiri H, Nasernejad B, Ebrahim H A, et al.A comprehensive kinetic study of the reaction of SO2with CaO by the random pore model[J].Chem Eng Technol, 2014, 37:2037-2046.
[13]Luo C, Shen Q, Ding N, et al.Morphological changes of pure micro- and nano-sized CaCO3during a calcium looping cycle for CO2capture [J].Chem Eng Technol, 2012, 35:547-554.
[14]Liu W, An H, Qin C, et al.Performance enhancement of calcium oxide sorbents for cyclic CO2capture - A review [J].Energy Fuels,2012, 26:2751-2767.
[15]Kierzkowska A M, Pacciani R, Müller C R.CaO-based CO2sorbents: From fundamentals to the development of new, highly effective materials [J].Chem Sus Chem, 2013, 6:1130-1148.
[16]Wang J, Huang L, Yang R, Zhang Z, et al.Recent advances in solid sorbents for CO2capture and new development trends [J].Energy Environ Sci, 2014, 7:3478-3518.
[17]Carlo A D, Bocci E, Zuccari F, et al.Numerical investigation of sorption enhanced steam methane reforming process using computational fluid dynamics Eulerian-Eulerian code [J].Ind Eng Chem Res, 2010, 49:1561-1576.
[18]Wang Y, Chao Z, Chen D, et al.SE-SMR process performance in CFB reactors: Simulation of the CO2adsorption/desorption processes with CaO based sorbents [J].Int J Greenhouse Gas Control, 2011, 5:489-497.
[19]Wang Y, Chao Z, Jakobsen H A.Numerical study of hydrogen production by the sorption-enhanced steam methane reforming process with online CO2capture as operated in fluidized bed reactors [J].Clean Technol Environ Policy, 2011, 13:559-565.
[20]Wu S F, Lan P Q.A kinetic model of nano-CaO reactions with CO2in a sorption complex catalyst [J].AIChE J, 2012, 58:1570-1577.
[21]Ping H L, Wu S F.Preparation of cage-like nano-CaCO3hollow spheres for enhanced CO2sorption [J].RSC Adv, 2015, 5:65052-65057.
[22]Ping H L, Wu S F.CO2sorption durability of Zr-modified nano-CaO sorbents with cage-like hollow sphere structure [J].ACS Sustain Chem Eng, 2016, 4:2047-2055.

