基于MoS2模拟酶快速比色检测葡萄酒中的亚硫酸根
陈清爱,宋志平,郭良洽,庞 杰
(1. 福建商学院旅游系,福建 福州 350012; 2. 福州大学化学学院,福建 福州 350116;3. 福建农林大学食品科学学院,福建 福州 350002)
基于MoS2模拟酶快速比色检测葡萄酒中的亚硫酸根
陈清爱1,宋志平2,郭良洽2,庞 杰3
(1. 福建商学院旅游系,福建 福州 350012; 2. 福州大学化学学院,福建 福州 350116;3. 福建农林大学食品科学学院,福建 福州 350002)
MoS2纳米片能够有效地催化过氧化氢氧化底物和3, 3′, 5, 5′-四甲基联苯胺(TMB), 产生颜色变化,利用亚硫酸根能够消耗过氧化氢而降低反应体系吸光度的原理,建立一种亚硫酸根的快速比色传感体系并用于葡萄酒样品的检测. 实验考察并优化了反应时间、 H2O2浓度、 pH值和温度等影响参数,在最优条件下(反应时间30 min、 H2O2浓度100 μmol·L-1、 pH值7.0、 温度25 ℃),亚硫酸根浓度在5.0 ~120.0 μmol·L-1范围内与吸光度具有良好的线性关系,检测限(3σ/k)为0.5 μmol·L-1. 采用所建立的方法测定葡萄酒中的亚硫酸根,样品加标回收率为96.6%~106.5%.
二硫化钼;亚硫酸根;过氧化氢;葡萄酒
0 引言
亚硫酸盐具有杀菌、 防腐、 溶解、 抗氧化和增酸等作用,常作为食品添加剂应用于食品加工中,如干果、 葡萄、 马铃薯产品、 果汁以及葡萄酒中. 食品中亚硫酸盐的含量有严格的规定,越来越多的研究表明,一定量的亚硫酸化合物能够引起哺乳动物中毒和其他副作用. 已有研究报道,高浓度的亚硫酸能够引起哮喘发作和过敏反应[1-3]. 联合国粮农组织(FAO)和世界卫生组织(WHO)联合食品添加剂专家委员会对食品添加剂在人体的每日允许摄入量(ADI)作出规定,其中二氧化硫的每日允许摄入量为0.7 mg·kg-1. 欧盟对葡萄酒中亚硫酸盐的最大允许添加量进行了规定,红葡萄酒中总二氧化硫质量浓度为160 mg·L-1,白葡萄酒和玫瑰葡萄酒中的总二氧化硫质量浓度为210 mg·L-1[4]. 我国在发酵酒的卫生标准中规定葡萄酒中二氧化硫质量浓度不得超过250 mg·L-1[5]. 对食品和饮料包括葡萄酒中的总亚硫酸盐进行量化的方法通常有两种. 一种为直接碘滴定法[6],但这种方法容易受滴定过程中碘形成的化合物干扰,因此该方法的准确度被质疑[6]. 官方甚至欧盟通常采用比较正式的(AOAC公认)基于优化的Monier-Williams (OMW)检测法[7],但这种方法的样品处理比较耗时,不能用于简便快速检测. 目前也报道了一些其他传统方法,例如毛细管电泳、 高效液相色谱法、 离子色谱法、 生物传感器、 荧光分析法以及电化学分析法等[3, 8-10]. 虽然这些传统方法具有灵敏度高的优点,但存在样品前处理复杂、 检测时间长、 需要大型的实验仪器等缺点,使得这些方法无法用于现场快速检测,无法满足执法机构现场抽查需要. 建立简单、 快速比色的亚硫酸盐检测方法具有重要的应用价值和实际意义.

图1 基于MoS2纳米片比色传感检测亚硫酸根的示意图 Fig.1 Colorimetric sensing of sulfite root based on MoS2 NSs
MoS2纳米片具有模拟酶特性,能够有效地催化过氧化氢氧化氧化底物TMB产生颜色变化[11]. 与生物酶相比,模拟酶具有低成本、 高稳定性、 可调控催化活性等优点[11-12]. MoS2纳米片的模拟酶特性已被尝试用于比色传感器的构建[11, 13-15],但在食品安全检测中应用的报道相对较少,本课题组曾报告了MoS2纳米片作为模拟酶用于可乐中磷酸根的比色检测[16]. 实验设计了一种基于MoS2纳米片的催化酶特性的亚硫酸根快速比色检测方案,其基本原理如图1所示,利用亚硫酸根能够消耗过氧化氢从而降低反应体系的吸光度来实现对亚硫酸根的比色传感检测. 实验中探讨了传感体系的可行性,讨论实验条件对该方法测定结果的影响,并将该方法用于白葡萄酒样品中亚硫酸根的检测.
1 实验部分
1.1 试剂和仪器
MoS2(18 μg·mL-1,纯度>99%),购自南京先丰纳米材料科技有限公司; 三(羟甲基)氨基甲烷、 30%(质量分数)过氧化氢、 36%(质量分数)盐酸、 氯化钠、 溴化钾、 硫酸钾均购自国药集团化学试剂有限公司; 硫酸购自衡阳市凯信化工限公司; 亚硫酸钠购自百灵威公司; 硝酸钠、 氯化钡、 氯化钾和硫酸铵购自天津市福辰化学试剂厂; 硝酸镍、 硝酸镁购自广东汕头西陇化工厂; 硫酸锌购自天津市致远化学试剂有限公司; 3, 3′, 5, 5′-四甲基联苯胺购自上海生工生物工程技术服务公司; 实验用水全部为超纯水(18.2 MΩ·cm,Millipore超纯水系统); 实验样品葡萄酒品牌为张裕解百纳干白葡萄酒.
QL-866旋涡混合器(海门市其林贝尔仪器制造有限公司); Thermo Cell恒温金属浴(杭州博日科技有限公司); pHS-3C精密酸度计(上海大普仪器厂); AR224CN电子天平(奥豪斯仪器(上海)有限公司); 尼康D7000数码相机(日本尼康公司); Lamda750紫外可见-近红外分光光度计(美国Perkin Elmer公司); FEI Tecnai G2F20 透射电镜(美国FEI公司).
1.2 实验方法1.2.1 基于MoS2模拟酶传感体系检测亚硫酸根
在塑料离心管中加入50 μL MoS2纳米片(18 μg·mL-1)、 50 μL TMB(12 mmol·L-1)、 200 μL Tric-HCl缓冲液(0.01 mol·L-1,pH=7.0)、 100 μL不同浓度的Na2SO3和100 μLH2O2(100 μmol·L-1),混合均匀,在25 ℃下反应30 min后加入50 μL 20%(体积分数)H2SO4终止反应. 用紫外-可见-近红外分光光度计测定其在350~550 nm范围的吸收光谱图. 以450 nm处的吸光度变化值(ΔA=A0-A)作为纵坐标,以亚硫酸根浓度为横坐标,制作工作曲线. 其中A0为反应体系在没有亚硫酸根存在时的吸光度;A为反应体系在亚硫酸根存在时的吸光度.
1.2.2 葡萄酒实际样品的处理
将张裕解百纳干白葡萄酒用超纯水稀释400倍待用.
2 结果与讨论
2.1 二硫化钼的表征
图2为MoS2的透射电镜测试结果, 由图2可见,MoS2的尺寸大约在20~50 nm. 图3为MoS2的高倍透射电镜图,可测得其晶格大小为0.62 nm,这与文献报道的大小一致[17-18]. 图4为MoS2的紫外吸收光谱,这表明它在612与657 nm处有吸收峰,这些吸收带被认为是在布里渊K点直接带隙跃迁产生的[19-21],同时伴随着价带自旋耦合能分裂,也与报道的分布一致. 图5为可见光下MoS2分散液,由图中可知MoS2的颜色为棕色且能够均一稳定地分散在溶液中.

图2 MoS2透射电镜图Fig.2 TEM images of MoS2

图4 MoS2吸收光谱Fig.4 Absorption spectrum of MoS2

图5 可见光下MoS2分散液Fig.5 Dispersion of MoS2 under visible light
2.2 传感体系可行性研究
反应体系只有H2O2和TMB存在时,在350~550 nm范围基本没有吸收峰,这表明反应体系没有发生显色反应(见图6曲线a). 当反应体系加入MoS2时,MoS2作为模拟酶能够有效地催化过氧化氢氧化底物TMB发生显色反应,反应体系在450 nm处有很强的吸收峰(见图6曲线c). 当反应体系进一步加入亚硫酸盐时,反应体系在450 nm处的吸收峰明显降低(见图6曲线b). 这说明亚硫酸根能消耗H2O2,从而降低了反应体系的吸光度. 图6中的插图为反应溶液加H2SO4终止反应前(上图)和终止反应后(下图)颜色变化,从中也可看出亚硫酸根存在时,溶液的颜色明显变浅.
2.3 传感体系的影响因素优化2.3.1 反应时间的影响
实验考察反应时间对传感体系的影响情况,体系由18 μg·mL-1MoS2纳米片+100 μmol·L-1H2O2+12 mmol·L-1TMB组成,结果见图7. 从图7中的曲线a可看出,当体系不加亚硫酸盐时,反应体系的吸光度随着时间的延长逐渐增大,当时间达到30 min左右反应体系基本达到平衡. 从图7中的曲线b可看出,当体系中加入60 μmol·L-1亚硫酸根时反应体系的吸光度也会随着时间的延长逐渐增大,但其增加的幅度比不加亚硫酸根时的反应体系小,加入亚硫酸根会使显色体系的吸光度明显降低,且反应时间为30 min时反应体系基本达到平衡,因此选择30 min作为该传感体系的最佳反应时间.

图6 不同反应体系的吸收光谱变化Fig.6 Corresponding absorption spectra after termination in different reaction system

图7 反应时间对传感体系的影响Fig.7 Effect of reaction time on the sensing system
2.3.2 H2O2浓度的影响
实验考察H2O2浓度对传感体系的影响情况,实验条件为18 μg·mL-1MoS2纳米片+12 mmol·L-1TMB+ 60 μmol·L-1亚硫酸根+H2O2(0、 10、 20、 40、 60、 80、 100、 120、 140 μmol·L-1),pH值为7,反应温度为25 ℃,反应时间为30 min,结果见图8. 从图8可知,在含有亚硫酸根的反应体系中,随着H2O2浓度的增大,其ΔA值逐渐增大,当H2O2浓度大于100 μmol·L-1时,其对应的ΔA值基本趋于不变,因此选择H2O2的最佳浓度为100 μmol·L-1.
2.3.3 pH值的影响
实验考察pH值对传感体系的影响情况,实验条件为18 μg·mL-1MoS2纳米片+12 mmol·L-1TMB+ 60 μmol·L-1亚硫酸根+100 μmol·L-1H2O2,pH值分别为3、 4、 5、 6、 7、 7.5、 8、 9,反应温度为25 ℃,反应时间为30 min,结果见图9. 从图9中可看出,pH值对该体系的影响比较大. 当pH值小于7.0时,随着pH值的增大,其对应的ΔA值缓慢上升; 但当pH值超过7.0时,随着pH值的增大,其对应的ΔA值迅速下降,这可能是由于在碱性条件下MoS2的催化活性大大降低,从而使得吸光度变化值迅速减小. 因此,确定该反应体系的最适pH值为7.0.

图8 H2O2浓度对传感体系的影响Fig.8 Effect of H2O2 concentration on the sensing system

图9 pH值对传感体系的影响Fig.9 Effect of pH value on the sensing system
2.3.4 温度的影响
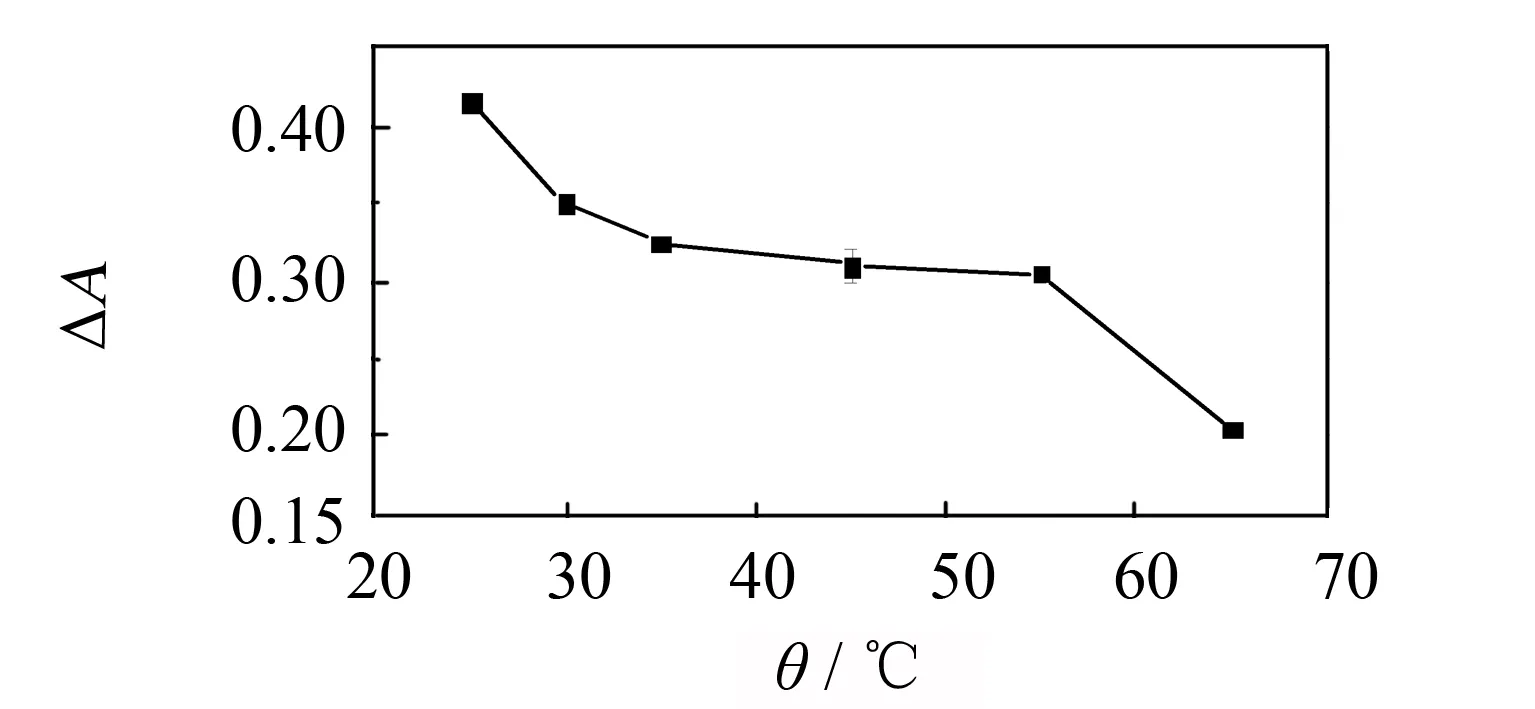
图10 温度对传感体系的影响Fig.10 Effect of temperature on the sensing system
实验考察温度对传感体系的影响情况,实验条件为18 μg·mL-1MoS2纳米片+12 mmol·L-1TMB+ 60 μmol·L-1亚硫酸根+100 μmol·L-1H2O2,pH值为7,反应温度分别为25、 30、 35、 45、 55、 65 ℃,反应时间为30 min,结果见图10. 从图10可知,传感体系的吸光度变化值随温度的增加呈缓慢下降趋势,当反应温度在30~55 ℃区间,其ΔA值基本趋于稳定. 但当温度超过55 ℃时,其ΔA值下降幅度明显,这可能是由于温度升高使得部分过氧化氢发生分解. 因此实验选择反应温度为25 ℃.
2.4 检测亚硫酸根的工作曲线
在最优反应条件下,随着亚硫酸根浓度的增加,其在450 nm处的吸光度呈有规律下降,如图11所示. 反应体系在450 nm处吸光度的降低程度ΔA(y)与亚硫酸根的浓度c(x)成正比,亚硫酸根浓度在5.0~120.0 μmol·L-1范围内具有良好的线性关系,其线性方程为y= 0.000 056 03 + 0.006 45x(R2=0.999 8),以3σ/k(其中σ=0.001 0,k=0.006 45)计算的检测限为0.5 μmol·L-1,如图12所示, 插图为亚硫酸根的线性校准曲线.

图11 不同浓度的亚硫酸根存在下传感体系中的吸收光谱图Fig.11 Absorption spectra of the sensor on addition of different concentrations of sulfite root

图12 传感体系检测亚硫酸根浓度的吸光度变化Fig.12 Absorbance change of the sensor as a fuction of sulfite root concentration
同时,还可以通过肉眼观察到,随着亚硫酸根浓度的变化其溶液对应的颜色也随之变化,如图13所示,亚硫酸根浓度从左往右依次为0、 5、 10、 20、 40、 60、 80、 100、 120、 140、 160 μmol·L-1. 在未加H2SO4终止反应前,随着亚硫酸根浓度的增大,溶液颜色由蓝色逐渐变淡,当加H2SO4终止反应后,溶液的颜色由黄色逐渐变淡. 肉眼可明显判断的亚硫酸根浓度为60 μmol·L-1.
2.5 传感体系的选择性
实验过程考察了传感体系的选择性,结果见图14. 从图14中的ΔA值变化可知,1.2 mmol·L-1Ba2+、 K+、 Mg2+、 Na+、 Ni2+、 Zn2+、 NH4+、 Br-、 Cl-、 SO42-、 NO3-等离子对反应体系的吸光度变化影响比较小,而0.12 mmol·L-1低浓度的亚硫酸根就可以产生明显的吸光度变化. 这说明该比色传感体系对亚硫酸根检测具有较高的选择性.

图13 不同浓度亚硫酸根其相应反应溶液在终止前(上)和终止后(下)的颜色变化Fig13 Corresponding photos of mixture solution before (top) and after (down) adding different concentrations of sulfite root

图14 传感体系的选择性(误差棒为3次实验的标准偏差)Fig.14 Selectivity of the sensing system (error bars show the standard deviations of measurements)
2.6 葡萄酒中亚硫酸盐的测定
将干白葡萄酒稀释400倍,采用加标回收法对亚硫酸盐进行检测,实验结果列于表1. 从表1可看出,对样品溶液进行3次不同加标量的测定,其加标回收率分别为106.5%、 97.4%和96.6%.

表1 基于MoS2传感体系检测葡萄酒样品中亚硫酸盐浓度的实验结果Tab.1 Results of sulfite detection based on MoS2sensing system in wine samples
3 结语
基于亚硫酸根能够消耗过氧化氢而降低MoS2-H2O2-TMB显色反应吸光度的原理,建立亚硫酸盐的可视化快速检测方法. 方法的线性范围为5.0~120.0 μmol·L-1,检测限(LOD)为0.5 μmol·L-1,定量限低于葡萄酒中亚硫酸根的国家限量标准. 利用该方法测定白葡萄酒中的亚硫酸根浓度,样品加标回收率为96.6%~106.5%,证明方法可靠. 该研究为葡萄酒中亚硫酸根的现场快速可视化检测提供了一种新方法.
[1] SILVA K R B, RAIMUNDO I M,GIMENEZ I F,etal. Optical sensor for sulfur dioxide determination in wines[J]. Journal of Agricultural and Food Chemistry, 2006, 54(23): 8 697-8 701.
[2] LOWINSOHN D, BERTOTTI M. Determination of sulphite in wine by coulometric titration[J]. Food Additives & Contaminants, 2001, 18(9): 773-777.
[4] KOCH M, KOPPEN R, SIEGEL D,etal. Determination of total sulfite in wine by ion chromatography after in-sample oxidation[J]. Journal of Agricultural and Food Chemistry, 2010, 58(17): 9 463-9 467.
[5] 国家卫生和计划生育委员会. 中国食品添加剂使用卫生标准: G2760-201[S]. 北京: 中国标准出版社, 2014.
[6] GONCALVES L M, GROSSO P J, JORGE M P,etal. Determination of free and total sulfites in wine using an automatic flow injection analysis system with voltammetric detectio[J]. Food Additives and Contaminants, 2010, 27(2): 175-180.
[7] CUNNIFF P. Official methods of analysis of AOAC International. Volume I agricultural chemicals, contaminants, drugs[J]. Trends in Food Science & Technology, 1995, 6(11): 382-382.
[8] MASAR M, DANKOVA M, ÖLVECKA E,etal. Determination of total sulfite in wine: zone electrophoresis-isotachophoresis quantitation of sulfate on a chip after an in-sample oxidation of total sulfite[J]. Journal of Chromatography A, 2005, 1 084(1): 101-107.
[9] MANA H, SPOHN U. Sensitive and selective flow injection analysis of hydrogen sulfite/sulfur dioxide by fluorescence detection with and without membrane separation by gas diffusion[J]. Analytical Chemistry, 2001, 73(13): 3 187-3 192.
[10] PUNDIR C S, RAWAL R. Determination of sulfite with emphasis on biosensing methods: a review [J]. Analytical Bioanalytical Chemistry, 2013, 405(10): 3 049-3 062.
[11] LIN T, ZHONG L, GUO L,etal. Seeing diabetes: visual detection of glucose based on the intrinsic peroxidase-like activity of MoS2nanosheets[J]. Nanoscale, 2014, 6(20): 11 856-11 862.
[12] GAO L, ZHUANG J, NIE L,etal. Intrinsic peroxidase-like activity of ferromagnetic nanoparticles[J]. Nature Nanotechnology, 2007, 2(9): 577-583.
[13] LI B L, LUO H Q, LEI J L,etal. Hemin-functionalized MoS2nanosheets: enhanced peroxidase-like catalytic activity with a steady state in aqueous solution[J]. Rsc Advances, 2014, 4(46): 24 256-24 262.
[14] SUN Z, ZHAO Q, ZHANG G,etal. Exfoliated MoS2supported Au-Pd bimetallic nanoparticles with core-shell structures and superior peroxidase-like activities[J]. Rsc Advances, 2015, 5 (14): 10 352-10 357.
[15] LEI J, LU X, NIE G,etal. One pot synthesis of algae like MoS2/PPy nanocomposite: a synergistic catalyst with superior peroxidase-like catalytic activity for H2O2detection[J]. Particle & Particle Systems Characterization, 2015, 32 (9): 886-892.
[16] 陈清爱, 钟良双, 庞杰, 等. 基于MoS2模拟酶检测可口可乐饮料中的磷酸根[J]. 福州大学学报(自然科学版), 2016, 44 (1): 124-128.
[17]WANGQH,KALANTAR-ZADEHK,KISA, et al.Electronicsandoptoelectronicsoftwo-dimensionaltransitionmetaldichalcogenides[J].NatureNanotechnology, 2012, 7(11): 699-712.
[18]LIUKK,ZHANGW,LEEYH, et al.Growthoflarge-areaandhighlycrystallineMoS2thinlayersoninsulatingsubstrates[J].NanoLetters, 2012, 12 (3): 1 538-1 544.
[19]JIQ,ZHANGY,GAOT, et al.EpitaxialmonolayerMoS2onmicawithnovelphotoluminescence[J].NanoLetters, 2013, 13 (8): 3 870-3 877.
[20]SPLENDIANIA,SUNL,ZHANGY, et al.EmergingphotoluminescenceinmonolayerMoS2[J].NanoLetters, 2010, 10 (4): 1 271-1 275.
[21]MAKKF,LEEC,HONEJ, et al.AtomicallythinMoS2:anewdirect-gapsemiconductor[J].PhysicalReviewLetters, 2010, 105 (13):136 805.
(责任编辑: 洪江星)
Rapid colorimetric detection of sulfite root in wine based on MoS2simulation enzyme
CHEN Qing’ai1, SONG Zhiping2, GUO Liangqia2, PANG Jie3
(1. Department of Tourism, Fujian Commercial College, Fuzhou, Fujian 350012, China; 2. College of Chemistry, Fuzhou University, Fuzhou, Fujian 350116, China; 3. College of Food Science, Fujian Agriculture and Forestry University, Fuzhou, Fujian 350002, China)
Molybdenum disulfide (MoS2) can catalytically oxidize 3, 3′, 5, 5′-tetramethylbenzidine (TMB) by H2O2to produce a blue color product, and the absorbance of system can reduce due to the consumption of H2O2by sulfite root. Based on this principle, a simple colorimetric method for sulfite root detection was developed and applied to detect sulfite in wine samples. Several analytical parameters including reaction time, the concentration of H2O2, pH value and temperature were investigated and optimized. Under the optimal conditions (reaction time 30 min, H2O2100 μmol·L-1, pH 7.0 and temperature 25 ℃), a linear relationship between the concentration of sulfite and absorbance could be obtained over the range of 5.0 to 120.0 μmol·L-1with a detection limit of 0.5 μmol·L-1(3σ/k). This method was applied to detect sulfite root in white grape wine with the recoveries of 96.6%-106.5%.
molybdenum disulfide (MoS2); sulfite root; H2O2; wine
10.7631/issn.1000-2243.2017.03.0432
1000-2243(2017)03-0432-06
2016-11-17
郭良洽(1975- ),博士,教授,主要从事食品安全方面的研究,lqguo@fzu.edu.cn
国家自然科学基金资助项目(21177023); 福建省科技厅科技计划资助项目(2017Y0007; 2015Y0045)
O661
A

