改性非晶态TiO2的制备及光催化性能研究
翁仁贵 ,王文明,刘心中,靳贵晓,颜振涛
(1. 福建工程学院生态环境与城市建设学院,福建 福州 350118; 2. 福州大学环境与资源学院,福建 福州 350116; 3. 福建工程学院材料科学与工程学院,福建 福州 350118)
改性非晶态TiO2的制备及光催化性能研究
翁仁贵1,王文明2,刘心中1,靳贵晓1,颜振涛3
(1. 福建工程学院生态环境与城市建设学院,福建 福州 350118; 2. 福州大学环境与资源学院,福建 福州 350116; 3. 福建工程学院材料科学与工程学院,福建 福州 350118)
采用溶胶-凝胶法制备改性非晶态TiO2,利用XRD、 SEM、 FT-IR、 低温N2吸附、 能谱及紫外可见漫反射光谱等测试手段对催化剂进行表征. XRD分析表明,改性TiO2的形态为非晶态. 电镜及能谱分析表明,改性非晶态TiO2颗粒大小均匀,分散性良好,Ag+已成功进行掺杂. 改性非晶态TiO2属于中孔材料,比表面积达188 m2·g-1,并且光谱响应范围扩大,对400~800 nm波长范围的光均具有良好的吸收. 以甲醛的降解考察改性非晶态TiO2的光催化活性,结果表明,在最佳改性条件下,所合成的改性非晶态TiO2在日光灯照射5 h后对甲醛的降解率达到74.9 %,优于P25型商品化TiO2对甲醛的降解效果.
改性非晶态TiO2; 甲醛; 光催化降解; 溶胶-凝胶法
0 引言
室内空气污染物中危害最大的是以甲醛为代表的挥发性有机化合物,其主要来源是室内装饰材料、 家具等[1]. 甲醛对人体健康危害极大,是最常见的优先级室内空气污染物之一[2], 已被世界卫生组织(WHO)正式确定为高致癌危险物质.
在常用的甲醛等空气污染物治理方法中,光催化降解污染物是一种重要的方法, 而TiO2作为一种廉价易得的光催化材料受到研究者的青睐[3-5]. 针对TiO2光催化降解性能的研究主要集中于晶态TiO2领域,因为有研究表明,非晶态TiO2存在尾态及带中缺陷,因此非晶态TiO2在紫外光下的降解性能非常弱[6-7]. 近年来,随着对TiO2光催化材料研究的深入,通过对非晶态TiO2进行改性后,发现其光催化性能得到明显提高[8-11],催化能力甚至优于晶态TiO2. 与此同时,非晶态TiO2制备成本较低,制备工艺简单.
Kanna等[12]通过研究发现非晶态TiO2相较于晶态TiO2有更大的比表面积,研究人员将自制非晶态TiO2用于吸附Mn2+、 Fe3+、 Cu2+、 Pb2+等金属离子,实验表明吸附效果良好. Buddee等[13]将金属元素Fe和Cr掺杂到非晶态TiO2中并进行光催化降解研究,实验结果表明无论在紫外光下还是可见光下,改性后的非晶态TiO2都具有良好的光催化性能,且非晶态TiO2具有较大的比表面积. Zou等[14]利用溶胶-凝胶法制得非晶态TiO2并用双氧水对其改性,结果表明该材料在可见光下和紫外光下均具有良好的光催化活性,与晶态TiO2的制备相比较,该方法还具有节约能源、 降低成本的优点.
本研究以钛酸四丁酯、 无水乙醇、 和硝酸制备非晶态TiO2,同时添加硝酸银对其进行改性,获得Ag改性非晶态TiO2,无需传统改性方法中的煅烧等步骤,使得该方法具有制备简单、 成本低的优点. 并进一步探索各种改性条件对光催化降解性能的影响,采用XRD、 SEM、 FT-IR、 BET、 能谱及紫外可见漫反射光谱等方法对合成的改性非晶态TiO2进行表征. 同时将改性非晶态TiO2与P25型商品化TiO2进行性能比较. 所得产物具有比表面积大、 可见光下光催化性能良好等优点,增强了非晶态TiO2的实用性.
1 实验部分
1.1 试剂与仪器1.1.1 实验试剂
钛酸四丁酯(化学纯,西亚化学工业有限公司); 无水乙醇(分析纯,西陇化工股份有限公司); 硝酸(分析纯,西陇化工股份有限公司); 硝酸银(分析纯,国药集团化学药剂有限公司); 甲醛(分析纯,西陇化工股份有限公司); 乙酰丙酮(分析纯,天津市大茂化学药剂厂); P25型商品化TiO2(纯度>99%,南京纳米海泰有限公司).
1.1.2 实验仪器
X射线衍射仪(D8 Advance,德国Bruker公司); FT-IR光谱仪(AVAT-AR 360,美国Nicolet公司); 场发射扫描电镜(Nova NanoSEM450,荷兰FEI公司); 能谱仪(X-MAX 50,牛津公司); BET测定仪(Autosorb IQ,美国Quantachrome公司); 紫外可见漫反射光谱仪(Lambda 900,Perkin-Elmer公司); 甲醛高精度探测器(JSA5-CH20-PID,深圳吉顺安科技有限公司); 双光束紫外可见分光光度计(TU-1900,北京普析通用仪器有限责任公司).
1.2 制备改性非晶态TiO2
采用溶胶-凝胶法制备改性非晶态TiO2. 将钛酸四丁酯、 去离子水、 乙醇、 硝酸按20∶200∶35∶x(x分别为0、 0.2、 1.0和2.0)的体积比进行量取; 将一定量的钛酸四丁酯和乙醇倒入烧杯中,充分搅拌,获得混合液,标记为A液; 将一定量的去离子水和硝酸倒入烧杯中,充分搅拌,获得混合液,标记为B液; B液继续搅拌,在搅拌过程中,将A液用滴管缓慢逐滴加入B液中,滴加完毕后,继续搅拌1 h; 搅拌结束后,将反应溶液静置4 h,然后再通过离心机将反应溶液中的TiO2前驱体分离出来; 将分离出来的TiO2前驱体进行多次的水洗及醇洗,直至浸出液呈中性,将清洗后的TiO2前驱体烘干,标记为粉末A; 将粉末A与硝酸银按质量比为1∶y(y为0、 0.02、 0.06、 0.10和0.20)进行量取,将两者充分混合于50 %(体积分数)的乙醇溶液中,超声30 min后,将其烘干,烘干好的粉末标记为粉末B; 将粉末B在不同温度下的真空干燥箱中进行热处理载碳,热处理温度(z)分别为0、 70、 150、 250 ℃,热处理时间为4 h. 热处理结束后所得粉末即为改性非晶态TiO2,现将制得的非晶态TiO2标记为x-y-z-amTiO2,x、y、z分别为硝酸体积配比量、 硝酸银质量配比量及热处理温度.
1.3 改性非晶态TiO2光催化降解甲醛
1) 将已标定的甲醛标准贮备液(0.287 mg·mL-1)用移液管量取10.00 mL移入1 L容量瓶中,加水至标线,摇匀,得到实验用甲醛初始溶液(2.87 μg·mL-1).
2) 将上述配置好的甲醛溶液用移液管量取100 mL置于烧杯中,用电子天平称取0.2 gx-y-z-amTiO2光催化剂加入到甲醛溶液中,在避光的条件下磁力搅拌30 min.
3) 打开光源(PHILIPS公司E40型80 W节能灯),悬浮液在光照条件下降解5 h,期间每隔1 h用注射器吸取10 mL溶液,用离心机进行离心,离心两次后(5 000 r·min-1,15 min·次-1),将离心好的溶液用移液管取上清液6.00 mL加入到25 mL具塞比色管中,加水至标线,摇匀.
4) 将乙酰丙酮溶液用移液管分别移取2.50 mL到上述比色管中,摇匀,置于水浴锅中60 ℃恒温加热15 min,冷却.
5) 用10 mm比色皿,以水作参比,在波长414 nm处测量溶液的吸光度. 溶液中剩余甲醛浓度通过以下公式进行计算:

式中:ρ为甲醛溶液剩余甲醛质量浓度(μg·mL-1);m为利用制得的甲醛标准曲线中的回归方程计算的甲醛质量(μg);V为具塞比色管中甲醛溶液加入体积,即6.00 mL.
2 结果与讨论
2.1 改性条件对光催化降解性能的影响2.1.1 硝酸银质量配比量对改性非晶态TiO2光催化性能的影响
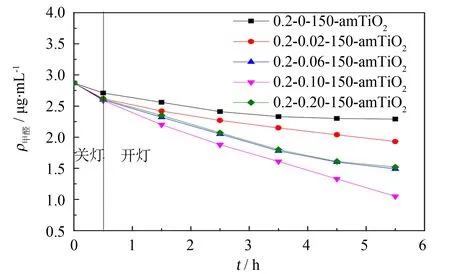
图1 硝酸银质量配比量对改性非晶态TiO2光催化性能的影响Fig.1 Effect of silver nitrate mass ratio on photocatalytic activity of modified amorphous TiO2
对硝酸银质量配比量进行优化. 将硝酸的体积配比量及热处理温度分别控制在0.2和150 ℃的条件下,将粉末A和硝酸银按质量比分别为1∶0、 1∶0.02、 1∶0.06、 1∶0.10、 1∶0.20进行制备改性,获得的产物分别命名为0.2-0-150-amTiO2、 0.2-0.02-150-amTiO2、 0.2-0.06-150-amTiO2、 0.2-0.10-150-amTiO2、 0.2-0.20-150-amTiO2,结果如图1所示.
从图1可知,在没有掺杂Ag+的条件下制备的光催化剂0.2-0-150-amTiO2对甲醛也具有一定的降解能力(降解率仅为20.2 %). 这可能是因为实验用的日光灯有少量紫外光溢出,同时该样品进行了150 ℃的热处理,因此具有一定的光催化降解能力. 0.2-0.02-150-amTiO2、 0.2-0.06-150-amTiO2、 0.2-0.10-150-amTiO2对甲醛的降解率分别为32.8%、 48.1%、 63.3%,这表明在一定范围内,随着硝酸银添加量逐渐增加,改性非晶态TiO2的光催化能力也越强. 而当硝酸银质量配比量继续增加时,0.2-0.20-150-amTiO2对甲醛的降解效果降低,甲醛降解率为47.0%. 造成上述现象的原因可能是由于非晶态TiO2电子迁移率较小,对其进行Ag+掺杂可提高光生空穴的产生速率,从而提高非晶态TiO2的光催化性能,而当Ag+掺杂量过多时,TiO2过于靠近价带顶,这会加快光生空穴和电子的复合,致使光生空穴存在时间缩短,光催化性能下降. 因此,结合实验结果和经济性考虑,确定实验最佳的硝酸银质量配比量为0.1.
2.1.2 热处理温度对改性非晶态TiO2光催化性能的影响
对热处理温度进行优化. 将硝酸的体积配比量及硝酸银的质量配比量分别控制在0.2和0.10的条件下,将粉末B分别在0 、 70 、 150 及250 ℃进行热处理,分别得到0.2-0.10-0-amTiO2、 0.2-0.10-70-amTiO2、 0.2-0.10-150-amTiO2、 0.2-0.10-250-amTiO2光催化剂,结果如图2所示.
从图2可以看出,随着热处理温度的提高,改性非晶态TiO2对甲醛的降解效果也越好. 0.2-0-150-amTiO2和0.2-0.10-0-amTiO2都对甲醛具有一定的降解效果,证明对非晶态TiO2进行Ag+掺杂或者热处理均可在一定程度上提高非晶态TiO2的光催化能力. 0.2-0.10-150-amTiO2和0.2-0.10-250-amTiO2光催化效果较为显著,甲醛降解率分别达到63.4%和76.3%,而0.2-0.10-0-amTiO2和0.2-0.10-70-amTiO2分别仅为29.3 %和37.3 %,这表明热处理可以显著提高非晶态TiO2的光催化性能,该现象是由于非晶态TiO2处于不稳定的“亚稳”状态,热处理会影响非晶态TiO2的形态,从而对其光催化性能产生影响. 从XRD表征分析中也可以验证这一点,当热处理温度为250 ℃时,非晶态TiO2已开始向晶态转变,具有较高的结晶度. 为保持材料的非晶态,结合降解效果及经济成本的考虑,确定实验最佳的热处理温度为150 ℃.
2.1.3 硝酸体积配比量对改性非晶态TiO2光催化性能的影响
对硝酸配比量进行优化. 将硝酸银的质量配比量及热处理温度分别控制在0.10及150℃的条件下,将钛酸四丁酯、 去离子水、 乙醇、 硝酸按20∶200∶35∶x(x分别为0.0、 0.2、 1.0和2.0)的体积比进行量取,采用溶胶-凝胶法进行制备,分别得到0-0.10-150-amTiO2、 0.2-0.10-150-amTiO2、 1.0-0.10-150-amTiO2、 2.0-0.10-150-amTiO2光催化剂,结果如图3所示.
从图3可以看出,随着硝酸体积配比量的增加,改性非晶态TiO2对甲醛的降解效果呈现先增加后降低的趋势,0-0.10-150-amTiO2、 0.2-0.10-150-amTiO2、 1.0-0.10-150-amTiO2、 2.0-0.10-150-amTiO2的降解率分别为27.9 %、 63.4 %、 74.9 %、 40.1 %. 结合XRD表征分析,当硝酸体积配比量增加时,1-0.1-150-amTiO2和2-0.1-150-amTiO2的晶化现象相较于0-0.1-150-amTiO2和0.2-0.1-150-amTiO2更为明显,这有利于提高非晶态TiO2光催化性能. 结合电镜扫描表征分析可以看出,硝酸体积配比量对采用溶胶-凝胶法制备的非晶态TiO2的外观形貌和颗粒大小影响显著,1.0-0.10-150-amTiO2颗粒最小,分散性更优. 因此,1.0-0.10-150-amTiO2和2.0-0.10-150-amTiO2虽然结晶度比0-0.1-150-amTiO2、 0.2-0.1-150-amTiO2高,但是2.0-0.10-150-amTiO2并不是颗粒状,已呈较大的块状,光催化性能比颗粒状的0.2-0.10-150-amTiO2差,而1.0-0.10-150-amTiO2外观形貌及结晶度的表现均良好,因此其光催化性能最好. 综上考虑,在改性非晶态TiO2的制备过程中最佳的硝酸体积配比量为1.0.
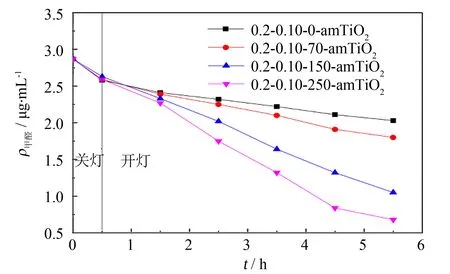
图2 热处理温度对改性非晶态TiO2光催化性能的影响Fig.2 Effect of heat treatment temperature on photocatalytic activity of modified amorphous TiO2

图3 硝酸体积配比量对改性非晶态TiO2光催化性能的影响Fig.3 Effect of nitric acid volume ratio on photocatalytic activity of modified amorphous TiO2
2.2 表征结果分析2.2.1 改性非晶态TiO2XRD图谱分析
图4为不同制备条件下的改性非晶态TiO2的XRD图谱. 图4(a)、 (b)、 (c)分别为不同硝酸银质量配比量、 不同热处理温度及不同硝酸体积配比量下的样品的XRD图谱.
从图4(a)可以看出,在不改变硝酸体积配比量及热处理温度的条件下,5组样品的XRD曲线大致相同,表明不同的硝酸银配比量对样品晶型影响程度小,样品无定型成分较多,因此都属于非晶态TiO2,样品0.2-0.10-150-amTiO2在2θ=25°附近的衍射包相较于其它样品更为尖锐,较高的结晶度有利于光催化性能的提高,这与甲醛降解实验结果一致.
从图4(b)分析得出,由于非晶态TiO2处于“亚稳”状态,因此,热处理温度对样品的晶型及结晶度影响较大. 在经不同温度热处理4 h后,样品的晶型及结晶度均有变化,0.2-0.10-0-amTiO2、 0.2-0.10-70-amTiO2衍射峰均不明显,结晶度很差,0.2-0.10-150-amTiO2在2θ=25°附近有一个宽化的衍射包出现,结晶度相对较差. 而0.2-0.1-250-amTiO2在经250 ℃热处理4 h后,样品衍射峰最为尖锐,结晶效果最明显,且锐钛矿(JCPDS 21-1272)[15-16]结构中(101)、 (004)、 (200)和(204)晶面已开始在0.2-0.1-250-amTiO2样品中出现,因此光催化活性最好,这与甲醛降解实验结果一致.
从图4(c)可以看出,在溶胶-凝胶的过程中,硝酸配比量会对样品的结晶度产生影响,0-0.10-150-amTiO2未出现相应的衍射峰,而0.2-0.10-150-amTiO2、 1.0-0.10-150-amTiO2和2.0-0.10-150-amTiO2在2θ=25°附近有一个宽化的衍射包出现,且从图中可以看出,2.0-0.10-150-amTiO2和1.0-0.10-150-amTiO2结晶度比0.2-0.10-150-amTiO2更高. 造成上述现象的原因可能是在溶胶-凝胶过程中反应溶液的pH会影响有机钛源水解产物的聚合方式,较高的pH值会使水解产物发生脱氧作用,使聚合反应向共顶方向进行,致使TiO2溶胶样品形成锐钛矿结构. 结合电镜扫描结果分析可知,2.0-0.10-150-amTiO2结块现象严重,光催化性能受到限制,这与甲醛光催化降解实验结果相一致.
综上可知,1.0-0.10-150-amTiO2结晶程度低,无定型成分含量大,因此该样品为非晶态TiO2.

图4 不同制备条件下的改性非晶态TiO2的XRD图谱Fig.4 XRD pattern of modified amorphous TiO2 from different conditions
2.2.2 改性非晶态TiO2形貌分析
图5为改性非晶态TiO2电镜扫描图. 从图5可知,在溶胶-凝胶法制备过程中,硝酸的添加量对改性非晶态TiO2的形貌影响显著,在一定范围内,随着硝酸添加量的增加,所制备的改性非晶态TiO2颗粒逐渐减小. 但当硝酸体积配比量为2.0时,所制备的 2.0-0.10-150-amTiO2样品为密实的块状. 从图中还可以看出,1.0-0.10-150-amTiO2相较于其它三者,分散性最好.

图5 改性非晶态TiO2电镜扫描图Fig.5 SEM of modified amorphous TiO2
pH值是溶胶-凝胶法制备纳米颗粒过程的一个重要因素,它对材料的颗粒形状、 大小及晶型结构有着重要影响. 当硝酸量增加时,由于质子化作用颗粒表面带正电荷,相邻颗粒间产生排斥力,从而克服相邻颗粒的靠近和聚集,抑制颗粒生长,控制晶粒尺寸,这有利于提高光催化剂的光催化性能. 而当硝酸添加量过多时,水洗醇洗后,样品在烘干过程中易结块,光催化性能降低.
2.2.3 改性非晶态TiO2能谱分析
图6 是改性非晶态TiO2的能谱图. 从图6可知,所制备的光催化材料1.0-0.10-150-amTiO2已成功进行Ag+掺杂,且杂峰较少,元素组分较为纯净. 由于非晶态TiO2有机物含量高,因此样品的碳元素组分含量较高.
2.3 改性非晶态TiO2与P25型商品化TiO2性能分析2.3.1 FT-IR分析
图7为样品的红外吸收光谱图. 从图7可知,1.0-0.10-150-amTiO2相较于P25所含官能团的种类及数量均更多,因此1.0-0.10-150-amTiO2振动峰更多且振动更为强烈; 两条曲线在400~800 cm-1之间较宽的吸收峰为Ti-O-Ti桥联伸缩振动吸收峰,证明样品主要成分为TiO2; 两条曲线在1 626 cm-1和3 000~3 600 cm-1之间的吸收峰对应是O-H的伸缩振动和弯曲振动,这可能是由于样品所含水分造成的,但这有利于促进TiO2光催化氧化进程; 1.0-0.10-150-amTiO2在2 900 cm-1附近及1 400 cm-1附近有吸收峰,这对应的是该样品所含有机物的C-H键的伸缩振动,对比来看,P25便没有这两处吸收峰; 在2 300~2 400 cm-1出现的吸收峰为CO2红外吸收峰,这可能是由于背景扣除不完全产生的.

图6 改性非晶态TiO2能谱图 Fig.6 EDS of modified amorphous TiO2
2.3.2 BET分析
图8(a)、 (b)分别为1.0-0.10-150-amTiO2和P25的N2吸脱附等温曲线,由图8可知,两者的N2吸附等温线有所区别,但两者曲线整体趋势呈反S型,均属于IV型等温线,表明样品属于介孔材料. 图9为样品的孔径分布曲线,样品比表面积数据见表3. 1.0-0.10-150-amTiO2属于比表面积较高的介孔材料,其比表面积为188 m2·g-1,远远大于P25,这有利于提高1.0-0.10-150-amTiO2光催化降解的性能.

图8 样品氮气吸脱附等温线 Fig.8 N2 adsorption-desorption isotherms of samples

表3 样品的比表面积数据
2.3.3 紫外可见漫反射光谱分析

图9 样品孔径分布曲线 Fig.9 Curve of sample pore size distribution
图10 为样品紫外可见漫反射光谱图. 从图10可知,实验通过热处理碳掺杂、 Ag+掺杂等改性手段所合成的1.0-0.10-150-amTiO2较P25光吸收带发生了明显的红移,说明经过改性后的1.0-0.10-150-amTiO2光响应范围扩大,使其在可见光区域均有响应,提高了材料的实用性. 实验所用光源为PHILIPS公司E40型80 W节能灯,其光源主要以蓝光(465~470 nm)、 黄光(565~570 nm)及红光(605~740 nm)为主,因此1.0-0.10-150-amTiO2在这样的光照条件下具备良好的光响应,具有一定的光催化性能,这与上述甲醛降解实验结果相一致.
2.3.4 改性非晶态TiO2和P25光催化降解甲醛的性能对比
为了解改性非晶态TiO2和P25型商品化TiO2的光催化降解性能,在节能灯照射下,将二者的光催化降解甲醛的能力进行对比,结果如图11所示. 改性非晶态TiO2对甲醛的降解能力要明显优于P25型商品化TiO2对甲醛的降解能力,一方面由于改性非晶态TiO2比P25商品化TiO2具有更好的可见光吸收能力,另一方面,BET检测结果可以较好地解释该现象,由于改性非晶态TiO2的比表面积要远大于P25,增加了改性非晶态TiO2与甲醛气体的碰撞几率,所以提高了TiO2的光催化效率.

图10 样品紫外可见漫反射光谱图Fig.10 UV-Vis DRS of the samples

图11 改性非晶态TiO2和P25对甲醛的降解曲线Fig.11 Curve of degradation of modified amorphous TiO2 and P25
3 结语
1) 通过改性实验研究表明,硝酸银质量配比量、 热处理温度及硝酸体积配比量均影响改性非晶态TiO2的光催化性能,结合技术因素和经济性,最终选择硝酸银质量配比量为0.1、 热处理温度为150 ℃、 硝酸体积配比量为1.0作为最佳改性条件开展非晶态TiO2的改性和制备,合成的1.0-0.10-150-amTiO2在日光灯照射5 h后对甲醛溶液的甲醛降解率达74.9 %,降解效果明显. 表明1.0-0.10-150-amTiO2具有较为良好的光催化性能.
2) 通过对1.0-0.10-150-amTiO2进行XRD分析,发现其形态为非晶态. 通过对不同条件改性得到的样品分别进行XRD分析,发现热处理温度及硝酸配比量对样品晶型的转变及结晶的程度影响较大,而硝酸银配比量对样品晶型的影响程度小.
3) 通过对样品进行电镜扫描分析,发现硝酸配比量对样品的外观形貌影响较大,在溶胶-凝胶法制备的过程中,硝酸的添加量影响终产物的颗粒大小. 通过对样品的能谱进行分析,发现样品所含杂峰较少,Ag+已成功进行掺杂.
4) 通过与P25进行对比,实验所制备的1.0-0.10-150-amTiO2官能团丰富,有利于提高其光催化性能. 1.0-0.10-150-amTiO2属于中孔材料,比表面积达188 m2·g-1,吸附性能优于P25,有利于污染物的降解. 1.0-0.10-150-amTiO2对光的响应范围提高,光吸收带红移,在400~800 nm范围内的光均具有良好的吸收,改善其可见光下的光催化性能,大大提高了实用性.
[1] 石碧清, 刘湘, 闾振华. 室内甲醛污染现状及其防治对策[J]. 环境科学与技术, 2007, 30(6): 49-51.
[2] SALTHAMMER T, MENTESE S, MARUTZKY R. Formaldehyde in the indoor environment[J]. Chemical Reviews, 2010, 110(4): 2 536-2 572.
[3] LIU T X, LI F B, LI X Z. TiO2hydrosols with high activity for photocatalytic degradation of formaldehyde in a gaseous phase[J]. Journal of Hazardous Materials, 2008, 152(1): 347-355.
[4] SHAO P, TIAN J, ZHAO Z,etal. Amorphous TiO2doped with carbon for visible light photodegradation of rhodamine B and 4-chlorophenol[J]. Applied Surface Science, 2015, 324(324): 35-43.
[5] LIAO Y, XIE C, LIU Y,etal. Comparison on photocatalytic degradation of gaseous formaldehyde by TiO2, ZnO and their composite[J]. Ceramics International, 2012, 38(6): 4 437-4 444.
[6] ECONOMOU E N, COHEN M H. Anderson's theory of localization and the Mott-CFO model[J]. Materials Research Bulletin, 1970, 5(8): 577-590.
[7] STONE V F, DAVIS R J. Synthesis, characterization, and photocatalytic activity of titania and niobia mesoporous molecular sieves[J]. Chemistry of Materials, 1998, 10(5): 19 959-19 965.
[8] AND W E S, LAMB H H. Synthesis of nanostructured titania powders via hydrolysis of titanium isopropoxide in supercritical carbon dioxide[J]. Langmuir, 2003, 19(7): 2 989-2 994.
[9] SUN T, HNG H H, YAN Q,etal. Preparation of Pt/TiO2nanocomposite thin films by pulsed laser deposition and their photoelectrochemical behaviors[J]. Journal of Photochemistry & Photobiology A Chemistry, 2001, 145(1): 11-16.
[10]LI Z, FANG Y, ZHAN X,etal. Facile preparation of squarylium dye sensitized TiO2nanoparticles and their enhanced visiblelight photocatalytic activity[J]. Journal of Alloys & Compounds, 2013, 564(564): 138-142.
[11] 何宇亮. 非晶态半导体物理学[M]. 北京: 高等教育出版社, 1989.
[12] KANNA M, WONGNAWA S, SHERDSHOOPONGSE P,etal. Adsorption behavior of some metal ions on hydrated amorphous titanium dioxide surface[J]. Songklanakarin Journal of Science & Technology, 2005, 27(5): 1 017-1 026.
[13] BUDDEE S, WONGNAWA S. Removal of dyes by photocatalytically active curcumin-sensitized amorphous TiO2under visible-light irradiation[J]. Journal of Sol-Gel Science and Technology, 2015, 75(1): 152-163.
[14] ZOU J, GAO J, XIE F. An amorphous TiO2sol sensitized with H2O2with the enhancement of photocatalytic activity[J]. Journal of Alloys & Compounds, 2010, 497(1): 420-427.
[15] HUANG W, TANG X, WANG Y,etal. Selective synthesis of anatase and rutile via ultrasound irradiation[J]. Chemical Communications, 2000, 15(15): 1 415-1 416.
[16] ZHANG H Z, MICHAEL F A, J F B. Preparing single-phase nanocrystalline anatase from amorphous titania with particle sizes tailored by temperature[J]. Nano Letters, 2001, 1(2): 81-85.
(责任编辑: 洪江星)
Preparation and photocatalytic property of modified amorphous TiO2
WENG Rengui1, WANG Wenming2, LIU Xinzhong1, JIN Guixiao1, YAN Zhentao3
(1. College of Ecological Environment and Urban Construction, Fujian University of Technology, Fuzhou, Fujian 350118, China; 2. College of Environment and Resources, Fuzhou University, Fuzhou, Fujian 350116, China; 3. College of Meterials Science and Engineering, Fujian University of Technology, Fuzhou, Fujian 350118, China)
The modified amorphous TiO2was prepared by the sol-gel method. The properties of the as-prepared samples were characterized by XRD, SEM, FT-IR, N2sorption analysis, EDS analysis and UV-Vis diffuse reflectance spectroscopy. The XRD analysis showed that modified TiO2was amorphous. The SEM and EDS analysis showed that the size of the modified amorphous TiO2particles was uniform and has good dispersion, and the Ag+was doped successfully. The modified amorphous TiO2belonged to the mesoporous materials, and the specific surface area was 188 m2·g-1. The light response range of the modified TiO2was improved, which had good absorption of light in the range of 400~800 nm. The results showed that the degradation rate of formaldehyde by the modified TiO2was 74.9 % under fluorescent lamp for 5 hours under best modified conditions. The photocatalytic performance of modified amorphous TiO2was superior to ordinary commercial TiO2(P25).
modified amorphous TiO2; formaldehyde; photocatalytic degradation; sol-gel method
10.7631/issn.1000-2243.2017.03.0410
1000-2243(2017)03-0410-08
2016-12-23
刘心中(1963-),教授,主要从事废弃物资源化工程及环境污染化学等方面的研究,liuxinzh01@163.com
福建省科技厅计划资助项目(2016H6002); 福建工程学院科研启动基金资助项目(GY-214016)
X505
A

