环己醇在酸性高锰酸钾溶液中的氧化反应研究
张元文, 胡 月, 刘 凡, 张元勤*
(1.眉山市洪雅中学,四川 洪雅 620360;2.乐山师范学院 化学学院,四川 乐山 614000)
环己醇在酸性高锰酸钾溶液中的氧化反应研究
张元文1, 胡 月2, 刘 凡2, 张元勤2*
(1.眉山市洪雅中学,四川 洪雅 620360;2.乐山师范学院 化学学院,四川 乐山 614000)
利用光谱法,研究了环己醇在酸性高锰酸钾溶液中的氧化反应动力学,探讨了不同温度、环己醇浓度和酸度对反应的影响,得出了反应的速率常数、反应级数和反应的活化能,并分析了SDS、CTAB和Brij35三种表面活性剂胶束对该反应的促进作用。结果表明:三种表面活性剂胶束对该氧化反应均表现出加速作用,作用大小依次为CTAB>Brij35>SDS。利用傅里叶红外光谱仪和气相色谱仪检测了反应产物为己二酸。
环己醇;吸光度;胶束;活化能;反应级数
己二酸是一种重要的化工原料,是合成尼龙-66等高分子材料的重要原料,在医药、染料、食品和涂料等领域也有广泛的应用[1]。用高锰酸钾氧化环己醇是生产己二酸的重要方法之一,但目前未见有关该反应动力学方面的研究报道。本文研究了在酸性条件下,高锰酸钾氧化环己醇的反应动力学,获得了相关的动力学数据。由表面活性剂形成的胶束,以其局部浓度效应、静电效应、极性效应、定位效应和微黏度效应影响、调节和控制着许多化学反应的进行[2-3],本文进一步研究了SDS、Brij35、CTAB三种表面活性剂胶束对该反应的影响,研究结果对改进高锰酸钾氧化环己醇合成己二酸有较好的指导价值。
1 实验部分
1.1 主要仪器与试剂
紫外可见分光光度计(Jasco V-630,Jasco公司,日本),傅里叶变换红外光谱仪(IRPrestige-21,岛津公司,日本),气相色谱仪(GC 7890Ⅱ,天美公司,中国)。环己醇,高锰酸钾,硫酸,十二烷基硫酸钠(SDS),聚氧乙烯醚(Brij35),十六烷基三甲基溴化铵(CTAB),己二酸,环己酮,草酸钠均为分析纯,实验用水为二次蒸馏水。
环己醇溶液:准确量取3 mL环己醇,用蒸馏水配制定容于100 mL容量瓶中,其储备浓度为0.288 mol.L-1;硫酸溶液:准确量取10 mL 98%浓硫酸,用蒸馏水配制,冷却后定容于100 mL容量瓶中,其储备浓度为1.84 mol.L-1;高锰酸钾溶液:用草酸钠标定已配制好的高锰酸钾溶液,其储备浓度为0.0291 mol.L-1;5×10-3mol.L-1十六烷基三甲基溴化铵(CTAB)、0.1 mol.L-1十二烷基硫酸钠(SDS)和5×10-3mol.L-1聚氧乙烯醚(Brij35)均用称重法配制。
1.2 实验方法
本反应在高锰酸钾溶液中的最大吸收波长525 nm处测定其吸光度[4],在反应中其他反应物以及产物在此波长下没有明显的吸收,因此,通过测定在此波长下吸光度随时间的变化,可得出高锰酸钾浓度随时间的变化关系。在此反应中,环己醇和氢离子的浓度远远大于高锰酸钾的浓度,在高锰酸钾浓度较低时,用高锰酸钾吸光度A的对数lnA对反应时间t作图,若得一直线,则表明该反应为准一级反应,由直线的斜率可获得反应速率常数。
1.2.1 不同温度对氧化反应的影响
准确移取已配制好的环己醇溶液、硫酸溶液以及蒸馏水各1 mL于比色皿中,混合均匀后恒温20 min,加入30 μL高锰酸钾溶液,在高锰酸钾的最大吸收波长525 nm处,测定吸光度随时间的变化关系,测定的温度分别为30℃、33℃、36℃、39℃、42℃。
1.2.2 环己醇反应级数的确定
准确移取已配制好的环己醇溶液0.5 mL、硫酸溶液1 mL以及蒸馏水1.5 mL于比色皿中,设置测定的温度为30℃,混合均匀后恒温20 min,加入30 μL高锰酸钾溶液,测定高锰酸钾吸光度随时间的变化关系。同法测定环己醇用量分别为1 mL、1.5 mL、2 mL、2.5 mL时高锰酸钾吸光度随时间的变化关系。
1.2.3 氢离子反应级数的确定
准确移取已配制好的环己醇溶液1 mL、硫酸溶液0.5 mL以及蒸馏水各1.5 mL于比色皿中,设置测定的温度为30℃,混合均匀后恒温20 min,加入30 μL高锰酸钾溶液,测定高锰酸钾吸光度随时间的变化关系。同法测定硫酸溶液为1 mL、1.5 mL、2 mL、2.5 mL时高锰酸钾吸光度随时间的变化关系。
1.2.4 表面活性剂对氧化反应的影响
准确移取已配制好的环己醇溶液、硫酸溶液以及SDS溶液各1 mL于比色皿中,设置测定温度为30℃,混合均匀后恒温20 min,加入30 μL高锰酸钾溶液,测定高锰酸钾吸光度随时间的变化关系。改变SDS的用量分别为0.2 mL、0.4 mL、0.5 mL、0.6 mL、0.8 mL、1.2 mL、1.5 mL、1.6 mL,测定高锰酸钾吸光度随时间的变化关系。同法测定在不同浓度的Brij35和CTAB表面活性剂溶液中,高锰酸钾吸光度随时间的变化关系。
1.2.5 氧化后产物的检测
在室温下将1 mL环己醇、1 mL硫酸以及1 mL水移于比色管中,加入30 μL高锰酸钾溶液,充分反应直至褪色。取少量无水乙醚加入充分反应的溶液中后置于分液漏斗中充分振摇进行萃取,溶液分为两层,上层液体为所得产物。用玻璃棒蘸取少量产物涂于玻璃器皿上,用傅里叶变换红外光谱仪测定反应产物的光谱数据。再取5 μL上层液体,以N2为载气,FID检测温度为250℃,进样温度为190℃,不分流用气相色谱仪检测。在同样条件下,用气相色谱仪再测定环己醇以及环己酮的气相色谱。
2 结果与讨论

图1 不同温度下环己醇氧化反应的lnA-t关系

图2 环己醇氧化反应的lnk-1/T关系
2.1 不同温度对氧化反应的影响
在环己醇、硫酸和高锰酸钾浓度分别为0.096 mol.L-1、0.61 mol.L-1和2.91×10-7mol.L-1的条件下,测定了在303 K、306 K、309 K、312 K、315 K下高锰酸钾吸光度随时间的变化关系,如图1所示。由图1可见各曲线均为直线,因此反应对高锰酸钾为一级反应,其斜率的负值即为反应速率常数k,不同温度下反应的速率常数见表1。

表1 不同温度下环己醇氧化反应的速率常数
用lnk对1/T作图,可得一直线,如图2所示,根据阿伦尼乌斯公式[5],由直线的斜率可计算出该反应的活化能为6.11×104J.mol-1。
2.2 环己醇反应级数的确定
在酸度为0.61mol.L-1,高锰酸钾浓度为2.91×10-7mol.L-1,温度为303 K,环己醇浓度分别为0.048 mol.L-1、0.096 mol.L-1、0.144 mol.L-1、0.192 mol.L-1、0.206 mol.L-1的条件下,测定反应吸光度随时间的变化关系,以lnA对时间t作图,得到速率常数k,如表2所见。

表2 303 K,不同环己醇浓度下反应的速率常数
假设反应的速度方程式为:

前已测出高锰酸钾的级数为1,因此反应的速率方程为:

令

则有

由式(4)可见,在满足准一级反应条件下,当保持H+浓度不变而改变己二醇初始浓度时,用lnk对ln[C6H6O]作图,得一直线,如图3所示,其斜率为1.0347,由此可确定环己醇的分级数为1级。同法可确定H+的分级数。
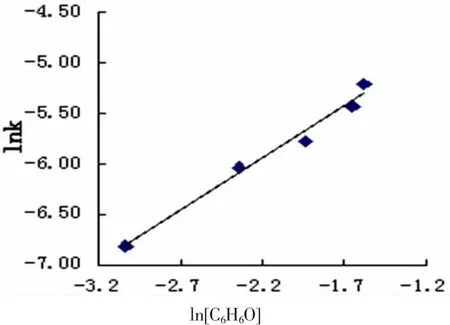
图3 303 K时lnk与ln[C6H6O]关系([H+]:0.61 mol.L-1,[MnO4-]:2.91×10-7mol.L-1)

表3 303 K时不同H+浓度下反应的速率常数

图4 303 K时lnk与ln[H+]关系([C6H6O]:0.096 mol.L-1,[MnO4-]:2.91×10-7mol.L-1)
2.3 氢离子反应级数的确定
在环己醇浓度为0.096 mol.L-1,温度为303 K,高锰酸钾浓度为2.91×10-7mol.L-1,硫酸的浓度分别为0.306 mol.L-1、0.61 mol.L-1、0.92 mol.L-1、1.23mol.L-1、1.31 mol.L-1的条件下,测定反应吸光度随时间的变化关系,以lnA对时间t作图,得到速率常数k,如表3所见。用lnk对ln[H+]作图,得一直线,如图4所示,其斜率为0.53,由此可确定H+的分级数为0.5级。
2.4 表面活性剂对氧化反应的影响
2.4.1 SDS胶束对氧化反应的影响
在环己醇浓度为0.096 mol.L-1,酸浓度为0.61 mol.L-1,高锰酸钾浓度为2.91×10-7mol.L-1和温度为303 K时,SDS表面活性剂对氧化反应的影响如图5所示。

图5 303 K时表面活性剂SDS胶束对反应的影响([C6H6O]:0.096 mol.L-1,[H+]:0.61 mol.L-1,[MnO4-]:2.91×10-7mol.L-1)
由图5可见,表面活性剂SDS胶束对氧化反应有明显的加速作用,SDS溶液中速率常数最大为本体相中速率常数的5.3倍,其原因可能是因为SDS胶束表面带负电荷,对H+有较强的吸附作用,使胶束表面H+浓度显著增加,从而加速反应进行。另外,SDS胶束对环己醇的增溶作用也加速了反应的进行。
2.4.2 Brij35胶束对氧化反应的影响
在环己醇浓度为0.096 mol.L-1,酸浓度为0.61 mol.L-1,高锰酸钾浓度为2.91×10-7mol.L-1和温度为303 K时,Brij35表面活性剂对氧化反应的影响如图6所示。
由图6可见,表面活性剂Brij35对氧化反应有显著的加速作用,Brij35溶液中速率常数最大为本体相中速率常数的7.4倍,其原因可能是Brij35胶束显著的增溶作用加速了反应的进行。因Brij35为非离子表面活性剂,既不与溶液中的H+有吸附或者排斥作用,也不与MnO4-有吸附或者排斥作用,使Brij35对反应的加速作用大于SDS对反应的作用。
2.4.3 CTAB胶束对氧化反应的影响
在环己醇浓度为0.096 mol.L-1,酸浓度为0.61 mol.L-1,高锰酸钾浓度为2.91×10-7mol.L-1和温度为303 K时,CTAB表面活性剂对氧化反应的影响如图7所示。

图6 303 K时表面活性剂Brij35对反应的影响([C6H6O]:0.096 mol.L-1,H+]:0.61 mol.L-1,[MnO4-]:2.91×10-7mol.L-1)

图7 303 K时表面活性剂CTAB对反应的影响([C6H6O]:0.096 mol.L-1,[H+]:0.61 mol.L-1,[MnO4-]:2.91×10-7mol.L-1)
由图7可见,CTAB对氧化反应有强烈的加速作用,CTAB溶液中速率常数最大为本体相中速率常数的15.6倍,其原因可能是因为CTAB为阳离子表面活性剂,其胶束表面的正电荷使高锰酸根负离子在胶束相中的浓度远大于本体相,从而加速了反应的进行。同时,CTAB胶束的增溶作用也加速了反应的进行。由上可知CTAB、SDS与Brij35胶束对氧化反应的加速效果为CTAB>Brij35>SDS,这可能是胶束的静电效应和增溶效应共同作用的结果。
2.5 反应产物的检测
对于环己醇在酸性高锰酸钾溶液中的产物,假设存在环己酮与己二酸两种产物中的一种或者两种,对产物进行检测判定。在室温条件下,把产物分别用傅里叶变换红外质谱仪和气象色谱仪检测,得到图8和图9。由图8可见,分别检测环己醇、环己酮、无水乙醚以及产物的峰值,得出环己酮的峰值为0.452,环己醇的峰值为0.397,产物的峰值为0.391,通过峰值可以排除产物为环己酮的可能性。由图9可知,峰值为3435 cm-1(分子间氢键O-H的伸缩振动)、1638 cm-1(C=O的伸缩振动)、1205 cm-1(C-O的伸缩振动)以及1051 cm-1(羧基上C-OH的弯曲振动),由峰值可以看出产物无其他副产物,主要是羰基或者羧基,与标准的己二酸红外图谱(图10)基本一致,因此,可判断本反应的主要产物为己二酸。
3 结论
在酸性溶液中,高锰酸钾氧化环己醇的反应对环己醇和高锰酸钾均为一级反应,对H+为0.5级反应,反应总级数为2.5级;表面活性剂Brij35、CTAB、SDS对反应均有显著的加速促进作用,其作用大小依次为CTAB>Brij35>SDS,局部浓度效应和静电效应可能是产生加速作用的主要因素。

图8 环己醇氧化后产物的气相色谱

图9 环己醇氧化后产物的红外图谱

图10 己二酸红外图谱
[1]屠庆华.己二酸市场现状及发展分析[J].化学工业,2010,28(3):11-14.
[2]FENDLER J H,FENDLER E J.Catalysis in micdlar and macromolecular systems[M].New York:Academic Press,1975.
[3]张元勤,曾宪诚,余孝其,等.SDS胶束对孔雀绿褪色反应的影响[J].物理化学学报,1998,14(2):147-153.
[4]武汉大学分析化学教研室.化学分析(下)[M].北京:人民教育出版社,1977:152.
[5]印永嘉,奚正楷,张树永,等.物理化学简明教程[M].4版.北京:高等教育出版社,2012:349.
A Research on the Oxidation Reaction of Cyclohexanol in the Acidic Potassium Permanganate
ZHANG Yuɑnwen1,HU Yue2,LIU Fɑn2,ZHANG Yuɑnqin2
(1.Hongya High School of Meishan,Hongya Sichuan 620360;2.School of Chemistry,Leshan Normal University,Leshan Sichuan 614000,China)
The reaction kinetics of the oxidation of cyclohexanol in the acidic potassium permanganate by spectrophotometry was studied in this paper.The observed first order rate constants were determined at different temperatures.The reaction rate and the activation energy of the reaction were obtained.The effects of SDS,CTAB and Brij35 micelles on the reaction were analyzed.And it has turned out that:The experiment results indicate that all of SDS,Brij35 and CTAB surfactants accelerate the oxidation reaction dramatically.The order of acceleration is CTAB>Brij35>SDS.The effect of surfactants on the oxidation reaction is a net effect from electrostatic effect and local concentration effect.
Cyclohexanol;Absorbance;Micelle;Activation Energy;Reaction Order
0643.1
A
1009-8666(2017)04-0028-06
10.16069/j.cnki.51-1610/g4.2017.04.006
[责任编辑、校对:李书华]
2017-03-15
张元文(1966—),男,四川仁寿人。眉山市洪雅中学教师,研究方向:高中化学。
张元勤(1963—),男,四川仁寿人。乐山师范学院化学学院教授,研究方向:表面活性剂物理化学。

