纤维产品经微生物发酵前后的营养价值研究
李慧芬,马成
(青岛根源生物技术集团有限公司,山东青岛266061)
根源生物技术专栏
纤维产品经微生物发酵前后的营养价值研究
李慧芬,马成
(青岛根源生物技术集团有限公司,山东青岛266061)
为研究纤维产品经微生物发酵前后的营养价值,本文在每千克麸皮中添加5 g自制酵解剂,制备了一种纤维酵解产品,即产品-1。产品-1室温存放3个月,即为产品-2。产品-3为市售纤维酵解产品,与产品-1成分类似。对产品1、2和3进行系列指标测定,以对纤维产品发酵前后的营养价值与稳定性进行研究。结果表明:产品-1与原料相比,粗蛋白质与小肽含量分别提高11.8%和3.6倍,相较于产品-3也都显著提高(P<0.05);pH降低26.2%,相较于产品-3也显著降低(P<0.05);还原糖、L-乳酸、VFA含量分别提高3.1倍、49倍、2.9倍,乳酸菌、酵母菌、芽孢菌菌量分别提高164614倍、100000倍、177倍,相较于产品-3也都显著提高(P<0.05);霉菌降解100%,黄曲霉毒素B1、呕吐毒素、玉米赤霉烯酮含量分别降低68.4%、76.8%、44%,粗纤维、酸性洗涤纤维、中性洗涤纤维含量分别降低19.6%、13.3%、13.6%,与产品-3相比,有降低的趋势。产品-2与产品-1相比,粗纤维、中性洗涤纤维与酸性洗涤纤维含量无显著差异(P>0.05),粗蛋白质、挥发性脂肪酸(VFA)含量随微生物分解作用显著提升(P<0.05),pH显著降低(P<0.05),还原糖作为底物被微生物消耗而显著下降(P<0.05),乳酸菌、酵母菌、芽孢菌菌量因菌体死亡而显著降低(P<0.05),霉菌因环境污染显著增加(P<0.05),毒素中黄曲霉毒素、呕吐毒素、玉米赤霉烯酮含量无显著差异(P>0.05)。
纤维酵解产品;纤维指标;微生物指标;毒素指标
纤维具有润便、治疗肥胖、调节血糖、降低血胆固醇水平、预防高血压等作用(刘成梅等,2003;谢碧霞等,2003)。麸皮的主要成分是粗纤维,包括纤维素、半纤维素、多戊糖及镶嵌物质等,而粗纤维不容易被动物吸收利用,且多含有各种毒素,因而限制了麸皮在饲料中的应用(陈凤莲等,2005)。
传统的纤维制备工艺是以小麦麸皮为原料,采用酶-化学法或单纯的酶法来制备,用酶法和化学法制备的工艺比较简单,成本也低廉,但是反复水浸泡冲洗和频繁热处理会明显减少纤维产品的持水力和溶胀性,且溶剂处理导致几乎100%水溶性纤维素、50%~60%半纤维素和10%~30%纤维素被溶解而损失。而采用发酵剂发酵膳食纤维,条件温和且具有很强的连续性,能够使得整个工艺过程的损耗率大大降低,对环境污染较小。发酵中采用的菌种均为纯菌,此合成工艺简单,具有一定的工业应用前景。
本研究对纤维产品麸皮微生物发酵前后的营养价值进行对比研究,探讨发酵前后粗蛋白质、小肽等蛋白质相关指标,还原糖指标,pH,L-乳酸、总挥发性脂肪酸(VFA)等酸指标,粗纤维、中性洗涤纤维与酸性洗涤纤维等纤维指标,乳酸菌、酵母菌、芽孢菌、霉菌等微生物指标,黄曲霉毒素、呕吐毒素、玉米赤霉烯酮等毒素指标的变化,以及产品存放3个月后是否稳定,为纤维酵解产品在饲料中的开发利用提供参考。
1 材料与方法
1.1 试验材料
1.1.1 供试发酵剂纤维发酵剂(GY fiber fermentation agent),主要成分是:高活性复合乳酸菌、酵母菌、芽孢杆菌及增值培养基,活菌总数≥5×108cfu/g。该产品由根源研发中心固体发酵实验室提供。
1.1.2 供试麸皮济宁细麸皮。
1.2 试验地点根源研发中心固体发酵实验室。1.3试验方案1000 kg麸皮+5 kg麸皮发酵剂+ 420 kg水,水温控制为35~40℃,搅拌机内混合均匀后,分装于干净双层密封袋内,25 kg/袋,37℃恒温厌氧发酵72 h,60℃烘干后粉碎,制备纤维酵解产品,即为产品-1。产品-1室温存放3月,即为产品-2。产品-3来自海阳,为市售纤维酵解产品,主要成分是:发酵麸皮、乳酸菌、酵母菌、芽孢菌等。对供试产品1、2和3进行系列指标测定与比较,以对纤维产品经微生物发酵前后的营养价值与稳定性进行研究。
1.4 测定项目及方法
1.4.1 蛋白质与小肽指标粗蛋白质:按照国标饲料中粗蛋白质测定方法(GBT 6432-94),采用凯氏定氮法测定。
小肽:按照国标大豆肽粉测定方法(GBT 22492-2008),采用三氯乙酸TCA-凯氏定氮法测定。
1.4.2 pH与还原糖指标pH:取10 g样品(精确到0.001 g),加50mL蒸馏水,混合后静置15min,用PHS-3C型pH计测定。
还原糖:样品离心,取上清液,将其稀释至相应倍数,取待测液2.0mL加2.0mL的DNS试剂充分摇匀,置沸水浴中煮沸10min。迅速冷却至室温,蒸馏水定容至15mL,充分混匀。用水作空白对照,在550 nm波长下测其吸光度。控制吸光度在0.2~0.3。计算其还原糖总量,根据试验中酶添加量的不同,各添加梯度的还原糖总量减去空白组的还原糖量为还原糖增量。计算公式如下:
C/(mg/mL)=(AX+B)×N/M×N1;
式中:AX+B为葡萄糖标曲mg;N为测定时稀释倍数;M为饲料绝干物质质量,g;N1为体外酶解液总体积,mL;
1.4.3 酸相关指标L-乳酸:取1 g样品(精确到0.001 g),加水100 mL,常温磁力搅拌1 h,10000 r/min离心10min,取上清,利用SBA生物传感器,测定L-乳酸含量。
VFA:挥发性短链脂肪酸,利用气象色谱(FPLC),分别测定乙酸、丙酸、丁酸、异丁酸、戊酸、异戊酸含量,这些酸的总和为总VFA。
1.4.4 微生物相关指标乳酸菌:按照企标-益生源嗜酸乳杆菌企业标准Q/370783YSY 013-2014,采用倾注法,利用MRS培养基测定。
酵母菌:按照企标-益生源酿酒酵母企业标准Q/370783YSY 014-2014,采用涂布法,利用YPD培养基测定。
芽孢菌:按照国标-饲用微生物制剂中枯草芽孢杆菌的检测GBT 26428-2010,采用涂布法,利用NA培养基测定。
霉菌:按照国标-食品安全国家标准、食品微生物学检验、霉菌和酵母计数标准GBT 4789.15-2010,采用倾注法,利用孟加拉红培养基测定。
1.4.5 毒素相关指标黄曲霉毒素B1:按照国标-饲料中黄曲霉毒素B1的测定标准,采用酶联免疫吸附法GBT 17480-2008(采用华安麦科96TELISA试剂盒),测定黄曲霉毒素B1含量。
呕吐毒素:按照国标-饲料中呕吐毒素的测定标准,采用酶联免疫吸附法GBT 17480-2008(上海ROMER 96TELISA试剂盒),测定呕吐毒素含量。
玉米赤霉烯酮:按照国标-谷物中玉米赤霉烯酮的测定标准,采用酶联免疫吸附法GB/T 5009.209-2008(采用上海ROMER 96T ELISA试剂盒),测定玉米赤霉烯酮含量。
1.4.6 纤维素相关指标粗纤维:按照国标-饲料中粗纤维含量测定GBT 6434-2006,参照山农发明专利201510093918.X和201510096780.9,采用特殊材料制作的筛网袋测定粗纤维。
中性洗涤纤维:按照国标-饲料中中性洗涤纤维的测定GBT 20806-2006,参照山农发明专利201510093918.X和201510096780.9,采用特殊材料制作的筛网袋测定中性洗涤纤维。
酸性洗涤纤维:按照国标-饲料中酸性洗涤纤维的测定NYT 1459-2007,参照山农发明专利201510093918.X和201510096780.9,采用特殊材料制作的筛网袋测定酸性洗涤纤维。
1.5 数据统计分析所有指标测定3个重复,试验结果均采用“平均值±标准误”表示。利用SPSS 16.0统计软件,对试验数据进行差异显著性分析,显著性水平为P<0.05。
2 结果及分析
2.1 粗蛋白质与小肽指标比较图1显示,经微生物发酵制备的纤维酵解产品-1与原料相比,粗蛋白质与小肽含量分别显著提升11.8%和3.6倍(P<0.05),也都显著高于产品-3(P<0.05)。室温存放过程中,水分逐渐减少,产品-2的粗蛋白质含量在3个月后,显著高于产品-1(P<0.05)。室温存放过程中,小肽类营养物质逐渐被残存的微生物消耗利用,3个月后,产品-2的小肽含量显著低于产品-1(P<0.05)。

图1 膳食纤维发酵前后粗蛋白质与小肽含量比较
2.2 pH与还原糖指标比较纤维产品发酵前后pH与还原糖含量比较结果如图2所示。结果表明,经微生物发酵制备的膳食纤维产品-1,pH降低26.2%,显著低于原料产品-3(P<0.05)。室温存放过程中,残存微生物持续发酵导致酸不断产生,pH逐渐降低,3个月后,产品-2的pH显著低于产品-1(P<0.05)。经微生物发酵制备的膳食纤维产品-1,还原糖提升3.1倍,显著高于原料产品-3(P<0.05)。室温存放过程中,还原糖类营养物质逐渐被残存的微生物消耗利用,3个月后,产品-2的还原糖含量显著低于产品-1(P<0.05)。

图2 膳食纤维发酵前后pH与还原糖含量比较
2.3 酸相关指标比较纤维产品发酵前后L-乳酸与VFA含量比较结果如图3所示。结果表明,经微生物发酵制备的膳食纤维产品-1,L-乳酸含量提升49倍,显著低高于原料产品-3(P<0.05)。室温存放过程中,产品-2的L-乳酸却并未持续增加,而是减少,并与产品-1的差异达到显著水平(P<0.05)。此外,经微生物发酵制备的膳食纤维产品-1,VFA含量提升2.9倍,显著高于原料(P<0.05),也显著高于产品-3(P<0.05)。室温存放过程中,残存微生物持续发酵导致酸不断产生,总酸逐渐升高,3个月后,产品-2的总VFA含量显著高于产品-1(P<0.05)。

图3 膳食纤维发酵前后L-乳酸与VFA含量比较
2.4 微生物相关指标比较纤维产品发酵前后乳酸菌菌量比较结果如图4所示。结果表明,经微生物发酵制备的膳食纤维产品-1,乳酸菌菌量提升164614倍,显著高于原料(P<0.05),也显著高于产品-3(P<0.05)。室温存放过程中,乳酸菌部分死亡,3个月后,产品-2的乳酸菌菌量显著低于产品-1(P<0.05)。
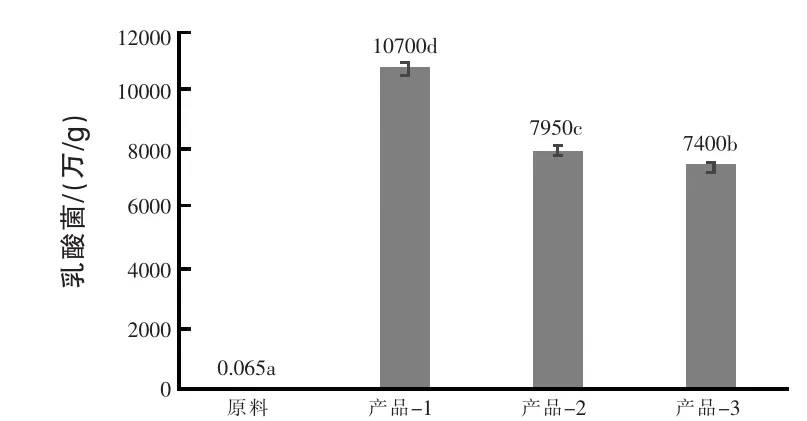
图4 膳食纤维发酵前后乳酸菌菌量比较
纤维产品发酵前后酵母菌菌量比较结果如图5所示。结果表明,经微生物发酵制备的膳食纤维产品-1,酵母菌菌量提升100000倍,显著高于原料(P<0.05),也显著高于产品-3(P<0.05)。室温存放过程中,残存氧气逐渐耗尽,兼性好氧的酵母菌大量死亡,3个月后,产品-2的酵母菌菌量显著低于产品-1(P<0.05)。

图5 膳食纤维发酵前后酵母菌菌量比较
纤维产品发酵前后芽孢菌菌量比较结果如图6所示。结果表明,经微生物发酵制备的膳食纤维产品-1,芽孢菌菌量提升177倍,显著高于原料(P<0.05),也显著高于产品-3(P<0.05)。室温存放过程中,部分芽孢萌发为营养体,但密封环境中氧气缺失,不利于芽孢菌生长,菌体逐渐死亡,3个月后,产品-2的芽孢菌菌量显著低于产品-1(P<0.05)。

图6 膳食纤维发酵前后芽孢菌菌量比较
纤维产品发酵前后霉菌菌量比较结果如图7所示。结果表明,经微生物发酵制备的膳食纤维产品-1,霉菌降解率达100%,霉菌含量显著低于原料(P<0.05),也显著低于产品-3(P<0.05)。室温存放过程中,发酵袋可能被环境中的霉菌孢子污染,霉菌菌量逐渐增长,3个月后,产品-2的霉菌菌量显著高于产品-1(P<0.05),显著低于原料与产品-3(P<0.05)。

图7 膳食纤维发酵前后霉菌菌量比较
2.5 毒素相关指标比较纤维产品发酵前后黄曲霉毒素B1含量比较结果如图8所示。结果表明,经微生物发酵制备的膳食纤维产品-1,黄曲霉毒素B1含量降低68.4%,显著低于原料(P<0.05),也显著低于产品-3(P<0.05)。室温存放3个月后,产品-2黄曲霉毒素B1含量与产品-1无显著差异(P>0.05)。

图8 膳食纤维发酵前后黄曲霉毒素B1含量比较
纤维产品发酵前后呕吐毒素含量比较结果如图9所示。结果表明,经微生物发酵制备的膳食纤维产品-1,呕吐毒素含量降低76.8%,显著低于原料(P<0.05),也显著低于产品-3(P<0.05)。室温存放过程中,产品-2的呕吐毒素含量与产品-1无显著差异(P<0.05)。

图9 膳食纤维发酵前后呕吐毒素含量比较
纤维产品发酵前后玉米赤霉烯酮含量比较结果如图10所示。结果表明,经微生物发酵制备的膳食纤维产品-1,玉米赤霉烯酮含量降低44%,低于原料但无显著差异(P>0.05),但显著低于产品-3(P<0.05)。室温存放3个月后,产品-2的玉米赤霉烯酮含量与产品-1无显著差异(P>0.05)。

图10 膳食纤维发酵前后玉米赤霉烯酮含量比较
2.6 纤维素相关指标比较纤维产品发酵前后纤维含量比较结果如图11所示。结果表明,经微生物发酵制备的膳食纤维产品-1,粗纤维含量降低19.6%,显著低于原料(P<0.05),但与产品-3无显著差异(P>0.05)。室温存放3个月后,产品-2的粗纤维含量比产品-1略有降低,但无显著差异(P>0.05)。经微生物发酵制备的膳食纤维产品-1,酸性洗涤纤维含量降低13.3%,显著低于原料(P<0.05),也显著低于产品-3(P<0.05)。室温存放3个月后,产品-2的酸性洗涤纤维含量比产品-1略有升高,但无显著差异(P>0.05)。经微生物发酵制备的膳食纤维产品-1,中性洗涤纤维含量降低13.6%,显著低于原料(P<0.05),但与产品-3无显著差异(P>0.05)。室温存放3个月后,产品-2的中性洗涤纤维含量比产品-1略有降低,但无显著差异(P>0.05)。

图11 膳食纤维发酵前后纤维含量比较
3 讨论与结论
研究表明,微生物发酵纤维饲料原料制备的纤维酵解产品,可显著提高产品中粗蛋白质含量(杨旭等,2011;陈烘伟,2011;王立克等,2002)。小肽含量的显著提高,与大分子蛋白类物质被微生物降解有关。但小肽又是容易被利用的营养物质,在产品存放过程中,残留微生物会优先利用,而导致该指标有所降低。
微生物发酵底物,可降低粗纤维、中性洗涤纤维、酸性洗涤纤维含量,释放还原糖,并可进一步分解为挥发性短链脂肪酸(VFA)与L-乳酸,从而产品pH显著降低,pH值低利于抑制杂菌的污染(王冬冬,2012;赵欣,2008)。微生物发酵制备纤维酵解产品的过程中,水分、温度与氧气环境合适,在长达72 h的持续恒温发酵中,乳酸菌、芽孢菌、酵母菌等益生菌不断繁殖,竞争了霉菌等有害菌的养分,并产生了抑制杂菌的乳酸菌素、细菌素等,且体系pH较低,这些都有利于抑制霉菌孢子的萌发,导致霉菌含量显著降低。然而,在产品保存过程中,仍需严格控制保存环境,保证低温、干燥,否则会引起霉菌污染。
本研究结果表明,经微生物发酵制备的纤维酵解产品-1、市售产品-3与原料相比,粗蛋白质与小肽含量显著提高,pH显著降低,还原糖、L-乳酸、VFA含量显著提高,微生物指标含量也显著提高,霉菌降解100%,毒素和纤维含量显著降低,但均以产品-1效果最好。产品-2与产品-1相比,纤维含量无显著差异,粗蛋白质、VFA等含量随微生物分解作用显著提升,pH显著降低,而还原糖作为底物被微生物消耗而显著下降,微生物指标因菌体死亡而显著减少,霉菌因环境污染显著增加,毒素含量中黄曲霉毒素、呕吐毒素、玉米赤霉烯酮无显著差异。
[1]陈凤莲,方桂珍,胡波.黑龙江地区小麦麸皮化学组成分析哈尔滨商业大学学报[J].2005,21(4):464~466.
[2]陈洪伟,叶淑红,王际辉,等.混菌固态发酵麸皮制备蛋白饲料的研究[J].中国酿造,2011,6:74~77.
[3]丁宏标,蔡辉益,陈露.中国饲料生物技术研究进展及发展方向[J].中国家禽,2001,10:2.
[4]刘成梅,李资玲,梁瑞红,等膳食纤维的国内外研究现状与发展趋势[J].粮食与食品工业,2003,4:25~27.
[5]王冬冬.酶解纤维质原料发酵生产L-乳酸:[硕士学位论文][D].河南洛阳:河南科技大学,2012.
[6]王立克,戴四发,孙福军.生物发酵对小麦麸皮营养成分的影响[J].安徽技术师范学院学报,2002,3:31~33.
[7]谢碧霞,李安平.膳食纤维[M].北京:科学出版社,2006.1~50.
[8]杨旭,薛永亮,李浪.微生物混合发酵提高麸皮营养价值的研究[J].中国酿造,2011,3:113~115.
[9]赵欣.干酪乳杆菌WT-8发酵小麦麸皮生产乳酸的研究及应用:[硕士学位论文][D].天津:天津科技大学,2008.
This experimentwas conducted to study the nutritive value of fiber products and its fiber glycolysis product. The product-1 was the product of bran fermentation,and room temperature storage product-1 for 3 months,which was the product-2.Product-3 was the commercialglycolysis fiber products,its composition was similar to product-1.Series of indicators of produt-1,2 and 3 weremeasured.The results showed that:compared with raw materials,the crude protein and small peptide of product-1 increased by 11.8%and 3.6 times,and also significantly improved compared with the product-3(P<0.05);pH reduced by 26.2%,and also significantly reduced compared with the product-3(P<0.05);the contentof sugar,L-lactic acid,volatile fatly acid(VFA),Lactobacillus,Saccharomycetes,Spore bacteria were increased by 3.1 times,49 times,2.9 times,164614 times,100000 times respectively,and also significantly improved compared with the product-3(P<0.05);mold degradation of 100%,aflatoxin,vomitoxin,zearalenone,crude fiber(CF),acid detergent fiber(ADF),neutral detergent fiber(NDF)were reduced by 68.4%,76.8%,44%,19.6%,13.3%,13.6%respectively,and had a tendency to reduce compared with the product-3.Compared with product-1,no significantdifference appeared in CF,NDF,ADF of product-2,while crude protein,VFA significantly raised alongwithmicrobiological degradation(P<0.05),pH decreased obviously(P<0.05),the contentof sugar reduced significantly when used as the substrate bymicroorganism(P<0.05),microorganism such as Lactobacillus,Saccharomycetes,Spore bacteria reduced remarkably because of thallus death(P<0.05),mycete increased observably on accountofenvironmental pollution(P<0.05).Among all the toxin index,therewere no significantdifference emerged inaflatoxin,vomitoxin and zearalenone(P>0.05).
fiber glycolysis product;fiber index;microorganism index;toxin index
S816.3
A
1004-3314(2017)06-0039-05
10.15906/j.cnki.cn11-2975/s.20170609

