分散固相萃取-分散液液微萃取结合气相色谱-三重四极杆质谱法测定茶叶中7种拟除虫菊酯类农药残留
孙梦园,石志红,李建勋,吴兴强,胡雪艳,张博伦,范春林*
(1.河北大学 化学与环境科学学院,河北 保定 071002;2.中国检验检疫科学研究院,北京 100176;3.北京工商大学 食品学院,北京 100048)
分散固相萃取-分散液液微萃取结合气相色谱-三重四极杆质谱法测定茶叶中7种拟除虫菊酯类农药残留
孙梦园1,2,石志红1*,李建勋2,3,吴兴强1,2,胡雪艳2,张博伦2,3,范春林2*
(1.河北大学 化学与环境科学学院,河北 保定 071002;2.中国检验检疫科学研究院,北京 100176;3.北京工商大学 食品学院,北京 100048)
将分散固相萃取和分散液液微萃取(d-SPE-DLLME)相结合,并与气相色谱-三重四极杆质谱(GC-MS/MS)联用,建立了快速测定茶叶中7种拟除虫菊酯类农药残留的方法。样品经乙腈提取,N-丙基乙二胺(PSA)和多壁碳纳米管(MWCNTs)净化,四氯化碳(CCl4)浓缩萃取后,采用GC-MS/MS进行分析。以全发酵红茶为基质,考察了提取剂种类、萃取剂的种类和体积、分散剂体积以及萃取时间对萃取效率的影响。以乙腈为提取剂进行分散固相萃取,在进行分散液液微萃取时,以200 μL CCl4为萃取剂,1 mL乙腈为分散剂,萃取时间为1 min。结果表明,7种拟除虫菊酯类农药在10~500 μg/kg浓度范围内线性关系良好,定量下限为1.0~10.0 μg/kg。7种农药在4种茶叶(红茶、绿茶、乌龙茶和黑茶)中4个添加水平下的平均回收率为75.4%~113.6%,相对标准偏差(RSD,n=5)不大于8.8%。该方法具有简单、快速、成本低、检出限低的特点。应用所建立的方法对12种市售茶叶样品进行检测,结果满意。
分散固相萃取;分散液液微萃取;气相色谱-三重四极杆质谱;农药残留;茶叶
茶以其气味芳香、有益于身体健康的特点,成为全球最受欢迎的饮品之一。研究表明,茶能够改善人体骨骼健康、减少肥胖、预防心血管疾病[1]。然而在茶叶种植和储藏过程中,广泛使用了各种农药。拟除虫菊酯类农药(Pyrethroid pesticides)具有广谱、低毒、高效、生物降解快、对农作物安全等特点,因此被广泛地应用于农业害虫防治中。拟除虫菊酯类农药与其他类农药相比毒性较低,但长期接触会对哺乳动物的神经、生殖及免疫系统产生危害[2-4]。国内外对茶叶中拟除虫菊酯残留量有严格的限制,例如中国国家标准(GB 2763-2014)规定茶叶中拟除虫菊酯类农药的最大残留限量(MRL)为1~20 mg/kg,欧盟的MRL为0.01~5 mg/kg。
目前测定拟除虫菊酯类农药残留量的主要方法有气相色谱法(GC-ECD)[5-6]、高效液相色谱法(HPLC/DAD)[7]及其质谱联用法(MS)[8-9]等。由于茶叶基体成分复杂并且拟除虫菊酯类农药在食品中的残留量相对较低,为了得到较为准确的检测结果,样品的前处理过程尤为关键。到目前为止,样品的前处理技术主要有固相萃取(SPE)[10]、固相微萃取(SPME)[11]、液液萃取(LLE)[12]、微波辅助萃取(MAE)[13]和搅拌棒吸附提取(SBSE)[14]。近年来,简单、高效、低成本已成为样品预处理方法的发展趋势。分散固相萃取(Dispersive solid-phase extraction,d-SPE)是由美国农业部[15]开发的一种样品净化前处理方法,将吸附剂直接加入到含目标分析物的样品溶液中,无需净化柱和其它设备就能达到较好的净化效果,方法简单、快速、低耗。分散液液微萃取(Dispersive liquid-liquid microextraction,DLLME)是Rezaee等[16]提出的一种微萃取技术。该技术通过向水中加入微量萃取剂和分散剂,形成乳浊液,分析物从样品溶液转移到有机相微滴中,离心分层即可实现对农药的富集,是一种操作简单、速度快、成本低、有机溶剂用量少、富集效率高的前处理方法。
Petrarca等[17]通过对比d-SPE和DLLME两种前处理方法,发现d-SPE能有效去除基质共提物,基质效应较低,但不包含富集过程,灵敏度较差;DLLME富集效果好,有较低的检出限和定量下限,但对于复杂基质由于共提取物的存在,受背景干扰严重,而且会对系统造成污染,增加维护成本,目前仅应用于简单基质中目标物的检测。因此,本文综合考虑两种技术的优缺点,将d-SPE和DLLME两种方法相结合,d-SPE净化去除色素和杂质后,经DLLME富集分析物以提高方法灵敏度,采用气相色谱-三重四极杆质谱法(GC-MS/MS)测定茶叶中7种拟除虫菊酯类农药残留,取得了较好的效果。
1 实验部分
1.1 仪器与试剂
Agilent 7890A-7000气相色谱-三重四极杆质谱仪(美国Agilent公司),配置7693自动液体进样器;KDC-40低速离心机(中国中佳公司);3-30K 高速冷冻离心机(德国Sigma 公司);N-EVAP 112氮吹浓缩仪(美国Organomation Associates 公司);SR-2DS水平振荡器(日本Taitec公司);Milli-Q超纯水机(美国Millipore公司);PL602-L电子天平(瑞士Mettler-Toledo公司);MX-S涡旋搅拌器(美国Scilogex公司)。
联苯菊酯、甲氰菊酯、高效氯氟氰菊酯、氯菊酯、氟氰戊菊酯、氰戊菊酯和溴氰菊酯7种标准品:纯度≥95%(德国Dr.Ehrenstorfer公司);内标:磷酸三苯酯,TPP(德国Dr.Ehrenstorfer公司);乙腈、甲醇和正己烷均为色谱纯(美国Honeywell公司);四氯化碳、三氯甲烷、氯苯、溴苯均为分析纯(天津市大茂化学试剂厂);冰醋酸、硫酸镁和氯化钠均为分析纯(广东西陇化工股份有限公司);多壁碳纳米管(MWCNTs)和乙二胺-N-丙基硅烷(PSA)(天津Bonna-Agela公司)。茶叶购于北京当地超市。
1.2 实验方法
1.2.1 色谱-质谱条件 色谱柱:Agilent DB-1701(30 m×250 μm×0.25 μm);恒流模式:流速为1.2 mL/min;载气:氦气,99.999%;柱温:初始温度100 ℃保持2 min,以30 ℃/min升至250 ℃,继而以5 ℃/min升至280 ℃,保持5 min,再以20 ℃/min升至300 ℃,保持2 min;进样口温度:250 ℃;进样量:1 μL;进样方式:不分流进样;溶剂延迟:6 min;EI离子源温度:230 ℃;EI源能量:70 eV;传输线温度:280 ℃;四极杆温度:150 ℃;碰撞气:高纯氮,99.999%;扫描模式:多重反应监测(MRM)模式。
1.2.2 标准溶液的配制 单标和混标储备液:准确称取约10 mg标准品于10 mL棕色容量瓶,根据溶解性,用甲醇或丙酮溶解并定容,得到单标溶液。根据单标浓度计算量取体积,配制成10 mg/L混标溶液。根据相应的检测水平,用甲醇逐级稀释至所需浓度。所有标准溶液均于4 ℃避光保存。
TPP内标溶液:用甲醇配成1 mg/L,4 ℃避光保存。
1.2.3 农药化合物MRM方法的建立 2 mg/L单标溶液在50~550m/z范围内运行MS1全扫描模式,根据所得到的化合物色谱图和全扫描谱图,确定其保留时间和丰度较高、质荷比较大的特征离子,作为MRM方法的前级离子。根据所得到的前级离子建立子离子扫描模式,碰撞电压在5~40 eV之间,每隔5 eV进行一次碰撞,比较在不同碰撞能量下所得到的扫描图,选出两个丰度较高的特征产物离子作为MRM方法的子离子。选择丰度较高的子离子用于定量分析,另一子离子用于定性分析。

图1 7种拟除虫菊酯混合标准溶液(2 mg/L)的总离子流图(TIC)Fig.1 Total ion chromatogram(TIC) of 7 pyrethoid pesticides standard solution(2 mg/L)1.bifenthrin;2.fenpropathrin;3.λ-cyhalothrin;4.permethrin;5.flucythrinate;6.fenvalerate;7.deltamethrin
1.2.4 分散固相萃取-分散液液微萃取 称取2.0 g茶叶研磨粉末于50 mL聚丙烯离心管中,加入100 μL TPP(IS)和4 mL超纯水,静置30 min。加入10 mL乙腈提取剂,水平振荡5 min后,再加入4 g无水MgSO4和1 g NaCl,加盖迅速混匀,于4 200 r/min下离心5 min。取3 mL上清液于15 mL含45 mg MWCNTs和75 mg PSA吸附剂的聚丙烯离心管中,涡旋后于8 000 r/min下离心5 min。取1 mL上清液于15 mL离心管,加入200 μL CCl4,涡旋混匀后加入4 mL超纯水,水平振荡1 min,形成均匀的乳浊液,于8 000 r/min下离心5 min使之分层。用微量注射器量取100 μL底层沉积相转移到2 mL进样小瓶,氮气吹干,用100 μL正己烷定容,过0.22 μm有机膜,供GC-MS/MS检测。
2 结果与讨论
实验选用7 种拟除虫菊酯类农药作为前处理技术开发的研究对象。基质选择含有茶多酚、茶色素、生物碱和氨基酸等多种干扰物质的全发酵红茶基质。通过对红茶中7种农药前处理条件的摸索,优化得到最佳前处理方法。7种农药的保留时间和离子对信息见表1,总离子流图(TIC)见图1。

表1 7种拟除虫菊酯类农药的保留时间(RT)、离子对信息、碰撞能(CE)、线性范围、线性方程、相关系数(r2)、检出限及定量下限Table 1 Retention time(RT),ion pair information,collision energy(CE),linear ranges,linear equations,correlation coefficients(r2),limits of detections(LODs)and limits of quantitation(LOQs) for 7 pyrethroid pesticides
2.1 分散固相萃取中提取剂的优化
对提取剂的种类进行考察。在红茶基质中添加100 μg/kg拟除虫菊酯农药,分别比较甲醇、丙酮、乙腈和1%醋酸乙腈溶液对7种农药的提取效果。结果发现,采用丙酮提取时,共提取物中的色素杂质含量较多,会对仪器造成污染。而采用乙腈提取时效果最好。因此本实验选取乙腈为最佳提取剂。
2.2 分散液液微萃取中萃取剂的优化
在DLLME中,萃取剂的选择直接影响萃取效率。萃取剂需满足:在水中溶解度较小;与分散剂有较好的混溶性;对目标分析物的萃取能力好[16]。本实验以内标法计算的回收率为指标,对萃取剂的种类进行考察,分别比较了三氯甲烷、氯苯、溴苯和四氯化碳对7种拟除虫菊酯的萃取效果。结果显示,使用四氯化碳的萃取效率最好,其对7种农药的萃取回收为78%~92%,而三氯甲烷、氯苯、溴苯3种溶剂对7种农药的萃取回收率均低于60%。因此本实验最终选择四氯化碳为萃取剂。
进一步比较了不同体积四氯化碳对萃取结果的影响,采用d-SPE净化乙腈提取液后,1 mL乙腈作为分散剂,分别加入不同体积(150,200,250,300 μL)四氯化碳萃取剂,对7种拟除虫菊酯进行萃取实验。结果显示,萃取剂体积从150 μL增至200 μL时,萃取效率升高,继续增大萃取剂体积,萃取效率逐渐降低,这是由于离心沉积相体积会随着萃取剂体积的增大而增大,最终导致富集倍数的降低。因此本实验选择四氯化碳萃取剂的最佳体积为200 μL。
2.3 分散液液微萃取中分散剂的优化
分散剂应在萃取剂和样品溶液中均具有较好的溶解性,以使萃取剂呈微小的液滴均匀分散在样品溶液中,充分接触分析物[18]。由于乙腈与水互溶,并与CCl4有较好的混溶性,因此本实验采用乙腈作为DLLME的分散剂。考虑到分散剂体积不仅会影响到萃取效率,同时也会改变农药的含量,比较了不同体积分散剂对农药的萃取情况。d-SPE净化离心后,取0.5mL乙腈提取液,分别加入0,0.5,1.0,1.5 mL乙腈纯溶剂。结果显示,分散剂体积为1 mL时萃取效果最好。这是因为分散剂较少时,萃取剂在水溶液中分散不均匀,不能形成很好的乳浊液体系,分析物不能快速有效地转移到萃取剂中,造成萃取效率降低;分散剂较多时,萃取剂和分析物在样品溶液中的溶解度增大,不易被萃取剂萃取,同样使萃取效率降低。因此本实验选择分散剂的最佳体积为1 mL。
2.4 萃取时间的优化
本实验考察了在水平振荡器上振荡不同时间(1,2,3,4 min)的萃取效率。结果显示,不同萃取时间对萃取效率无明显影响。这是因为在分散剂作用下,萃取剂能迅速以细小液滴均匀地分散在样品溶液中,极大地增大了萃取剂与分析物的接触面积,从而可在短时间内达到萃取平衡。为了节省时间,本实验选取最佳萃取时间为1 min。
2.5 基质效应
基质效应是指基质中的共提取干扰物影响目标化合物的离子化,从而使化合物在仪器上的响应发生增强或抑制,最终影响定量结果,因此需对目标化合物在不同基质中的基质效应进行评价,并选择适合的方法抵消基质效应。本文通过测定一系列不同浓度(1,2,5,10,50,100,500 μg/kg)的基质标准溶液和相对应的溶剂标准溶液,分别建立标准曲线,比较两条标准曲线的差异,从而判断基质效应。计算公式如下:基质效应=(基质匹配标准曲线斜率/溶剂标准曲线斜率-1)×100%[19]。通过计算发现,4种茶叶基质中高效氯氟氰菊酯表现为弱基质抑制效应,其余6种农药均表现为基质增强效应,其中以联苯菊酯的基质增强效应最为明显,达130%以上(见表2)。为抵消基质效应影响,本实验选择基质匹配标准曲线对样品进行定量分析。

表2 7种拟除虫菊酯农药在4种茶叶基质中的基质效应(%)Table 2 Matrix effects of seven pyrethroid pesticides in 4 kinds of tea matrixes(%)
2.6 线性范围、检出限与定量下限
以红茶空白样品制备含量为1,2,5,10,50,100,500 μg/kg的基质标准样品,在优化后的色谱-质谱条件下进行测定。7种拟除虫菊酯类农药的线性系数(r2)为0.999 1~0.999 9,方法的线性关系良好。以3倍信噪比计算检出限,以线性最小添加水平为定量下限,7种拟除虫菊酯类农药的检出限为0.1~3.0 μg/kg,方法定量下限为1.0~10.0 μg/kg(见表1)。结果表明,该方法的富集效果好、灵敏度高,适用于茶叶基质中拟除虫菊酯类农药残留的检测,能满足各国农药残留限量标准的检测要求。
2.7 回收率与精密度
在红茶、绿茶、乌龙茶和黑茶空白样品中做加标回收率实验,添加水平分别为5,10,50,100 μg/kg,每个浓度做5个平行,回收率及精密度数据见表3。4个添加水平下,7种农药的平均回收率分别为78.3%~109.4%,82.7%~111.8%,75.4%~113.6%和82.6%~107.1%,相对标准偏差(RSD)不大于8.8%,方法的准确度和精确度均能达到满意的结果,能够对实际样品中的7种拟除虫菊酯类农药进行准确定量。
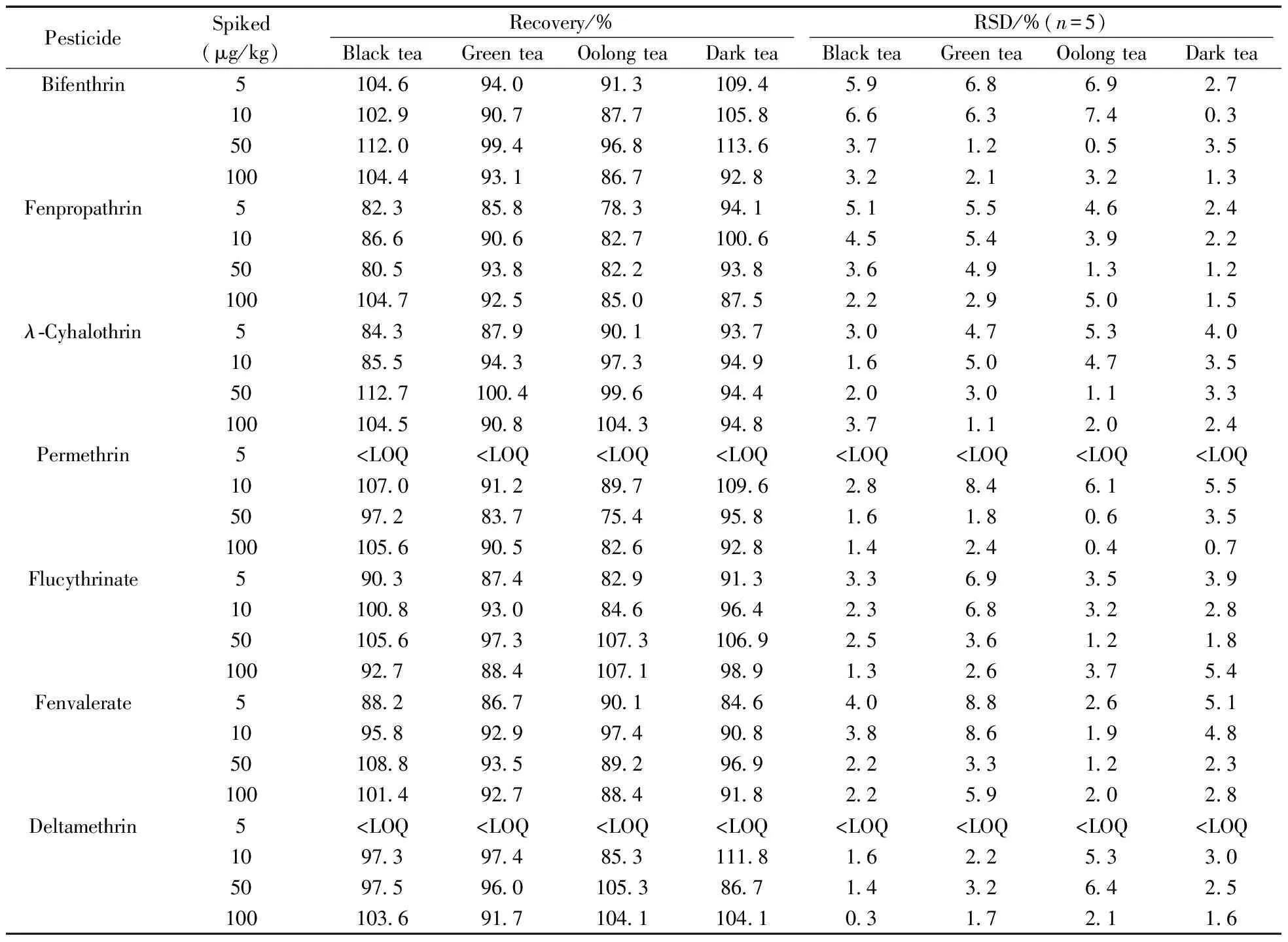
表3 4种茶叶中7种拟除虫菊酯的回收率及相对标准偏差(n=5)Table 3 Recoveries and relative standard deviations(RSD)of 7 pyrethroid pesticides spiked in 4 kinds of tea(n=5)
2.8 实际样品的测定
随机抽取本地区12例市售茶叶样品,包括3种红茶、5种绿茶、2种乌龙茶和2种黑茶,利用本方法对其进行分析测定。样品中检出联苯菊酯、甲氰菊酯、高效氯氟氰菊酯、氯菊酯和溴氰菊酯5种农药,共检出17频次。其中绿茶2号样品检出农药种类多并且含量高,联苯菊酯、甲氰菊酯、高效氯氟氰菊酯和溴氰菊酯的含量分别为29.1,38.1,75.5,384.4 μg/kg,乌龙茶1号样品检出的氯菊酯低于方法的定量下限。共8个样品中检出农药,检出率为66.67%,检出农药的残留量均未超过中国和欧盟MRL标准。
2.9 与文献方法的比较
将所建立的d-SPE-DLLME方法与文献[5,20-22]报道的方法从样品处理时间、试剂用量、检出限等方面进行对比,结果见表4。与其它方法相比,d-SPE-DLLME具有操作简单、快速、有机溶剂用量少和检出限低等优点,因此可作为痕量拟除虫菊酯农药分析的快速有效方法。

表4 本方法与文献方法对拟除虫菊酯农药在茶叶中残留分析结果的比较Table 4 Comparison of this method with other methods from references for determination of pyrethroid pesticides in tea
3 结 论
本文结合d-SPE净化技术和DLLME微萃取技术,并与GC-MS/MS联用,成功地应用于茶叶中7种拟除虫菊酯类农药残留的测定。与其它常规样品制备技术相比,该方法简单、成本低、易操作,且有机溶剂用量少,分析时间短,虽然茶叶基质较为复杂,但仍得到了较高的回收率和较好的净化富集效果,可以作为茶叶基质中痕量拟除虫菊酯类农药残留的常规检测方法。
[1] Sudathip S T,Yang C S.Int.J.TeaSci.,2015,11(1/2):29-40.
[2] Soderlund D M,Clark J M,Sheets L P,Mullin L S,Piccirillo V J,Sargent D,Stevens J T,Weiner M L.Toxicology,2002,171(1):3-59.
[3] Koureas M,Tsakalof A,Tsatsakis A,Hadjichristodoulou C.Toxicol.Lett.,2012,210(2):155-168.
[4] Repetto R,Baliga S S.HealthPolicyandPlanning,1997,12(2):97-106.
[5] Liu T F,Yang D F,Dong M H,Fan J,Xie X Q.Chin.J.Pestic.Sci.(刘腾飞,杨代凤,董明辉,范君,谢修庆.农药学学报),2015,17(5):571-578.
[6] Tian L M,Sun Z Y,Xiang M,Song C M,Yang Y K,Li X M.FoodSci.(田丽梅,孙志勇,向明,宋春满,杨叶昆,李雪梅.食品科学),2015,36(20):239-241.
[7] Weng S Q,You Y J.Chin.J.Pharm.Anal.(翁淑琴,游勇基.药物分析杂志),2011,31(9):1818-1823.
[8] Rong J F,Wei H,Huang H S,Li Y J,Xu M Z.J.Instrum.Anal.(荣杰峰,韦航,黄伙水,李亦军,许美珠.分析测试学报),2016,35(1):8-15.
[9] Wu C,Cheng G,Zhao Z Q,Wang L.FujianAnal.Test.(吴成,程刚,赵志强,王蕾.福建分析测试),2016,25(3):48-51.
[10] Liu Q,Sun L,Zhang L.J.Instrum.Anal.(刘琪,孙雷,张骊.分析测试学报),2010,29(10):1048-1052.
[11] Wu M X,Chen G,Liu P,Zhou W H,Jia Q.J.Chromatogr.A,2016,1456:34-41.
[12] Wu J,Lu J,Chris W,Lin Y J,Lu H.J.Chromatogr.A,2010,1217(41):6327-6333.
[13] Otake T,Numata M.Anal.Lett.,2014,47(13):2281-2293.
[14] Hou Y,Cao Q E,Xie X G,Wang B X,Xu J C,Yang L,Yang Y,Yang Y.Chin.J.Chromatogr.(侯英,曹秋娥,谢小光,王保兴,徐济仓,杨蕾,杨燕,杨勇.色谱),2007,25(1):25-29.
[15] Anastassiades M,Lehotay S J.J.AOACInt.,2003,86(2):412-431.
[16] Rezaee M,Assadi Y,Hosseini Milani M R,Aghaee E,Ahmadi F,Berijani S.J.Chromatogr.A,2006,1116(1/2):1-9.
[17] Petrarca M H,Fernandes J O,Godoy H T,Cunha S C.FoodChem.,2016,212:528-536.
[18] Cao J P,Xie Q L,Zhou J M,Yi Z H.J.Instrum.Anal.(曹江平,解启龙,周继梅,易宗慧.分析测试学报),2015,34(5):616-624.
[19] Kmellar B,Fodor P,Pareja L,Ferrer C,Martinez-Uroz M A,Valverde A,Fernandez-Alba A R.J.Chromatogr.A,2008,1215(1/2):37-50.
[20] Zhang F,Lei J Q,Yang F.Chem.Reagents(张放,雷霁卿,杨霏.化学试剂),2016,38(1):47-51.
[21] Xie J L,Xiao H J,Zhang W,Chen X Q,Bao Z F,Zhu X.J.NorthwestNormalUniv.(谢吉林,肖海军,张偎,陈孝权,鲍治帆,朱希.西南师范大学学报),2015,40(12):27-32.
[22] Su J F,Zhong M S,Chen J,Guo X,Chen J X,Liang Z,Liu J J.J.Instrum.Anal.(苏建峰,钟茂生,陈晶,郭昕,陈劲星,梁震,刘建军.分析测试学报),2015,34(6):625-638.
Determination of 7 Pyrethroid Pesticide Residues in Tea by Gas Chromatography-Triple Quadrupole Mass Spectrometry Combined with Dispersive Solid-phase Extraction and Dispersive Liquid-Liquid Microextraction
SUN Meng-yuan1,2,SHI Zhi-hong1*,LI Jian-xun2,3,WU Xing-qiang1,2,HU Xue-yan2,ZHANG Bo-lun2,3,FAN Chun-lin2*
(1.College of Chemistry and Environmental Science,Hebei University,Baoding 071002,China;2.Chinese Academy of Inspection and Quarantine,Beijing 100176,China;3.School of Food and Chemical Engineering,Beijing Technology and Business University,Beijing 100048,China)
A gas chromatography-triple quadrupole mass spectrometric(GC-MS/MS)method for the determination of 7 pyrethroid pesticide residues in tea was developed using dispersive solid-phase extraction and dispersive liquid-liquid microextraction(d-SPE-DLLME)as sample preparation methods.The samples were extracted with acetonitrile,purified with primary secondary amine(PSA)and multi-walled carbon nanotubes(MWCNTs) as sorbents,concentrated into carbon tetrachloride(CCl4),and analyzed by GC-MS/MS.The effects of different kinds of extractants,volume and types of extractants,volume of dispersants and extraction time on extraction efficiency were investigated by using full fermented black tea as the matrix.In the experiment,acetonitrile was used as extractant in d-SPE,200 μL of CCl4was used as extractant,1 mL of acetonitrile was used as dispersant,and extraction time was 1 min in DLLME.The results showed that the calibration curves of 7 pesticides were linear in the range of 10-500 μg/kg,and the limits of quantitation were 1.0-10.0 μg/kg.The average recoveries of 7 pesticides in four kinds of tea(black tea,green tea,oolong tea and dark tea)at four spiked levels were in the range of 75.4%-113.6%.The relative standard deviations(RSD,n=5) were not more than 8.8%.The proposed method showed the advantages of simplicity,rapidness,low cost and low detection limit,and was successfully applied in the detection of twelve commercially available tea samples.
dispersive solid-phase extraction(d-SPE);dispersive liquid-liquid microextraction(DLLME);gas chromatography-triple quadrupole mass spectrometry(GC-MS/MS);pesticide residue;tea
2016-12-15;
2017-01-17
水果和蔬菜中农药化学污染物残留水平调查及数据库建设( 2015FY111200)
10.3969/j.issn.1004-4957.2017.05.003
O657.63;F767.2
A
1004-4957(2017)05-0595-06
*通讯作者:石志红,教授,研究方向:色谱分析 ,Tel:13582289470,E-mail:shizhihong6276@sina.com 范春林,研究员,研究方向:食品安全 ,Tel:18810026919,E-mail:caiqfcl@163.com

