紫菀地下不同部位重量与其药用成分含量相关性研究
郭伟娜 纪霞,朱晓雨 王婧 朱月健 程磊
(亳州职业技术学院药学院,安徽 亳州 236800) (安徽中医药大学药学院,安徽 合肥 230031)(亳州职业技术学院药学院,安徽 亳州 236800)(安徽普康中药资源有限公司,安徽 亳州 236800)(亳州职业技术学院药学院,安徽 亳州 236800)
紫菀地下不同部位重量与其药用成分含量相关性研究
郭伟娜 纪霞,朱晓雨 王婧 朱月健 程磊
(亳州职业技术学院药学院,安徽 亳州 236800) (安徽中医药大学药学院,安徽 合肥 230031)(亳州职业技术学院药学院,安徽 亳州 236800)(安徽普康中药资源有限公司,安徽 亳州 236800)(亳州职业技术学院药学院,安徽 亳州 236800)
采用称重法分别称量单株紫菀(Astertataricus)根、根茎和母根的重量,并采用高效液相色谱法分别测定单株药用部位的紫菀酮、槲皮素和山萘酚的含量,探讨紫菀地下不同部位重量与入药部位的主要药用成分含量之间的相关性。结果表明:根、根茎、母根的重量变异系数分别为46.7%、53.29%、38.6%,药用成分紫菀酮、槲皮素、山萘酚含量变异系数分别为27.53%、48.42%、38.57%,紫菀酮的含量与根和根茎的重量比显著相关;山萘酚含量与根重显著相关。由此显示:根与根茎的重量比可作为衡量紫菀药材品质的重要依据。
紫菀(Astertataricus);根;根茎;紫菀酮;山萘酚
紫菀(AstertataricusL.f.)为我国常用中药材,来源于菊科紫菀的干燥根和根茎[1],具有润肺化痰、止咳痰的功效。研究表明,紫菀止咳化痰的的主要成分为紫菀酮,此外,还含有山萘酚、槲皮素等抗氧化生物活性功能成分,在抑制溶血、脂质过氧化物反应和免疫调节方面均有显著作用[2]。现有研究显示:紫菀各器官变异较大,其中根茎重变异系数高达70.5%,且根茎性状与其他部位性状存在显著的相关关系[3,4],但性状变异是否影响药材质量未见报道。为此,本研究采用称重法和高效液相色谱法系统分别测定紫菀地下不同部位重量和入药部位的主要药用成分含量,并采用SPSS软件对结果进行相关性分析,以为药材品质评价提供参考。
1 材料与方法
1.1 材料、仪器与试剂
试验材料于2015年3月中旬栽培于亳州中医药研究所药用植物园内,经安徽中医药大学方成武教授鉴定为紫菀(AstertataricusL.f.),采挖时间为2015年12月中旬。
所用主要设备包括高效液相色谱仪Agilent1260、SPD-10Avp检测器、Class-VP工作站,DL-180超声波破碎仪(浙江海天电子仪器厂),MA200电子天平等。
试剂紫菀酮、槲皮素、山萘酚(购自中国食品药品检定研究院),乙腈(天津科密欧产品)均为色谱纯,水为纯净水。
1.2 方法1.2.1 根、根茎、母根的称重
2015年12月采取亳州中医药研究所药用植物园中紫菀药材原植物10株,标记为1~10号,除去泥土,清洗干净,将根、根茎、母根分离,置于40℃烘箱中,烘干后称取各部位重量。
1.2.2 主要药用成分含量测定
采用高效液相色谱法进行。
1)色谱条件 色谱柱ZORBAX SB-C18(5μm, 250mm×4.6mm);流速:1.0mL/min;紫菀酮的检测波长为200nm,柱温30℃,进样量20μL,流动相选择100%乙腈。槲皮素和山萘酚的检测波长为360nm,柱温30℃,进样量10μL,流动相选择乙腈(A)和0.1%磷酸水(B)梯度洗脱,0~10min,25%~40%A;10~15min,40%~45%A;15~20min,45%~100%A;20~30min,100%A。
2)对照溶液配制 ①紫菀酮:精确称取紫菀酮10mg,置于10mL容量瓶中,乙腈定容,再吸取1mL稀释至浓度为0.1mg/mL的对照溶液。②槲皮素与山萘酚:精确称取槲皮素和山萘酚各10mg,分别用甲醇定容于10mL量瓶,各自稀释10倍,再吸取槲皮素1mL,山萘酚1.5mL,混合定容于50mL量瓶,配制成槲皮素浓度为0.002mg/mL、山萘酚浓度为0.003mg/mL的混合对照溶液。
3)样品溶液配制 分别将1~10号样品的药用部位粉碎过3号筛。①紫菀酮样品:精确称取干燥后粉末各1g,加氯仿20mL,称重,温浸1h,超声20min,冷却,用氯仿补足重量。②槲皮素和山萘酚样品:精确称取干燥后粉末各1g,加80%甲醇20mL,摇匀,称量,超声提取20min,取出,放冷,用80%甲醇补足质量,摇匀。
4)线性关系考察 精确吸取紫菀酮对照溶液1、5、10、15、20、25μL,进样测定,以进样量为横坐标、峰面积为纵坐标,求其直线回归方程。精确吸取槲皮素和山萘酚混合对照溶液1、2、5、10、15、20μL,进样测定,以进样量为横坐标、峰面积为纵坐标,对槲皮素和山萘酚分别求其直线回归方程。
5)精密度试验 取紫菀1号样品溶液重复进样5次,每次20μL,测定峰面积的相对标准偏差值(RSD)。
6)重现性试验 取紫菀1号样品5份,按照紫菀酮样品溶液的配制方法制成供试溶液,每份进样20μL,测定峰面积RSD。
7)稳定性试验 制备供试品溶液,分别于0、2、4、6、8、10、12、24h吸取供试品溶液20μL,进样分析并测定紫菀酮、槲皮素和山萘酚的峰面积RSD。
8)回收率试验 精确称取紫菀2号样品粉末5份各1.0g,加入1mg/mL的紫菀酮对照溶液2.5mL,另外称取6号样品粉末5份各1.0g,各加入1mg/mL的槲皮素对照溶液1.5mL和1mg/mL的山萘酚对照溶液1.5mL,按前述配制方法分别配制溶液,计算平均回收率。
1.3 相关性分析
采用SPSS V20统计分析软件对紫菀地下部位的生物量,包括根重、根茎重、母根重、入药部位重量、根与根茎重量比以及入药部位紫菀酮、槲皮素和山萘酚含量进行相关性分析。
2 结果与分析
2.1 紫菀入药部位主要药用成分测定的方法学考察
1)线性关系 分别以紫菀酮对照溶液、槲皮素和山萘酚混合对照溶液进样量为横坐标,以峰面积为纵坐标,对紫菀酮得直线回归方程为Y=114.72X+3.6977,R=0.9999,表明紫菀酮在0.1~2.5μg含量范围线性关系良好;对槲皮素得直线回归方程为Y=70.573X-6.1275,R=0.9999,表明槲皮素在0.002~0.040μg含量范围线性关系良好;对山萘酚得直线回归方程为Y=131.14X-11.107,R=0.9999,表明山萘酚在0.003~0.060μg含量范围线性关系良好。
2)精密度 试验测得紫菀酮、槲皮素、山萘酚的峰面积RSD分别为0.17%、0.08%、0.07%。
3)重现性 试验测得紫菀酮的峰面积RSD为0.04%,表明重现性良好。
4)稳定性 试验测得紫菀酮、槲皮素和山萘酚的峰面积RSD分别为0.21%、0.12%和0.08%,表明样品溶液在24h内稳定。
5)回收率 试验测得紫菀酮回收率为101.7%(RSD0.68%),槲皮素回收率98.10%(RSD0.44%),山萘酚回收率99.32%(RSD0.96%)。
6)液相色谱图 紫菀酮、槲皮素和山萘酚的液相色谱图分别见图1、图2。
图1 紫菀酮(I)成分的HPLC色谱图
图2 槲皮素(Ⅰ)和山萘酚(Ⅱ)成分的HPLC色谱图
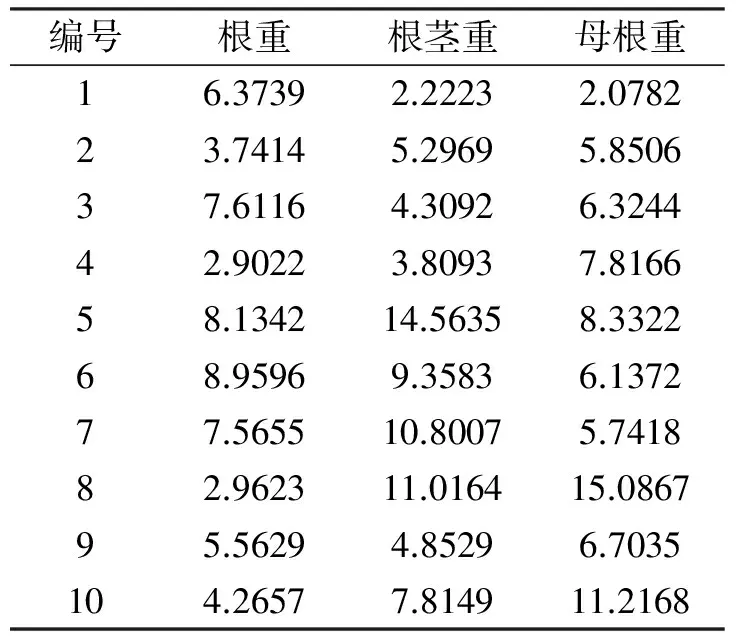
2.2 紫菀地下不同部位重量差异
10株紫菀根、根茎和母根的重量称量结果见表1。由表1可知,紫菀地下各部位重量变异系数在38.61%~53.29%之间。根及根茎重量差异较大,根茎部变异系数达53.29%;根部变异系数为46.7%。各部位平均生物量比重相当,约各占1/3。
2.3 主要药用成分含量差异
以单株为单位,将紫菀的入药部位根和根茎混合,采用高效液相色谱法测定其中紫菀酮、槲皮素和山萘酚的含量,测定结果如表2所示。经统计,药用成分紫菀酮、槲皮素、山萘酚含量变异系数分别为27.53%、48.42%、38.57%。
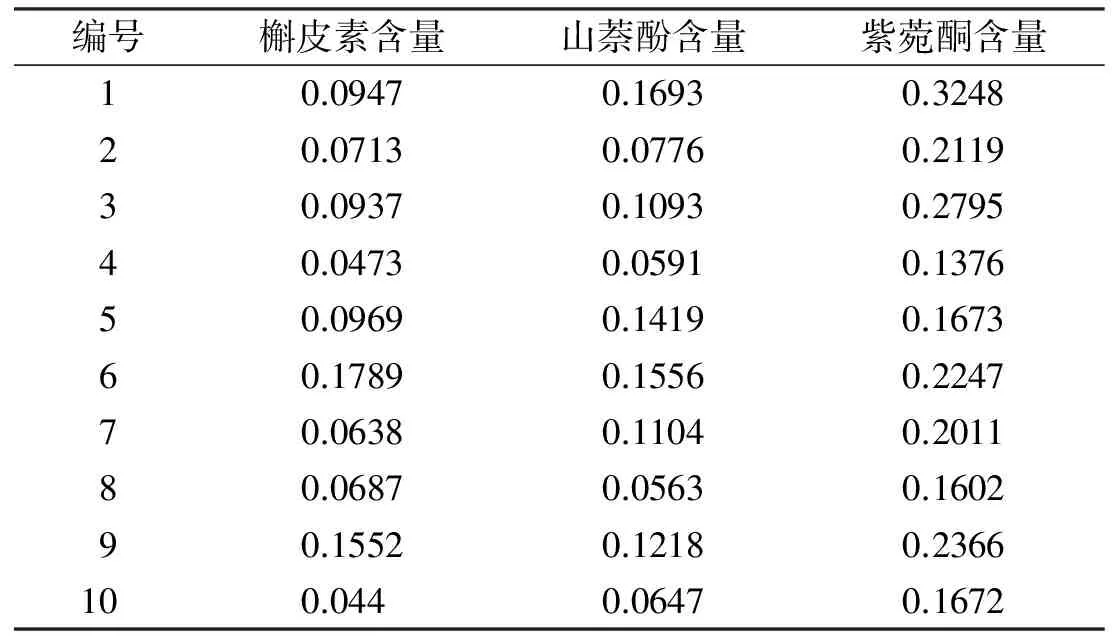
表2 紫菀药用部位3种化学成分含量 mg·g-1
2.4 相关性分析
利用SPSS V20软件对紫菀地下部位的生物量,包括根重(X1)、根茎重(X2)、母根重(X3)、入药部位根和根茎总重量(X4)、根与根茎重量比(X5)以及入药部位紫菀酮含量(X6)、槲皮素含量(X7),山萘酚含量(X8)共8个变量进行相关性分析,结果见表3。
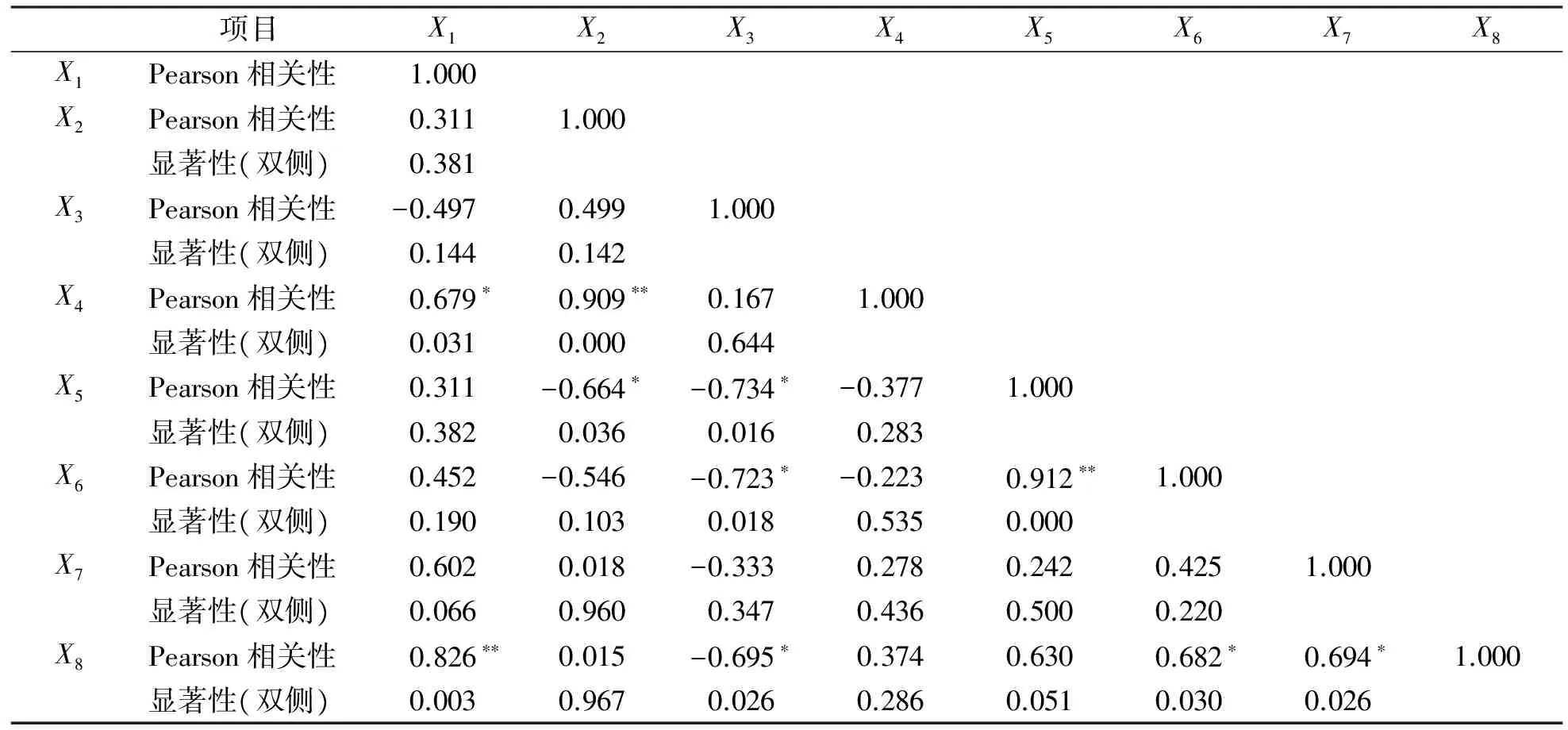
表3 紫菀地下不同部位重量与入药部位的主要药用成分含量相关性分析
注:**表示 在 0.01 水平(双侧)上显著相关,*表示在 0.05 水平(双侧)上显著相关。
结果显示:紫菀入药部位重量与根茎重在0.01 水平上显著相关,与根重在0.05 水平上显著相关;紫菀酮的含量与根和根茎的重量比在0.01水平上显著相关,与母根重在0.05水平上显著负相关;山萘酚的含量与根重在0.01水平上显著相关,与母根重在0.05水平上呈显著负相关,与紫菀酮和槲皮素的含量在0.05 水平上显著相关。
3 讨论
药用植物的化学成分是其防病治病的物质基础[5]。紫菀所含的三萜类紫菀酮[1]、黄酮类槲皮素、山萘酚是迄今研究较多的活性成分[6,7],其中紫菀酮为目前紫菀药材质量控制的特征性成分[1]。就单株紫菀入药部位而言,3种成分的含量呈现较大变异,变异系数分别为48.42%、38.57%和27.53%。紫菀的地下器官由根、根茎和母根3部分组成,本研究显示各部位比例相当,但单株间各部位重量变异较大,变异系数分别为46.7%、53.29%和38.61%。相关性分析显示:单株间紫菀不同部位重量与药用成分含量直接相关,其中入药部位紫菀酮含量与根和根茎重量比呈显著正相关,与母根重量呈负相关;山萘酚的含量与根重显著正相关,因此根的比重可作为衡量紫菀药材品质的重要依据。传统观点认为紫菀“根长,色紫红,柔韧者为佳”[8],说明根为衡量药材品质的决定因素,与本研究结果相一致。此外,笔者市场调查发现,紫菀药材在加工过程中常把根下部剪掉,仅保留上部约5~6cm,而传统加工方法将紫菀的根辫成辫状,本研究结果显示:根的比重与主要药用成分含量均呈现正相关,因此建议在紫菀的加工过程中保留下部的细根。
研究结果中值得注意的是入药部位重量与根茎重显著相关,即:根茎为紫菀药材产量的主要决定因素。而根茎重与紫菀酮和山萘酚的含量呈负相关,说明根中的主要药用成分含量高于根茎,植物根和根茎的药用成分含量往往不同,如虎杖根状茎与根中的虎杖苷、 白藜芦醇等5 种活性成分含量不同[9,10],野生甘草和栽培甘草地下不同部分甘草酸含量也呈现较大差异[11]。目前紫菀栽培为无性繁殖,对繁殖材料缺乏提纯复壮及良种优选等管理措施,因此目前的栽培紫菀根短、数量少,根和根茎的重量比与主要药用成分含量差异大,从而导致临床使用疗效不稳定。紫菀单株间丰富的变异虽然影响了目前药材的品质,但也为优选种质提供了丰富的资源。因此,在紫菀栽培主产区收集种质资源,利用数据分析软件及现代化学仪器对外部特征和质量之间进行深入研究,对选育优质种源和确保临床疗效具有重要意义。
[1]国家药典委员会.中华人名共和国药典(一部)[M].北京:化学工业出版社,2015:342.
[2]库尔班江,欧阳艳,努尔买买提.紫菀属植物化学成分及药理作用研究进展[J].中国野生植物资源,2010,29(2):1~4,33.
[3]张庆田,艾军,李昌禹.紫菀种质资源研究[J].特产研究,2009,43(3):43~49.
[4]程磊,郭伟娜,牛倩.药用紫菀数量性状遗传变异及主成分聚类分析[J].齐齐哈尔医学院学报,2014,35(1):8~9.
[5]胡正海.药用植物的结构、发育与药用成分的关系[M].上海:上海科学技术出版社,2014.
[6]夏成凯,郭伟娜,王甫成,等.一测多评法测定紫菀中5种黄酮类成分含量[J].中药材,2015,38(1):112~114.
[7]王甫成,夏成凯,栗进才,等.HPLC同时测定紫菀中5种黄酮类成分[J].中成药,2012,34(2):306~309.
[8]国家中医药管理局中华本草编委会.中华本草(第七卷)[M].上海:上海科学技术出版社,1998:703~704.
[9]郑会丹,郑冰珊,叶冬青,等.浙产虎杖根茎与根中大黄素含量比较[J].中华中医药学刊,2012(2):431~433.
[10]刘耀武,王军,储姗姗,等.虎杖根状茎与根中5种化合物的分布规律[J].中国中药杂志,2015,40(24):4834~4839.
[11]赵则海,曹建国,付玉杰,等.野生与栽培甘草不同部位甘草酸分布特点及其意义[J].植物学报,2006,23(2):164~168.
[编辑] 余文斌
2017-02-20
安徽省高校自然科学重点项目(KJ2017A774);安徽省高等学校省级质量工程项目(2016sjjd055);安徽省科技重大专项(16030801113);安徽省亳州市科技计划项目(BK2015009)。
郭伟娜(1983-),女,硕士,讲师,主要从事药用中药化学研究,guoweina0201@163.com。
Q949.783.5;R914
A
1673-1409(2017)10-0038-05
[引著格式]郭伟娜,纪霞,朱晓雨,等.郭伟娜紫菀地下不同部位重量与其药用成分含量相关性研究[J].长江大学学报(自科版),2017,14(10):38~42.

