接种邻苯二甲酸酯(PAEs)降解菌缓解PAEs对玉米胁迫效应和机制研究
陈学斌,赵海明,莫测辉,蔡全英
暨南大学环境学院,广东 广州 510632
接种邻苯二甲酸酯(PAEs)降解菌缓解PAEs对玉米胁迫效应和机制研究
陈学斌,赵海明,莫测辉,蔡全英*
暨南大学环境学院,广东 广州 510632
邻苯二甲酸酯(PAEs)是一类典型的环境内分泌干扰物,国内农业土壤普遍受PAEs的污染。土壤中的PAEs可被农作物吸收累积,影响植物的生理生化特性和农产品的质量安全。探索PAEs污染土壤的生物修复技术以及高效降解菌缓解PAEs污染胁迫和降低农作物吸收累积PAEs迫在眉睫。以在土壤中的质量分数和检出频率均较高的邻苯二甲酸二(2-乙基己基)酯(DEHP)为目标化合物,采用DEHP污染土壤(18 mg·kg-1和75 mg·kg-1)进行盆栽玉米(Zea mays)试验,研究接种PAEs高效降解菌(嗜吡啶红球菌Rhodococcus pyridinivorans XB)缓解DEHP胁迫对玉米生长、吸收积累DEHP的影响及其抗氧化酶系统的响应。结果显示,经DEHP处理的玉米丙二醛质量摩尔浓度显著增加(P<0.05),尤其是高浓度处理的玉米根系丙二醛质量摩尔浓度增加464%;且高浓度处理的玉米根系过氧化氢酶和多酚氧化酶活性显著增加(P<0.05),生物量显著下降(P<0.05),说明DEHP严重影响玉米的生长。与不接种微生物处理相比,玉米接种菌株XB能显著提高玉米体内超氧化物歧化酶(10%~154%)、过氧化氢酶(11%~34%)及多酚氧化酶(48%~288%)活性,显著降低丙二醛质量摩尔浓度(30%~60%),提高玉米生物量(5%~85%),减少玉米对DEHP的吸收积累(4%~60%)。结果说明菌株XB能缓解土壤DEHP对玉米生长的胁迫,降低玉米吸收积累DEHP,有利于保障农产品质量安全。
邻苯二甲酸二(2-乙基己基)酯;嗜吡啶红球菌;玉米;抗氧化酶系统;吸收累积
邻苯二甲酸二(2-乙基己基)酯(DEHP)是一种具有长侧链的邻苯二甲酸酯(PAEs)化合物,被广泛用作增塑剂,其在塑料膜中的质量分数可高达40%~60%(鲁磊安等,2016)。随着地膜覆盖和塑料大棚的推广应用,大量DEHP被释放到环境中。长侧链的DEHP在环境中难以降解(Wang et al.,2015),在中国农田土壤中普遍检测出DEHP,其质量分数比其他短侧链PAEs化合物的高(Cai et al.,2008;杨国义等,2007)。例如,珠三角菜地和稻田土壤乃至全国农业土壤单个PAEs化合物的平均质量分数均以DEHP最高(Cai et al.,2008;Niu et al.,2014;蔡全英等,2005;鲁磊安等,2016)。DEHP是一种内分泌干扰物(Meng et al.,2014),可产生“致癌”毒性,被美国环保局(USEPA)和中国环境监测总站列为“优控污染物”。因此,土壤DEHP污染及其危害备受关注。
农田土壤中的DEHP会被植物包括农作物吸收累积,影响农产品质量安全。作者前期研究发现,一定质量分数的DEHP会抑制菜心(Brassica campestris)和水稻(Oryza sativa)生长,导致根系形态结构和根系分泌物种类及质量分数发生变化,生物量下降(Zhao et al.,2015;陈桐等,2015;陈意良等,2016)。而且,DEHP会引起水稻体内抗氧化系统如过氧化物酶(POD)、多酚氧化酶(PPO)活性及丙二醛(MDA)质量摩尔浓度发生变化(陈意良等,2016),影响植物正常的生理生化功能(如菜心叶片的光合作用)等(Zhao et al.,2016)。因此,探寻缓解土壤DEHP污染影响的方法对保障农作物生长和农产品安全尤为重要。
土壤微生物是维持土壤质量的重要组成部分。有研究发现,某些外源微生物可以缓解土壤污染物对植物生长的胁迫。例如,在铜污染土壤中接种微生物可以增强海州香薷(Elsholtzia splendens)的光合作用(如光能利用率和碳同化能力)并提高有机物的积累,缓解铜胁迫对海州香薷的毒害,显著提高植株的株数、株高、生物量等(李月灵等,2015)。在多环芳烃污染土壤上种植紫花苜蓿(Medicago sativa L.)并接种里氏木霉菌(Trichodermaressei FS10-C)、复合根瘤菌(Rhizobium meliloti)菌剂可以提高紫花苜蓿生物量(姚伦芳等,2014)。在DEHP和邻苯二甲酸二正丁酯(DBP)污染土壤中接种AM真菌光壁无梗球囊霉菌(Acaulospora lavis)和苏格兰球囊霉(Glomus caledonium)能够促进豇豆(Vigna unguiculata)生长、提高叶绿素a及叶绿素b质量摩尔浓度和根瘤数(王曙光等,2003)。然而,目前关于接种PAEs降解菌对植物生长、抗氧化酶系统及吸收累积有机污染物的研究鲜见报道。
本研究以前期筛选获得的PAEs高效降解菌株嗜吡啶红球菌(Rhodococcus pyridinivorans XB)为实验材料。前期研究发现,该菌株能以DEHP为唯一碳源并使其完全矿化,在无机盐培养基中以DEHP为唯一碳源(质量浓度800 mg·L-1)5 d降解率达87%、在烧杯实验中修复DEHP污染土壤(质量分数为100 mg·kg-1)10 d降解率为70%。采用DEHP污染土壤盆栽玉米(Zea mays),并接种嗜吡啶红球菌,研究接种DEHP高效降解菌缓解DEHP胁迫对玉米生长、吸收积累DEHP的影响及其抗氧化酶系统的响应,以期为农产品安全生产和污染土壤修复提供科学依据。
1 材料与方法
1.1 供试材料
菌株XB分离自活性污泥,经鉴定属于嗜吡啶红球菌种(Rhodococcus pyridinivorans),保存于广东省微生物菌种保藏中心(编号:60054)。从保存降解菌的试管中挑取菌株XB于液体LB培养基中,于培养箱内振荡培养24 h(30 ℃,150 r·min-1),所得菌液离心5 min(4 ℃,4500 r·min-1)后,弃去上清液,用0.9%的灭菌生理盐水冲洗菌体,重复3次并重悬制成浓度为8.0×108cfu·mL-1的接种菌剂。
水稻土取自华南农业大学实验农场,采集后于室内风干、粉碎过1 mm和2 mm筛备用。水稻土DEHP的背景值为0.24 mg·kg-1,pH为5.59,有机质为30.2 g·kg-1,阳离子交换量为7.67 cmol·kg-1,全氮为1.26 g·kg-1,全磷为1.79 g·kg-1,全钾为18.0 g·kg-1;粒径组成中砂粒占52.0%,粉粒41.9%,粘粒6.1%。人工配制DEHP污染土壤进行玉米盆栽试验。定量量取溶于丙酮(分析纯)的DEHP,添加到1 mm的土壤中,搅拌混匀,置于暗处让丙酮自然挥发3 d(中途不断搅拌使溶剂挥发殆尽),配制获得DEHP质量分数分别为200 mg·kg-1和1000 mg·kg-1的污染土壤。结合农田土壤DEHP的实际质量分数(0.2~25.2 mg·kg-1)(He et al.,2015)和前期研究结果(高质量分数100 mg·kg-1处理植物仍可以正常生长,但生理生化反应严重受抑制)(Zhao et al.,2016;陈意良等,2016),土壤DEHP质量分数分别设置为20 mg·kg-1和100 mg·kg-1。将上述污染土壤与未污染土壤(粒径为2 mm)按1∶9(质量比)搅拌混匀,污染土壤经15 d避光自然老化,测得DEHP初始质量分数分别为18 mg·kg-1和75 mg·kg-1。
1.2 方法
1.2.1 盆栽试验
盆栽试验在暨南大学环境学院温室进行。将上述土壤装盆(瓷盆的底径30 cm、上口径33 cm、高30 cm),每盆装污染土壤4.5 kg,量取菌剂100 mL,以等量无菌生理盐水为对照,与土壤充分混匀。土壤施用化肥为尿素、过磷酸钙和氯化钾(均为分析纯),施用量分别为氮0.20 g·kg-1、磷0.15 g·kg-1和钾0.20 g·kg-1(磷、钾的施肥量按P2O5、K2O计)。盆栽试验设置空白对照(Control)、低污染水平土壤(Low,18 mg·kg-1)、高污染水平土壤(High,75 mg·kg-1)、低污染水平土壤接菌(Low-Inoculation)、高污染水平土壤接菌(High-Inoculation),每个处理设置3个重复,采用随机排列。
采用超甜金银粟2号种子进行盆栽土壤试验。玉米种子用过氧化氢(15%)消毒10 min,灭菌高纯水洗干净后置于生化培养箱中催芽24 h。采用基质育苗至4~5片叶子时选取生长健康、长势基本一致的玉米幼苗移栽至上述盆中,每个盆种植4株,移栽25 d后采样。玉米茎叶和根系用自来水和超纯水清洗干净并擦干水分称重,取部分鲜样进行植物酶测定,剩余的经冷冻干燥机(赛默飞世尔LL3000,美国)冻干后磨碎检测DEHP质量分数。
1.2.2 植物抗氧化酶、多酚氧化酶及丙二醛的测定方法
玉米根系及茎叶组织匀浆液提取:准确称取2.0 g玉米样品,加入8 mL10 mmol·L-1磷酸盐缓冲液(pH=7.4),冰浴条件下制备获得20%的组织匀浆,离心10 min,取上清液待测。
植物抗氧化酶活性及丙二醛测定:根据试剂盒标准方法(严青云等,2016),利用试剂盒(南京建成生物科技有限公司)进行提取,采用黄嘌呤氧化酶法(羟胺法)测定超氧化物歧化酶(SOD)活性,采用钼酸铵比色法测定过氧化氢酶(CAT)活性,采用硫代巴比妥酸法测定丙二醛(MDA)质量摩尔浓度。采用邻苯二酚法(Ma et al.,2014)测定多酚氧化酶(PPO)活性,以单位质量下单位时间内分光光度值OD(420 nm)每增加0.01为1个单位。
1.2.3 植物体DEHP提取和质量分数测定
DEHP提取采用超声提取方法(Zhao et al.,2015)并有适当修改。称取植物样品1 g置于玻璃离心管中,加20 mL二氯甲烷(色谱纯)超声提取10 min(重复3次),3500 r·min-1离心5 min后取上清液合并,采用硅胶柱净化,旋转蒸发仪(亚荣RE-52A,上海)以50 r·min-1转速浓缩后,转移至棕色进样瓶中,氮吹定容至1 mL,4 ℃保存待测。
待测液中DEHP 采用气相色谱质谱联用仪(GC-MS)分析,参考USEPA 8270C方法(United States Environmental Protection Agency,1996)。GC-MS联用仪型号为GC-MSQP2010(岛津,日本),色谱柱为DB-5MS石英毛细管柱(30 m×0.25 mm×0.25 μm),载气为高纯氦气(He)。质谱仪采用电子轰击源(EI)。配制梯度浓度为0.1、0.2、0.5、1.0、2.0、4.0 μg·mL-1的DEHP标准溶液并绘制标准曲线。DEHP空白加标回收率为85.1%~90.4%,方法检出限为5.2 μg·kg-1。
1.2.4 统计分析方法
采用Microsoft Excel 2010软件处理数据,文中数据均为各处理的平均数±标准偏差。采用SPSS 17.0软件进行单因素方差分析(One-way ANOVA),采用最小显著差异法(LSD)进行显著性分析。
为了比较暴露于不同质量分数DEHP污染胁迫下玉米接种菌株与对照处理的响应差异,采用生物量敏感响应指数(Biomass Response to Stress,BRS)进行评价。BRS又可称为胁迫响应生物量,指在某种胁迫存在情况下植物(或某组织、器官)生物量相对于胁迫不存在情况下的生物量增减量。BRS的计算方法参照Wang et al.(2009)文献,公式如下:
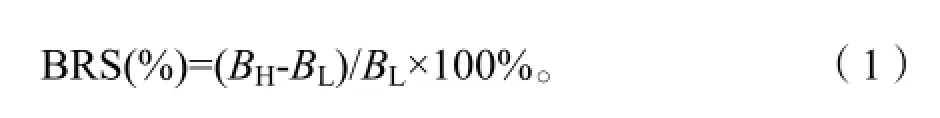
式中,BRS为生物量敏感响应指数,BH为高污染水平玉米生物量,BL为低污染水平玉米生物量。
2 结果
2.1 接种XB菌对DEHP胁迫下玉米生物量的影响
土壤DEHP胁迫影响玉米的生长。与空白对照相比,低水平处理(18 mg·kg-1)的玉米生物量显著(P<0.05)增加(高14%),高水平处理(75 mg·kg-1)的则显著(P<0.05)降低(低50%)(图1),这与多环芳烃污染对互米花草(Spartina alterniflora)的影响情况类似(刘静等,2015),即低水平促进植物的生长,高水平则抑制生长。与不接种微生物的处理相比,接种菌株XB促进了玉米生长,生物量增加,尤其是高水平DEHP处理接种菌株XB其玉米生物量是对应未接种处理的1.85倍,说明高水平DEHP土壤污染接种菌株XB能有效提高植物的抗逆性。不接种微生物处理的生物量敏感响应指数(BRS)小于接种菌株XB处理(表1),说明没有接种菌株的玉米受DEHP胁迫更为敏感。由此可知,高水平DEHP污染会严重影响植物生长,在土壤中添加嗜吡啶红球菌XB能有效消除DEHP对植物生长的抑制作用。

图1 玉米植株的生物量Fig. 1 Biomass of the maize

表1 生物量敏感性响应指数Table 1 Index of biomass response to stress
2.2 接种XB菌对玉米体内DEHP质量分数的影响
不同DEHP处理下玉米根系和茎叶(或地上部)对DEHP的积累情况如表2所示。植物根系和茎叶DEHP质量分数均随土壤DEHP质量分数增加而增加,这与不同品种菜心对土壤中PAEs的吸收积累规律相似(Zhao et al.,2015),说明植物可从土壤中吸收累积DEHP。与不接种菌株处理相比,接种菌株XB的根系DEHP质量分数显著下降,茎叶略有下降但差异不显著。玉米根系DEHP质量分数比茎叶的高,转运系数(茎叶DEHP质量分数/根系DEHP质量分数)低于1.0,即DEHP更多被滞留在根系。
2.3 接种XB菌对玉米体内丙二醛质量摩尔浓度的影响
丙二醛(MDA)是细胞膜质的过氧化产物,若植物体内丙二醛积累,则表明植物体内质膜过氧化作用加剧(陈则友等,2012)。由图2可知,玉米根系MDA质量摩尔浓度随着土壤DEHP质量分数的增加而显著增加,低污染水平和高污染水平处理的MDA质量摩尔浓度分别比空白对照高出258%和464%,表明膜质过氧化加剧,细胞伤害加重。低水平DEHP处理玉米茎叶的MDA质量摩尔浓度也比空白对照高出69%。但玉米茎叶MDA比对应处理根系的低,这可能是由于根系吸收或吸附的DEHP对其产生了比较直接的质膜过氧化作用。茎叶DEHP主要通过根系吸收并向上运移,其运移系数小于1.0(表2),即DEHP更易被滞留在根部(Cai et al.,2015;Zhao et al.,2015),故DEHP对玉米茎叶产生的质膜过氧化作用相对较小,其MDA质量摩尔浓度较根系的低。类似地,有研究发现随土壤PAEs质量分数增加小麦幼苗叶片MDA质量摩尔浓度呈上升趋势(张慧芳等,2010)。与不接种微生物处理相比,接菌处理显著降低根系MDA质量摩尔浓度(低、高污染水平处理分别降低了60%和56%)和低污染水平处理茎叶MDA质量摩尔浓度(降低了31%);但高污染水平接菌处理的茎叶MDA质量摩尔浓度显著增加。这可能与高污染水平DEHP处理下玉米茎叶累积更多DEHP(表2),导致其质膜过氧化作用更强有关。类似地,紫花苜蓿与真菌在联合修复石油污染土壤时,其体内MDA质量摩尔浓度呈先下降后上升趋势(李德生等,2011)。镉胁迫条件下接种芽孢杆菌T3(Bacillus sp.),蒌蒿(Artemisia selengensis)体内MDA质量摩尔浓度显著减少(周小梅等,2016)。
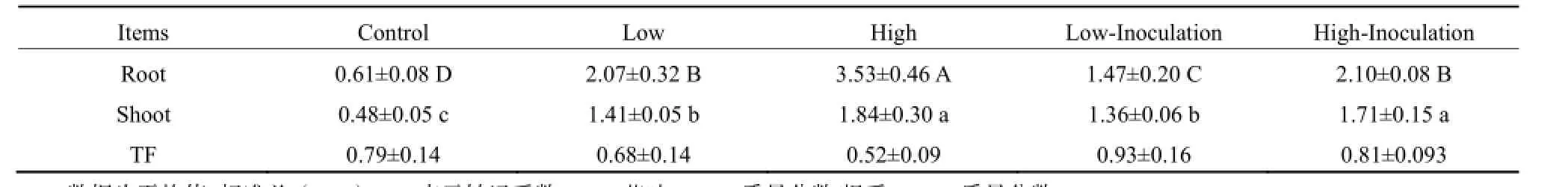
表2 玉米体内DEHP质量分数及转运系数Table 2 DEHP concentration in the maize and translocation factor mg·kg-1

图2 接种菌株XB对玉米体内MDA质量摩尔浓度的影响Fig. 2 Effect of inoculating strain XB on the content of MDA in the maize

图3 接种菌株XB对玉米体内SOD活性的影响Fig. 3 Effect of inoculating strain XB on the activity of SOD in the maize
2.4 接种XB菌对玉米体内抗氧化酶活性的影响
通常,植物受污染物胁迫会引起植物代谢紊乱和活性氧水平升高。为避免由活性氧造成的氧化伤害,植物体内的抗氧化酶如SOD、CAT、PPO等活性升高,可有效地清除过量的活性氧,保护细胞或减轻活性氧的伤害(夏民旋等,2015)。由图3可知,与空白对照相比,低水平DEHP处理的玉米根系SOD活性显著增加(36%),而高水平DEHP处理的根系和茎叶SOD活性显著下降(33%),表明在低水平污染条件下,玉米能有效地清除体内的活性氧自由基;但高水平污染下玉米细胞产生活性氧自由基的功能被激发,其体内SOD活性不足以消除DEHP所引起的氧化胁迫,从而导致SOD活性的降低(常青等,2008)。然而,高水平DEHP处理接种菌株XB能显著提高玉米根系和茎叶SOD活性,分别是对应不接种微生物处理的2.54倍和1.34倍,分别比空白对照高出69%和3%。可见,土壤接种XB菌能有效增强玉米抗氧化酶SOD活性。
随土壤DEHP质量分数增加,根系CAT活性先下降(19%)后上升(5%),高分别数DEHP处理茎叶的CAT活性也显著高于空白对照(58%)(图4)。类似地,刘金光等(2012)发现随镉质量分数增加龙葵(Solanum nigrum)幼苗CAT活性先下降后上升。与未接菌处理相比,接菌处理玉米茎叶CAT活性变化不大,但根系的CAT活性明显增加;高污染水平接菌处理CAT活性比对应不接菌处理的高34%,差异显著。说明在土壤DEHP高水平胁迫下接种菌株XB可提高玉米的抗氧化胁迫。
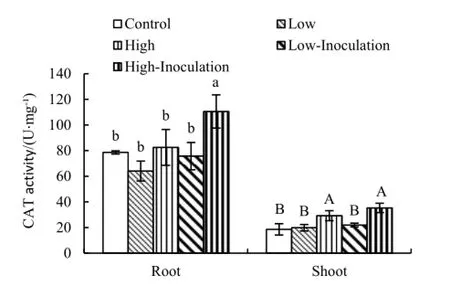
图4 接种菌株XB对玉米体内CAT活性的影响Fig. 4 Effect of inoculating strain XB on the activity of CAT in the maize
随着土壤DEHP质量分数的增加,玉米根系PPO活性显著增加(143%~223%)(图5),高水平处理玉米茎叶PPO活性比空白对照的高63%,说明玉米抵御DEHP胁迫能力增强。接种菌株XB后,玉米根系和茎叶PPO活性显著增加,其中根系的PPO活性分别比对应低水平和高水平未接菌处理的提高了192%和64%,茎叶的分别提高了288%和48%。这可能是由于菌株刺激玉米根系和茎叶形成应激机制,激活玉米PPO活性。

图5 接种菌株XB对玉米体内PPO活性的影响Fig. 5 Effect of inoculating strain XB on the activity of PPO in the maize
3 讨论
DEHP是一种典型的内分泌干扰物,会影响植物的生长和生理生化反应(Zhao et al.,2015,2016)。抗氧化酶系统在植物防御污染物胁迫机制中起重要作用(An et al.,2009)。有研究表明,在PAEs污染条件下,不同植物的组织细胞活性氧损伤加剧,植物抗氧化酶系统产生应激反应,酶活性发生改变(Zhang et al.,2014;Ma et al.,2015;胡芹芹等,2008)。其中一些特定PPO能对植物体内吸收累积的污染物进行转化及代谢(Schroder,2007),在受污染胁迫时,PPO酶活性增加(龚帅帅等,2011)。本研究中,与空白对照相比,DEHP低水平处理玉米根系和茎叶MDA质量摩尔浓度增加,质膜过氧化增加,相应地,其根系和茎叶SOD和PPO活性显著增加,减缓了DEHP胁迫,生物量显著增加。但高水平处理玉米根系的MDA质量摩尔浓度比空白对照的增加了3.6倍,可能造成比较严重的质膜过氧化损伤,虽然CAT和PPO活性增加,但SOD活性下降,生物量亦随之下降。
在污染土壤中接种外源微生物(如降解菌或植物促生菌)能够缓解污染物对植物的胁迫。例如,在镉污染条件下接种内生真菌(Neotyphodium gansuense),可提高醉马草(Achnatherum inebrians)体内SOD、CAT等活性,降低镉胁迫产生的活性氧损伤(MDA质量摩尔浓度显著降低)(Zhang et al.,2010);甘蓝型油菜(Brassica napus)接种抗镉菌群后其生物量上升(Sheng et al.,2006)。本研究中,在DEHP污染条件下种植的玉米接种菌株XB后,根系SOD、CAT、PPO活性显著增加,表明细菌可能与玉米根系形成协同作用,其抗氧化酶系统被激活,有效地去除逆境中产生的超氧阴离子O2-及H2O2等活性氧自由基,降低污染胁迫,提高生物量(如高污染水平接种处理玉米生物量提高了85%)。当然,也可能是菌株XB降解了部分土壤中的DEHP,降低其胁迫作用,使得MDA质量摩尔浓度下降,酶活性提高,生物量亦随之提高。
另外,在污染土壤中接种微生物可以降低植物对污染物的吸收累积。例如,植入短芽孢杆菌(Brevibacillus brevis)和摩西球囊霉真菌(Glomus mosseae)都可增强三叶草(Trifolium)在镍胁迫下的生长能力,并降低其对镍的吸收积累(Vivas et al.,2006)。本研究中,玉米接种XB菌显著降低了根系对DEHP的吸收积累,这可能是由于菌株XB促进了玉米对土壤及植物体内DEHP的降解,也可能是由于菌株XB以土壤中的DEHP为共代谢基质将其降解,减少了土壤中DEHP的质量分数,进而导致玉米对DEHP的吸收积累下降。但菌株XB调节玉米植株体内生理生化、降低植物体内DEHP质量分数等机制仍有待进一步研究。
4 结论
在土壤DEHP不同质量分数污染胁迫下,玉米MDA显著增加,质膜过氧化损伤加剧,且高污染水平处理显著降低玉米生物量,玉米根系CAT和PPO活性显著增加,产生应激响应。接种降解菌XB可以显著降解MDA质量摩尔浓度,提高玉米体内SOD、CAT及PPO活性,缓解DEHP胁迫,降低玉米对DEHP的吸收积累,有利于保障农产品安全。
AN J, ZHOU Q X, SUN Y B, et al. 2009. Ecotoxicological effects of typical personal care products on seed germination and seedling development of wheat ( Triticum aestivum L. )[J]. Chemosphere, 76(10): 1428-1434.
CAI Q Y, MO C H, WU Q T, et al. 2008. The status of soil contamination by semivolatile organic chemicals (SVOCs) in China: a review [J]. Science of the Total Environment, 389(2-3): 209-224.
CAI Q Y, XIAO P Y, CHEN T, et al. 2015. Genotypic variation in the uptake, accumulation, and translocation of di-(2-ethylhexyl) phthalate by twenty cultivars of rice (Oryza sativa L.) [J]. Ecotoxicology and Environmental Safety, 116: 50-58.
HE L Z, GIELEN G, BOLAN N S, et al. 2015. Contamination and remediation of phthalic acid esters in agricultural soils in China: a review [J]. Agronomy for Sustainalbe Development, 35(2): 519-534.
MA T T, CHRISTIE P, LUO Y M, et al. 2014. Physiological and antioxidant responses of germinating Mung Bean seedlings to phthalate esters in soil [J]. Pedosphere, 24(1): 107-115.
MA T T, TENG Y, CHRISTIE P, et al. 2015. Phytotoxicity in seven higher plant species exposed to di-n-butyl phthalate or bis (2-ethylhexyl) phthalate [J]. Frontiers of Environmental Science & Engineering, 9(2): 259-268.
MENG X Z, WANG Y, XIANG N, et al. 2014. Flow of sewage sludge-borne phthalate esters (PAEs) from human release to human intake: Implication for risk assessment of sludge applied to soil [J]. Science of the Total Environment, 476-477: 242-249.
NIU L L, XU Y, XU C, et al. 2014. Status of phthalate esters contamination in agricultural soils across China and associated health risks [J]. Environmental Pollution, 195: 16-23.
SCHRODER P. 2007. Phytoremediation: Methods and reviews [M]. Totowa: Humana Press: 251-263.
SHENG X F, XIA J J. 2006. Improvement of rape (Brassica napus) plant growth and cadmium uptake by cadmium-resistant bacteria [J]. Chemosphere, 64(6): 1036-1042.
USEPA. 1996. Method 8270C Semivolatile organic compounds by gas chromatography-mass spectrometry(GC/MS) [S]. Revision 3ed. United States Environmental Protection Agency.
VIVAS A, BIRO B, NEMETH T, et al. 2006. Nickel-tolerant Brevibacillus brevis and arbuscular mycorrhizal fungus can reduce metal acquisition and nickel toxicity effects in plant growing in nickel supplemented soil [J]. Soil Biology & Biochemistry, 38(9): 2694-2704.
WANG J L, YUAN J G, YANG Z Y, et al. 2009. Variation in cadmium accumulation among 30 cultivars and cadmium subcellular distribution in 2 selected cultivars of water spinach(Ipomoea aquatica Forsk.) [J]. Journal of Agricultural and Food Chemistry, 57(19): 8942-8949.
WANG J, ZHANG M Y, CHEN T, et al. 2015. Isolation and identification of a di-(2-ethylhexyl) phthalate-degrading bacterium and its role in the bioremediation of a contaminated soil [J]. Pedosphere, 25(2): 202-211.
ZHANG X X, FAN X M, LI C J, et al. 2010. Effects of cadmium stress on seed germination, seedling growth and antioxidative enzymes in Achnatherum inebrians plants infected with a Neotyphodium endophyte [J]. Plant Growth Regulation, 60(2): 91-97.
ZHANG Y, WANG L, DU N, et al. 2014. Effects of diethylphthalate and di-(2-ethyl)hexylphthalate on the physiology and ultrastructure of cucumber seedlings [J]. Environmental Science and Pollution Research, 21(2): 1020-1028.
ZHAO H M, DU H, XIANG L, et al. 2015. Variations in phthalate ester (PAE) accumulation and their formation mechanism in Chinese flowering cabbage (Brassica parachinensis L.) cultivars grown on PAE-contaminated soils [J]. Environmental Pollution, 206: 95-103.
ZHAO H M, DU H, XIANG L, et al. 2016. Physiological differences in response to di-n-butyl phthalate (DBP) exposure between low- and high-DBP accumulating cultivars of Chinese flowering cabbage (Brassica parachinensis L.) [J]. Environmental Pollution, 208: 840-849.
蔡全英, 莫测辉, 李云辉, 等. 2005. 广州、深圳地区蔬菜生产基地土壤中邻苯二甲酸酯 (PAEs) 研究[J]. 生态学报, 25(2): 283-288.
曾巧云, 莫测辉, 蔡全英, 等. 2006. 邻苯二甲酸二丁酯在不同品种菜心-土壤系统的累积[J]. 中国环境科学, 26(3): 333-336.
常青, 郑宇铎, 高娜娜, 等. 2008. 邻苯二甲酸二乙基己酯对蚕豆根尖微核及幼苗超氧化物岐化酶的影响[J]. 生态毒理学报, 3(6): 596-600.
陈桐, 蔡全英, 吴启堂, 等. 2015. PAEs胁迫对高/低累积品种水稻根系形态及根系分泌低分子有机酸的影响[J]. 生态环境学报, 24(3): 494-500.
陈意良, 鲁磊安, 莫测辉, 等. 2016. DEHP胁迫对高/低累积邻苯二甲酸酯品种水稻抗氧化酶系统的影响[J]. 热带作物学报, 37(8): 1484-1488.
陈则友, 曹学章, 彭安萍, 等. 2012. AM真菌和水分条件对稀土尾矿堆中植物生长的影响[J]. 农业环境科学学报, 31(11): 2101-2107.
龚帅帅, 韩进, 高彦征, 等. 2011. 抑制剂和安全剂对高羊茅根中酶活性和菲代谢的影响[J]. 生态学报, 31(14): 4027-4033.
胡芹芹, 熊丽, 田裴秀子, 等. 2008. 邻苯二甲酸二丁酯 (DBP) 对斜生栅藻的致毒效应研究[J]. 生态毒理学报, 3(1): 87-92.
李德生, 高晶, 秦晓, 等. 2011. 2株真菌修复石油污染土壤及对植物幼苗生长的影响[J]. 天津理工大学学报, 27(3): 84-88.
李月灵, 金则新, 李钧敏, 等. 2015. 接种土壤微生物对铜胁迫下海州香薷生长及光合生理的影响[J]. 生态学报, 35(12): 3926-3937.
刘金光, 张玉秀, 史沛丽, 等. 2012. 镉对龙葵种子萌发及子叶抗氧化酶活性的影响[J]. 农业环境科学学报, 31(5): 880-884.
刘静, 周美利, 张楠, 等. 2015. 多环芳烃菲和芘对互花米草生长和生理特征的影响[J]. 南开大学学报: 自然科学版, 48(1): 14-20.
鲁磊安, 陈学斌, 赵海明, 等. 2016. 珠三角地区稻田土壤和谷粒中邻苯二甲酸酯(PAEs)的分布特征及人体健康暴露风险[J]. 农业环境科学学报, 35(7): 1242-1248.
王曙光, 林先贵, 尹睿, 等. 2003. 土壤中酞酸酯 (PAEs) 对丛枝菌根化植物生长的影响[J]. 农村生态环境, 19(1): 31-35.
夏民旋, 王维, 袁瑞, 等. 2015.超氧化物歧化酶与植物抗逆性[J]. 分子植物育种, 13(11): 2633-2646.
严青云, 向垒, 吴小莲, 等. 2016. 环丙沙星高、低积累菜心 (Brassica campestris L.) 抗氧化性能的差异[J]. 环境科学学报, 36(7): 2694-2700.
杨国义, 张天彬, 高淑涛, 等. 2007. 广东省典型区域农业土壤中邻苯二甲酸酯的分布特征[J]. 应用生态学报, 18(10): 2308-2312.
姚伦芳, 滕应, 刘方, 等. 2014. 多环芳烃污染土壤的微生物-紫花苜蓿联合修复效应[J]. 生态环境学报, 23(5): 890-896.
张慧芳, 苗艳明, 丁献华, 等. 2010. 邻苯二甲酸酯对小麦幼苗生理指标的影响[J]. 安徽农业科学, 38(7): 3374-3377.
周小梅, 赵运林, 董萌, 等. 2016. 芽孢杆菌T3菌株对镉胁迫下蒌蒿生理特性和根际微生物的影响[J]. 西北植物学报, 36(10): 2030-2037.
Alleviation of Phthalic Acid Ester (PAE) Stress on Maize by Inoculating PAEs-degrading Strain
CHEN Xuebin, ZHAO Haiming, MO Cehui, CAI Quanying*
School of Environment, Jinan University, Guangzhou 510632, China
Phthalic acid esters (PAEs) is a class of typical enviromnental endocrine disrupters.In China, the agricultural soil was generally contaminated by PAEs. PAEs in soil can affect plant growth and their physiological and biochemical characteristics, and also can be taken up and accumulated by crop which affects the safety of agricultural products. It is very urgent to explore the bioremediation technologies of PAEs contaminated soil and to investigate the alleviation of efficient PAE-degrading strain on PAE stress and reduction of PAE uptake and accumulation by crops. In this study, di(2-ethylhexyl) phthalate (DEHP), with higher detection frequency and concentrations among PAE compounds in soil, was selected as the target compound. Maize (Zea mays) was grown in DEHP contaminated soil with concentrations of 18 and 75 mg·kg-1(namely low and high DEHP treatment, respectively) by the pot experiment, and efficient PAE- degrading bacterium (Rhodococcus pyridinivorans XB) was inoculated in maize to investigate its alleviation of DEHP stress on maize growth and DEHP accumulation. Results show that soil DEHP significantly increased malondialdehvde (MDA) content of maize (P<0.05), especially for the root of high DEHP treatment (by 464%). Correspondingly, the maize biomass of the high DEHP treatment decreased significantly (P<0.05), even though the activities of superoxide dismutase and catalase of maize root significantly increased (P<0.05), indicating serious DEHP stress occurred on maize. Compared with non-inoculated microbe treatment, inoculating strain XB could significantly improve the activities of superoxide dismutase (by 10%~154%), catalase (by 11%~34%), polyphenol oxidase (by 48%~288%) and increase maize biomass (by 5%~85%), while reduced malondialdehvde content (by 30%~60%) and DEHP accumulation of maize (by 4%~60%). This suggests that the strain XB could alleviate the stress of DEHP on maize growth, reduce accumulation of DEHP in maize, which is helpful for ensuring the safety of agricultural products.
Di(2-ethylhexyl) phthalate; Rhodococcus pyridinivorans; maize; antioxidant enzyme system; accumulation
10.16258/j.cnki.1674-5906.2017.03.019
X172
A
1674-5906(2017)03-0493-07
陈学斌, 赵海明, 莫测辉, 蔡全英. 2017. 接种邻苯二甲酸酯(PAEs)降解菌缓解PAEs对玉米胁迫效应和机制研究[J]. 生态环境学报, 26(3): 493-499.
CHEN Xuebin, ZHAO Haiming, MO Cehui, CAI Quanying. 2017. Alleviation of phthalic acid ester (PAE) stress on maize by inoculating PAEs-degrading strain [J]. Ecology and Environmental Sciences, 26(3): 493-499.
国家自然科学基金项目(41573087;U1501233);广东省自然科学基金研究团队项目(1614060000034);广东省应用型科技研发专项项目(2016B020242005)
陈学斌(1991年生),男,硕士研究生,研究方向为有机污染土壤修复。E-mail: 340197081@qq.com *通信作者。蔡全英,E-mail: yingqy@126.com
2017-03-01

