Dowex Marathon A固相萃取-氢化物发生-原子荧光光谱法测定食品和水中硒含量
吴 航,姜效军,*,吕琳琳,2,艾 天
(1.辽宁科技大学化学工程学院,辽宁 鞍山 114051;2.鞍山师范学院化学与生命科学学院,辽宁 鞍山 114007)
Dowex Marathon A固相萃取-氢化物发生-原子荧光光谱法测定食品和水中硒含量
吴 航1,姜效军1,*,吕琳琳1,2,艾 天1
(1.辽宁科技大学化学工程学院,辽宁 鞍山 114051;2.鞍山师范学院化学与生命科学学院,辽宁 鞍山 114007)
建立食品和水样中硒的Dowex Marathon A固相萃取-氢化物发生-原子荧光光谱检测方法,基于Dowex Marathon A树脂交换技术消除食品和水中金属离子对硒含量测定的干扰。硒的检出限为0.013 μg/L,定量限为0.043 μg/L,线性定量范围为0.1~10.0 μg/L,线性相关系数为0.999 9,方法回收率不小于95%,相对标准偏差小于3%(n=11)。方法操作简单、灵敏度高、回收率好,适用于多种食品和水样中硒含量的测定,准确性通过标准物质验证,结果满意。
硒是人和动物的必需微量营养元素,具有重要的生理功能,在预防克山病、某些癌症和延缓衰老中发挥着重要作用[1-3]。我国2/3的地区缺硒,适当补充硒可以增强人体抗癌能力、提高免疫功能、防止人体过快衰老[4-5]。硒能加强VE的抗氧化作用,二者在这一生理功能上有协同作用[6-7]。所以,准确分析食品和水中的硒含量具有重要的现实意义。
测定硒的方法主要有联苯胺比色法[8]、石墨炉原子吸收法[9]、分光光度法[10]、电感耦合等离子体发射光谱法[11]、高效液相色谱法[12]、氢化物-原子荧光光谱法[13-14],其中氢化物-原子荧光光谱法具有操作简单、干扰少、灵敏度高等诸多特点[15]。但是如果在基体干扰并且硒元素浓度较低的情况下,想要直接检测出样品中的硒含量是非常困难的[16]。常用分离富集技术有离子交换法[17-18]、浊点萃取法[19]、溶剂萃取法[20]、沉淀法[21]、深共晶溶剂萃取法[22]、离子液体法[23]和固相萃取法等诸多方法[24-25]。然而,离子交换法缺乏选择性,浊点萃取法的局限性是金属元素分配系数相对较低,溶剂萃取法需要使用大量有机溶剂,深共晶溶剂在室温条件下黏度较高限制了其作为萃取剂的应用,离子液体法的缺点为毒性较大,成本较高[26]。固相萃取技术是目前常用的样品前处理方法,其操作简单,富集效率高,回收率好[27-29]。
Dowex Marathon A(DMA)是一种为除盐而使用的均粒性树脂。小颗粒的均粒树脂展现出比传统粒径树脂更快的动力性,改良的动力学带来了更好的再生效率,更高的运行交换容量。本实验提出一种快速、准确分离食品和水中硒的固相萃取方法,并通过原子荧光光谱法进行定量分析。该方法是基于DMA树脂对微量金属离子的保留提出的,目前还鲜见使用这种树脂来进行此类分离富集的相关报道。
1 材料与方法
1.1 材料与试剂
豆(n=2)、果蔬(n=7)、草本植物(n=6)、肉制品(n=8)、香料(n=16)、面粉(n=1)、饮料(n=5) 于辽宁鞍山地区购买;DMA树脂 莱特莱德北京水处理设备公司;浓硝酸、双氧水(均为优级纯)美国Aladdin公司;标准物质GBW10014(GSB-5圆白菜) 中国地质科学院地球物理地球化学勘察研究所;硒标准溶液(GBW(E)080215,100 mg/L) 中国计量科学研究院;实验用水均为超纯水(电阻率18.2 MΩ·cm,25 ℃)。标准使用液每天用超纯水稀释制备,1.0 g DMA树脂用于固相萃取。
1.2 仪器与设备
AFS-930双道原子荧光光度计 北京吉天仪器有限公司;MARS微波消解仪 美国CEM公司;Milli-Q Academic超纯水机 美国Millipore公司;Orion-star A211台式PH/ORP测量仪 美国Thermo Electron公司。实验用聚四氟乙烯容器、玻璃容器均在1∶3硝酸中浸泡48 h以上,用超纯水冲洗3 次备用。
1.3 方法
1.3.1 样品预处理及标准溶液配制
用超纯水将豆类、蔬菜、水果和草本植物等清洗干净,将有壳的样品研磨备用。然后,70 ℃条件下干燥24 h,肉制品110 ℃条件下干燥48 h。硒标准溶液:取100 μg/mL硒标准储备液10.0 mL,定容至100 mL。
1.3.2 固相萃取
取6 mL SPE空柱管,在底部铺上筛板,装入DMA树脂,轻轻敲打使填料均匀填充避免过柱时出现大量的气泡,压好筛板,即得自制SPE小柱。使用前用pH值为4.5的稀盐酸活化,保持柱体湿润。取25 mL含5 μg/L硒(Ⅳ)溶液,样品溶液和洗脱液的流速控制为2.0 mL/min。样品溶液流出后,用少量超纯水冲洗柱子,再用25 mL浓度为0.3 mol/L硝酸溶液洗脱。
1.3.3 硒含量的测定
称取样品0.300 0 g左右(精确至0.000 1 g)于聚四氟乙烯消解管中,加4 mL浓硝酸浸泡过夜,次日加3 mL H2O2程序升温进行消解,同时做空白实验。消解完全后,样液澄清透明,150 ℃条件下赶酸至近干。加入盐酸2.0 mL,100 g/L铁氰化钾溶液1.0 mL,用超纯水定容至25 mL,再用KH2PO4-H3PO4缓冲液调节pH值至4.5。
收集固相萃取洗脱液蒸发浓缩至2 mL,浓度为0.5 mol/L硝酸溶液,最后用原子荧光光谱法测定洗脱液中的金属含量。
1.3.4 仪器条件
原子化器高度8 mm;灯电流60 mA;载气流量300 mL/min;屏蔽气流量1 000 mL/min;原子化温度800 ℃;光电倍增管负高压300 V;延迟时间1 s;读数时间8 s;进样体积1 mL。
2 结果与分析
2.1 标准曲线
配制质量浓度为10 μg/L的硒标准溶液,按仪器工作条件测定标准溶液吸光度,以硒质量浓度(μg/L)为横坐标,荧光强度为纵坐标,绘制标准曲线y=67.875 1x+ 6.287 7,R2为0.999 9,测定质量浓度在0.1~10.0 μg/L线性关系良好,适用于样品的测定分析。
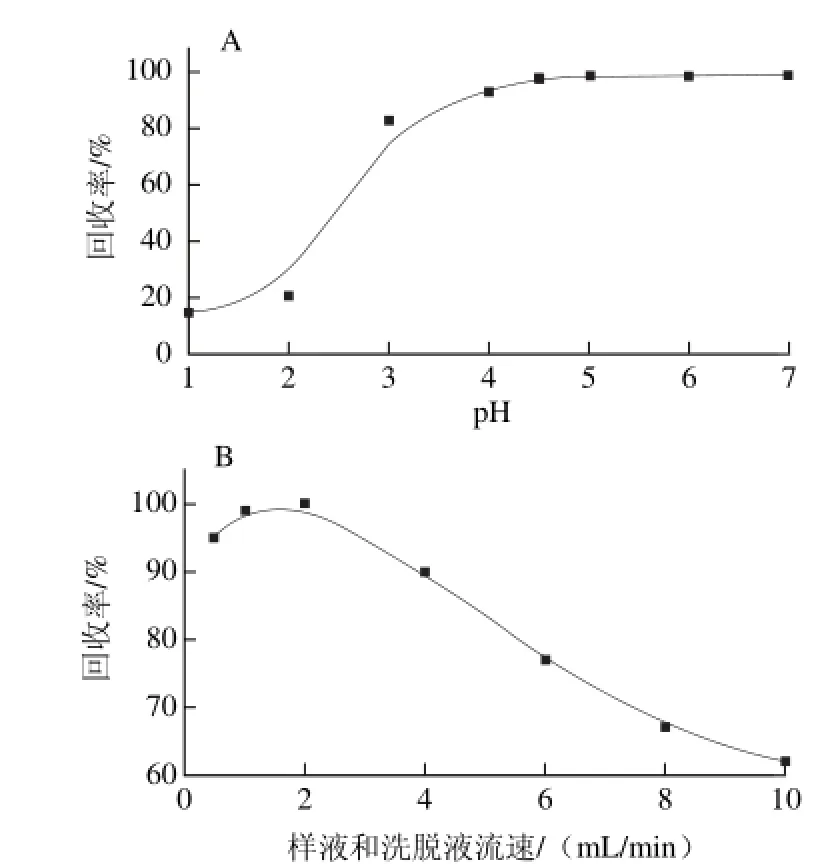
图 1 pH值(A)、样液和洗脱液流速(B)对回收率的影响Fig. 1 Effect of pH and flow rates of sample and eluent on recovery of 100 mg/L Se (Ⅳ) on DMA
2.2 pH值及样液和洗脱液流速的考察在固相萃取中,溶液的pH值是影响回收率的关键参数。研究pH值在1.0~7.0的范围内对硒(Ⅳ)离子回收率的影响。缓冲溶液分别为HCl-KCl缓冲液pH 1.0~2.0,
KH2PO4-H3PO4缓冲液pH 3.0~5.0,KH2PO4-NaOH缓冲液
pH 6.0~7.0。如图1A可知,在pH值范围为4.0~7.0时,回收率达到95%以上,当pH值为4.5时,回收率达到最高。在缓冲液pH值为4.5,洗脱液为25 mL 0.3 mol/L硝酸条件下考察样液和洗脱液流速对回收率的影响。如图1B所示,在0.5~10 mL/min的范围内,流量通过柱旋塞调整,当流速为2 mL/min时,金属离子的回收率最高为
100%,所以样液和洗脱液流速选择2 mL/min。
2.3 洗脱液类型、浓度和体积的考察

表 1 不同体积和浓度的盐酸与硝酸对回收率的影响Table 1 Effects of volumes and concentrations of HCl and HNO3solutions on the recovery of the analyte
对树脂上吸附硒(Ⅳ)的洗脱,分别以不同浓度和体积的稀酸溶液洗脱,如表1所示。25 mL浓度为0.3 mol/L硝酸溶液对金属离子能够完全洗脱。所以,选取体积为25 mL浓度为0.3 mol/L硝酸溶液作为实验的洗脱液。
2.4 树脂用量的考察
在pH 4.5,洗脱液为25 mL 0.3 mol/L硝酸溶液,样液和洗脱液流速为2 mL/min条件下研究树脂用量对金属离子的吸附影响。结果表明,回收率随着树脂用量的增加而升高,当树脂用量为1.0 g时,回收率达到100%。树脂超过1.0 g后,由于洗脱液不足,金属离子的回收率降低。当增加洗脱液体积后,回收率不变。
2.5 基质离子的考察
Au3+、Ag+、Fe3+、Co2+、Ni2+、Cu2+、Zn2+等离子会对硒含量的测定存在干扰[30-31],加入一定量的铁氰化钾作掩蔽剂可以消除这些离子对硒检测的干扰,并且可以在原子化器内较好地生成硒化氢。结果表明,当铁氰化钾质量浓度在10.0 μg/L时基本消除了干扰,并且对原子荧光信号无影响,从而保证结果的准确性。
2.6 检出限、标准差和富集因子结果
将空白溶液的pH值(25 mL,n=11)用KH2PO4-H3PO4缓冲溶液调节至pH 4.5,然后富集分析。方法的检出限,为3 倍空白溶液的标准偏差,为0.013 μg/L,定量限为10 倍空白溶液的标准偏差,为0.043 μg/L。在优化条件下,对硒质量浓度10.0 μg/L溶液进行连续11 次的循环洗脱,用原子荧光光谱法定量,相对标准偏差低于3%。如表2所示,当样品体积为500 mL时,回收率保持不变,计算得硒(Ⅳ)富集因子为250。
表 2 样品体积对分析物回收率的影响(n=3)Table 2 Effect of sample volume on the recovery of the analyte (n= 3)

表 2 样品体积对分析物回收率的影响(n=3)Table 2 Effect of sample volume on the recovery of the analyte (n= 3)
样品体积/mL1002003004005006007008001 000回收率/%100±1 100±1 99±1 99±1 97±1 94±1 93±1 92±1 92±1
2.7 精密度和准确性实验结果

表 3 样品检测的准确性(n=3)Table 3 Results of accuracy test for real samples (n = 3)
将已知量的硒(Ⅳ)添加到水样和食品样品中,进行富集分析,如表3所示。添加量和实际测定值达到很好的吻合,回收率均高于95%,从而可以确认该方法的准确性。
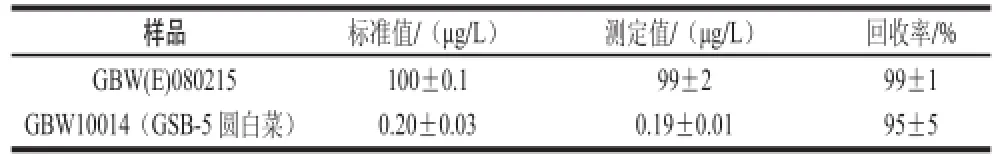
表 4 通过固相萃取方法测定标准物质中硒含量(n=3)Table 4 Results of Se determination in standard reference materials by using the presented pre-concentration procedure (n = 3)
验证固相萃取的准确性,将标准物质GBW(E)080215和GBW10014(GSB-5 圆白菜)分析检测。如表4所示,测定值和标准值可以达到很好的吻合。

表 5 通过固相萃取测定分析物中硒含量(n=3)Table 5 Results of Se determination in some food samples by application of the proposed solid phase extraction procedure (n = 3) μg/kg
将方法应用到食品样品中硒元素的分离和富集,如表5所示,硒含量最高的是鱼肉为15.06 μg/kg,鸡肉和肉桂分别为10.07 μg/kg和8.79 μg/kg,本方法可应用于食品和水中硒含量的测定。
3 结 论
本实验使用DMA树脂作为吸附剂的固相萃取法被用于分离富集硒(Ⅳ)离子,用原子荧光光谱法测定多种食品样品和水中硒含量。对于可能存在的干扰进行分析,并没有找到明显的干扰。通过分析标准物质,对于方法的准确性进行验证,本方法具有简单方便、准确、成本低廉等优点。为食品和水中硒含量的测定提供完善的检测方法。
[1] HATFIELD D L, TSUJI P A, CARLSON B A. Selenium and selenocysteine: roles in cancer, health, and development[J]. Trends in Biochemical Sciences, 2014, 39(3): 112-120. DOI:10.1016/ j.tibs.2013.12.007.
[2] PATRICK L. Selenium biochemistry and cancer: a review of the literature[J]. Alternative Medicine Review, 2004, 9(3): 239-258.
[3] AMOAKO P O, UDEN P C, TYSON J F. Speciation of selenium dietary supplements[J]. Analytical Chemistry Acta, 2009, 652(3): 315-323. DOI:10.1016/j.aca.2009.08.013.
[4] 张贵花. 硒的生物学功能及其抗癌机理研究进展[J]. 中国饲料添加剂, 2011(12): 11-13.
[5] REID M E, DUFIELD L A J, SLATE E, et a1. The nutritional prevention of cancer: 400 mcg per day selenium treatment[J]. Nutrition and Cancer, 2008, 60(2): 155-163. DOI:10.1080/01635580701684856.
[6] EDYTA R, EDYTA W, EWA J, et al. Association between plasma selenium level and NRF2 target genes expression in humans[J]. Journal of Trace Elements in Medicine and Biology, 2015, 30: 102-106. DOI:10.1016/j.jtemb.2014.11.008.
[7] MARCO V, PETER G, CARLOTTA M, et al. Selenium speciation in human serum and its implications for epidemiologic research: a crosssectional study[J]. Journal of Trace Elements in Medicine and Biology, 2015, 31: 1-10. DOI:10.1016/j.jtemb.2015.02.001.
[8] 陈懿. 固相分光光度法测定食品中的痕量硒[J]. 贵州农业科学, 2012, 40(4): 62-65. DOI:10.3969/j.issn.1001-3601.2012.04.018.
[9] MANJUSHA R, DASH K, KARUNASAGAR D. UV-photolysis assisted digestion of food samples for the determination of selenium by electrothermal atomic absorption spectrometry (ETAAS)[J]. Food Chemistry, 2007, 105: 260-265. DOI:10.1016/ j.foodchem.2006.11.011.
[10] 刘有芹, 杨庆辉, 黄函, 等. 紫外分光光度法测定枸杞子、陈皮、生姜中硒含量[J]. 理化检验: 化学分册, 2010, 46(3): 329-330.
[11] 熊晓燕, 张永进, 王津. 电感耦合等离子体-原子发射光谱法测定高纯硒中18 种杂质元素[J]. 冶金分析, 2010, 30(7): 35-38. DOI:10.3969/j.issn.1000-7571.2010.07.008.
[12] 施能进. 高效液相色谱法测定蛋氨酸硒[J]. 饲料研究, 2011(3): 40-41. [13] BUNKER V W, DELVES H T. Accurate determination of selenium in biological materials without perchloric acid for digestion[J]. Analytica Chimica Acta, 1987, 201: 331-334. DOI:10.1016/S0003-2670(00)85354-4.
[14] SEHLOSKE L, WALDNER H, MARX F. Optimization of sample pretreatraent in the HG-AAS selenium analysis[J]. Analytical Biochemistry, 2002, 372(2): 700-704. DOI:10.1007/s00216-001-1229-z.
[15] LAVILLA I, GONZALEZ-COSTAS J M, BENDICHO C. Improved microwave-assisted wet digestion procedures foraccurate Se determination in fish and shellfish by flow injection-hydride generation-atomicabsorption spectrometry[J]. Analytica Chimica Acta, 2007, 591(2): 225-230. DOI:10.1016/j.aca.2007.03.075.
[16] SACMACI S, KARTAL S, SACMACI M. Selective separation and preconcentration of Fe(Ⅲ) and Zn(Ⅱ) ions by solvent extraction using a new triketone reagent[J]. Clean-Soil Air Water, 2011, 39(6): 584-590. DOI:10.1002/clen.201000291.
[17] AMIN N K, ABDELWAHAB O, ELASHTOUKHY E S Z. Removal of Cu(Ⅱ) and Ni(Ⅱ) by ion exchange resin in packed rotating cylinder[J]. Desalination and Water Treatment, 2015, 55: 199-209. DOI: 10.1080/19443994.2014.913208.
[18] NABI S A, ALIMUDDIN, ISLAM A. Synthesis and characterization of a new cation exchanger-zirconium(Ⅵ) iodotungstate: separation and determination of metal ion contents of synthetic mixtures, pharmaceutical preparations and standard reference material[J]. Journal of Hazardous Materials, 2009, 172: 202-207. DOI:10.1016/ j.jhazmat.2009.06.168.
[19] SHOKROLLAHI A, GHAEDI M, HOSSAINI O, et al. Cloud point extraction and flame atomic absorption spectrometry combination for copper(Ⅱ) ion in environmental and biological samples[J]. Journal of Hazardous Materials, 2008, 160: 435-440. DOI:10.1016/ j.jhazmat.2008.03.016.
[20] JHA M K, GUPTA D, CHOUBEY P K, et al. Solvent extraction of copper, zinc, cadmium and nickel from sulphate solution in mixer settler unit (MSU)[J]. Separation and Puri cation Technology, 2014, 122: 119-127. DOI:10.1016/j.seppur.2013.10.045.
[21] KOMJAROVA I, BLUST R. Comparison of liquid-liquid extraction, solid-phase extraction and co-precipitation preconcentration methods for the determination of cadmium, copper, nickel, lead and zinc in seawater[J]. Analytica Chimica Acta, 2006, 576: 221-228. DOI:10.1016/j.aca.2006.06.002.
[22] KARIMI M, DADFARNIA S, HAJI S A M, et al. Deep eutectic liquid organic salt as a new solvent for liquid-phase microextraction and its application in ligand less extraction and pre-concentration of lead and cadmium in edible oils[J]. Talanta, 2015, 144: 648-654. DOI:10.1016/ j.talanta.2015.07.021.
[23] LEYMA R, PLATZER S, JIRSA F, et al. Novel thiosalicylate-based ionic liquids for heavy metal extractions[J]. Journal of Hazardous Materials, 2016, 314: 164-171. DOI:10.1016/j.jhazmat.2016.04.038.
[24] DAS D, GUPTA U, DAS A K. Recent developments in solid phase extraction in elemental speciation of environmental samples with special reference to aqueous solutions[J]. TrAC Trends in Analytical Chemistry, 2012, 38: 163-171. DOI:10.1016/j.trac.2011.01.020.
[25] TOBIASZ A, WALAS S. Solid-phase-extraction procedures for atomic spectrometry determination of copper[J]. Trends in Analytical Chemistry, 2014, 62: 106-122. DOI:10.1016/j.trac.2014.06.018.
[26] DAI Y, WITKAMP G J, VERPOORTE R, et al. Natural deep eutectic solvents as a new extraction media for phenolic metabolites in Carthamus tinctorius L.[J]. Analytical Chemistry, 2013, 85: 6272-6278. DOI:10.1021/ac400432p.
[27] JIANG Donglei, SUN Xiulan, ZHANG Yinzhi. Preparation and application of acrylamide molecularly imprinted solid-phase extraction materials[J]. Analytical Methods, 2012, 4(11): 3760-3766. DOI:10.1039/C2AY25814E.
[28] TEKKELI S E, ONAL C, ONAL A. A review of current methods for the determination of acrylamide in food products[J]. Food Analytical Methods, 2012, 5(1): 29-39. DOI:10.1007/s12161-011-9277-2.
[29] 程雷, 郑炎夏, 徐虹, 等. 固相萃取-高效液相色谱-串联质谱法测定食品中的丙烯酰胺[J]. 食品科学, 2012, 33(2): 231-234.
[30] 徐宝玲. 氢化物原子荧光法测定硒时元素的干扰及其消除[J]. 分析化学, 1985, 13(1): 29-33.
[31] 王震, 范世华, 方肇伦. 顺序注射蒸汽发生非色散原子荧光光谱
Determination of Se in Food and Water Samples by Solid Phase Extraction-Hydride Generation-Atomic Fluorescence Spectroscopy
WU Hang1, JIANG Xiaojun1,*, LÜ Linlin1,2, AI Tian1
(1. College of Chemical Engineering, University of Science and Technology Liaoning, Anshan 114051, China; 2. School of Chemistry and Life Science, Anshan Normal University, Anshan 114007, China)
A solid phase extraction method coupled with hydride generation-atomic fluorescence spectrometry (HGAFS) method was developed for the determination of Se in various food and water samples. The method was based on the retention of the trace metal ions on Dowex Marathon A ion exchange resin for eliminating the interference from co-existing metal ions. The limits of detection (LOD) for Se (Ⅳ) was 0.013 μg/L, while the limit of quanti cation (LOQ) was 0.043 μg/L. The linear range was in the range of 0.110.0 μg/L (R2= 0.999 9). The relative standard derivation was less than 3% for 11 parallel determinations. The recovery was more than 95%. The method was rapid, accurate and precise, and its accuracy was satisfactorily veri ed by using it to analyze certi ed reference materials.
solid phase extraction; Dowex Marathon A; atomicuorescence spectrometry; food samples; selenium
定环境样品中痕量硒[J]. 分析化学, 2005, 33(2): 195-197.
10.3321/j.issn:0253-3820.2005.02.012.
DOI:10.7506/spkx1002-6630-201710034
O657.31
A
1002-6630(2017)10-0204-04
吴航, 姜效军, 吕琳琳, 等. Dowex Marathon A固相萃取-氢化物发生-原子荧光光谱法测定食品和水中硒含量[J]. 食品科学, 2017, 38(10): 204-207. DOI:10.7506/spkx1002-6630-201710034. http://www.spkx.net.cn
WU Hang, JIANG Xiaojun, LÜ Linlin, et al. Determination of Se in food and water samples by solid phase extraction-hydride generation-atomic fluorescence spectroscopy[J]. Food Science, 2017, 38(10): 204-207. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201710034.http://www.spkx.net.cn
2016-08-18
辽宁鞍山市高端人才培养计划项目(20153743)
吴航(1982—),男,博士研究生,研究方向为食品中重金属。E-mail:aswuhang@sina.com
*通信作者:姜效军(1961—),男,教授,博士,研究方向为食品中重金属、电化学。E-mail:anshanjiangxj@163.com
固相萃取;Dowex Marathon A树脂;原子荧光;食品样品;硒

