壳聚糖-埃洛石纳米管微球的制备及 其对木瓜蛋白酶的固定化
丁利君,瞿叶辉,刘 丹
(广东工业大学轻工化工学院,广东 广州 510006)
壳聚糖-埃洛石纳米管微球的制备及 其对木瓜蛋白酶的固定化
丁利君,瞿叶辉,刘 丹
(广东工业大学轻工化工学院,广东 广州 510006)
运用交联-吸附法制备壳聚糖-埃洛石纳米管(chitosan-halloysites nanotube,CTS-HNTs)复合微球固定木瓜蛋白酶,并通过傅里叶红外光谱、扫描电子显微镜、荧光标记等方法进行表征。2% CTS+1% HNTs制备的微球对木瓜蛋白酶的固定量最高。固定化条件为木瓜蛋白酶质量浓度1 mg/mL、固定化时间10 h。固定化木瓜蛋白酶最适pH 6.8(游离酶pH 7.2)、最适温度60 ℃(游离酶50 ℃),保存30 d该酶相对活性为62%(游离酶27%),使用4 次后,木瓜蛋白酶的相对活性仍然保留26. 26%。 CTS-HNTs微球固定化木瓜蛋白酶耐贮存,操作稳定性强,可以提高酶的利用率,降低酶解的成本,提高生产效率。
壳聚糖-埃洛石;微球;固定化;木瓜蛋白酶
酶的固定化是用固体材料将酶束缚或限制于一定区域内,仍具有特定的催化反应、并可回收及重复使用的一类技术[1],易于与底物、产物分离,便于后续的分离和纯化,增加产物的产率,节约成本,适于产业化、连续化、自动化生产[2]。酶的固定化方法有物理方法(主要包括包埋法[3-4]、吸附法[5-7])、化学方法(主要有交联法[8-9]和共价键法[10-13])。固定化载体的选择是酶固定化技术的关键因素之一,要求载体不溶于水,有大的比表面积和多孔结构,带有与酶发生反应的官能团,机械刚性和稳定性好。天然高分子载体最大的特点是无毒性,传质性能好,近年研究比较热门的天然高分子载体如壳聚糖(chitosan,CTS)、海藻酸钠和纤维等,在厌氧条件下易被微生物所分解,使用寿命较短,在一定程度上限制其应用[14];常用的合成高分子载体为聚丙烯、聚丙烯酰胺、聚丙烯腈等[14]虽能经受微生物的作用,但耐热性较差;无机材料有较好的刚性和稳定性,而酶与无机载体之间的离子相互作用对酶活的影响比较大[15]。将有机材料和无机材料组成新的复合载体是近年固定化酶载体研究的热点之一[16-17]。CTS和埃洛石纳米管(halloysite nanotube,HNTs)由于各自材料的优越性,引起了越来越多的关注与研究。
CTS即聚葡萄糖胺(1-4)-2-氨基-β-D葡萄糖,只溶于稀盐酸、硝酸等无机酸和部分有机酸,具有良好的相容性、安全性和微生物降解性[18]。HNTs是天然存在的1∶1二八面体高岭土系矿物,是近年来材料相关领域研究的热点[19],HNTs具有纳米中空管状结构,比表面积、吸附性高,易负载各种微粒包括酶[20-23]。CTS-HNTs微球是通过CTS包埋HNTs而形成,具有较多孔状及球状结构的微球,增加负载酶的量,提高酶 活的保存性。Zhai Rui等[24]以CTS和HNTs为原料制备混合纳米管固定辣 根过氧化 物酶,有效提高去除废水中苯酚的效率。
木瓜蛋白酶活性高、热稳定性强,被广泛应用于食品、日化等多个行业。但游离的木瓜蛋白酶重复使用受限,热稳定性、酸碱稳定性和贮存稳定性较差。有研究表明,与游离酶相比,通过 不同载体固定的木瓜蛋白酶的最适反应pH值、最适温度、酸碱稳定性、热稳定性和贮存稳定性等方面都得到很大的改善。何平等[25]用海藻酸钠和CTS固定化木瓜蛋白酶,并用于催化合成Trp-Phe-NH2,产率达27.8%。本研究通过对CTS和HNTs的改性,以包埋的方式,采用中和沉淀法,制备CTS-HNTs微球;以戊二醛为交联剂,通过交联-吸附,固定木瓜 蛋白酶,并对其进行表征分析,以提高木瓜蛋白酶的利用率。
1 材料与方法
1.1 材料与试剂
CTS 浙江金壳生物化学有限公司;HNTs 远鑫纳米科技公司;L-酪氨酸 阿拉丁试剂公司;木瓜蛋白酶(800 U/mg) 广州市华琪生物科技有限公司;酪蛋白、L-半胱氨酸 美国Sigma公司;磷酸二氢钠、乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA)等均为国产分析纯。
激活剂溶液为半胱氨酸20 mmol/L、EDTA 1 mmol/L的混合液,用0.1 mol/L磷酸缓冲液配制(pH 7.2)。
1.2 仪器与设备
JY92-IIDN超声波细胞粉碎机 宁波新芝生物科技股份有限公司;UV-1200型紫外-可见分光光度计上海美普达仪器有限公司;Nicolet 6700型傅里叶红外光谱仪 美国赛默飞世尔科技公司;S-3400N型扫描电子显微镜 日本日立公司;STA 409 PC型热 综合分析仪德国Netzsch公司。
1.3 方法
1.3.1 CTS-HNTs微球的制备
称取一定量HNTs溶于蒸馏水中,超声处理(功率300 W,空占比1∶1)15 min,制备均匀悬浮液;称取一定量的CTS,加入2%的醋酸溶液,磁力搅拌4 h,除气泡,制备透明CTS溶液。二者分别以不同比例用量(1% CTS+1% HNTs、2% CTS+2% HNTs、1% CTS+ 2% HNTs、2% CTS+1% HNTs、2% CTS、1% CTS)制备CTS-HNTs微球。将HNTs溶液边搅拌边缓慢加入相等体积的CTS溶液中,持续搅拌4 h后,用装有5号针头的注射器将CTS-HNTs溶液逐滴滴到凝结液(2 mol/L NaOH溶液)中,制备CTS-HNTs微球,然后用蒸馏水浸泡,室温放置12 h,换水清洗至中性,4 ℃保存。
1.3.2 木瓜蛋白酶的CTS-HNTs微球固定
称取1 g CTS-HNTs微球(湿球),加入10 mL 5%戊二醛溶液,室温恒温振荡3 h,进行交联,然后用蒸馏水清洗,再用0.1 mol/L磷酸钠缓冲溶液(pH 7.2)清洗,直至洗液中无戊二醛。加入2 mL 1 mg/mL的木瓜蛋白酶溶液,4 ℃固定化12 h,用0.1 mol/L磷酸钠缓冲溶液(pH 7.2)清洗,至溶液中无游离木瓜蛋白酶,4 ℃冷藏待用。比较不同比例的CTS、HNTs制备的微球的固定化效果,研究酶质量浓度、固定时间、pH值等因素对木瓜蛋白酶固定量的影响,分析CTS-HNTs微球固定木瓜蛋白酶的最适pH值、最适温度、pH值稳定性、热稳定性。
1.3.3 固定量及酶活性测定
木瓜蛋白酶固定量测定:当固定化过程结束后,将上清液与微球颗粒分离,清洗颗粒至洗液中不含游离木瓜蛋白酶,将上清液与洗液合并,于280 nm波长处测定吸光度,固定量计算如式(1)所示:

式中:P为木瓜蛋白酶固定量/(mg/g);Ca为加入木瓜蛋白酶溶液质量浓度/(mg/mL);Va为加入木瓜蛋白酶溶液的体积/mL;Vb为固定后上清液与洗液的体积/mL;Cb为未被固定的酶,即上清液与洗液中木瓜蛋白酶质量浓度/(mg/mL);m为微球载体质量/g。
游离木瓜蛋白酶活性测定:按照GB/T 23527—2009《蛋白酶制剂》的方法配制酪氨酸溶液并绘制标准曲线,参考易喻等[26]的方法并作改进,测定木瓜蛋白酶的活性。移取0.1 mL的木瓜蛋白酶溶液,并加入0.9 mL激活剂,置于37 ℃水浴10 min,再加入1 mL底物酪蛋白,混匀,37 ℃反应10 min后,立即加入3 mL 5%的三氯乙酸溶液剧烈振荡,终止反应。静置30 min后,于4 000 r/min离心10 min,取上清液测定275 nm波长处的吸光度。空白试样在加入底物酪蛋白之前,先加入三氯乙酸终止反应。酶活性的计算如式(2)所示:

式中:A为试样品酶解溶液的吸光度;A0为对照样品酶解溶液的吸光度;K为酪氨酸标准曲线斜率;V为酶解溶液的体积/mL;t为反应时间/h;n为稀释倍数;m为酶量/(mg/mL)。
固定化木瓜蛋白酶的活性测定:取待用的固定化木瓜蛋白酶的CTS-HNTs微球,加入1 mL激活剂,其他步骤同游离酶活性的测定。
1.3.4 CT S-HNTs微球固定化木瓜蛋白酶的表征
红外光谱分析:采用傅里叶变换红外光谱仪,分别对CTS、CTS-HNTs复合微球及固定化木瓜蛋白酶的化学结构进行分析。将样品干燥后磨成粉状,进行压片,再放置于红外光谱仪中进行扫描分析。
微观结构分析:采用扫描电子显微镜对CTS-HNTs微球固定化 木瓜蛋白酶表面形态及内部结构进行分析。将CTS-HNTs微球样品表面镀金60 s后,在15 kV的测试电压条件下,观测CTS-HNTs微球物理形态的变化。
热重分析:将CTS-HNTs微球自然风干后,与CTS、HNTs粉末进行热重分析。分析条件:温度范围:室温到600 ℃,升温速率:10 ℃/min,气氛:N2,研究热降解行为。
2 结果与分析
2.1 CTS-HNTs微球的制备及其对木瓜蛋白酶固定化效果
分别以不同比 例的CTS和HNTs制备微球,观察各种微球的破损度、饱满度。由图1a可知,复合微球中,1%的CTS由于质量分数太小,不足以包埋同质量分数的HNTs,无法形成规则饱满的微球;2% CTS+1% HNTs制备的微球,球形较饱满,破损少,微球成型规则,制球效果好。将二者充分搅拌混匀制备悬浮液,CTS溶液将HNTs包埋,然后将悬浮液中和沉淀,制备CTS-HNTs微球(图1b)。通过吸附-交联方法,CTS-HNTs微球与戊二醛发生交联反应,生成席夫碱;交联后CTS-HNTs微球上的另一端醛基与酶上的氨基发生美拉德反应,生成席夫碱,使得木瓜蛋白酶交联在CTS-HNTs微球上[27],由于CTS-HNTs微球内部孔隙较多,木瓜蛋白酶可通过吸附作用进入微球内部。

图 1 CTS-HNTs微球的制 备及其对木瓜蛋白酶的固定化Fig. 1 Preparation of CTS-HNTs microspheres and immobilization of papain onto them
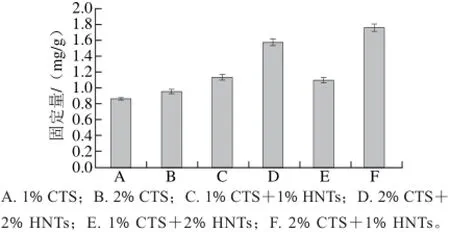
图 2 不同CTS和HNTs比例制成微球的酶固定量Fig. 2 Effect of different CTS/HNTs ratios on the enzyme immobilization capacity of microspheres
由图2可知,2% CTS+1% HNTs时,微球饱满度好,对木瓜蛋白酶的固定量最高。2.2 CTS-HNTs微球对木瓜蛋白酶固定化的表征分析
2.2.1 傅里叶红外光谱分析
将样品干燥后磨成粉状,再进行压片,再放置于红外光谱仪中进行扫描分析。图3E是HNTs的红外光谱图,在3 695 cm-1和3 621.6 cm-1处是HNTs表面的O—H振动,在1 630.2 cm-1处是O—H变形振动,Si—O的面内伸缩振动位于1 031.8 cm-1,910 cm-1处为Si—O的垂直伸缩振动;图3D是CTS的红外光谱图,3 425.9 cm-1附近为—OH和—N—H的伸缩振动峰,聚合物骨架的—CH伸缩振动峰位于2 878.9 cm-1附近,1 659.7 cm-1与1 087 cm-1处为C=O和C—O—C的伸缩振动,—NH的变形振动位于1 380 cm-1处;图3A是CTS与HNTs按2% CTS+ 1% HNTs比例制成球后的红外光谱图,图谱特征综合了两者的特征;图3B是CTS-HNTs复合微球经戊二醛交联后的红外光谱图,戊二醛的醛基与CTS上的氨基通过聚合作用生成席夫碱,而图谱上1 564.4 cm-1处的峰为—C=N—的伸缩振动,恰好验证了席夫碱的生成,使得复合微球的化学结构更加稳定;图3C是CTSHNTs复合小球经戊二醛交联后,再加入木瓜蛋白酶进行固定化得到的红外光谱图,木瓜蛋白酶上的—NH与戊二醛的醛基交联生成席夫碱,从图谱中可看出1 564.6 cm-1处有—C=N—的伸缩振动,并且相比于经戊二醛交联后的CTS-HNTs微球而言,有稍微增强的趋势,但是由于木瓜蛋白酶结合量较少,增强的强度不明显。红外结果表明,木瓜蛋白酶已经由化学交联结合到CTS-HNTs复合微球上。
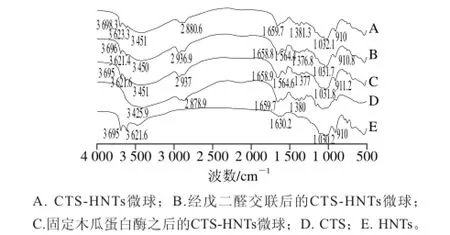
图 3 红外光谱分析Fig. 3 Infrared spectra of microsphere samples
2.2.2 扫描电子显微镜分析
将样品表面镀金60 s后,在15 kV的测试电压下,通过扫描电子显微镜观测表面及横切面的形态变化。图4结果表明,交联后的CTS-HNTs微球表面孔隙增加,球形更紧密,结构更稳定,更有利于蛋白酶的固定及包埋。微球固定木瓜蛋白酶后,其表面及横切面明显增加了细小的点状物,结构更紧密(图4b、4c)。这是由于微球表面和横切面的木瓜蛋白酶分子,既与戊二醛交联,也与CTS上的氨基交联,生成两个席夫碱,使其结构更加紧密,这与红外光谱图的结果一致。

图 4 样品扫描电子显微镜图Fig. 4 SEM images of microsphere samples
2.2.3 热重分析

图 5 微球样品热重分析Fig. 5 TG analysis of microsphere samples
从图5可看出,HNTs的热稳定性最高,质量损失较少。在270 ℃时CTS分解加速,可能是CTS链发生了降解,CTS-HNTs微球的质量损失显低于CTS。CTS质量损失5%时温度是57 ℃,CTS-HNTs微球质量损失5%时温度为146 ℃;270 ℃时,CTS质量损失20%,而CTS-HNTs
微球在温度290 ℃左右质量损失20%,所以HNTS可以增强CTS微球的热稳定性;一方面在产生挥发物时形成的炭可以作为屏障阻碍挥发损失的扩散[27],CTS-HNTs微球的炭残余含量高于纯CTS,因此,CTS-HNTs微球有更好的热稳定性;另一方面,CTS和HNTs之间有氢键和静电相互作用[28]。所以,CTS和HNTs是相容的,且HNTs可以改善CTS的热稳定性。
2.3 固定化条件对固定化效果的影响

图 6 酶质量浓度(a)、固定时间(b)、pH值(c)对固定化酶相对活性的影响Fig. 6 Influence of enzyme concentration, immobilization time and pH on relative activity of immobilized enzyme
在pH 7.2、4 ℃条件下,分别将CTS-HNTs微球置于不同质量浓度木瓜蛋白酶溶液中固定12 h,研究酶质量浓度对酶固定化活性的影响。由图6a可知,木瓜蛋白酶质量浓度为1 mg/mL时,CTS-HNTs微球固定的木瓜蛋白酶量和相对活性最大,可能是1 mg/mL木瓜蛋白酶在CTS-HNTs微球上固定量达到饱和状态,若质量浓度再增加,已固定在CTS-HNTs微球上的木瓜蛋白酶会产生位阻效应,从而影响固 定化酶的相对活性[29]。
在pH 7.2、4 ℃条件下,分别将CTS-HNTs微球置于1 mg/mL木瓜蛋白酶溶液中,研究固定时间对酶固定化酶活性的影响。图6b表明,在0~10 h内,随着固定化时间的延长,CTS-HNTs微球固定化木瓜蛋白酶的相对活性逐渐增大,在10 h后,趋于平衡,可能是因为木瓜蛋白酶与CTS-HNTs微球载体上的羰基全部反应生成席夫碱,达到吸附饱和。
分别将CTS-HNTs微球置于不同pH值的木瓜蛋白酶溶液(1 mg/mL)中12 h(4 ℃),研究pH值对酶固定化活性的影响。从图6c可看出,pH值为7.2时,CTS-HNTs微球固定化木瓜蛋白酶的酶相对活性达到最高。
2.4 CTS-HNTs微球固定化木瓜蛋白酶的性能分析
2.4.1 固定化木瓜蛋白酶的最适pH值和最适温度

图 7 固定化酶的最适pH值(a)和最适温度(b)Fig. 7 Optimum pH and temperature for the immobilized papain
从图7a可知,在pH 6.8时,固定化木瓜蛋白酶的相对活性最大,而游离酶的最适pH 7.2,与游离酶比较,固定化酶的最适反应pH值向酸性方向偏移。图7b可看出,固定化酶的最适温度为60 ℃,比游离酶的最适温度(50 ℃)升高10 ℃,固定化酶和微球载体的结合后,对催化反应温度敏感性降低[30],固定化木瓜蛋白酶比游离酶更稳定。
2.4.2 固定化木瓜蛋白酶的pH值稳定性


图 8 固定化酶的性能Fig. 8 Stability analysis of the immobilized papain
将游离木瓜蛋白酶与固定化木瓜蛋白酶分别置于不同pH值的磷酸溶液中,在室温放置24 h后,分别测定其酶活性,比较游离木瓜蛋白酶与固定化木瓜蛋白酶的pH值稳定性(酶相对活性最高为100%)。由图8a可看出,在酸性条件下,pH值对固定化酶和游离酶相对活性的影响趋势相同,但在碱性时,随pH值的升高,固定化酶的相对活性受pH值影响相对较小,这是由于固定化木瓜蛋白酶,微球上的羟基一定程度上改变了溶液的微环境,提高固定化木瓜蛋白酶的耐碱性。
2.4.3 固定化木瓜蛋白酶的热稳定性
将游离木瓜蛋白酶及固定化木瓜蛋白酶置于不同温度中保存2 h后冷却至室温,测定其酶活性,比较其热稳定性。图8b表明,温度为30 ℃时,游离酶的相对活性高于固定化酶,但游离酶的相对活性随着温度的升高而降低;固定化木瓜蛋白酶在40 ℃时活性较高,且高于游离酶;固定化酶的相对活性也随着温度的升高而降低,但都高于游离酶的活性。可能因为30 ℃时,游离酶的活性催化基团比较容易扩展,随着温度的升高,酶的活性催化中心改变空间构象,逐渐失去活性;而固定化木瓜蛋白酶30 ℃时由于微球载体的束缚而无法显出较好的催化活性;但随着温度的升高,固定化酶的部分活性基团被吸附于CTS-HNTs微球复合载体表面及内部,其活性空间构象得到保护,减少了热振动对酶分子的影响,固定化酶热稳定性增强。
2.4.4 固定化木瓜蛋白酶的贮存稳定性
将游离木瓜蛋白酶与固定化木瓜蛋白酶保存在4 ℃冰箱中,隔一定时间取出并分别测定其酶活性,分析其贮存稳定性。由图8c可看出,固定化酶和游离酶的相对活性都随着保存时间的延长而降低。与游离酶相比,固定化酶的相对活性下降速度比较缓慢,在4 ℃贮存30 d,固定化木瓜蛋白酶的相对活性仍保持在62%,游离酶的相对活性降到27%。可见,固定化酶相比游离酶,拥有更好的贮存性能,该性能对酶的利用有十分重要的意义。
2.4.5 固定化木瓜蛋白酶的操作稳定性
将CTS-HNTs微球固定化木瓜蛋白酶反复使用后,用磷酸溶液清洗CTS-HNTs微球至无酪蛋白析出,研究固定化酶的操作稳定性。由图8d可知,固定化木瓜蛋白酶的相对活性随着使用次数的增加而逐渐降低,使用4 次后,固定化酶的相对活性保留26.26%。
3 结 论
以2% CTS+1% HNTs制备CTS-HNTs微球,采用交联-吸附的方法可以固定木瓜蛋白酶。固定化木瓜蛋白酶的最适温度为60 ℃,最适pH值为6.8,而游离木瓜蛋白酶的最适温度为50 ℃,最适pH值为7.2。与游离酶比,固定化木瓜蛋白酶有良好的贮存稳定性和操作稳定性。采用CTS-HNTs微球固定化木瓜蛋白酶,降低了成本,提高了木瓜蛋白酶的利用价值。
[1] 李彦锋, 李军荣, 伏莲娣. 固定化酶的制备及应用[J]. 高分子通报, 2001(2): 13-16. DOI:10.3969/j.issn.1003-3726.2001.02.002.
[2] CAO L. Immobilised enzymes: science or art[J]. Current Opinion in Chemical Biology, 2005, 9(2): 217-226. DOI:10.1016/j.cbpa.2005.02.014.
[3] 高霞, 刘聪燕, 陈彦, 等. 酶技术在中药黄酮类成分研究中的应用[J]. 中草药, 2014, 45(16): 2412-2417. DOI:10.7501/ j.issn.0253-2670.2014.16.025.
[4] 黄铃. 琼脂包埋法固定化α-淀粉酶特性的研究[J]. 化学与生物工程, 2007, 24(8): 56-58. DOI:10.3969/j.issn.1672-5425.2007.08.017.
[5] 游金坤, 余旭亚, 赵鹏. 吸附法固定化酶的研究进展[J]. 化学工程, 2012, 40(4): 1-5. DOI:10.3969/j.issn.1005-9954.2012.04.001.
[6] MOZAFFAR S, KOEI K. Enhancement of Rhizopus oryzae lipase activity immobilized on alkyl-functionalized spherical mesocellular foam: influence of alkyl chain length[J]. Microporous and Mesoporous Materials, 2009, 118(1/2/3): 115-120. DOI:10.1016/ j.micromeso.2008.08.022.
[7] ZENG H Y, HE J, XIA K, et al. Characterization of phenol degradation by high-efficiency binary mixed culture[J]. Environmental Science and Pollution Research, 2010, 17(5): 1035. DOI:10.1007/s11356-009-0248-8.
[8] 韩志萍, 叶剑芝, 罗荣琼. 固定化酶的方法及其在食品中的应用研究进展[J]. 保鲜与加工, 2012, 12(5): 48-53. DOI:10.3969/ j.issn.1009-6221.2012.05.011.
[9] LÓPEZ-GALLEGO F, BETANCOR L, MATEO C, et al. Enzyme stabilization by glutaraldehyde crosslinking of adsorbed proteins on aminated supports[J]. Journal of Biotechnology, 2005, 119(1): 70-75. DOI:10.1016/j.jbiotec.2005.05.021.
[10] 李小冬, 吴嘉, 贾东晨. 固定化酶的研究方法概述[J]. 中国酿造, 2011, 30(11): 5-9. DOI:10.3969/j.issn.0254-5071.2011.11.002.
[11] 相欣然, 黄和, 胡燚, 等. 纳米复合材料固定化酶的研究进展[J].无机化学学报, 2017, 33(1): 1-16. DOI:10.11862/CJIC.217.016.
[12] MONIER M, AYAD D M, WEI Y, et al. Immobilization of horseradish peroxidase on modified chitosan beads[J]. International Journal of Biologica l Macromolecules, 2010, 46(3): 324-330. DOI:10.1016/ j.ijbiomac.2009.12.018.
[13] 刘晓贞, 郑璐梦, 张育淇, 等. 环氧基功能化块体SiO2大孔材料对漆酶的固定化[J]. 功能材料, 2014, 45(20): 20028-20032. DOI:10.3969/ j.issn.1001-9731.2014.20.007.
[14] 王宇. 固定化酶载体材料的研究进展[J]. 基层医学论坛, 2013, 17(22): 2952-2953. DOI:10.3969/j.issn.1672-1721.2013.22.069.
[15] 袁定重, 张秋禹, 侯振宇, 等. 固定化酶载体材料的最新研究进展[J]. 材料导报, 2006, 20(1): 69-72. DOI:10.3321/j.issn:1005-023X.2006.01.018.
[16] 林芳. 壳聚糖/埃洛石复合吸附剂的制备与吸附性能[J]. 广州化工, 2015, 43(3): 116-118. DOI:10.3969/j.issn.1001-9677.2015.03.043.
[17] 苗利军. 壳聚糖在食品工业中的应用研究进展[J]. 农业工程, 2014, 4(4): 89-90. DOI:10.3969/j.issn.2095-1795.2014.04.028.
[18] DU M, GUO B, JIA D. Newly emerging applications of halloysite nanotubes: a review[J]. Society of Chemical Industry, 2010, 59(5): 574-582. DOI:10.1002/pi.2754.
[19] 易奎, 罗四海, 陈涛, 等. 埃洛石纳米管作为载体的研究进展[J].上海塑料, 2012(4): 1-5. DOI:10.3969/j.issn.1009-5993.2012.04.001.
[20] 马智, 王金, 叶高祥, 等. 埃洛石纳米管的应用研究现状[J]. 化学进展, 2012, 43(3): 116-118. DOI:10.3969/j.issn.1001-9677.2015.03.043.
[21] ZHAI R, ZHANG B, LIU L, et al. Immobilization of enzyme biocatalyst on natural halloysite nanotubes[J]. Catalysis Communications, 2010, 12(4): 259-263. DOI:10.1016/j.catcom.2010.09.030.
[22] LUO P, ZHAO Y, ZHANG B, et al. Study on the adsorption of Neutral Red from aqueous solution onto halloysite nanotubes[J]. Water Research, 2010, 44(44): 1489-1497. DOI:10.1016/ j.watres.2009.10.042.
[23] ROOJ S, DAS A, THAKUR V, et al. Preparation and properties of natural nanocomposites based on natural rubber and naturally occurring halloysite nanotubes[J]. Materials & Design, 2010, 31(4): 2151-2156. DOI:10.1016/j.matdes.2009.11.009.
[24] RUI Z, ZHANG B, WAN Y Z, et al. Chitosan-halloysite hybridnanotubes: horseradish peroxidase immobilization and applications in phenol removal[J]. Chemical Engineering Journal, 2013, 214(4): 304-309. DOI:10.1016/j.cej.2012.10.073.
[25] 何平, 黄卓烈, 黎春怡, 等. 海藻酸钠-壳聚糖固定化木瓜蛋白酶催化内吗啡肽的合成[J]. 中国生物化学与分子生物学报, 2008, 24(5): 426-431. DOI:10.3969/j.issn.1007-7626.2008.05.007.
[26] 易喻, 李慧娟, 陈建澍, 等. 纸纤维固定木瓜蛋白酶的研究及应用[J]. 浙江工业大学学报, 2013, 41(2): 147-151. DOI:10.3969/ j.issn.1006-4303.2013.02.007.
[27] DICK C M, LIGGAT J J, SNAPE C E. Solid state13C NMR study of the char forming processes in polychloroprene[J]. Polymer Degradation and Stability, 2001, 74(3): 397-405. DOI:10.1016/S0141-3910(01)00174-4.
[28] LIU M, ZHANG Y, WU C, et al. Chitosan/halloysite nanotubes bionanocomposites: structure, mechanical properties and biocompatibility[J]. International Journal of Biological Macromolecules, 2012, 51(4): 566-575. DOI:10.1016/j.ijbiomac.2012.06.022.
[29] GIORNO L. Kinetic resolution of racemic mixtures in multiphase enzyme membrane reactors: influence of ester type and oil/water interface on process performance[J]. Journal of Biotechnology, 2007, 131(2): S115. DOI:10.1016/j.jbiotec.2007.07.199.
[30] LUCAS E C, WILLIAMS A. pH dependencies of individual rate constants in papain-catalyzed reactions[J]. Biochemistry, 1969, 8(12): 5125-5135. DOI:10.1021/bi00840a067.
Preparation of Chitosan-Halloysites Nanotube Microspheres and Their Application in Immobilization of Papain
DING Lijun, QU Yehui, LIU Dan
(School of Chem ical Engineering and Light Industry, Guangdong University of Technology, Guangzhou 510006, China)
Chitosan-halloysites nanotube (CTS-HNTs) composite microspheres were successfully prepared by crosslinkingadsorption method, and used to immobilize papain. The successful immobilization of papain on CTS-HNTs composite microspheres was confirmed through infrared spectroscopy, scanning electron m icroscopy, and fluorescent labeling. The microspheres prepared with 2% CTS and 1% HNTs displayed the highest immobilization ef ciency for papain. The optimal immobilization conditions were determined as 1 mg/mL and 10 h for papain concentration and immobilization time, respectively. The optimal pH and temperature for the immobilized enzyme were 6.8 and 60 ℃, respectively, while those for the free enzyme were 7.2 and 50 ℃, respectively. After 30 days of storage, the relative activity of the immobilized and free papain was 62% and 27%, respectively. The immobilized enzyme retained 26.26% of the initial activity after fourth repeated use. Th e immobilized papain had good storage stability and operational stability, enhancing the utility efficiency of the enzyme, cutting down the cost of enzymatic hydrolysis and enhancing the production ef ciency.
chitosan-halloysites; composite microspheres; immobilized enzyme; papain
10.7506/spkx1002-66 30-201 710021
Q814
A
1002-6630(2017)10-0123-07
丁利君, 瞿叶辉, 刘丹. 壳聚糖-埃洛石纳米管微球的制备及其对木瓜蛋白酶的固定化[J]. 食品科学, 2017, 38(10): 123-129. DOI:10.7506/spkx1002-6630-201710021. http://www.spkx.net.cn
DING Li jun, QU Yehui, LIU Dan. Preparation of chitosan-halloysites nanotube microspheres and their application in immobilization of papain[J]. Food Science, 2017, 38(10): 123-129. (in Chinese with English abstract)
10.7506/ spkx1002-6630-201710021. http://www.spkx.net.cn
2016-07-12
广东省教育部产学研合作重大专项(2013A090100009)
丁利君(1965—),女,教授,硕士,研究方向为天然产物化学与功能性。E-mail:ddddlj@foxmail.com

