蟠桃褐腐病原菌生物学特性及细胞壁降解酶活性
宋丹丹,孔庆军,李鸿彬,任雪艳,*
蟠桃褐腐病原菌生物学特性及细胞壁降解酶活性
宋丹丹1,孔庆军2,李鸿彬1,任雪艳2,*
(1.石河子大学生命科学学院,新疆 石河子 832003;2.陕西师范大学食品工程与营养科学学院,陕西 西安 710062)
由桃褐腐病原菌(Monilinia fructicola)引起的蟠桃褐腐病是蟠桃采后主要的病害,造成水果采后损失严重。同时,M. fructicola引起果实采后疾病的发生,因宿主不同,其致病性也不尽相同。以M. fructicola为对象,研究其在不同环境条件(温度、pH值、光照条件)下的生物学特性和不同培养条件(温度、pH值、培养时间)对M. fructicola自身产生的细胞壁降解酶活性的影响。结果表明:M. fructicola孢子萌发和芽管延长的最适pH值为5.0,且偏弱酸性环境更适宜其生长,但是过酸环境其孢子萌发率明显降低;菌落生长的最适温 度范围为20~28 ℃,高于36 ℃,则菌不能正常生长;温度会影响菌落形态,温度不同,则菌落形态不同;光照对菌落生长影响甚微;内切葡聚糖酶(endoglucanase,EG)、β-葡萄糖苷酶(β-glucosi dase,BG)、果胶甲基半乳糖醛酸酶(polymethylgalacturonase,PMG)、多聚半乳糖醛酸酶(polygalacturonase,PG)活力均在28 ℃ 条件下最 高;pH 6.0时EG、BG酶活力均达到最高;PMG、PG酶活力在pH 7.0时达到最高;EG、BG、PMG、PG在培养5 d时的酶活力最高;在各pH值、温度、培养时间条件下,BG酶活力高于EG酶活力,PG酶活力 高于PMG酶活力。
桃褐腐病原菌;生物学特性;细胞壁降解酶活力;培养条件
蟠桃(Amygdalus persica Linn. var. compressa)别名仙桃,因形美色艳、味佳肉细、汁多甘厚、味浓香溢、营养丰富而受到人们的青睐,热销港外。蟠桃采收后会迅速进入呼吸高峰期,果实采后由真菌引起的果实的腐败变质,使果实在流通过程中难以贮藏,从而导致鲜桃出口量与出口额的下降[1-2]。桃褐腐病是由链核盘菌属(Monilinia. spp)引起的主要水果采后疾病,对采后水果的感染率极高,直接影响果实的口感、品质、销量,造成了极大的经济损失[3-4]。
桃褐腐菌分为美澳型核果褐腐菌(Monilinia fructicola)、核果褐腐菌(M. laxa)和仁果褐腐菌(M. fiuctigena)三大类[3]。其中,M. fructicola在我国广泛分布[4]。致病过程中病原菌产生的细胞壁降解酶,如纤维素酶、果胶酶、角质酶等,是使桃果实发病的因素之一[5-6]。
纤维素酶是一类能够分解纤维素的酶的总称,包括水解酶类,一般分为葡聚糖内切酶(1,4-β-D-glucan glucanohydrolase,真菌产生简称EG,细菌产生简称Cx)、葡聚糖外切酶(1,4-β-D-glucan cellobilhydrolase,Cl)和β-葡萄糖苷酶(β-1,4-glucosidase,BG)[7-8]。内切葡聚糖酶,破坏β-1,4-葡萄糖苷键,形成大量纤维寡糖、葡萄糖和纤维二糖,包括多个组分,专一性不强。外切葡聚糖酶,此酶作用时每次水解下一个纤维二糖单位,单独作用于天然纤维素时,几乎无还原糖生成。β-葡萄糖苷酶,是一种能够水解还原性的β-D-葡萄糖苷键的水解酶,在食品风味的改善及纤维素降解等领域具有重要的应用价值[9]。纤维素酶各酶组分单独作用时效果不是很强,但当它们协同作用时却表现出很强的分解活性[10]。
果胶酶是一类能够分解果胶类物质的酶的总称,含有多种组分的复合酶。其广泛分布于植物和微生物中,在某些原生动物和昆虫中也有发现。自然界微生物中,细菌、放线菌、酵母和霉菌都能够分泌果胶酶。常见的果胶酶有多聚半乳糖醛酸酶(polygalacturonase,PG)、果胶酯酶(pectinesterase,PE)、聚甲基半乳糖醛酸酶(polymethylgalacturonase,PMG)、聚甲基半乳糖醛酸裂解酶(polymethylgalacturonate lyase,PMGL)和聚半乳糖醛酸裂解酶(polygalacturonate lyase,PGL)。PG是一种在细胞壁结构的改变中起重要作用的酶,主要功能是将果实中果胶的主要成分,即多聚半乳糖醛酸降解为半乳糖醛酸,使细胞壁结构解体,导致果实软化[11]。PMG是一种专一水解底物糖苷键的水解酶,对底物的酯化程度具有选择性,以酯含量高的果胶酯酸为底物。
本实验所用病原菌是从蟠桃病果上分离得到的,经形态学和分子生物学鉴定为M. fructicola,属于链核盘菌属。链核盘菌属病菌是影响核果果实货架期的主要真菌病害之一。国内外对核果果实褐腐病害采后病理生理和采后病害控制技术方面已做了大量的研究[12-13],而对胞壁降解酶活力、致病机理及环境条件对细胞壁降解酶的影响研究较少。所以,探索在可控条件下的菌丝生长和孢子萌发的最适环境条件及不同培养条件下病原菌细胞壁降解酶活力,以掌握病原菌在致病过程中,主要致病因子及菌生长状况的动态变化,有利于进一步解释其致病的机制,也有利于在采后储存和运输过程中控制环境条件来降低蟠桃褐腐病发生的可能性。
1 材料与方法
1.1 材料与菌种
蟠桃为市购,挑选大小及成熟度较为均一、无病虫害且无机械损伤的果实。
美澳型核果褐腐菌(M. fructicola)由蟠桃褐腐病病果上分离纯化得到。
1.2 试剂与培养基
3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS) 上海科丰实业有限公司;苯酚、酒石酸钾钠、HCl、醋酸钠天津市天力化学试剂有限公司;乙二胺四乙酸二钠 天津市永晟精细化工有限公司;连苯三酚 上海晶都生物技术有限公司;三羟甲基氨基甲烷北京广达恒益科技有限公司;醋酸 天津市富宇精细化工有限公司;水杨苷 成都埃法生物科技有限公司;多聚半乳糖醛酸上海拓旸生物科技有限公司;柑橘果胶 上海莼试生物技术有限公司;Tris 北京博奥拓达科技有限公司。
马铃薯葡萄糖(potato dextrose,PDB)培养基:马铃薯200 g、葡萄糖20 g、琼脂18 g、蒸馏水1 000 mL,自然pH值。
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基:PDB中加入琼脂18 g。
纤维素酶培养液[14]:羧甲基纤维素钠盐0.5 g、KH2PO40.5 g、CaCl20.5 g、VB10.5 g、MgCl22 mmol、酵母粉5.0 g、酒石酸铵0.5 g、蒸馏水1 000 mL。
果胶酶培养液[15]:KNO32.0 g、K2HPO41.0 g、KCl 0.5 g、MgSO4·7H2O 0.5 g、L-天冬酰胺0.5 g、FeSO40.01 g、VB10.2 mg、羧甲基纤维素钠盐10.0 g、蒸馏水1 000 mL。
1.3 仪器与设备
LDZX-30KBS型立式压力蒸汽灭菌器 上海申安医疗器械厂;YT-L5-2D型超净工作台 北京亚泰科隆仪器技术有限公司;DH4000Ⅱ型电热恒温培养箱天津市泰勒斯仪器有限公司;ZD-85A型双功能恒温气浴摇床 江苏省金坛市友联仪器研究所;ML104型电子天平、Orion Star A111型台式pH计 梅特勒-托利多仪器(上海)有限公司;ME21(MSHOT)型数码生物显微镜 日本奥林巴斯公司;XB-K-25型血球计数板上海求精实业有限公司;XL30 ESEM型环境扫描电镜荷兰Philips公司;冷冻高速离心机 赛默飞世尔科技有限公司;电热恒温水浴锅 上海科恒实业发展有限公司;全波长酶标仪 美国热电公司。
1.4 方法
1.4.1 生物特性的测定
1.4.1.1 pH值和萌发时间对M. fructicola孢子萌发及芽管延长的影响
向50 mL PDB培养液的锥形瓶中加入孢子悬浮液使其终浓度为6×105个/mL,于28 ℃、130 r/min摇床培养5、7、9、11 h后用显微镜进行镜检,计算孢子萌发率及芽管延长的长度(萌发标准是芽管长度超过孢子本身直径的一半)。每个处理重复3 次。
1.4.1.2 温度和光照对病原菌M. fructicola生长的影响
在培养7 d的M. fructicola PDA平板上切取5 mm菌块接种到新PDA培养皿中,设计光照(太阳光)、黑暗2 个处理,并分别在20、24、28、32、36 ℃条件下培养,在2、3、4、6 d后分别测量不同温度条件下菌落生长直径并作记录。每个处理重复3 次。
1.4.2 酶活力的测定
1.4.2.1 葡萄糖标准曲线的制作
准确称取100 mg葡萄糖(预先在105 ℃烘干至恒质量),用去离子水溶解后定容至100 mL,得到葡萄糖标准溶液。取标准溶液0、0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0 mL,加蒸馏水定容至2 mL,再分别加入3 mL DNS试剂,混匀后沸水浴5 min,立即冷却至室温,加蒸馏水至25 mL,摇匀,540 nm波长处测吸光度,以此制作葡萄糖标准曲线,计算出回归方程和回归系数。
1.4.2.2 纤维素酶活力的测定
粗酶液的提取:向50 mL PDB培养液的锥形瓶中加入孢子悬浮液使其终浓度为6×105个/mL,于28 ℃、130 r/min摇床中培养,设置不同的温度梯度及培养时间,进行取样,4 层纱布过滤,4 ℃、10 000 r/min离心30 min,上清液4 ℃保存备用。
酶活力的测定:采用DNS法[16]。
BG酶活力的测定:在试管中加入粗酶液0.5 mL,然后加入1 mL 50 mmol/L醋酸-醋酸钠缓冲液(pH 5.0,内含1.0%水杨苷),于50 ℃条件下准确酶解30 min,立即加入3.0 mL DNS试剂终止反应,充分摇匀后沸水浴6 min,取出冷却,用蒸馏水定容至20 mL,充分摇匀后在540 nm波长处测定OD值,通过查标准曲线或用线性回归方程求出还原糖的质量浓度。对照将粗酶液换为蒸馏水,其余操作同上。
EG酶活力的测定:以1.0%羧甲基纤维素钠代替BG测定方法中的1.0%水杨苷,其他操作相同。
以上酶活力单位(U/mL)定义为在50℃条件下,每毫升酶液在1 min内催化底物生成1 μg葡萄糖所需的酶量。1.4.2.3 果胶酶活力的测定
粗酶液的提取同1.4.2.2节方法。酶活力的测定采用DNS法[16]。
PG活力的测定:在试管中加入粗酶液0.5 mL,然后加入0.5 mL 50 mmol/L醋酸-醋酸钠缓冲液(pH 5.0,内含1.0%多聚半乳糖醛酸),于50 ℃准确酶解60 min,立即加入DNS试剂 3.0 mL终止反应,充分摇匀后沸水浴6 min,取出冷却,用蒸馏水定容至20 mL,充分摇匀后在540 nm 波长处测定OD值,通过查标准曲线或用线性回归方程求出还原糖的含量。对照将粗酶液换为蒸馏水,其余操作同上。
PMG活力的测定:以1.0%果胶代替PG测定方法中的1.0%多聚半乳糖醛酸,其他操作相同。以上酶活力单位(U/mL)定义为1 mL酶液每分钟催化底物产生1 μg半乳糖酵酸为一个酶活力单位。
1.4.2.4 不同培养条件下酶活力的测定
不同培养温度:向50 mL PDB培养液的锥形瓶中加入孢子悬浮液使其终浓度为6×105个/mL,于28 ℃、130 r/min摇床培养,设置温度梯度18、23、28、33、38 ℃。培养5 d后测定酶活力。每个处理重复3 次。
不同初始pH值:向50 mL PDB培养液的锥形瓶中加入孢子悬浮液使其终浓度为6×105个/mL,设置初始pH值梯度4.0、5.0、6.0、7.0、8.0。130 r/min培养5 d后测定酶活力。每个处理重复3 次。
不同培养时间:向50 mL PDB培养液的锥形瓶中加入孢子悬浮液使其终浓度为6×105个/mL,于28 ℃、130 r/min摇床培养,分别在培养 1、3、5、7、9 d后测定酶活力。每个处理重复3 次。
2 结果与分析
2.1 不同环境条件下蟠桃病原菌M. fructicola的生物学特性
2.1.1 pH值和萌发时间对M. fructicola孢子萌发及芽管延长的影响
为了测定pH值对孢子萌发及芽管长度的影响,分别测定了在5、7、9、11 h pH值对孢子萌发及芽管长度的影响。在5 h时,pH 3.0、4.0的萌发率分别为52.4%、60.0%,其余pH值下孢子均萌发;在培养7 h后,pH 3.0孢子萌发率为80.0%,其余pH值条件下孢子萌发率均为100%;在培养9 h时,在pH 3~8孢子萌发率均达到100%。
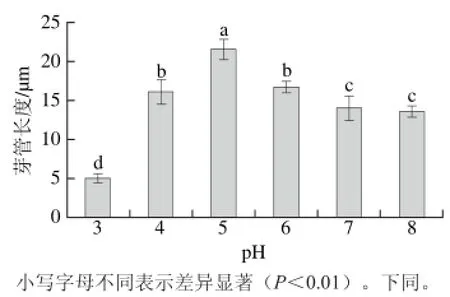
图 1 7 h时pH值对M. fructicola芽管延长的影响Fig. 1 Effect of pH on germ tube extension of M. fructicola after cultivated for 7 h
如图1所示,pH 5.0时,M. fructicola孢子的芽管长度显著高于其他pH值(P<0.01);当pH 3.0时,M. fructicola孢子的芽管生长速率明显降低;碱性条件下,随着pH值的升高,孢子萌发率及芽管长度变化不显著(P>0.01)。综合可知,酸性环境更利于病原菌生长,当培养基pH值过低、过高时,M. fructicola孢子萌发及芽管延长,均有降低,且在pH值小于3.0,孢子的萌发率以及芽管长度降低明显。
2.1.2 温度和光照对M. fructicola孢子萌发及菌落生长的影响

图 2 温度对菌落生长的影响Fig. 2 Effect of temperature on colony growth of of M. fructicola
如图2所示,M. fructicola在20~32 ℃时可以正常生长,高于36 ℃时不能生长。培养初期,菌落在培养在1 d和2 d时,28 ℃菌落生长速率显著高于其他温度(P<0.01),但是在培养4 d后,温度为20 ℃和24 ℃的菌落直径超过28 ℃条件下培养的菌落直径。
28 ℃以下,光照对M. fructicola生长的影响较小,光照与在黑暗下的菌落直径差异不显著(P>0.01),但是当温度为32 ℃时,光照下菌落直径为4.13 cm,黑暗处菌落直径为3.55 cm,说明高温下,光照对菌落生长的影响增大。36 ℃为致死温度,培养过程中无生长迹象。温度对菌落的形态也具有影响,培养温度为20 ℃时,菌落为褐色,呈同心圆状,温度为24 ℃时菌落形态与20 ℃相差不多,但是当温度达到28 ℃,菌落颜色变浅,且不再呈同心圆状,且在20~28 ℃范围内,菌落均贴培养基生长,当温度为32 ℃时,像棉花状于接种处生长出长的突起的白色菌丝,说明高温条件下基生菌丝蔓延速率减慢,且孢子生成量下降。
2.2 不同环境条件下M. fructicola的酶活力
2.2.1 葡萄糖标准曲线
运用Excel绘制标准曲线,对应的回归方程为y= 0.007 9x-0.012 3,R2=0.995 9。该标准曲线线性关系良好,可用于酶活力的测定。
2.2.2 不同条件下细胞壁降解酶的活性变化
2.2.2.1 温度对M. fructicola产生的细胞壁降解酶活性的影响

图 3 温度对纤维素酶活性的影响Fig. 3 Effects of temperatures on cellulase activity of M. fructicola
如图3所示,在18~38 ℃范围内,M. fructicola均可产生EG和BG,且BG酶活力要明显高于EG。在高于18 ℃时,EG和BG酶活力均呈逐渐上升趋势,当温度达到28 ℃时,2 种酶活力均达到峰值,BG酶活力为16.05 U/mL,EG酶活力为8.51 U/mL,高于28 ℃,2 种酶活力均呈下降趋势,尤其是BG酶活力急剧下降,说明BG酶活力受温度影响较大。
如图4所示,在18~38 ℃范围内,M. fructicola均可产生PG和PMG。在高于18 ℃时,PG和PMG酶活力均呈逐渐上升趋势,当温度达到28 ℃时,2 种酶活力均达到峰值,PG酶活力为15.23 U/mL,PMG酶活力为13.39 U/mL。高于28 ℃以后,2 种酶活力均急剧下降。
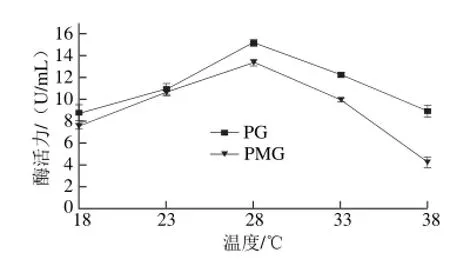
图 4 温度对果胶酶活性的影响Fig. 4 Effect of temperature on pectinase activity of M. fructicola
2.2.2.2 pH值对M. fructicola产生的细胞壁降解酶活性的影响

图 5 pH值对纤维素酶活性的影响Fig. 5 Effect of pH on cellulase activit y of M. fructicola
如图5所示,在pH 4.0~8.0范围内,M. fructicola均可产生EG和BG,且BG酶活力要明显高于EG。在pH 4.0~6.0时,EG和BG酶活力均呈逐渐上升趋势,当pH 6.0时,2 种酶活力均达到峰值,BG酶活力为13.19 U/mL,EG酶活力为9.34 U/mL,pH值大于6.0后2 种酶活力均下降,且BG酶活力下降趋势更为明显,说明BG酶活力受pH值影响较大。

图 6 pH值对产果胶酶活性的影响Fig. 6 Effect of pH on pectinase activity of M. fructicola
如图6所示,在pH 4.0~8.0范围内,M. fructicola均可产生PG和PMG。在pH 4.0~7.0时,PG和PMG酶活力均呈逐渐上升趋势,当pH 7.0时,2 种酶活力均达到峰值,PG酶活力为8.56 U/mL,PMG酶活力为6.76 U/mL,pH值大于7.0后2 种酶活力均下降明显。
2.2.2.3 培养时间对M. fructicola产生的细胞壁降解酶的活性影响
由图7可知,在培养1~9 d内,M. fructicola均可产生EG和BG,且BG酶活力要高于EG。在第1~5天内,EG和BG酶活力均呈上升趋势,且BG酶活力上升更显著。当第5天时,2 种酶活力均达到峰值,BG酶活力为16.05 U/mL,EG酶活 力为8.51 U/mL,第5天后2 种酶活力均下降。
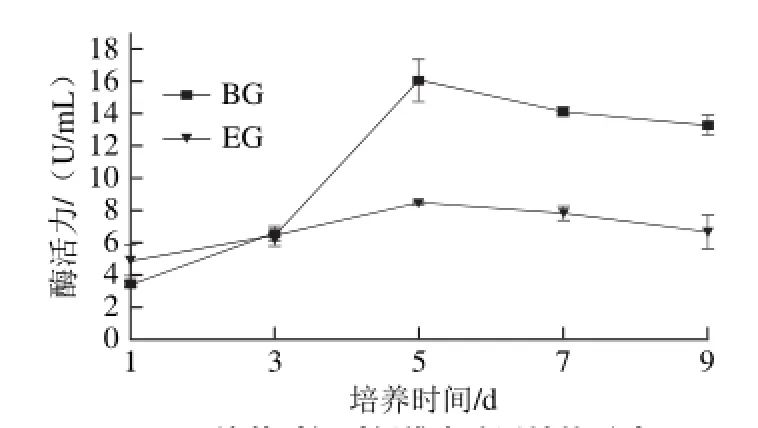
图 7 培养时间对纤维素酶活性的影响Fig. 7 Effect of culture time on cellulose activity of M. fructicola

图 8 培养时间对果胶酶活性的影响Fig. 8 Effect of culture time on pectinase activity of M. fructicola
如图8所示,在培养1~9 d内,M. fructicola均可产生PG和PMG,在1~5 d时,PG和PMG酶活力均呈急剧上升趋势,当第5天时,2 种酶活力均达到峰值,PG酶活力为15.23 U/mL,PMG酶活力为13.39 U/mL,第5天后,2 种酶活力均明显下降,且整个培养过程中,PG和PMG酶活力及变化趋势相差不大。
3 讨 论
目前关于采后果实褐腐病的研究主要集中在桃[17-19]、樱桃[20-22]、李[22,24-25]、苹果[26-27]等果实上。近年来研究发现不同地区不同寄主上的褐腐病菌生物学特性除了温度影响存在一定差异,其他无明显差异[28],本实验表明,M. fructicola在20~32 ℃之间均可以生长,致死温度为36 ℃,孢子萌发最适pH值为5.0,光照对菌落生长影响甚微。郝晓娟等[24]发现欧李M. fructicola菌丝在7~27 ℃范围内均可生长,最适生长温度为22 ℃,温度高于32 ℃病菌停止生长,孢子萌发最适温pH值为6.0~8.0,光照对孢子萌发没有显著影响。而赵晓燕等[19]报道的M. fructicola在35 ℃时仍可生长。这说明不用地区不同寄主M. fructicola的生物学特性温度和pH值的影响均有差异,光照条件无明显差异。
病原菌使宿主发病不仅与病原菌本身的生物学特性相关,同时也与病原菌细胞壁降解酶活力有很密切的联系。宋喜霞[29]发现人参锈腐病在体外也可以产生PG、果胶甲基反式消除酶(pectin methyl trans-eliminase,PMTE)、PMG和Cx 4 种细胞壁降解酶,并判断PMTE和PG在锈腐菌侵染人参过程中起重要作用。李宝聚等[30]证明果胶酶、纤维素酶在黄瓜黑星病菌致病中起着 重要作用,是主要的致病因子之一。Sasaki等[31]报道灰葡萄孢菌株的致病力与β-葡聚糖苷酶具有相关性。李喜玲等[32]证明了灰葡萄孢菌株的致病力与纤维素酶活力呈正相关,灰霉菌果胶酶活力高低与致病力强弱有一定的相关性。这都印证了纤维素酶和果胶酶是病原菌的两种重要的致病因子,所以对病原菌细胞壁降解酶活力进行测定可以间接地了解病原菌在不同条件下对宿主的致病能力。
近年来,有关腐朽菌产纤维素酶的研究较少[33]。韩树英等[14]研究发现,M. fructicola在培养5 d时纤维素酶活力最高,EG为21.71 U/mL,BG为10.69 U/mL。当初始pH 6.0时,产EG最高,酶活力为12.62 U/mL。菌株在4.0~6.0之间有利于产生EG,该菌适宜在偏酸环境下生长。本研究中,在培养5 d和初始pH 6.0时的EG、BG酶活力最高,与其结果一致。董小梅[34]发现龙眼焦腐病菌在1~14 d、8~38 ℃、pH 4.5~8.5范围内均可产生Cx、BG、PG和PMG,在培养6 d酶活力均达到最大,Cx酶活力明显高于其他3 种酶,最适培养温度为28 ℃,PMG酶活力最大,最适pH值为7.0,且PG酶活力显著高于其他3 种酶。说明病原菌不同,其最适产酶条件也存在差异。
且在实验中发现病原菌的最适生长条件与其最适产酶条件存在差异。实验证明,M. fructicola生长的最适温度和其产酶最适温度相同,均为28 ℃,李宝聚等[16,35]也有类似的研究结果,其团队证明了灰霉病菌孢子的萌发和菌丝扩展最适温度为20 ℃,其细胞壁降解酶β-葡萄糖苷酶、PG和Cx也在20 ℃时表现出最高的活性。但是,虽然病原菌生长的最适温度与产酶最适温度相同,但其最适pH值却存在差异,M. fructicola生长的最适pH值为5.0,而产纤维素酶最适pH值为6.0,产果胶酶最适pH值为7.0,因此病原菌生长最适的环境条件与其最优产酶条件由于其各自影响因素的差异而不尽相同。
真菌病原菌侵染植物是一个复杂的过程,在侵入寄主果实过程中其致病力的大小首先与病原菌的生物学特性相关,其次,病原菌在侵入宿主初期会遇到细胞壁屏障,在病原菌与寄主识别的过程中,病原菌释放细胞壁降解酶,从而有利于其入侵。对褐腐病原菌侵入蟠桃果实,除了自身特性、酶活力,还存在一系列其他的致病因子还有待于基因水平及功能上进一步探索。
[1] 董金皋. 农业植物病理学: 北方本[M]. 北京: 中国农业出版社, 2001: 203-207.
[2] 杨海清. 桃褐腐病菌致病性及拮抗细菌生防机制的研究[D]. 呼和浩特: 内蒙古农业大学, 2007: 1-2.
[3] IOOS R, FREY P. Genomic variation within Monilinia laxa, M. fructigena and M. fructicola, and application to species identi cation by PCR[J]. European Journal of Plant Pathology, 2000, 106(4): 373-378. DOI:10.1023/A:1008798520882.
[4] Y☒NEZ-MENDIZÁBAL V, ZERIOUH H, VI☒AS I, et al. Biological control of peach brown rot (Monilinia spp.) by Bacillus subtilis CPA-8 is based on production of fengycin-like lipopeptides[J]. European Journal of Plant Pathology, 2012, 132(4): 609-619. DOI:10.1007/s10658-011-9905-0.
[5] ALBERSHEIM P, JONES T M, PATRICIA D. Biochemistry of the cell wall in relation to infective process[J]. Annual Review of Phytopathology, 1969, 7: 171-194. DOI:10.1146/annurev. py.07.090169.001131.
[6] MEDGEN K, HSHN M, DEISING H. Morphogenesis and mechanisms of penetration by plant pathogenic fungi[J]. Annual Review of Phytopathology, 1996, 34: 367-386. DOI:10.1146/annurev. phyto.34.1.367.
[7] 李燕红, 赵辅昆. 纤维素酶的研究进展[J]. 生命科学, 2005, 17(5): 392-397. DOI:10.3969/j.issn.1004-0374.2005.05.005.
[8] 张小梅, 李单单, 王禄山, 等. 纤维素酶家族及其催化结构域分子改造的新进展[J]. 生物工程学报, 2013, 29(4): 422-433. DOI:10.13345/ j.cjb.2013.04.008.
[9] 潘利华, 罗建平. β-葡萄糖苷酶的研究及应用进展[J]. 食品科学, 2006, 27(12): 803-807. DOI:10.3321/j.issn:1002-6630.2006.12.210.
[10] 赵艳琴, 吴元华, 伏颖, 等. 烟草靶斑病菌(Rhizoctonia solani)细胞壁降解酶活性分析及其致病作用[J]. 烟草科技, 2014(11): 84-88.
[11] 段学武, 张昭其, 季作梁. PG酶与果实的成熟软化[J]. 果树学报, 2001, 18(4): 229-233. DOI:10.13925/j.cnki.gsxb.2001.04.012.
[12] SISQUELLA M, CASALS C, PICOUET P, et al. Immersion of fruit in water to improve radio frequency treatment to control brown rot in stone fruit[J]. Postharvest Biology and Technology, 2013, 80: 31-36. DOI:10.1016/j.postharvbio.2013.01.010.
[13] CHEN Jiaojiao, ZHANG Shaoshan, YANG Xiaoping. Control of brown rot on nectarines by tea polyphenol combined with tea saponin[J]. Crop Protection, 2013, 45: 29-35. DOI:10.1016/ j.cropro.2012.11.006.
[14] 韩树英, 池玉杰, 薛煜. 一株褐腐真菌产纤维素酶活力的分析[J].安徽农业科学, 2014, 42(16): 4953-4955. DOI:10.13989/ j.cnki.0517-6611.2014.16.001.
[15] 陈峰, 许煜泉, 祝新德, 等. 聚半乳糖醛酸酶高产菌的产酶条件研究[J]. 工业微生物学报, 2001, 31(4): 9-12. DOI:10.3969/ j.issn.1001-6678.2001.04.003.
[16] 李宝聚, 陈立芹, 孟伟军, 等. 温湿度调控对番茄灰霉病菌产生的细胞壁降解酶的影响[J]. 植物病理学报, 2003, 33(3): 209-221. DOI:10.13926/j.cnki.apps.2003.03.004.
[17] de CAL A, SANDÍN-ESPAÑA P, MARTINEZ F, et al. Role of gluconic acid and pH modulation in virulence of Monilinia fructicola on peach fruit[J]. Postharvest Biology and Technology, 2013, 86: 418-423. DOI:10.1016/j.postharvbio.2013.07.012.
[18] MARI M, MARTINI C, GUIDARELLI M, et al. Postharvest biocontrol of Monilinia laxa, Monilinia fructicola and Monilinia fructigena on stone fruit by two Aureobasidium pullulans strains[J]. Biological Control, 2012, 60: 132-140. DOI:10.1016/j.biocontrol.2011.10.013.
[19] 赵晓燕, 王颖洁, 杨海清, 等. 环境条件对桃褐腐病菌生长和分生孢子萌发的影响[J]. 北京农学院学报, 2007, 22(4): 34-37.
[20] ORO L, ERICA F, MAURIZIO C, et al. Biocontrol of postharvest brown rot of sweet cherries by Saccharomyces cerevisiae Disva 599, Metschnikowia pulcherrima Disva 267 and Wickerhamomyces anomalus Disva 2 strains[J]. Postharvest Biology and Technology, 2014, 96: 64-68. DOI:10.1016/j.postharvbio.2014.05.011.
[21] QIN G Z, TIAN S P, XU Y, et al. Combination of antagonistic yeasts with two food additives for control of brown rot caused by Monilinia fructicola on sweet cherry fruit[J]. Journal of Applied Microbiology, 2006, 100(3): 508-515. DOI:10.1111/j.1365-2672.2005.02821.x.
[22] SPOTTS R A, CERVANTES L A, FACTEAU T J. Integrated control of brown rot of sweet cherry fruit with a preharvest fungicide, a postharvest yeast, modi ed atmosphere packaging, and cold storage temperature[J]. Postharvest Biology and Technology, 2002, 24(3): 251-257. DOI:10.1016/S0925-5214(01)00155-7.
[23] 徐成楠, 周宗山, 吴玉星, 等. 欧李褐腐病病原菌鉴定[J]. 植物病理学, 2011, 41(6): 626-630. DOI:10.13926/j.cnki.apps.2011.06.008.
[24] 郝晓娟, 高莹, 李新凤, 等. 欧李褐腐病病原菌生物学特性及其寄主范围[J]. 果树学报, 2014, 31(1): 101-104. DOI:10.13925/j.cnki. gsxb.2014.01.006.
[25] WOJCIECH J, JANISIEWIC Z, WAYNE M, et al. Yeasts associated with plums and their potential for controlling brown rot after harvest[J]. Yeast, 2014, 31(6): 207-218. DOI:10.1002/yea.3009.
[26] VASIC M, DUDUK N, IVANOVIC M S. First report of brown rot caused by Monilia polystroma on apple in serbia[J]. Plant Disease, 2013, 97(1): 145-145.
[27] IMRE H, BALLA B, VÁMOS A, et al. In uence of preharvest calcium applications, fruit injury and storage atmospheres on postharvest brown rot of apple[J]. Postharvest Biology and Technology, 2012, 67(5): 29-36. DOI:10.1016/j.postharvbio.2011.12.008.
[28] 凡先芳, 王宝刚, 曾凯芳. 采后果实褐腐病防治技术研究进展[J]. 食品工业科技, 2015, 36(12): 390-394. DOI:10.13386/ j.issn1002-0306.2015.12.074.
[29] 宋喜霞. 人参与锈腐菌互作生理生化机制的研究[D]. 长春: 吉林农业大学, 2007: 15-23.
[30] 李宝聚, 周长力, 赵奎华, 等. 黄瓜黑星病菌致病机理的研究Ⅱ细胞壁降解酶及其在致病中的作用[J]. 植物病理学报, 2000, 30(1): 13-18. DOI:10.13926/j.cnki.apps.2000.01.003.
[31] SASAKI I, NAGAYAMA H. Beta-glucosidase from Botrytis cinerea: its relation to the pathogenicity of this fungus[J]. Bioscience Biotechnology and Biochemistry, 1994, 58(4): 616-620. DOI:10.1271/ bbb.58.616.
[32] 李喜玲. 灰葡萄孢致病力的分化及与细胞壁降解酶活性的关系研究[D]. 合肥: 安徽农业大学, 2008: 28-33.
[33] 安莉颖, 施思, 谭德勇, 等. 里氏木霉RutC-30产纤维素酶条件优化研究[J]. 安徽农业科学, 2012, 40(8): 4818-4820. DOI:10.13989/ j.cnki.0517-6611.2012.08.021.
[34] 董小梅. 龙眼焦腐病菌细胞壁降解酶及其致病机理的研究[D]. 福州:福建农林大学, 2010: 16-23.
[35] 李宝聚, 陈立芹, 孟伟军, 等. 温度调控对番茄灰霉病菌侵染的影响[J].植物保护, 2004, 30(2): 75-80.
Biological Characteristics and Cell Wall Degrading Enzyme Activities of Flat Peach Brown Rot Pathogen
SONG Dandan1, KONG Qingjun2, LI Hongbin1, REN Xueyan2,*
(1. College of Life Sciences, Shihezi University, Shihezi 832003, China; 2. College of Food Engineering and Nutritional Science, Shaanxi Normal University, Xian 710062, China)
Brown rot disease caused by Monilinia fructicola is one of the major postharvest diseases ofat peach, which causes serious postharvest loss. Meanwhile, the pathogenicities of M. fructicola for different fruit hosts are different. In this investigation, we studied the biological characteristics of M. fructicola under different culture conditions including temperature, pH, and light, and we also examined the impacts of culture temperature, pH and time on the activities of cell wall degrading enzymes. The results showed that the optimum pH for spore germination and germ tube extension of M. fructicola was 5.0 and it grew well in a weak acidic environment, while the spore germination rate was signi cantly lower in an excessively acidic environment. The optimum temperature for colony growth was in the range of 20~ 28 ℃, and the pathogen could not grow normally at a temperature above 36 ℃. Temperature affected colony morphology, and at different temperatures, the colony morphology characteristics were different. Light had little effect on the hyphal growth. The activities of the cell wall degrading enzymes endoglucanase (EG), β-glucosidase (BG), polymethylgalacturonase (PMG), and polygalacturonase (PG) were the highest at 28 ℃. The activities of EG and BG reached the highest values at pH 6.0, while the activities of PMG and PG reached the highest values at pH 7.0. The activi ties of these four enzymes were the highest after cultivation for 5 days. Regardless of changes in pH, temperature and incubation time, BG activity was higher than EG activity and PG activity was higher than PMG activity.
Monilinia fructicola; biological characteristics; cell wall degrading enzymes; culture conditions
10.7506/spkx1002-6630-201710008
Q934.1;Q55
A
1002-6630(2017)10-0042-07
2016- 07-14
国家自然科学基金地区科学基金项目(31260402;31460411;21362028);国家自然科学基金面上项目(31671904);陕西省农业科技创新与攻关项目(2016NY-184;2016NY-194);中央高校基本科研业务费专项(GK201503069;GK201603095)
宋丹丹(1991—),女,硕士研究生,研究方向为果蔬采后防治。E-mail:1424435556@qq.com
*通信作者:任雪艳(1978—),女,副教授,博士,研究方向为农产品贮藏与加工。E-mail:rxy104@snnu.edu.cn
宋丹丹, 孔庆军, 李鸿彬, 等. 蟠桃褐腐病原菌生物学特性及细胞壁降解酶活性[J]. 食品科学, 2017, 38(10): 42-48.
DOI:10.7506/spkx1002-6630-201710008. http://www.spkx.net.cn SONG Dandan, KONG Qingjun,LI Hongbin, et al. Biological characteristics and cell wall degrading enzyme activities of flat peach brown rot pa thogen[J]. Food Science, 2017, 38(10): 42-48. (in Chinese with English abstract) DOI:10.7506/ spkx1002-6630-201710008. http://www.spkx.net.cn

