碱金属改性的MnCu/γ-Al2O3催化剂催化分解N2O性能
赵春艳, 李翠清, 黄增斌, 李 晶, 王 虹, 宋永吉
(北京石油化工学院 绿色化学与催化材料研究所, 北京 102617)
碱金属改性的MnCu/γ-Al2O3催化剂催化分解N2O性能
赵春艳, 李翠清, 黄增斌, 李 晶, 王 虹, 宋永吉
(北京石油化工学院 绿色化学与催化材料研究所, 北京 102617)
以γ-Al2O3为载体,采用浸渍法制备了MnCu复合金属氧化物负载量不同的MnCu/γ-Al2O3催化剂。考察了不同碱金属(Na、K、Rb)改性对MnCu/γ-Al2O3催化剂催化分解N2O反应性能的影响。采用XRD、BET、H2-TPR、XPS和SEM等手段表征催化剂。结果表明,对于MnCu/γ-Al2O3催化剂,适宜的MnCu复合金属氧化物负载量为20%(Cat-20),此时添加碱金属K、Rb使Cat-20催化剂Mn—O键和Cu—O键弱化,降低了催化剂的还原温度,提高了Mn4+/Mn3+原子比,从而有利于提高Cat-20催化剂催化分解N2O反应性能。当添加K、Rb的质量分数分别为6%时,Cat-20-K(6)和Cat-20-Rb(6)均具有相对较高的催化分解N2O反应活性,其对应的N2O完全转化的反应温度分别为510℃和500℃,而Na的添加对催化剂活性影响较小。
氧化锰; 氧化铜;γ-Al2O3; 碱金属助剂; 氧化亚氮; 催化分解
N2O作为一种温室效应气体,对全球气候变化的贡献中约占6%(体积分数)[1]。与CO2相比,N2O在大气中的含量虽相对较低,但其全球增暖潜能(GWP)是CO2的310倍,且其寿命约为150年,对对流层中的臭氧(O3)层有极其严重的破坏作用,造成O3的减少量约占O3总减少量的70%[2]。N2O主要来自汽车尾气、己二酸生产以及硝酸生产等工业过程,其对环境的影响已引起各国学者的广泛关注。
直接催化分解N2O技术是消除N2O最有效的方法,即将N2O在催化剂的作用下直接分解为N2和O2,而没有其他副产物的生成,是一个完全的绿色催化过程。其中,Cu基和Mn基复合金属氧化物由于具有良好的催化分解N2O反应活性,成为广大学者的研究重点[3-9]。Smeets等[10]用离子交换法制备了一系列不同分子筛负载的Cu基催化剂,在相同的Cu/Al原子比时,Cu/ZSM-5分子筛催化剂具有相对较高的直接催化分解N2O反应活性。研究发现,N2O分解反应的控制步骤是相同吸附态O*结合生成O2分子并从催化剂表面脱附的反应,而Cu的负载量与O2的解吸速率密切相关,Cu负载量较低时,O原子需要重新组成O2并从催化剂表面脱离。Abu-Zied等[11-12]采用固体离子交换法制备了一系列金属交换ZSM-5分子筛催化剂,评价结果表明,不同催化剂的直接催化分解N2O反应活性从大到小顺序为Cu(Fe)、Co(Pd)、Ag(Ce)、La、H、Y、Ni(Mn)、Cd、Zn。Spassova等[13]研究发现,Cu-Mn之间存在强相互作用,有利于电荷的迁移和交换(Cu2++Mn3+→Cu++Mn4+),从而使得N2O在催化剂活性位上更易获得电子,以削弱N—O键。
添加碱金属Li、Na、K、Rb、Cs可以改善催化剂活性组分的分散性,减弱活性组分氧化物的键能,从而提高催化剂直接催化分解N2O反应活性。武海鹏等[14-15]研究了K改性对NiAl类复合氧化物催化分解N2O反应活性的影响。研究表明,K离子的引入,使催化剂表面分布的Ni+周围电子云密度增加,减弱了催化剂表面Ni—O键强度,从而降低了NiO的还原温度,提高了催化剂催化分解N2O反应的活性。Asano等[16]研究了无取代的Co3O4尖晶石催化剂中添加K的作用,催化剂中Co2+被N2O分解的O2氧化为Co3+的同时,K的添加促进了Co3+→Co2+的还原,从而提高了催化剂催化分解N2O反应的活性。Haber等[17]的研究同样表明,在Rh/γ-Al2O3催化剂中,碱金属Li、Na、K、Cs的添加,一方面使催化剂中活性组分Rh在载体表面分散更均匀,同时碱金属的强负电性增加了催化剂表面氧化物的负电荷,阻止了Rh的扩散和晶粒变大,提高了催化剂催化分解N2O反应活性。
笔者以γ-Al2O3为载体,以MnCu复合金属氧化物为活性组分,采用共浸渍法制备了MnCu/γ-Al2O3催化剂;采用X射线衍射(XRD)、N2脱附-吸附、H2程序升温还原(H2-TPR)、X射线光电子能谱(XPS)和扫描电镜(SEM)等手段表征催化剂。通过固定床微反装置考察了催化剂催化分解N2O的反应性能,并进一步研究了碱金属(Na、K、Rb)改性对MnCu/γ-Al2O3催化剂催化分解N2O反应性能的影响。
1 实验部分
1.1 试剂与原料
催化剂原料:拟薄水铝石粉,工业级,中国铝业股份有限公司产品;50%硝酸锰溶液(50% Mn(NO3)2,质量分数),分析纯,北京益利精细化学品有限公司产品;六水合硝酸铜(Cu(NO3)2·6H2O),分析纯,淄博圣诺化工有限公司产品;硝酸钠(NaNO3)、硝酸钾(KNO3)、硝酸铷(RbNO3),均为分析纯,中国医药(集团)上海化学试剂公司产品;去离子水,实验室自制。
气体原料:氧化亚氮(N2O)、高纯N2、空气,均为北京氙禾玉气体技术有限公司产品。
1.2 催化剂的制备
以MnCu复合金属氧化物负载量为15%(质量分数,以MnO2和CuO总质量占催化剂总质量分数计,下同)制备MnCu/γ-Al2O3催化剂为例,首先称取200 g拟薄水铝石粉在马福炉中于550℃焙烧4 h,制得γ-Al2O3载体(BET比表面积为240 m2/g)以备用。根据前期实验研究结果[18],按n(Mn)/n(Cu)=3称取4.73 g 50%Mn(NO3)2溶液和1.06 g Cu(NO3)2·6H2O,并溶解于150 mL去离子水中,配制Mn(NO3)2和Cu(NO3)2的混合溶液,将8.5 gγ-Al2O3载体浸渍于此混合溶液中并搅拌均匀,然后放入集热式恒温加热磁力搅拌器中,于90℃加热至水分基本蒸干;将所得黏稠样品置入烘箱中于80℃干燥12 h,然后在马福炉中以程序升温的方式加热焙烧,起始温度为25℃,升温速率为1°/min,升至120℃、200℃、350℃时分别停留2 h,继续升温至800℃,停留时间为4 h。最后将经过焙烧的粉末样品进行压片研磨,筛选出20~40目的颗粒备用。根据以上方法,分别制备MnCu复合金属氧化物负载量为15%、20%、25%、30%、35%的MnCu/γ-Al2O3催化剂。制备的催化剂以Cat-a表示,其中a代表MnCu复合金属氧化物的质量分数。
以Cat-20为研究基础,分别考察添加碱金属(Na、K、Rb)对该催化剂催化分解N2O反应性能的影响。称取6.31 g 50%Mn(NO3)2溶液和1.42 g Cu(NO3)2·6H2O溶解于150 mL去离子水中,配制Mn(NO3)2和Cu(NO3)2的混合溶液;之后分别加入NaNO3、KNO3、RbNO3(质量分数分别为2%、4%、6%、8%,以碱金属氧化物占催化剂总质量分数计)使其溶解并充分混合均匀。将8 g的γ-Al2O3载体浸渍于混合金属溶液中,采用前述干燥及焙烧条件制备不同碱金属改性的Cat-20系列催化剂。制备的催化剂以Cat-20-M(b)表示,M分别代表碱金属Na、K、Rb,b代表碱金属的质量分数。
1.3 催化剂的表征
采用日本岛津公司XRD-6000X射线衍射仪进行XRD表征,Cu靶辐射,Kα辐射源,管电压40 kV,管电流30 mA,扫描速率4°/min,扫描步长0.02,扫描范围为10°~80°。
采用美国麦克公司ASPS2020型自动比表面积测定仪测定BET比表面积。样品首先经过300℃、0.133 Pa脱气处理1 h,然后在-196℃下进行N2吸附-脱附实验。
采用美国Micromeritics Chemisorb 2750脉冲化学吸附仪进行H2程序升温还原(H2-TPR)表征,还原气体组成5%(体积分数)H2/He,流速为20 mL/min,从室温以15℃/min的速率升温至850℃。
采用美国ThermoFisher Scientific公司的ESCALAB 250进行XPS表征,射线源为AlKα的X射线,图像分辨率3 μm,测试前将催化剂充分研磨干燥。
采用FEI公司的Quanta400F扫描电子显微镜(SEM)表征催化剂的外貌形态。
1.4 催化剂的评价
在固定床微反装置上进行催化剂催化分解N2O反应性能评价。反应管为内径8 mm的石英玻璃管,催化剂装填量为1.0 mL,气体体积空速(GHSV)为4800 h-1;原料气组成为6800×10-6(体积分数)N2O,8800×10-6(体积分数)O2,N2为平衡气。反应尾气通过北京北分瑞利分析仪器有限公司3420A气相色谱进行在线检测(TCD检测器,Porapak Q色谱柱,柱箱温度50℃,注样器50℃,检测器100℃,热丝温度140℃),H2为载气,流量60 mL/h。
采用程序升温的方式,测定不同反应温度下N2O的转化率。
式中,x(N2O)为N2O的转化率;A1(N2O)为反应开始前色谱检测到原料气N2O的峰面积;A2(N2O)为反应开始后色谱检测到的反应尾气中N2O的峰面积。以Tx表示N2O转化率为x时所对应的反应温度;在N2O转化率相同的情况下,反应温度越低,催化剂的活性越好。
2 结果与讨论
2.1 Cat-a催化分解N2O反应性能
图1为Cat-a催化分解N2O反应温度与N2O转化率的关系。从图1可见,N2O转化率均随反应温度的升高而增加,Cat-15催化分解N2O反应活性最低;Cat-20催化分解N2O反应活性有较大幅度提高,其N2O转化率分别达到95%和100%时所对应的反应温度分别为540℃和570℃。当MnCu复合金属氧化物负载量进一步提高,Cat-a催化分解N2O反应活性没有明显变化。
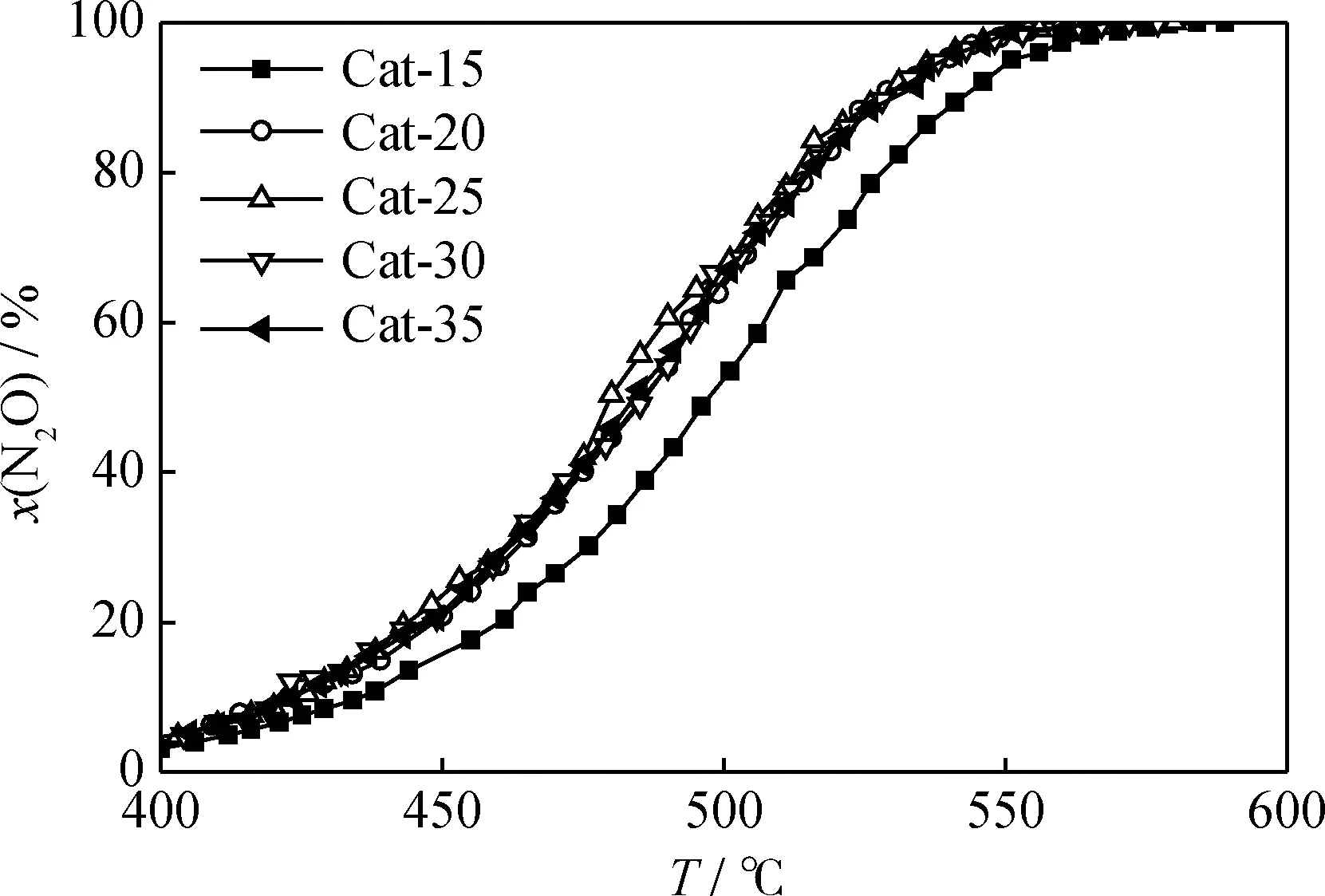
图1 Cat-a催化分解N2O的反应温度与N2O转化率的关系曲线Fig.1 Curves of N2O conversion with reaction temperature for Cat-ap=101.3 kPa; GHSV=4800 h-1
图2为Cat-a的XRD谱。由图2可知,Cat-15在2θ为31.726°、37.450°、45.549°、60.452°和66.499°检测到载体γ-Al2O3(PDF50-0741)的特征衍射峰,而未观察到Mn、Cu氧化物的特征衍射峰,可能是活性组分负载量比较小且在载体表面高度分散的原因[19]。Cat-20在2θ为30.862°、36.262°、58.400°、64.232°出现MnAl2O4(PDF29-0880)尖晶石的特征衍射峰。MnCu复合金属氧化物的质量分数越高,MnAl2O4尖晶石的特征衍射峰强度越大,表明结晶度变大且晶相尺寸也逐渐增加,这可能导致活性组分在载体表面部分团聚,从而使BET比表面积显著减小(见表1)。

图2 Cat-a的XRD谱Fig.2 XRD patterns of Cat-a(1) Cat-15; (2) Cat-20; (3) Cat-25; (4) Cat-30; (5) Cat-35

表1 Cat-a的比表面积Table 1 BET surface area of Cat-a
图3为Cat-a的H2-TPR曲线。由图3可知,Cat-a在H2-TPR曲线均只出现1个归属于Mn-Cu-O-Al的复合氧化物的还原峰。随着MnCu复合金属氧化物质量分数的增加,还原峰温度先降低后升高;Cat-25还原峰温度相对最低为261℃,这可能由于随着MnCu复合金属氧化物质量分数的增加,催化剂活性中心数量越来越多,由于氢溢流效应使还原生成的金属Cu催化了MnxOy的还原,或者是还原的金属Cu诱发了MnxOy晶格中氧的移动,导致MnxOy的还原峰温度向低温方向移动[20-22]。当MnCu复合金属氧化物质量分数大于25%时,根据XRD表征结果,活性组分在载体表面发生部分团聚,使得催化剂的还原变得越来越困难,从而使催化剂还原峰温度又逐渐提高。此外,与Cat-25具有较低的还原峰温度相比,Cat-20耗氢峰面积相对较大,说明该催化剂具有更多的易被还原物种,因此Cat-20和Cat-25 2个催化剂具有相近的催化分解N2O反应活性。从经济角度考虑,以Cat-20为研究基础,考察碱金属改性对Cat-20催化分解N2O反应性能的影响。
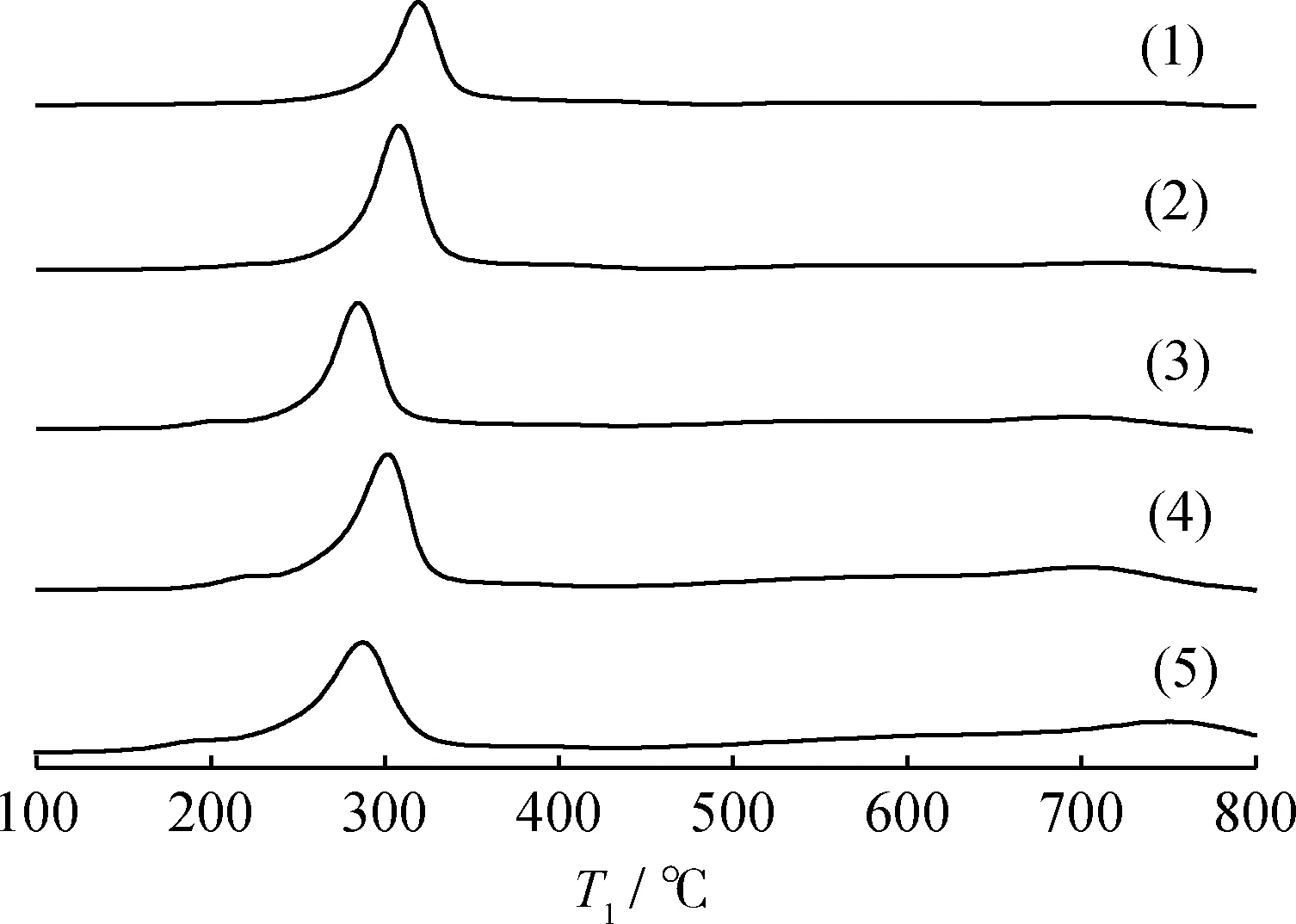
图3 Cat-a的H2-TPR曲线Fig.3 H2-TPR profiles of Cat-a(1) Cat-15; (2) Cat-20; (3) Cat-25; (4) Cat-30; (5) Cat-35
2.2 碱金属改性对Cat-20催化分解N2O反应性能影响
图4为Cat-20-M(b)催化分解N2O反应温度与N2O转化率关系曲线。从图4(a)可知,采用K改性有利于提高Cat-20催化分解N2O反应活性,少量K的添加能明显提高Cat-20催化分解N2O反应活性;当K的添加质量分数提高到6%时,Cat-20-K(6)催化分解N2O的反应活性达到相对最高,其T95和T100分别为466℃和510℃,比Cat-20催化剂分别降低了74℃和60℃。Cat-20-K(8)催化分解N2O的活性没有进一步明显变化。由图4(b)可知,采用Rb改性也有利于提高Cat-20催化分解N2O反应活性,其结果与K的影响相似。Cat-20-Rb(6)催化分解N2O活性达到相对最高,其T95和T100分别为459℃和500℃,比Cat-20分别降低了81℃和70℃;进一步提高Rb的添加量,Cat-20-Rb(8)催化分解N2O的反应活性提高不明显。由图4(c)可知,与K、Rb不同,在N2O转化率达到90%以后,少量Na的添加使Cat-20-Na(2)催化分解N2O反应活性略有降低,进一步提高Na的添加量,催化剂催化分解N2O反应活性与Cat-20相差不大。由上可知,采用K、Rb、Na分别对Cat-20进行改性,适宜的碱金属添加量均为6%时,此时催化剂分别具有相对较高的催化分解N2O反应活性。
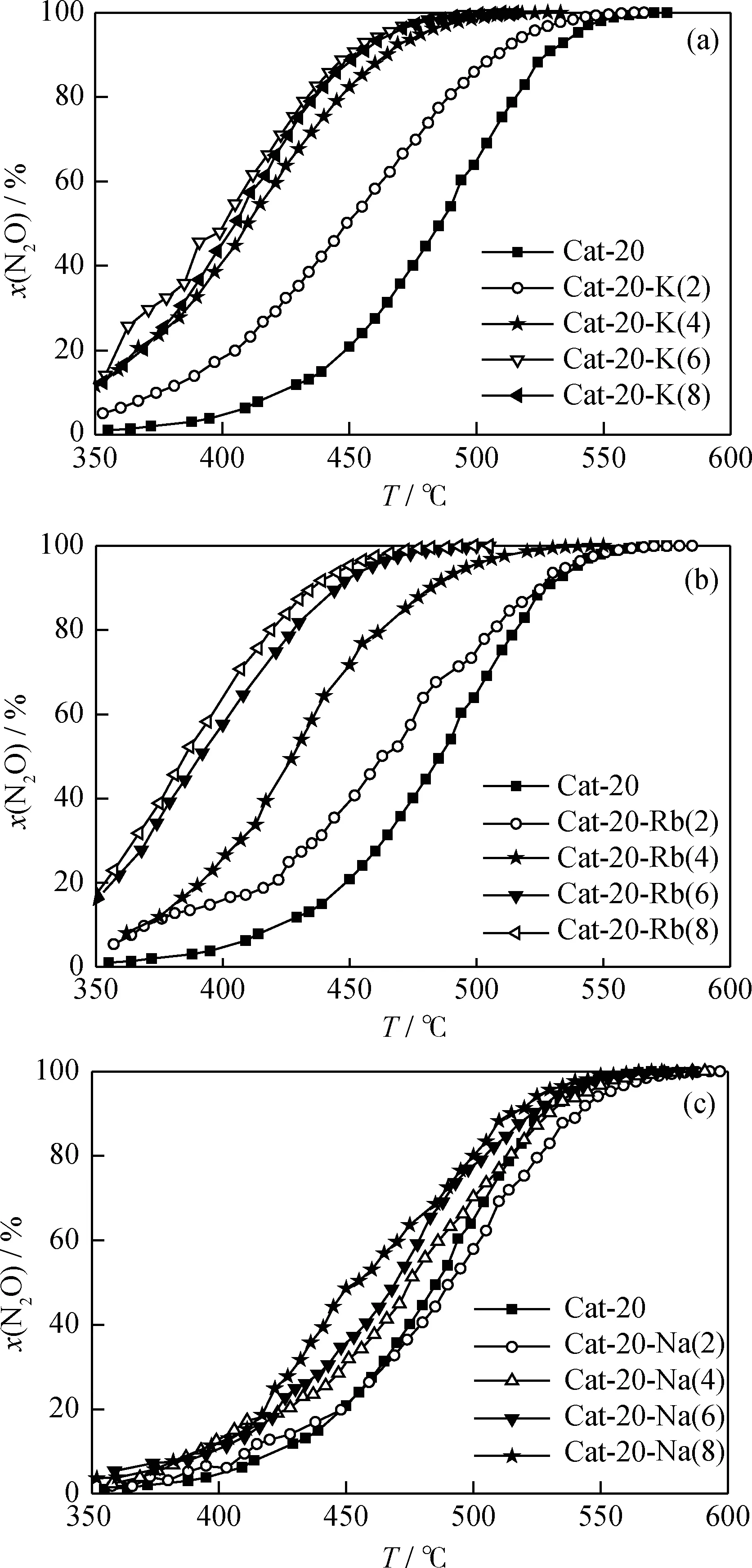
图4 Cat-20-M(b)催化分解N2O反应温度与N2O转化率关系曲线Fig.4 Curves of N2O conversion with reaction temperature for Cat-20-M(b)M: (a) K; (b) Rb; (c) Nap=101.3 kPa; GHSV=4800 h-1
图5为Cat-20和Cat-20-M(6)的XRD谱。由图5 可知,碱金属改性并没有改变Cat-20本体的晶相结构,但一些特征峰的强度发生不同程度变化。Na改性使Cat-20在2θ为30.862°和36.262°的特征峰变强,说明催化剂中具有尖晶石结构的MnAl2O4物相结晶度提高;此外,K和Rb改性使Cat-20在2θ为30.862°、36.262°、58.400°和64.232°的衍射峰强度变弱、峰型变宽,说明催化剂中具有尖晶石结构的MnAl2O4物相粒径尺寸变小,在载体表面的分散性提高,从而对催化剂催化分解N2O反应有利,这与活性评价结果一致。
表2为Cat-20-M(6)催化剂的比表面积。由表2可见,Na改性使Cat-20比表面积略有减小,而K、Rb改性对Cat-20比表面积影响不大或略有增加。

表2 Cat-20-M(6)比表面积Table 2 BET surface area of Cat-20-M(6)
图6为Cat-20-M(6)的Mn2p、Cu2p的XPS分峰拟合曲线。表3为Cat-20-M(6)的XPS定量分析结果。从图6可见,在643.8~643.4 eV、642.5~643.2 eV和641.3~641.0 eV检测到的3个峰,分别归属于Mn4+、Mn3+和Mn2+的2p3/2信号峰[8,23-24];在935.0~935.5 eV和932.2~934.0 eV处出现的衍射峰,分别归属于Cu2+和Cu+的特征峰[26-28],且在943.2 eV左右出现了典型的CuO的卫星峰[5-7],表明催化剂中有CuO的存在,并且在载体上均匀分布,因而XRD谱中没有检测到CuO的特征衍射峰。与Cat-20相比,Cat-20-K(6)和Cat-20-Rb(6)表面Mn4+、Mn3+和Mn2+的结合能以及Cu2+和Cu+结合能均降低,使Mn—O键和Cu—O键的键能强度减弱;同时Mn4+/Mn3+的原子比和Cu2+/Cu+的原子比均提高,提高了催化剂的还原性,从而提高了催化剂催化分解N2O反应活性[25,29],这与催化剂评价结果相符。相反,Cat-20-Na(6)表面Mn4+、Mn3+和Mn2+的结合能并未降低或略有增加,且Mn4+/Mn3+的原子比降低,同时Cu2+和Cu+结合能变化很小,Cu2+/Cu+的原子比有一定程度提高,Cat-20-Na(6)催化分解N2O反应性能可能是Mn—O与Cu—O共同作用的结果[19]。
图7为Cat-20和Cat-20-M(6)的SEM照片。由图7可知,无碱金属添加时催化剂成细碎颗粒状均匀分布;Na改性使催化剂颗粒明显变大且分布不均,并出现部分团聚现象;分别采用K和Rb改性使催化剂颗粒大小相对比较均匀且松散分布。催化剂的形貌对催化分解N2O反应活性有一定影响。
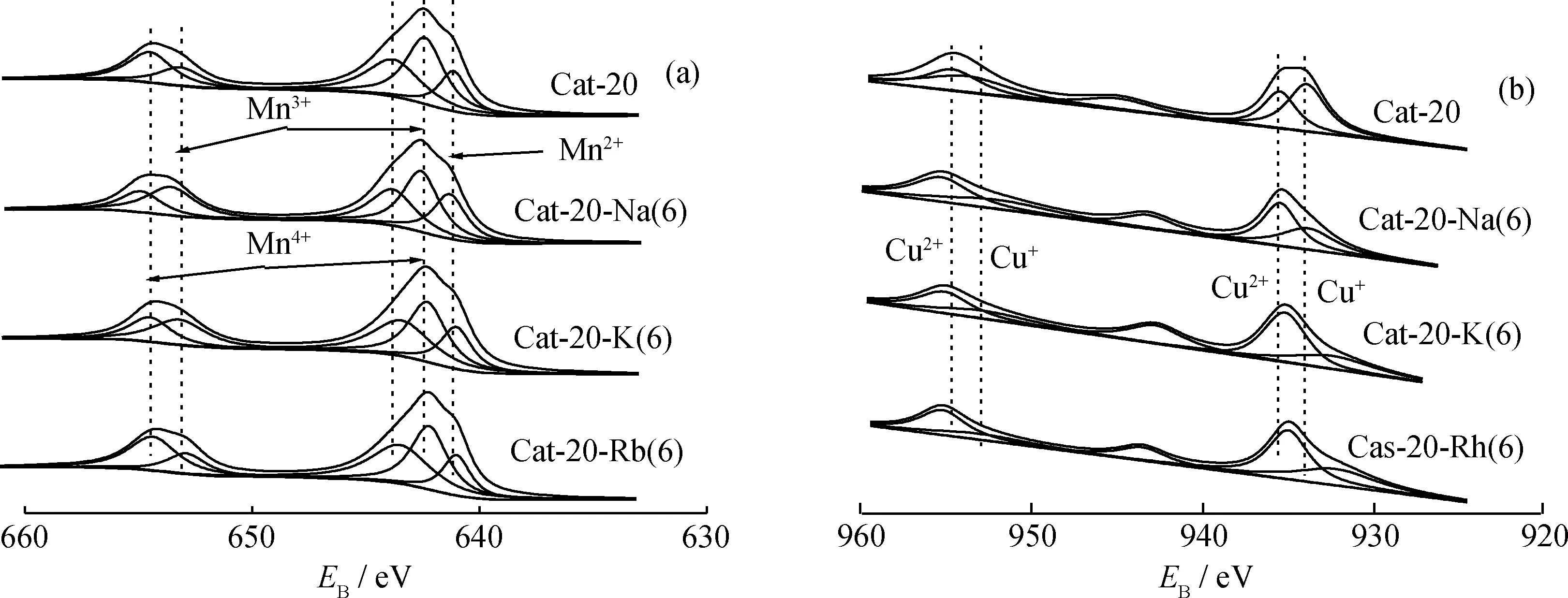
图6 Cat-20-M(6)的Mn 2p、Cu 2p的XPS分峰拟合曲线Fig.6 XPS fitting curves of Mn 2p and Cu 2p of Cat-20-M(6)(a) Mn 2p; (b) Cu 2p

表3 Cat-20-M(6)的XPS定量分析结果Table 3 Quantitative analysis of XPS results for Cat-20-M(6)

图7 Cat-20和Cat-20-M(6)的SEM照片Fig.7 SEM images of Cat-20 and Cat-20-M(6)(a) Cat-20; (b) Cat-20-Na(6); (c) Cat-20-K(6); (d) Cat-20-Rb(6)
在实验室微型反应器装置上对Cat-20-K(6)进行活性稳定性评价。图8为Cat-20-K(6)催化分解N2O反应活性稳定性。从图8可见,当反应时长达100 h时,N2O转化率一直维持在99%以上,表明该催化剂具有良好的活性稳定性。
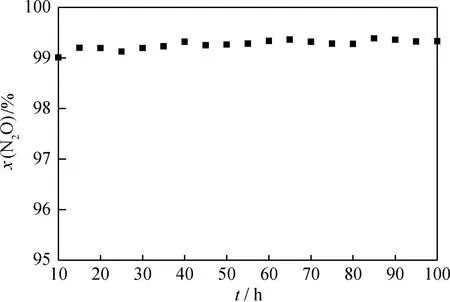
图8 Cat-20-K(6)催化分解N2O反应活性稳定性Fig.8 Activity stability of Cat-20-K(6) for N2O decompositionp=101.3 kPa; GHSV=4800 h-1
3 结 论
考察了MnCu/γ-Al2O3催化剂活性组分负载量以及碱金属(Na、K和Rb)改性对催化剂催化分解N2O反应性能的影响。结果表明,催化剂适宜的MnCu复合金属氧化物负载量为20%;碱金属K和Rb改性能显著提高Cat-20催化剂催化分解N2O反应活性,适宜的添加量为6%,此时Cat-20-K(6)和Cat-20-Rb(6)催化剂催化分解N2O反应活性相对最高,N2O转化率达100%的反应温度分别为510℃和500℃。K、Rb的改性减弱了Mn—O键和Cu—O键的键能,增加了活性组分分散度,提高了催化剂还原性能,从而有利于提高催化剂催化分解N2O反应性能。Cat-20-K(6)催化剂具有良好的活性稳定性,在100 h反应时间内其催化分解N2O反应转化率一直保持在99%以上。
[1] 秦大河, Thomas Stocker. IPCC第五次评估报告第一工作组报告的亮点结论[J].气候变化研究进展, 2014, 10(1): 1-6. (QIN Dahe, THOMAS Stocker. Highlights of the IPCC Working Group I Fifth assessment report[J].Advances in Climate Change Research, 2014, 10(1): 1-6.)
[2] 李孟丽, 杨晓龙, 康立平, 等. N2O的催化分解研究[J].化学进展, 2012, 24(9): 1801-1817. (LI Mengli, YANG Xiaolong, KANG Liping, et al. Catalysts for catalytic decomposition of nitrous oxide[J].Progress in Chemistry, 2012, 24(9): 1801-1817.)
[4] PEKRIDIS G, ATHANASIOU C, KONSOLAKIS M, et al. N2O abatement overγ-Al2O3supported catalysts: Effect of reducing agent and active phase nature[J].Top Catalysis, 2009, 52(13): 1880-1887.
[5] DOU Z, ZHANG H J, PAN Y F, et al. Catalytic decomposition of N2O over potassium-modified Cu-Co spinel oxides[J].Journal of Fuel Chemistry and Technology, 2014, 42(2): 238-245.
[6] XIE P F, MA Z, ZHOU H B, et al. Catalytic decomposition of N2O over Cu-ZSM-11 catalysts[J].Microporous and Mesoporous Materials, 2014, 191(3): 112-117.
[7] PAN Y F, FENG M, CUI X, et al. Catalytic activity of alkali metal doped Cu-Al mixed oxides for N2O decomposition in the presence of oxygen[J].Journal of Fuel Chemistry and Technology, 2012, 40(5): 601-607.
[9] AMROUSSE R, KATSUMI T. Substituted ferrite MxFe1-xFe2O4(M=Mn, Zn) catalysts for N2O catalytic decomposition processes[J].Catalysis Communications, 2012, 26(35): 194-198.
[10] SMEETS P J, SELS B F, VANTEEFFELEN R M, et al. The catalytic performance of Cu-containing zeolites in N2O decomposition and the influence of O2, NO and H2O on recombination of oxygen[J].Journal of Catalysis, 2008, 256(2): 183-191.
[11] ABU-ZIED B M, SCHWIEGER W, UNGER A. Nitrous oxide decomposition over transition metal exchanged ZSM-5 zeolites prepared by the solid-state ion-exchange method[J].Applied Catalysis, B: Environmental, 2008, 84(1-2): 277-288.
[12] ABU-ZIED B M, SOLIMAN S A, ABDELLAH S E. Pure and Ni-substituted Co3O4spinel catalysts for direct N2O decomposition[J].Chinese Journal of Catalysis, 2014, 35(7): 1105-1112.
[13] SPASSOVA I, KHRISTOVA M, NICKOLOV R, et al. Novel application of depleted fullerene soot (DFS) as support of catalysts for low-temperature reduction of NO with CO[J].Journal of Colloid and Interface Science, 2008, 320(1): 186-193.
[14] 武海鹏, 钱振英, 徐晓玲, 等. K改性NiAl类水滑石衍生复合氧化物催化分解N2O[J].燃料化学学报, 2011, 39(2): 115-121. (WU Haipeng, QIAN Zhenying, XU Xiaoling, et al. N2O decomposition over K-promoted NiAl mixed oxides derived from hydrotalcite-like compounds[J].Journal of Fuel Chemistry and Technology, 2011, 39(2): 115-121.)
[15] 武海鹏, 李文静, 郭丽, 等. 碱金属助剂类型及前驱物对改性NiAl复合氧化物催化分解N2O活性的影响[J].燃料化学学报, 2011, 39(7), 550-555. (WU Haipeng, LI Wenjing, GUO Li, et al. Effect of promoter species and precursors on catalytic activity of alkali metal promoted NiAl mixed oxides for N2O decomposition[J].Journal of Fuel Chemistry and Technology, 2011, 39(7): 550-555.)
[16] ASANO K, OHNISHI C, IWAMOTO S, et al. Potassium-doped Co3O4catalyst for direct decomposition of N2O[J].Applied Catalysis, B: Environmental, 2008, 78(3-4): 242-249.
[17] HABER J, NATTICH M, MACHEJ T. Alkali-metal promoted rhodium-on-alumina catalysts for nitrous oxide decomposition[J].Applied Catalysis, B: Environmental, 2008, 77(3-4): 278-283.
[18] 赵春艳. Mn基复合氧化物催化剂氧化亚氮催化分解性能[D].北京: 北京化工大学, 2015.
[19] CHEN H H, ZHANG H P, YAN Y. Fabrication of porous copper/manganese binary oxides modified ZSM-5 membrane catalyst and potential application in the removal of VOCs[J].Chemical Engineering Journal, 2014, 254(7): 133-142.
[20] 戴越. 改性载体MnOx/γ-Al2O3负载不同金属氧化物催化剂的制备、表征及性能研究[D].南京: 南京大学, 2012.
[21] 李丹. CuO-MnxOy/γ-Al2O3催化剂的制备、表征及催化还原NO的性质研究[D].南京: 南京大学, 2011.
[22] TIAN M, WANG A Q, WANG X D, et al. Effect of large cations (La3+and Ba2+) on the catalytic performance of Mn-substituted hexaaluminates for N2O decomposition[J].Applied Catalysis, B: Environmental, 2009, 92(3-4): 437-444.
[23] PIUMETTI M, FINO D, RUSSO N.Mesoporous manganese oxides prepared by solution combustion synthesis as catalysts for the total oxidation of VOCs[J].Applied Catalysis, B: Environmental, 2015, 163(163): 277-287.
[24] ZHANG Z S, CHEN B B, WANG X K, et al. NOxstorage and reduction properties of model manganese-based lean NOxtrap catalysts[J].Applied Catalysis, B: Environmental, 2015, 165(165): 232-244.
[25] KUMAR S, VINU A, SUBRT J, et al. Catalytic N2O decomposition on Pr0.8Ba0.2MnO3type perovskite catalyst for industrial emission control[J].Catalysis Today, 2012, 198(1): 125-132
[26] PAPAVASILIOU J, AVGOUROPOULOS G, IOANNIDES T. Combined steam reforming of methanol over Cu-Mn spinel oxide catalysts[J].Journal of Catalysis, 2007, 251(1): 7-20.
[27] CHEN H Y, LIN J, TAN K L, et al. Comparative studies of manganese-doped copper-based catalysts:The promoter effect of Mn on methanol synthesis[J].Applied Surface Science, 1998, 126(3-4): 323-331.
[28] CAO H Y, LI X S, CHEN Y Q, et al. Effect of loading content of copper oxides on performance of Mn-Cu mixed oxide catalysts for catalytic combustion of benzene[J].Journal of Rare Earths, 2012, 30(9): 871-877.
[29] PAN Y F, FENG M, CUI X, et al. Catalytic activity of alkali metal doped Cu-Al mixed oxides for N2O decomposition in the presence of oxygen[J].Journal of Fuel Chemistry and Technology, 2012, 40(5): 601-607.
Performance of MnCu/γ-Al2O3Catalysts Modified byAlkali Metal for N2O Catalytic Decomposition
ZHAO Chunyan, LI Cuiqing, HUANG Zengbin, LI Jing, WANG Hong, SONG Yongji
(TheGreenChemistryandCatalysisMaterialsLaboratory,BeijingInstituteofPetrochemicalTechnology,Beijing102617,China)
Usingγ-Al2O3as the support, a series of MnCu/γ-Al2O3catalysts with different loading contents of Mn and Cu composite metal oxides were prepared by the impregnation method. The effect of different alkali metals (Na, K or Rb) doping in MnCu/γ-Al2O3catalysts on N2O decomposition activity was investigated, and the catalysts were characterized by XRD, BET, H2-TPR, XPS and SEM. The results showed that the appropriate loading content of Mn and Cu composite metal oxides was 20% for MnCu/γ-Al2O3catalyst.The bond energy of Mn—O and Cu—O was weakened as Cat-20 catalyst doped by alkali metals of K or Rb, which resulted in decreased reduction temperature and improved Mn4+/Mn3+atomic ratio. Consequently, the Cat-20 catalyst was favorable to the N2O decomposition reaction. Cat-20-K(6) and Cat-20-Rb(6), the catalyst doped 6% content of alkali metal K and Rb, respectively, possessed a better N2O complete conversion temperature of 510℃ and 500℃, respectively. However, alkali metal Na doped in catalyst displayed little effect on the catalytic activity.
manganese oxide; copper oxide; alumina; alkali metal promoter; nitrous oxide; catalytic decomposition
2016-05-10
国家自然科学基金项目(21343009)资助
赵春艳,女,硕士研究生,从事环境催化方面的研究
李翠清,女,教授,博士,从事油品清洁利用、工业尾气减排研究;E-mail:licuiqing@bipt.edu.cn
1001-8719(2017)03-0439-08
O643.3
A
10.3969/j.issn.1001-8719.2017.03.007

