结核分枝杆菌ABC转运器胞外结构域COG1732的结晶研究
陈江淮,何永兴
结核分枝杆菌ABC转运器胞外结构域COG1732的结晶研究
陈江淮,何永兴
(兰州大学, 兰州市 中国 730000)
【目的】COG1732蛋白是结核分枝杆菌H37Rv菌株中的一个ATP-结合盒转运蛋白的底物结合蛋白,但其蛋白质三维结构及其生物学功能尚未明了,生物信息学分析表明COG1732蛋白可能做为参与渗透调节剂向细胞内转运过程中的底物识别过程,进一步改变跨膜结构域。本研究通过表达,纯化COG1732蛋白用于蛋白质晶体生长分析。【方法】针对结核分枝杆菌的一个ABC转运蛋白(ABC transporter)的胞外底物结合域COG1732。通过原核表达的方法,将表达COG1732的序列构建到带有T7启动子的载体pet28b,通过使用大肠杆菌表达系统BL21(DE3)大量表达COG1732蛋白。并通过镍亲和色谱和离子交换色谱的方法将COG1732蛋白纯化。将纯化好的COG1732蛋白浓缩至浓度为70mg/ml。分装保存到-80冰箱。并进行结晶条件的筛选。【结果】纯化的COG1732蛋白用悬滴气相扩散法得到了棒状晶体。【结论】成功构建了COG1732蛋白的原核表达载体﹑建立了表达纯化策略并获得了初步结晶的实验条件,为最终解析其三维结构奠定了基础。
ABC转运器;多药抗性蛋白;蛋白质晶体;结核分枝杆菌
1 前言
ABC转运蛋白(ABC transporter)最早发现于细菌[1,2],是细菌质膜上的一种运输蛋白(transporter),属于一个庞大而多样的蛋白家族,每个成员都含有两个高度保守的ATP结合区(ATP binding cassette),故名ABC转运蛋白[3,4],他们通过结合ATP发生二聚化,ATP水解后解聚,通过构象的改变将与之结合的底物转移至膜的另一侧。在大肠杆菌中78个基因(占全部基因的5%)编码ABC转运器蛋白,在动物中可能更多[5,6,7]。虽然每一种ABC转运器只转运一种或一类底物,但是其蛋白家族中具有能转运离子﹑氨基酸﹑核苷酸﹑多糖﹑多肽﹑甚至蛋白质的成员。ABC转运器还可催化脂双层的脂类在两层之间翻转,这在膜的发生和功能维护上具有重要的意义。第一个被发现的真核细胞的ABC转运器是多药抗性蛋白[8,9.10](multidrug resistance protein, MRP),该基因通常在肝癌患者的癌细胞中过表达,降低了化学治疗的疗效。约40%的患者的癌细胞内该基因过度表达。ABC转运器还与病原体对药物的抗性有关,如临床常用的抗真菌药物有氟康唑 ﹑酮康唑﹑伊曲康唑等,真菌对这些药物产生耐药性的一个重要机制是通过MDR蛋白降低了细胞内的药物浓度。结核分枝杆菌Mycobacterium tuberculosis H37Rv 是分枝杆菌科中一种致病性极强的病菌[11],是造成结核病的主要原因[12]。在1882年由Robert Koch 首次发现,M.tuberculosis具有不同寻常的蜡质外衣(最要由于分枝菌酸的存在),这使得细胞免于革兰氏染色。M.tuberculosis在临床治疗中表现出革兰氏阳性和革兰氏阴性的特性[13]。我们针对结合分枝杆菌具有的高度耐药性为出发点,通过生物信息学方法在结合分枝杆菌的基因簇中找到一个可能与多重耐药性相关的ABC转运蛋白,并从其底物结合域着手,探究这个蛋白的功能。本次研究通过构建COG1732的原核表达载体,并获得转运蛋白的底物结合域的表达﹑纯化和初步结晶的实验条件,为最终通过x射线晶体衍射技术解析其三维结构奠定基础。
2 材料和方法
2.1 分子克隆
菌株Mycobacterium tuberculosis H37Rv (re-annotation) ,E.coli BL21(DE3),E.coli DH5α(DE3)。均来自本实验室,pet28b(Novagen)质粒也是来自本实验室。PrimeStar 聚合酶,T4 DNA Ligase,T4 buffer,NdeI,NotI购买自TAKARA 。Yeast Extract,Tryptone 购买自OXOID,引物的设计以COG1732基因的序列为依据,使用DNA序列分析软件primer premier 5.0,并用NdeI和NotI作为酶切位点,根据一般引物设计原则设计引物,由GENEWIZ公司合成。
上游引物:NdeI 5'——GGAATTCATATGAAACCAAACC ACGCCGGAAA——3'
下游引物:NotI 5'——ATAAGAATGCGGCCGCCTACTGC CGCACTGGATGATCGA——3'其中划线部分为酶切位点。
以结核分枝杆菌Mycobacterium tuberculosis H37Rv菌液作为模板, PCR扩增COG1732的编码DNA序列。反应体系如下:primer star 5×PS buffer 10 μL,2.5 mM/L dNTP 4 μL,引物各(10 nM/L)1 μL,模板 1 μL,酶 1 μL,ddH2O补齐至50 μL。扩增参数:98 0C预变性5 min。98 0C,30 S。58 0C,15 S。72 0C,1 min。35个循环,72 0C后延伸10 min。
2.2 PCR 产物回收及质粒构建
用AXYGEN质粒小提试剂盒回收PCR产物。双酶切PCR产物体系如下: NdeI 2 μL,NotI 2 μL,PCR产物25 μL,H/BSA buffer 5 μL,ddH2O至 50 μL,4小时后用质粒小提试剂盒回收PCR产物,双酶切pet28b(Novagen)体系如下: NdeI 2 μL,NotI 2 μL,pet28b 30 μL,H/BSA buffer 5 μL,ddH2O至 50 μL。酶切10 小时左右跑琼脂糖核酸电泳(1%)并用AXYGEN凝胶回收试剂盒回收切开的质粒。构建重组质粒体系如下: pet28b 2 μL,PCR 6 μL,T4 buffer 1 μL,T4 ligase 1 μL。连接过夜,后转化到 E.coli DH5α。涂布到含有卡那霉素(50 ng/mL)12小时左右挑取单克隆,过夜后用AXYGEN质粒小提试剂盒提质粒,将提出的质粒并跑琼脂糖核酸电泳(1 %)并与空白质粒对照,挑出含有插入片段大小的质粒,做双酶切,体系如下: NdeI 2 μL,NotI 2 μL,pet28b 30 μL,H/BSA buffer 5 μL,ddH2O至50 μL。经过大约12小时左右,跑琼脂糖核酸电泳(1 %)。将双酶切检测出来的重组质粒,送到GENEWIZ测序,挑出可以用的重组质粒进行表达。
2.3 蛋白纯化与结晶
先将重组质粒转化到E.coli.BL21 ,并在50 mL的液体LB加入卡那霉素(50 ng/mL),370C,220 rpm/min 的摇床(Thermo scientific MAXQ 4000)中活化。12小时左右之后吸取20 mL活化的菌液以1:50接种到1 L的液体LB培养基中添加卡那霉素浓度(50 ng/mL)在37 0C ,220rpm/min的摇床中培养当菌液的生长曲线达到对数期OD600=0.6左右的时候,加入诱导剂IPTG(0.2 μM/L)。并在16 0C ,220 rpm/min 的条件下让蛋白表达。24小时后收菌用的是500 mL的日立(HITACHI himac CR22GII)专用的收菌瓶在8000 rpm,10 min 常温条件下收集,并倒掉上清。将菌体用结合缓冲液30mL(20 mM Tris=8.0,10 mM NaCl 10 mM 咪唑)重悬菌体。将重悬的菌液用超声波细胞粉碎机(BioSafer650-92)功率400 w ,8 min裂解。后用高速冷冻离心机(SIGMA 3K30)12000 rpm 30 min 4 0C离心后立即将上清吸出放在干净的50 mL管子中置于冰上,弃沉淀。准备过镍柱(GE HEALTH)平衡镍柱用结合缓冲液(20 mM Tris=8.0,10 mM NaCl 10 mM 咪唑)大概5个柱体积。平衡好镍柱之后就可以将裂解出来的上清加入镍柱,可以将流传液再过一遍镍柱。后用5个柱体积的洗脱缓冲液(20mM Tris=8.0,10 mM NaCl 20 mM 咪唑)洗脱一次。然后依次用2个柱体积的洗脱缓冲液(20 mM Tris=8.0,10 mM NaCl 50 mM 咪唑),2个柱体积的洗脱缓冲液(20 mM Tris=8.0,10 mM NaCl 100 mM 咪唑),2个柱体积的洗脱缓冲液(20 mM Tris=8.0,10 mM NaCl 250 mM 咪唑),2个柱体积的洗脱缓冲液(20 mM Tris=8.0,10 mM NaCl 500 mM 咪唑),2个柱体积的洗脱缓冲液(20 mM Tris=8.0,10 mM NaCl 1 M 咪唑)洗脱将梯度洗脱下来的液体准备跑12%聚丙烯酰胺凝胶电泳(SDS-PAGE)。每个25 μL(5 μL loading bufer+20 μL洗脱液)在1000C 10 min 水浴锅中煮沸。上样跑SDS-PAGE 185 V 85 mA 1h 后用考马斯亮蓝R250染色液(0.1% (w/v)考马斯亮蓝R250,25%(v/v)异丙醇,(v/v)冰醋酸)染色。染好色之后就用考马斯亮蓝脱色液(10%(v/v)醋酸。5%(v/v)乙醇)脱色。然后将洗脱体系用Millipore超滤离心管(3000DA)用日立高速冷冻离心机(HITACHI himac CR22GII)在3000 g的条件下离心脱盐,盐浓度低于10 mM后。将蛋白液用20 mM Tris(PH=8.0)稀释10-20倍,用来过离子交换柱。做法如下:先用20 mM Tris (PH=8.0),1M NaCl冲洗柱子5个柱体积。后用ddH2O冲洗5个柱体积,接下来用20 mM Tris (PH=8.0)平衡柱子5个柱体积,然后将稀释好的蛋白液上样,用不同浓度的NaCl梯度洗脱20 mM Tris (PH=8.0) 100 mM NaCl,20 mM Tris (PH=8.0) 200 mM NaCl,20 mM Tris (PH=8.0) 300 mM NaCl,20 mM Tris (PH=8.0) 400 mM NaCl,20 mM Tris (PH=8.0)500 mM NaCl,分别用两个柱体积。将洗脱下来的蛋白液分别跑SDSPAGE。将条件20 mM Tris (PH=8.0)300 mM NaCl洗脱下来的洗脱液用Millipore超滤离心管(3000DA)在日立高速冷冻离心机(HITACHI himac CR22GII)在3000 g的条件下离心脱盐,盐浓度低于100 mM后。用Thermo 2000 微量分光光度计测浓度为90.7 mg/mL 将多余蛋白分装好放在-800C冻起来。留下部分用来点晶体。使用坐滴法,ABC蛋白的浓度为27mg/mL,条件为1 μL蛋白加1 μL结晶缓冲液。并在24小时之后观察结晶的结果,持续一周。并在出现比较好的条件下用悬滴法进行晶体的优化。
3 实验结果
Pet28b构建之后转化的DH5α挑出的单克隆经过菌落PCR验证为阳性,并且Pet28b构建的质粒送去测序的结果显示完全正确。
COG1732蛋白在大肠杆菌BL21(DE3)小量诱导表达,重组菌在IPTG诱导后,菌体通过超声裂解后,上清和沉淀通过SDS-PAGE结果显示在大概23-35 Kda分子量大小出显示出有特征蛋白质的表达条带。上清和沉淀中都有,但是明显上清中多(图1)。将1L的诱导菌离心收集好,破碎离心后将上清首先进行镍柱亲和层析纯化,纯化结果显示,以获得较高纯度的目的蛋白,但仍含有杂蛋白(图2)可以看出在洗脱体系20 mM Tris=8.0,10 mM NaCl 250 mM咪唑中的蛋白浓度最高。并将含有高纯度目的蛋白质的洗脱液,利用阴离子交换层析进行进一步纯化(图3)可以看出在20 mM Tris pH8.0,300 mM氯化钠的洗脱液中蛋白质纯度最好,同时经过阴离子交换之后的目的蛋白质的纯度达到了95%以上。完全可以用来进行蛋白质的晶体培养及后续的优化。

图 1 小量诱导的上清和沉淀,M表示为116 Kda蛋白质分子量标准。

图 2 镍柱纯化ABC蛋白的结果,其中1表示为116 Kda蛋白质分子量标准,2表示20 mM Tris pH8.0,50 mM咪唑洗脱结果,3表示20 mM Tris pH8.0,100 mM咪唑洗脱结果,4表示20 mM Tris pH8.0,250 mM咪唑洗脱结果,5表示20 mM Tris pH8.0,500 mM咪唑洗脱结果,6表示为沉淀。
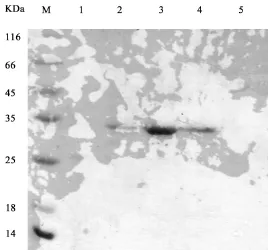
图3 ABC蛋白阴离子交换纯化结果, M为116KDa标准分子量,1为20 mM Tris pH8.0,100 mM氯化钠洗脱结果,2为20 mM Tris pH8.0,200 mM氯化钠洗脱结果,3为20 mM Tris pH8.0,300 mM氯化钠洗脱结果,4为20 mM Tris pH8.0,400 mM氯化钠洗脱结果,5为20 mM Tris pH8.0,500 mM氯化钠洗脱结果。
结果在160C在晶体培养箱中经过一段时间之后观察发现有晶体出现(表一)。其中部分条件下的晶体出现了。

表 1 出现COG1732晶体的条件
其中将条件73#的基础上进行了优化条件,后在ABC浓度27mg/mL,0.2 M 氯化钠,0.1 M Tris(ph=8.5),17.5%(w/v) PGE3350的条件下得到晶体如图4。
4 结论
当COG1732蛋白的镍柱纯化的条件为在250 mM咪唑浓度下就可以基本将目的蛋白洗脱下来,并且用100 mM咪唑可以将杂蛋白洗掉大部分。并且在离子交换的过程中300 mM氯化钠就可以纯化出来。在结晶的过程中经过研究发现蛋白质的氨基酸残基可以去掉几个这样有利于晶体的生长,并在条件73#的基础上进行了优化条件,后在0.2 M 氯化钠,0.1 M Tris(ph=8.5),17.5%(w/v) PGE3350的条件下长出了完整的蛋白质晶体。这以条件的晶体可以用来做x-射线的衍射。为进一步研究结核分枝杆菌的致病机理和高度耐药性提供的方便。
5 讨论
在摸索结晶条件时发现,所得到的COG1732蛋白晶体在不同的条件下在结晶条件非常相近的情况下可以生长出相同晶型的晶体,大多数晶体属于四方晶系。这说明影响蛋白晶体生长和晶型的因素是很微妙的,具体原因有待进一步的探讨。ATP-结合盒转运器(ABC转运蛋白)是转运系统超级家族成员之一,现有从原核生物到人类所有的纲中最古老的家族之一[14,15]。BC转运蛋白通常组成为底物结合亚基,一个或两个的跨膜蛋白一个或两个的与膜偶联的ATP酶。ATP酶亚基利用与ATP结合并水解获得能量将底物吸收或者运出细胞膜,并不是所有的内排系统都有周质空间的结合蛋白,一些同源的ATP酶的功能是非转运相关的过程比如转运RNA和DNA的修复[16,17]。ABC转运蛋白具有ATP-结合盒转运器相似的序列,尽管整体的膜蛋白可能在进化上相互独立,否则形成不同的蛋白家族。整个ABC外排系统有三次独立的进化[18]。多数的ABC转运蛋白具有原核生物和真核生物的共同特点[19]。ABC蛋白在细胞的很多生命活动过程是必须的,在人类基因的突变会造成很多的遗传疾病[20]ABC转运蛋白也参与多重耐药性,这个特性也是第一个鉴别出来的特征[21]。对于一个完整的ABC转运蛋白的研究通常使用的方法为X-ray和透射电镜,基本结构域和原理机制如图四所示[22],本次研究中由于蛋白的结晶完整度不好,推荐进行蛋白质肽段的截短突变,由于底物结合蛋白位于周质空间,在合成的时候会有一段信号肽帮助其跨膜,因此将信号肽截掉可能有助于形成完整的晶体。可以将28位氨基酸前面的部分截短。将有助于结晶。
6 致谢
感谢导师何永兴对本课题提供的研究方案以及在具体的实施过程中给予的周密指导,以及实验室单位所有成员对本课题提供的支持与帮助。因为有了你们科研的路上充满欢乐。感谢国家自然科学基金对本课题的资金支持(基金号.30300616和81172437)以及中央高校对兰州大学的的基础研究基金(基金号.lzujbky-2014-85和lzujbky-2015-k18)
[1] Jones P M, George A M.The ABC transporter structure and mechanism: perspectives on recent research[J].Cellular and Molecular Life Sciences, 2004, 61 (6): 682-699.
[2] Ponte Sucre A.ABC Transporters in Microorganisms.[M] Caister Academic Pressed.2009.
[3] Goffeau A, de Hertogh B, Baret P V , et al.ABC Transporters.Encyclopedia of Biological Chemistry (Seconded.)[M].London: Academic Press, 2013.
[4] Davidson A L, Dassa E, Orelle C, et al.Structure, function, and evolution of bacterial ATP-binding cassette systems[J].Microbiology and Molecular Biology Reviews, 2008, 72 (2): 317-364.
[5] Wang B, Dukarevich M, Sun E I, et al.Membrane porters of ATP-binding cassette transport systems are polyphyletic[J].The Journal of Membrane Biology,2009, 231 (9): 1-10.
[6] Khwaja M, Ma Q, Saier M H , et al.Topological analysis of integral membrane constituents of prokaryotic ABC efflux systems[J].Research in Microbiology, 2005, 156 (2): 270-277.
[7] Ter B J, Guskov A, Slotboom D J, et al.Structural diversity of ABC transporters[J].The Journal of General Physiology, 2014, 143(4): 419-435.
[8] Choi CH.ABC transporters as multidrug resistance mechanisms and the development of chemosensitizers for their reversal[J].Cancer Cell International, 2005, 5(10): 30-40.
[9] Dean M, Hamon Y, Chimini G, et al.The human ATP-binding cassette (ABC) transporter superfamily[J].Journal of Lipid Research,2001,42 (7): 1007-1017.
[10] Scott M P, Lodish H F, Berk A, et al.Molecular Cell Biology[M].San Francisco: W.H.Freeman, 2012.
[11]Martínez A, Torello S, Kolter R, et al.Sliding motility in mycobacteria[J].Journal of Bacteriology, 1999, 181(23): 7331-7338.
[12]Sherris J C.Medical microbiology: an introduction to infectious diseases[M].Elsevier Biomedical Press:BV, 1984.
[13]Fu L M, Fu L C S, et al.Is Mycobacterium tuberculosis a closer relative to gram-positive or gram-negative bacterial pathogens?[J].Tuberculosis, 2002, 82(2): 85-90.
[14]Jones P M, George A M.The ABC transporter structure and mechanism: perspectives on recent research [J].Cellular and Molecular Life Sciences.Mar 2004 ,61 (6): 682-699.
[15] Ponte Sucre A.ABC Transporters in Microorganisms [M].Caister Academic Press, 2009.
[16] Davidson AL, Dassa E, Orelle C, et al.Structure, function, and evolution of bacterial ATP-binding cassette systems[J].Microbiology and Molecular Biology Reviews.Jun 2008, 72 (2): 317-364.
[17] Goffeau A, de Hertogh B, Baret P V, et al.ABC Transporters.Encyclopedia of Biological Chemistry (Seconded.) [M].London: Academic Press 2013.
[18] Wang B, Dukarevich M, Sun E I, et al.Membrane porters of ATP-binding cassette transport systems are polyphyletic[J] .The Journal of Membrane Biology.Sep 2009, 231 (1): 1-10.
[19] Choi C H.ABC transporters as multidrug resistance mechanisms and the development of chemosensitizers for their reversal [J].Cancer Cell International, Oct 2005, 5: 30-40.
[20] Dean M, Hamon Y, Chimini G, et al.The human ATP-binding cassette (ABC) transporter superfamily[J] .Journal of Lipid Research.2001 ,42 (7): 1007-1017.
[21] Scott M P, Lodish H F, Berk A, et al.Molecular Cell Biology[M].San Francisco: W.H.Freeman, 2012.
[22] Kaspar P.Structure and mechanism of ATP-binding cassette transporters[J].philosophical tranactions of the royal society B, 2009, 364: 239-245.
Crystallization for The Outer Membrane Subunit COG1732 of Mycobacterium Tuberculosis H37Rv
Chen Jianghuai, He Yongxing
(Lanzhou University, Lanzhou City, China 730000)
[Object] COG1732 protein is one of the ATP-binding cassette substrate binding proteins for Mycobacterium tuberculosis H37Rv.COG1732 protein three-dimension structure and function are not identify, bioinformation analysis have shown that COG1732 protein maybe participate in osmosis uptake into cell and identify substance.And change transmembrane structure domain.In this study, COG1732 protein was purified for crystal and analyze their structural features [method] For the ABC transporter substrate binding domain COG1732 of Mycobacterium tuberculosis H37Rv, use prokaryotic recombinant expression, the COG1732 gene was inserted into pet28b with T7 promoter, and the plasmid was transformed into E.coli BL21 (DE3) to overexpress.Target protein was purified by nickel affinity chromatography and ions exchange chromatography.Purified COG1731 protein concentrated to 70mg/ml, aliquot and stored at -80 freezer for crystal screen.[result] Get crystal of target protein COG1732 with haggle vapor diffusion mothed [conclusion] We have successfully constructed COG1732 protein prokaryotic expression vector, established a prefect purification protocol of recombinant protein , determined the crystal condition , and built the foundation to resolved its structure.
ABC transporter; multidrug resistance protein; protein crystal; Mycobacterium tuberculosis
Q518.3 [Document Code] A
10.11967/ 2017150206
Q518.3
A DOI:10.11967/2017150206
国家自然科学基金(基金号:30300616和81172437)以及中央高校对兰州大学的的基础研究基金(基金号:lzujbky-2014-85和lzujbky-2015-k18)
陈江淮,男,1991年生,在读硕士研究生,E-mail: chenjh14@lzu.edu.cn,主要研究领域为蛋白质晶体学。
何永兴,性别 男,1983年生,博士研究生,E-mail: heyx@lzu.edu.cn,职称 副教授,主要研究领域为蛋白质晶体学。

