目标导向液体治疗单肺通气肺癌根治术患者术中肺功能及中心静脉血炎症因子水平观察
许辉,疏树华,王迪,章敏,柴小青
(安徽医科大学附属省立临床学院,合肥230001)
目标导向液体治疗单肺通气肺癌根治术患者术中肺功能及中心静脉血炎症因子水平观察
许辉,疏树华,王迪,章敏,柴小青
(安徽医科大学附属省立临床学院,合肥230001)
目的 观察目标导向液体治疗(GDFT)单肺通气肺癌根治术患者术中的肺功能及中心静脉血炎症因子水平。方法 60例拟行肺癌根治术的患者,随机分为观察组和对照组各30例,观察组、对照组术中分别采用GDFT、传统液体疗法补液。分别于单肺通气前(T1)、单肺通气30 min(T2)、单肺通气1 h(T3)、恢复双肺通气10 min(T4)及术毕(T5)时抽取两组桡动脉血,测定两组氧分压(PaO2)及二氧化碳分压(PaCO2),计算并记录氧合指数(OI)及呼吸指数(RI)。分别于T1、T5及术后24 h(T6)时采集两组中心静脉血,采用ELISA法测定血清肿瘤坏死因子α(TNF-α)、白细胞介素6(IL-6)、IL-10。结果 观察组T1、T2、T3、T4及T5时OI分别为431±59、284±38、276±31、325±42、384±56,对照组分别为425±53、246±32、239±26、284±33、316±45;观察组T1、T2、T3、T4及T5时RI分别为0.38±0.16、2.28±0.52、2.46±0.45、1.72±0.43、1.35±0.48,对照组分别为0.36±0.15、1.82±0.46、1.88±0.42、1.14±0.38、0.84±0.35。与对照组比较,观察组T2~T5时OI升高,RI降低(P均<0.05)。观察组T1、T5、T6血清TNF-α分别为16.2±2.8、67.9±10.1、143.7±31.6,对照组分别为15.6±2.5、98.4±9.6、214.5±38.2;观察组T1、T5、T6血清IL-6分别为8.4±1.3、56.3±9.8、49.5±8.2,对照组分别为8.2±1.3、71.4±12.5、68.3±11.4;观察组T1、T5、T6血清IL-10分别为92.2±14.3、77.1±10.4、92.2±14.3,对照组18.4±4.6、69.5±11.7、42.8±8.3。与对照组比较,T5、T6时观察组血清TNF-α,IL-6水平降低(P均<0.05)。结论 GDFT可减轻肺癌根治术患者OLV后肺脏弥散及氧合功能的损害,减轻体内炎症反应的发生。
目标导向液体治疗;肺癌根治术;单肺通气;每搏量变异度
单肺通气(OLV)是胸外科手术常用的一种非生理性通气策略。OLV期间,通气侧肺受大潮气量和高气道压刺激可使肺泡过度萎陷、膨胀等,而非通气侧肺受到缺氧/再灌注损伤及手术牵拉、挤压等操作刺激,均可导致肺组织炎性反应,诱发急性肺损伤(ALI),严重影响患者预后[1]。限制性液体疗法补液是以往临床常用的OLV补液方法,但研究[2]发现限制性液体疗法OLV时ALI发生率普遍较高。目标导向液体治疗(GDFT)是根据动态血流动力学参数进行围术期液体治疗的新理念,可满足个体化容量管理需要。研究[3]表明,GDFT可改善微循环灌注及组织氧供,提高患者动脉氧合,减轻局部组织炎症反应。目前关于GDFT对肺癌根治术患者OLV后肺功能损伤的作用相关报道较少。我们观察了GDFT对肺癌根治术患者OLV时术中肺功能及中心静脉血炎症因子水平变化。现将结果报告如下。
1 资料与方法
1.1 临床资料 选择2016年2~11月间安徽医科大学附属省立临床学院胸外科行择期肺癌根治术的肺癌患者60例。纳入标准:年龄35~60岁,ASA分级Ⅰ~Ⅱ级,心功能Ⅰ~Ⅱ级,BMI 18.5~25.0 kg/m2。排除标准:OLV时间<45 min,一周内发生过肺部感染,存在阿片类药物过敏以及严重肝、肾、肺疾病病史。60例患者采用随机数字表法分为观察组和对照组各30例。观察组中男22例、女8例,年龄(51±6)岁,ASA分级为Ⅰ级4例、Ⅱ级26例,BMI(22.1±2.6) kg/m2,术前血红蛋白Hb(132±17)g/L。对照组中男21例、女9例,年龄(52±4)岁,ASA分级为Ⅰ级5例、Ⅱ级25例,BMI(21.7±2.4) kg/m2,术前血红蛋白Hb(125±14)g/L。两组性别比例、年龄、BMI、ASA分级、术前Hb水平等临床资料具有可比性。本研究已获得我院伦理委员会批准。所有患者或其委托人均知情同意并签署知情同意书。
1.2 麻醉方法 两组均行肺癌根治术。术前常规禁饮禁食,观察组连接Narcotrend麻醉/脑电意识监测系统(MT公司,德国),对照组桡动脉连接FloTrac/Vigileo监测系统(Edwards公司,美国)。麻醉诱导方法:静脉注射咪达唑仑0.02 mg/kg、依托咪酯0.6 mg/kg、舒芬太尼0.4 μg/kg、罗库溴铵0.8 mg/kg,纤维支气管镜引导下行双腔支气管插管,确认导管位置后连接呼吸机行正压机械通气,设定双肺通气时VT 8~10 mL/kg,呼吸频率(RR)10~12次/分,I∶E为1∶2,FiO2=100%,设定呼吸末正压PEEP为5 cm H20,单肺通气时调节VT 6~8 mL/kg,RR 10~16次/分。调节呼吸机参数维持PETCO2在30~40 mmHg,SpO2>90%。麻醉诱导完成后静脉泵注丙泊酚4~8 mg/(kg·h)、瑞芬太尼0.05~0.2 μg/(kg·h),吸入1%~2% 七氟醚维持NTI值37~46(常规麻醉状态),随后行颈内静脉穿刺置管,持续监测CVP。术中间断予以顺式阿曲库铵维持肌肉松弛度,维持患者鼻咽温>35.5 ℃。
1.3 GDFT治疗方法 观察组参照文献[4]根据每博量变异度(SVV)及CI进行指导补液:麻醉诱导前静脉输注6%羟乙基淀粉溶液(130/0.4)5~7 mL/kg补充代偿性血管扩张量,随后以8 mL/(kg·h)持续输注复方乳酸钠林格液,排除手术压迫心脏的影响后,若SVV<11%,CI>2.5 L/(min·m2),则继续按照原方案继续补液;若出现SVV>11%,则静脉输注6%羟乙基淀粉溶液(130/0.4)50 mL/min直至SVV<11%持续2 min以上,若SVV<9%,则暂缓补液,补液时注意维持CI>2.5 L/(min·m2);若5min后SVV仍>11%或者CI<2.5 L/(min·m2),则考虑静脉应用小剂量3~5 μg/(kg·h)多巴胺丁酚;对照组采用经典液体疗法进行容量管理,于麻醉诱导前静脉输注6%羟乙基淀粉溶液(130/0.4)5~7 mL/kg补充代偿性血管扩张量,在排除手术压迫心脏的影响后,调节补液量以维持MAP 65~110 mmHg,HR60~100 bpm,CVP 6~12 mmH2O,尿量>0.5mL/(kg·h)。若两组术中出现Hb<80 g/L,则输注红细胞悬液,维持Hb>80 g/L。若术中出现MAP<基础值20%,持续1 min以上,且调节补液量无效时,则考虑静脉给予去氧肾上腺素20~40 μg或麻黄碱6 mg。
1.4 观察指标及方法 分别于单肺通气前(T1)、单肺通气30 min(T2)、单肺通气1 h(T3)、恢复双肺通气10 min(T4)及术毕(T5)时抽取两组桡动脉血,测定两组氧分压(PaO2)及二氧化碳分压(PaCO2),计算并记录氧合指数(OI)及呼吸指数(RI)。OI=PaO2/FiO2;RI=P(A-a)DO2/PaO2;P(A-a)DO2=(PB-PH2O)×(FiO2-PaO2-PaCO2)/RQ(其中PB=760 mmHg;PH2O=47 mmHg;RQ=0.8)。分别于T1、T5及术后24 h(T6)时采集两组中心静脉血,采用ELISA法测定血清肿瘤坏死因子α(TNF-α)、白细胞介素6(IL-6)、IL-10。观察并记录两组术中OLV时间、术中晶体液和胶体液用量、总输液量、出血量、尿量以及血管活性药物使用情况。记录两组术后72 h内肺部并发症(包括急性肺损伤、肺部感染、肺水肿、肺不张等)发生情况。
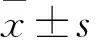
2 结果
不同时间点两组OI、RI比较见表1。
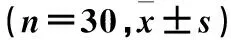
表1 不同时间点两组OI、RI比较
注:与本组T1时间点比较,aP<0.05;与对照组比较,bP<0.05。
不同时点两组血清TNF-α、IL-6及IL-10水平比较见表2。
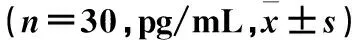
表2 不同时点两组血清TNF-α、IL-6及IL-10水平比较
注:与本组T1比较,aP<0.05;与对照组比较,bP<0.05。
观察组和对照组单肺通气时间分别为(109±22)、(113±18)min,二者比较,P>0.05。两组术中晶体液和胶体液用量、总输液量、出血量、尿量比较见表3。观察组、对照组血管活性药物使用率分别为10%、37%,二者比较,P>0.05。
观察组1例发生肺部感染,对照组3例发生急性肺损伤、4例肺部感染。观察组肺部并发症发生情况明显优于对照组,P<0.05。

表3 两组术中晶体液和胶体液用量、总输液量、出血量、尿量比较
注:与对照组比较,aP<0.05。
3 讨论
ALI是胸外科手术后常见的并发症,发生率2%~12%,OLV被认为是导致以及加重ALI的主要因素之一[5]。研究表明,OLV期间,过度容量负荷不仅会导致第三间隙液体储留,影响脏器功能恢复,增加术后肺水肿的发生率[6]。因此,传统的观点主张在肺部手术时通过限制性输液以避免肺水肿的发生,但常规的血流动力学参数存在静态性及滞后性,难以及时准确地估计患者的容量状态,容易导致组织灌注不足,影响组织愈合,增加术后肺部感染和肺不张等肺部并发症的发生率[7]。SVV是一种功能性血流动力学监测参数,Suehiro[8]研究证实通过FloTrac/Vigileo监测系统得到的SVV可准确反映单肺通气患者的容量状态。
OI常用于评价肺换气及氧合功能,正常值为400~500 mmHg,与患者肺损伤程度呈正相关,在肺功能障碍或通气/血流比值失调时明显下降[9]。RI是反映肺脏弥散功能的重要指标,与肺功能状态呈负相关,其水平越高表示患者肺损伤越严重[10]。本研究结果显示,与T1比较,观察组、对照组T2~T5时OI降低,RI升高。两组患者OLV后OI及RI降低,提示两组患者OLV后肺功能受到损伤。与对照组比较,观察组T2~T5时OI升高,RI降低,提示GDFT可减轻OLV后肺脏弥散及氧合功能的损害,但并不能完全避免肺组织的损伤。
TNF-α 和IL-6是炎症反应过程中的主要促炎因子,在OLV所致肺损伤中发挥着重要的作用[11]。而IL-10是由M2型巨噬细胞分泌的一种重要的抗炎细胞因子,可以抑制炎症反应的发生,其水平高低与机体炎症反应强度成反比[12]。本研究结果发现,与T1比较,T5、T6时观察组、对照组血清TNF-α、IL-6及IL-10水平升高,提示OLV所致的肺组织缺氧/再灌注损伤可同时激活患者体内促炎反应及抗炎反应,。与对照组比较,T5、T6时观察组血清TNF-α、IL-6水平降低,提示GDFT可有效抑制体内炎症反应的发生,从而在OLV时发挥肺保护效应。同时,观察组1例发生肺部感染,对照组3例发生急性肺损伤、4例肺部感染。观察组肺部并发症发生情况明显优于对照组,说明GDFT伴OLV患者术后肺功能的恢复更佳。但由于术后肺功能恢复的影响因素较多,本研究不能排除其余因素对结果的影响,因此本结果具有一定局限性,还需进一步扩大样本量、评估患者术后长期肺功能,来明确GDFT对肺癌根治术患者OLV后肺功能的影响。
综上所述,GDFT可减轻肺癌根治术患者OLV后肺脏弥散及氧合功能的损害,减轻体内炎症反应的发生。
[1] Dulu A, Pastores SM, Park B,et al. Prevalence and mortality of acute lung injury and ARDS after lung resection[J]. Chest, 2006,130(1):73-78.
[2] Cabrera-Benitez NE, Laffey JG, Parotto M,et al. Mechanical ventilation-associated lung fibrosis in acute respiratory distress syndrome: a significant contributor to poor outcome[J]. Anesthesiology, 2014,121(1):189-198.
[3] 吕雪彩,曹江北,潘伟,等.不同每搏量变异度指导下的目标导向液体治疗对老年患者术后认知功能的影响[J].临床麻醉学杂志,2016,32(7):629-632.
[4] Zhang J, Chen CQ, Lei XZ,et al. Goal-directed fluid optimization based on stroke volume variation and cardiac index during one-lung ventilation in patients undergoing thoracoscopy lobectomy operations: a pilot study[J]. Clinics, 2013,68(7):1065-1070.
[5] Licker M, Fauconnet P, Villiger Y. Acute lung injury and outcomes after thoracic surgery[J]. Curr Opin Anaesthesiol ,2009,22(1):61-67.
[6] Haas S, Kiefmann R, Eichhorn V,et al. Hemodynamic monitoring in one-lung ventilation[J]. Anaesthesist, 2009,58(11):1085-1096.
[7] Futier E, Constantin JM, Petit A,et al. Conservative vs restrictive individualized goal-directed fluid replacement strategy in major abdominal surgery: A prospective randomized trial[J]. Arch Surg, 2010,145(12):1193-1200.
[8] Suehiro K. Stroke volume variation as a predictor of fluid responsiveness in patients undergoing one-lung ventilation[J]. J Cardiothorac Vasc Anesth, 2010,24(5):772-775.
[9] 王东昕,阚红莉,于晓东,等.右美托咪定对肺癌根治术患者单肺通气时的肺保护作用[J].中华麻醉学杂志,2014,34(6):674-677.
[10] 游露,陈松,张红.缺血后处理对CPB犬肺缺血再灌注损伤时NF-κB及ICAM-1表达的影响[J].中华麻醉学杂志,2015,35(7):868-871.
[11] Schilling T, Kozian A, Senturk M,et al. Effects of volatile and intravenous anesthesia on the alveolar and systemic inflammatory response in thoracic surgical patients[J]. Anesthesiology, 2011,115(1):65-74.
[12] Gao W,Liu DD, Li D. Effect of Therapeutic Hypercapnia on Inflammatory Responses to One-lung Ventilation in Lobectomy Patients[J]. Anesthesiology, 2015,122(6):1235-1252.
安徽省自然科学基金资助项目(1608085QH210)。
10.3969/j.issn.1002-266X.2017.19.030
R782.5
B
1002-266X(2017)19-0094-03
2017-02-08)

