乳腺癌组织SATB2 蛋白表达变化及其意义
王岩,王培顺,李淑琴,王昭昕,周军,李淑琴
(1连云港市第一人民医院,江苏连云港 222002;2徐州医科大学)
乳腺癌组织SATB2 蛋白表达变化及其意义
王岩1,王培顺1,李淑琴1,王昭昕1,周军1,李淑琴2
(1连云港市第一人民医院,江苏连云港 222002;2徐州医科大学)
目的 观察乳腺癌组织中核基质结合蛋白质2(SATB2)表达变化,并探讨其临床意义。方法 选择282例乳腺癌患者,以其手术切除乳腺癌组织切片为观察组,以其中43例患者的癌旁组织切片为癌旁组,另取36例乳腺良性病变患者的病变组织切片为乳腺良性病变组。采用免疫组化SP法检测各组SATB2表达。分析乳腺癌组SATB2表达与与乳腺癌患者临床病理参数及生存期的关系。结果 乳腺癌组、癌旁组、乳腺良性病变组SATB2蛋白阳性表达率分别为74.39%(61/82)、41.86%(18/43)、36.11%(13/36)。乳腺癌组SATB2蛋白阳性表达率高于癌旁组和乳腺良性病变组(P均<0.05)。乳腺癌组织SATB2蛋白表达与肿瘤体积、腋窝淋巴结转移、远处转移、生存期有关(P均<0.05),与年龄、TNM分期、雌激素受体表达、孕激素受体表达、人表皮生长因子受体-2表达无关(P均>0.05)。结论 乳腺癌组织中SATB2表达上调。乳腺癌组织中SATB2阳性表达与乳腺癌组织肿瘤体积、腋窝淋巴结转移、远处转移、生存期有关。检测乳腺癌组织中SATB2表达有助于乳腺癌的诊断、病情判断及生存期评估。
乳腺癌;核基质结合蛋白质2;淋巴结转移;远处转移;生存期
乳腺癌的发生发展过程受到多种基因和蛋白的调控,明确其中那些与乳腺癌的临床病理参数有关有助于乳腺癌的诊断与治疗[3]。文献报道[4~6],核基质结合区结合蛋白2(SATB2)在正常细胞中几乎不表达,而高表达于结直肠癌、胃癌、卵巢癌等肿瘤组织中。SATB2和SATB2有高度同源性。SATB1在乳腺癌的发生发展过程中发挥重要作用。但关于乳腺癌组织中SATB2表达变化及其与乳腺癌临床病理参数和生存期的关系鲜见报道。本研究观察了乳腺癌组织中SATB2表达变化,并分析其与乳腺癌临床病理参数和生存期的关系,探讨其作为乳腺癌的诊断、治疗及生存期预估指标的可行性。现报告如下。
1 资料与方法
1.1 临床资料 选择2005年9月~2010年9月我院收治的82例乳腺癌患者的乳腺癌组织存档切片为乳腺癌组。82例乳腺癌患者全部为女性,年龄30~78(48.12±7.18)岁,其中<50岁42例,≥50岁40例。根据2003版WHO乳腺癌组织病理学分类标准[7]:乳腺浸润导管癌70例,其他组织学类型乳腺癌12例。根据2002年美国癌症联合会(AJCC)的TNM分期标准[8],Ⅰ~Ⅱ期38例(Ⅰ期20例,Ⅱ期18例),Ⅲ~Ⅳ期44例(Ⅲ期36例,Ⅳ期8例)。腋窝淋巴结转移57例,腋窝淋巴结无转移25例。有远处转移8例,无远处转移74例。所有病例均有完整的临床随访资料,随访截止时间为2015年9月,生存时间的计算为手术日期到随访截止日期,或因复发转移及其他原因死亡的日期。生存期<5年21例,生存期≥5年61例。同时取其中43例患者距离癌组织5 cm处无癌细胞浸润的癌旁组织切片作为癌旁组。取36例同期就诊的乳腺良性病变患者的病变组织切片作为乳腺良性病变组。36例乳腺良性病变病例全部为女性,年龄28~75(46.28±6.67)岁。乳腺增生28例,乳腺纤维瘤8例。乳腺癌患者和乳腺良性病变患者的性别年龄分布差异无统计学意义。本研究已通过医院伦理委员会批准,所有患者均签署知情同意书。
1.2 SATB2表达检测方法 采用免疫组化SP法。68 ℃烤片20 min。经常规二甲苯脱蜡和梯度酒精脱水后将切片完全浸泡于水中待用。在37℃下用3%H2O2孵育切片10 min,以抑制内源性过氧化酶活性。PBS冲洗3次,转移至0.01 mmol/L枸橼酸缓冲液(pH 6.0)中煮沸15~20 min,自然冷却20 min后,采用物理降温法加快冷却至室温,以修复抗原。PBS冲洗3次,37 ℃下用羊血清工作液封闭10 min,滴加一抗,4 ℃冰箱孵育过夜。PBS冲洗3次,滴加二抗,室温下孵育30 min。PBS冲洗3次,用新鲜配置的DAB溶液显色,用自来水冲洗,反蓝。用自来水冲洗后,用苏木素复染30 s,常规脱水、透明及干燥后封片。
以细胞质中出现明显的棕黄色或棕褐色颗粒定义为SATB2阳性细胞。每个组织切片先于100倍下随机选择5个SATB2阳性细胞最密区,后于400倍下随机计数每100个肿瘤细胞中的含有的阳性细胞数。颗粒为棕黄色且阳性细胞比≥50%,或颗粒为棕褐色且阳性细胞比≥25%为SATB2表达阳性,否则为SATB2表达阴性。
1.3 统计学方法 采用SPSS17.0统计软件。计数资料比较采用χ2检验和Fisher确切概率法。P<0.05为差异具有统计学意义。
2 结果
乳腺癌组、癌旁组、乳腺良性病变组SATB2蛋白阳性表达率分别为74.39%(61/82)、41.86%(18/43)、36.11%(13/36)。乳腺癌组SATB2蛋白阳性表达率高于癌旁组和乳腺良性病变组(P均<0.05);癌旁组和乳腺良性病变组SATB2蛋白阳性表达率相比,P>0.05。
乳腺癌组织SATB2蛋白表达与乳腺癌临床病理参数及生存期的关系见表1。由表1可见,乳腺癌组织SATB2蛋白表达与肿瘤体积、腋窝淋巴结转移、远处转移、生存期有关(P均<0.05),与年龄、TNM分期、雌激素受体(ER)表达、孕激素受体(PR)表达、人表皮生长因子受体-2(Her-2)表达无关(P均>0.05)。
3 讨论
肿瘤的发生、发展与转移是恶性肿瘤发展的基本途径,是一个肿瘤与宿主之间相互作用的多步骤过程,受到多种相关基因的调控。SATB2基因位于人类2号染色体2q33区,其编码的SATB2蛋白全长733个氨基酸,包含一个同源结构域(氨基酸序列614~677)、一个具有二聚体化功能的 Pfam-B_10016结构域(57~231)、两个CUT结构域(352~437和482~560)[9~12]。SATB2也是一种核基质结合区结合蛋白质,与SATB1具有高度同源性,通过对染色质高级结构的影响实现对目标基因表达的特异性调控,进一步调节细胞分化、凋亡、肿瘤生长与转移[13]。本研究结果显示乳腺癌组织中SATB2阳性表达率明显高于癌旁组织和乳腺良性肿瘤组织。提示SATB2与乳腺癌关系密切。进一步分析乳腺癌组织SATB2表达与肿瘤体积、腋窝淋巴结转移、远处转移、生存期有关。提示SATB2参与了乳腺癌发生、发展及转移的进程,SATB2表达阳性是乳腺癌的一个不良预后因素。检测乳腺组织SATB2表达有助于乳腺癌的诊断、病情判断及生存期预估。本研究结果显示,乳腺癌组织SATB2蛋白表达与乳腺癌患者年龄、TNM分期、ER表达、PR表达、Her-2表达无关,与文献[14]结果不同,原因可能与入组人群、样本量大小研究方案及结果判断标准不同有关。
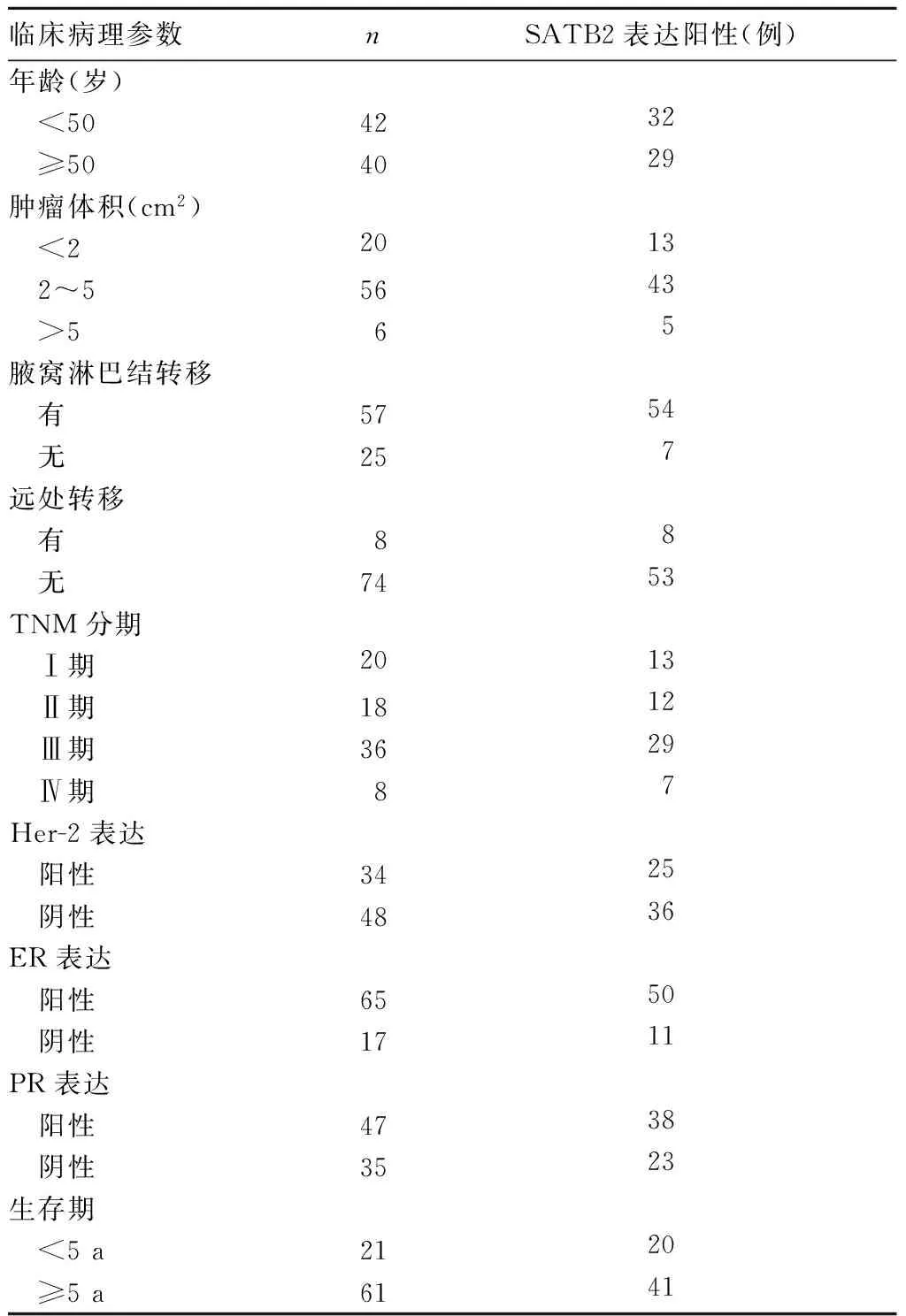
表1 乳腺癌组织SATB2表达与乳腺癌临床病理参数的关系
但是SATB2在乳腺癌发生发展中的分子机制还不明确,或与TNF-α、IL-4、IL-10等多种与肿瘤相关的细胞调控因子的表达有关,这还有待进一步研究证实。SATB1蛋白在乳腺癌中可能发挥基因组织者的作用,可以显著的改变乳腺细胞的基因表达谱,使其向乳腺癌细胞转变,并增加其侵袭能力。SATB2可能发挥类似作用。已有文献报道,SATB2和SATB1蛋白下调乳腺癌细胞IL-4、IL-13、MAF1基因及蛋白的表达。另外笔者推测,SATB2在乳腺癌发生发展过程中发挥的作用可能是一些信号传导通路,如Wnt通路、PI3K-Akt通路实现的。将来我们将进一步研究这些信号通路在其中发挥的具体作用。综上所述,乳腺癌组织中SATB2表达上调。乳腺癌组织中SATB2阳性表达与乳腺癌组织肿瘤体积、腋窝淋巴结转移、远处转移、生存期有关。检测乳腺癌组织中SATB2表达有助于乳腺癌的诊断、病情判断及生存期评估。
[1] 郑莹,吴春晓,张敏璐.乳腺癌在中国的流行状况和疾病特征[J].中国癌症杂志,2013,23(8):561-569.
[2] 徐雅莉,孙强,单广良,等.中国女性乳腺癌发病相关危险因素:病例对照研究[J].协和医学杂志,2011,2(1):7-14.
[3] Perez Montiel D, Arispe Angulo K, Cantú-de León D, et al. The value of SATB2 in the differential diagnosis of intestinal-type mucinous tumors of the ovary: primary vs metastatic[J]. An Diagn Pathol, 2015,19(4):249-252.
[4] Creytens D, Ferdinande L. SATB2 is a novel marker of osteoblastic differentiation in bone and soft tissue tumours: comment on Conner et al. (2013)[J]. Histopathology, 2015,67 (2 ):272-273.
[5] 吕京澴,王凤,樊峰,等.结直肠癌原发灶及淋巴结转移灶中SATB2表达及意义[J].临床与实验病理学杂志,2015,31(3):251-254.
[6] Stadler SC, Hacker U, Burkhardt R. Cholesterol metabolism and breast cancer[J]. Current Opinion Lip, 2016,27 (2 ):200-201.
[7] 中国乳腺癌内分泌治疗专家共识专家组.中国乳腺癌内分泌治疗专家共识(2015年版)[J].中国癌症杂志,2015,25(9):755-760.
[8] 中国抗癌协会乳腺癌诊治指南与规范(2015版)[J].中国癌症杂志,2015,25(9):692-754.
[9] 曹晓飞,刘庆宏.SATB1、SATB2与肿瘤的侵袭转移[J].实用医学杂志,2010,26(16):3052-3054.
[10] 程凯,吴楠,石群立.SATB2免疫组化染色在肿瘤病理诊断应用中的研究进展[J].诊断病理学杂志,2015,22(9):571-573.
[11] Zhao X,Qu Z,Tickner J,et al. The role of SATB2 in skeletogenesis and human disease[J]. Cytokine Growth Factor Rev, 2014,25(1):35-44.
[12] 陈虎,周培培,杨蓉,等.SATB2、NANOG和OCT4在口腔鳞癌中的表达及临床意义[J].口腔医学,2015,35(12):1016-1019.
[13] 王凤,陈世荣,樊峰,等.结直肠癌组织SATB2蛋白表达与上皮-间充质转化相关性研究[J].中华肿瘤防治杂志,2015,22(19):1540-1543.
[14] de Glas NA, Kiderlen M, Vandenbroucke JP, et al. Performing survival analyses in the presence of competing risks: a cinical example in older breast cancer patients[J]. Jour Nation Canc Institute, 2016,108(5):366.
[15]王婧男,郑燕,肖东杰,等.SATB1与HER2表达和乳腺癌分化程度的相关性[J].山东大学学报(医学版),2012,50(9):91-95.
国家自然科学基金资助项目(81602319)。
10.3969/j.issn.1002-266X.2017.19.027
R737.9
B
1002-266X(2017)19-0086-03
017-01-20)

