标准剂量泼尼松联合谷氨酰胺对131I治疗后Graves眼病的保护作用*
张 庆,邵 毅,关晏星,刘少正,陈庆杰,张 青△
(南昌大学第一附属医院:1.核医学科;2.眼科 330006)
论著·临床研究
标准剂量泼尼松联合谷氨酰胺对131I治疗后Graves眼病的保护作用*
张 庆1,邵 毅2,关晏星1,刘少正1,陈庆杰1,张 青1△
(南昌大学第一附属医院:1.核医学科;2.眼科 330006)
目的 探讨泼尼松联合谷氨酰胺(2 g/d)对131I治疗后Graves眼病(GO)的保护作用。方法 将行131I治疗伴轻-中度活动性或暂无活动性GO但有高危因素的Graves甲状腺功能亢进患者分为两组,试验组(n=59)治疗后2 d开始口服泼尼松(0.44±0.13)mg/kg同时补充谷氨酰胺,泼尼松每2周逐渐减量5 mg至2个月停药;对照组(n=57)泼尼松起始剂量为(0.43±0.14)mg/kg,不补充谷氨酰胺,其余同试验组。评估两组患者治疗后2、4、6个月时GO变化以及不良反应。结果 两组患者基线特征无明显差异,治疗后6个月试验组除突眼度外CAS评分(2.8±0.8vs.3.5±0.9)、眼球突出度[(19.6±8.1)mmvs.(21.7±3.0)mm]、睑裂宽度[(11.3±2.9)mmvs.(13.8±3.1)mm],改善程度均优于对照组(P<0.01)。两组均无GO新发或者恶化;两组疗效比较差异无统计学意义(P>0.05)。对照组比试验组不良反应更多(63.1%vs.30.5%,P<0.01),体质量增加更明显[(3.8±1.8) kgvs.(1.4±1.2)kg,P<0.01],两组患者收缩压和舒张压均轻度上升[(10±4)mm Hgvs.(9±5)mm Hg,P>0.05]。结论131I治疗后使用起始约0.4 mg/kg、2个月的泼尼松,同时口服补充谷氨酰胺(2 g/d)能有效改善轻-中度GO,并且有效降低不良反应。
Graves眼病;泼尼松;谷氨酰胺;碘放射性同位素
131I治疗Graves甲状腺功能亢进是非常有效的方法,但可能导致15%~20%的患者Graves眼病(Graves orbitopathy,GO)的新发或恶化[1-2]。尽管也有研究[3]认为甲状腺功能持续的异常(甲状腺功能亢进或者未及时纠正甲状腺功能减退)才是主要原因而与治疗方法无关,但多个指南或共识仍认为131I是GO进展的独立危险因素之一。基于糖皮质激素(glucocorticoid,GC)的免疫抑制作用常推荐口服泼尼松进行预防,但适用的人群、何时开始、最佳的剂量和疗程仍有争议,推荐的标准剂量GC(起始0.4~0.5 mg/kg,1个月后逐渐减量共维持3个月)的不良反应仍很常见,而且这种GC预防性治疗是否同样适合中国人群也不确定。近年研究发现,作为条件必需氨基酸的谷氨酰胺具有许多重要的生理功能和药理作用,GC的不良反应与机体的分解代谢增加、组织细胞谷氨酰胺耗竭密切相关[4-5]。因此笔者在131I治疗后使用标准剂量的泼尼松同时补充谷氨酰胺,观察能否改善GO的预后以及减少GC的不良反应。
1 资料与方法
1.1 一般资料 将2013年3月至2015年3月在本院进行131I治疗的116例患者,经眼科评估后按照制定的试验标准和随机数字表分别纳入试验组(131I+标准剂量泼尼松+谷氨酰胺)和对照组(131I+标准剂量泼尼松)。其中试验组59例,对照组57例,本研究经本院伦理委员会审核批准。
1.2 纳入及排除标准 纳入标准:(1)根据2007年《中国甲状腺疾病诊疗指南》确诊为Graves甲状腺功能亢进;(2)首次131I治疗;(3)根据1997年修订的GO临床活动性评分表(CAS)评定为活动性GO;(4)根据2008年欧洲GO协作组(EUGOGO)病情评估标准[6]评定为轻度或中度GO;(5)之前未曾针对GO进行治疗;(6)暂无活动性GO但有以下任一高危因素:吸烟;年龄大于或等于60岁的男性;T3≥5 nmol/L;促甲状腺激素受体抗体(TRAb)≥8.8 IU/L;(7)签署知情同意书。排除标准:(1)已进行过131I治疗;(2)妊娠及哺乳期妇女;(3)已进行了眼病治疗(包括眼部手术、球后放疗、GC等免疫抑制剂、云克注射等等);(4)合并糖尿病、胃溃疡、青光眼等GC使用禁忌证;(5)严重肝、肾功能不全;(6)重度活动性GO。
1.3 治疗方法
1.3.1131I治疗 两组患者均个体化计算131I剂量。根据甲状腺重量、质地、24 h摄碘率、病程等进行临床评分[7]。
1.3.2 泼尼松与谷氨酰胺治疗 两组均在131I 治疗后2 d开始口服泼尼松(每片5 mg),设定起始剂量0.4 mg·kg-1·d-1,计算出的剂量往上加到5的倍数,每日早饭后顿服,每14天减量5 mg,总共维持2个月,同时口服钙尔奇D每日600 mg。试验组同时口服麦滋林颗粒,该药为临床常用的L-谷氨酰胺口服制剂,每次1袋(0.67 g),每天3次合计2 g,共服用2个月。
1.4 随访及疗效评价 每2个月复查两组患者的临床表现、甲状腺功能、血糖、血电解质、体格检查(包括体质量、血压、眼部检查等),记录不良反应,随访至少6个月。6个月时的GO改变是本研究的主要观察结果。眼部检查尽量固定由2位有经验的眼科医师完成,研究期间并不知道患者的分组,包括严重性评估:(1)测量眼睑挛缩;(2)参照www.eugogo.eu的彩色相片评估软组织受累程度;(3)用Hertel突出计测量眼球突出度;(4)眼外肌的功能和复视;(5)评估角膜受累程度;(6)评估视神经受累程度。活动性评估用CAS评分,以下为随访时候增加:3个月内(1)突眼度增加2 mm以上;(2)眼球在任一方向内运动幅度下降5°;(3)视力表敏感度下降1行,复查随访时≥4/10分为活动性GO。注意进行GO的鉴别诊断以排除其他眼病造成的上述表现,选程度更重的那一侧眼部作为评估对象。甲状腺功能亢进评价:随访6个月,患者甲状腺功能正常或甲状腺功能减退视为治愈,症状改善及甲状腺激素水平下降视为好转,症状加重及激素上升视为无效。GO评估:改善、恶化的标准为在一侧眼部发生以下至少2条改变:(1)突眼度或者眼睑裂变化2 mm以上;(2)CAS改变2分以上;(3)复视评分改变1级以上;(4)视力表敏感度改变2行以上。少于以上指标变化者为GO稳定。不良反应:观察患者的体质量变化;收缩压或者舒张压改变;症状如失眠、神经兴奋、抑郁、胃肠道反应、心悸、疲乏、痤疮;血糖、电解质等变化。

2 结 果
2.1 一般结果 两组患者性别、年龄、体质量、血压等一般资料,差异无统计学意义(P>0.05),见表1。
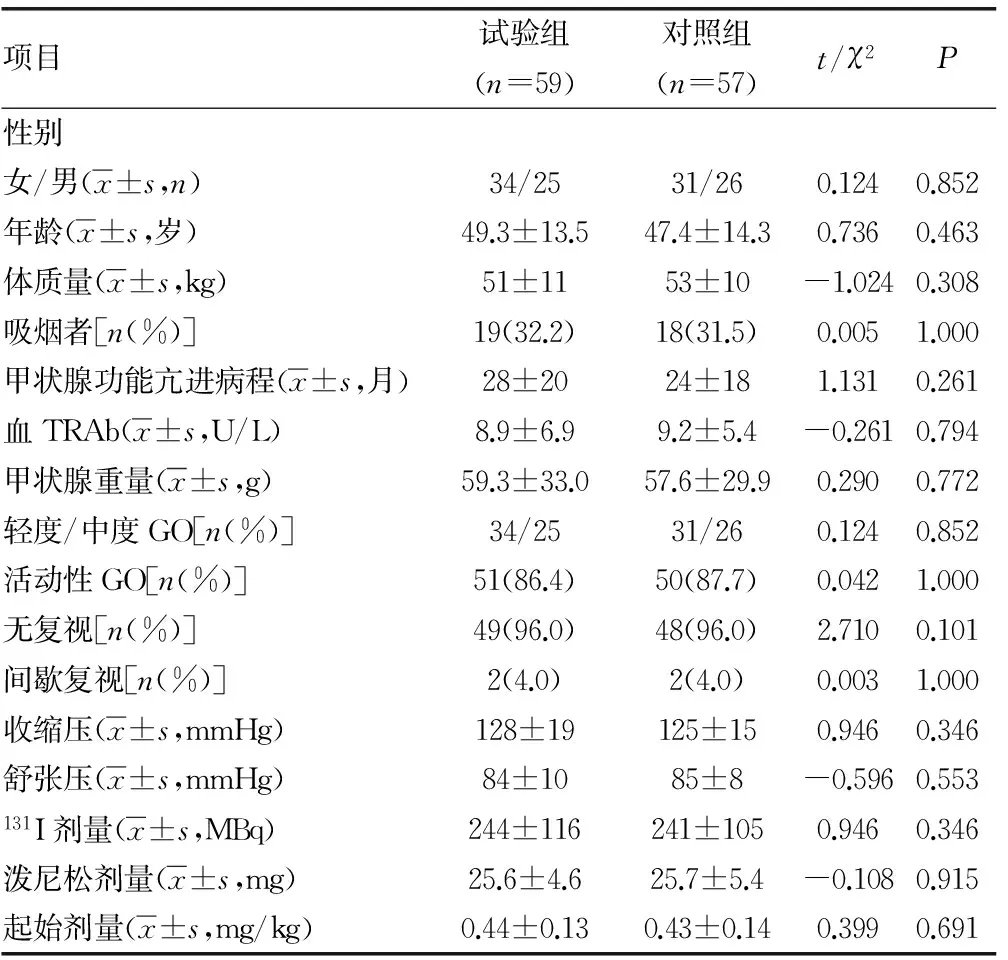
表1 两组患者的基线临床特征
2.2 两组患者GO指标治疗前后对比 两组患者治疗前基线时眼球突出度、眼睑挛缩、CAS评分比较差异无统计学意义(P>0.05),经过治疗后试验组除突眼度变化不明显外,CAS和眼睑挛缩指标均有好转,差异有统计学意义(P<0.01),对照组患者CAS评分有所下降(P<0.01),突眼度和眼睑挛缩无明显变化(P>0.05)。6个月时两组间除突眼度以外其余两项指标差异有统计学意义(P<0.05),见表2。
2.3 两组患者的GO预后对比 在2个月时,即GC治疗结束时,两组分别有36例(61%)、34例(59.6%)的患者GO得到改善,余下处于稳定状态。在随后的随访(4个月和6个月),试验组分别新增3例患者改善,对照组分别有3例和2例患者得到改善,无任何新发GO或GO恶化。最终,试验组GO改善人数为42例(71.2%),稳定17例(28.8%),对照组改善39例(68.4%)、稳定18例(31.6%)。两组比较差异无统计学意义(P>0.05),见表3。
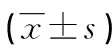
表2 两组患者治疗前后GO改变对比
Pa、 Pb分别表示两组内治疗前后的比较,Pc为治疗后两组间比较。
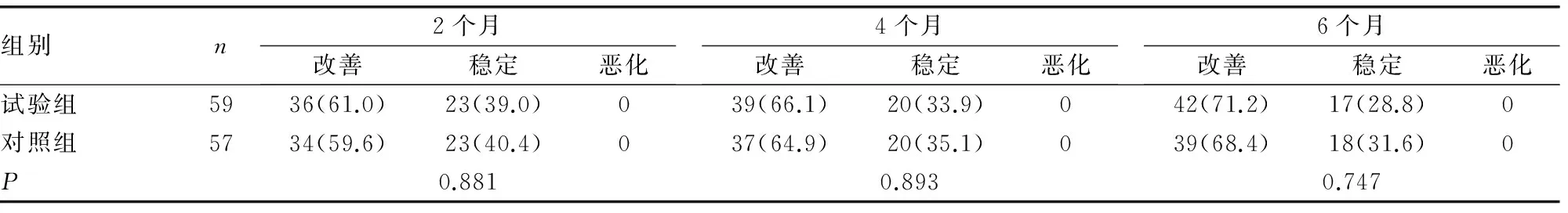
表3 两组患者的GO预后对比[n(%)]
2.4 不良反应分析 2个月GC治疗结束随访时,对照组患者体质量平均增加(3.8±1.8)kg,其中14例患者出现轻度满月脸面容和体态;试验组患者体质量平均增加(1.4±1.2)kg(3.8±1.8vs.1.4±1.2;P=0.001)。两组患者收缩压和舒张压均轻度上升,平均上升(10±4)mm Hg和(9±5)mm Hg。出现以下至少1项(水肿、兴奋、失眠、抑郁、胃不适、血糖升高、低血钾、痤疮)与GC有关的不良反应,对照组有36例(63.1%);试验组有18例(30.5%),均为轻度水肿或者低血钾;差异有统计学意义(P=0.001)。对照组8例(14.0%)出现胃部不适需配合制酸药治疗,其余不良反应均无需特别处理,停药后逐渐消失。
3 讨 论
普遍认为对于已经有GO或有发展为眼病风险的患者须尽快治愈甲状腺功能亢进,并将甲状腺功能维持在正常水平。GO恶化可能与甲状腺破坏后,共同抗原TSH受体释放激发自身免疫(本研究也发现治疗后TRAb水平明显升高)以及治疗后出现甲状腺功能减退而未及时纠正有关,尤其有高危因素者[8]。尽管131I 治疗后TRAb水平升高可能维持几年,但131I治疗后相对短时间(约3个月)的口服中等剂量的GC(起始30~40 mg)足够消除这种危险因素,而且并不影响131I的疗效[6]。 4个随机对照试验[8]合计378例治疗前无或者仅有轻度GO的患者131I治疗后未给予GC预防治疗,GO进展的有108例,171例给予了GC预防的患者无1例出现GO进展。国内李素平等[9]的系统评价也表明131I联合泼尼松改善GO、防止诱发和加重明显优于单用131I。EUGOGO共识和美国甲状腺协会联合临床内分泌医师协会指南均推荐如对活动期GO进行131I治疗时,应当预防性应用GC(131I治疗后1~3 d开始口服泼尼松0.4~0.5 mg·kg-1·d-1,逐渐减量,3个月后停药),对非活动期GO但伴有高危因素者是否使用GC则存在分歧[6]。中国指南[10]也推荐轻度活动性 GO(尤其是吸烟患者)选择131I 治疗时应同时使用GC,但没有提及具体的剂量、疗程等。欧洲甲状腺协会的问卷调查[11]显示欧洲国家GC起始平均剂量37.6 mg(15~80 mg),平均16 d(2~60 d)后开始减量,中位疗程为90 d(20~120 d),中位累积剂量为1 000 mg。段炼等[12]报道的方法为60~100 mg/d起效后逐渐减量维持3~6个月。林枫等[13]报道131I治疗后给予泼尼松20 mg/d 或者30 mg/d,连续1个月,随访半年GO恶化率仅为0.35%(1/289)和0.36%(1/276)。EUGOGO也提及1~2个月的GC治疗可能同样有效。这表明在当前有限的循证医学证据下,GC预防疗法仍存在很多不一致。
最近,有2个回顾性的研究报道了131I治疗GD伴轻度或中度GO时使用更小剂量的泼尼松(0.2~0.3 mg/kg)和更短疗程(4~6周),通过Meta分析[2]与不加干预或安慰剂组进行间接对比,小剂量泼尼松有效地防止了GO的进展,并与标准剂量组(0.4~0.5 mg/kg)相比差异无统计学意义(OR=1.7,P=0.47)。但最近针对日本人群的一项较大样本随机对照研究[14]表明起始15 mg、疗程6周的泼尼松预防性使用,131I治疗后12.1%(18/148)出现GO恶化,小剂量短疗程GC的作用还需进一步验证。因此本研究仍然采用起始剂量0.4 mg/kg,兼顾对GO的治疗作用,结果显示两组均无GO新发和恶化,得到改善的比例分别为71.2%和68.4%,但尚不能得出优于3个月疗程的结论。本研究无GO恶化的原因首先在于采用个体化计算131I剂量,而非像欧美国家常用固定较大剂量治疗,而且治疗后及时纠正甲状腺功能减退,对于仍然甲状腺功能亢进的使用抗甲状腺药物维持甲状腺功能保持正常,尽量减少了GO恶化的危险因素。其次,本研究判断GO恶化的标准较为严格,加之节约医疗费用以临床评估为主没有结合影像(如MRI)评估,也可能低估了GO的恶化率。另外,随访终点笔者定为6个月,是研究[1]报道131I治疗后GO恶化的高峰时间,但实际可发生在2年内任何时间点,因此本研究可能低估了恶化的发生率。
标准剂量GC持续3个月对GO的保护疗效确切,但所致不良反应亦很常见,因此减少GC治疗相关的不良反应具有明显的现实意义。近年来谷氨酰胺因其独特的生理功能逐渐成为多学科领域的研究热点。谷氨酰胺是体内含量最多的游离氨基酸,主要在肌肉合成、储存。为快速增殖分化的细胞如巨噬细胞、淋巴细胞、肠黏膜上皮细胞、肿瘤细胞供能,是依赖葡萄糖合成ATP途径受损后的最重要的替代途径;是生糖氨基酸,肝糖原异生的重要底物;也是嘧啶、嘌呤核苷酸、氨基酸生物合成的必需原料之一;是蛋白质代谢的重要调节因子,能促进蛋白质合成;还有调节免疫、抗氧自由基等功能[15-16]。临床上在刚使用GC的时候往往表现出良好的治疗效果,推测与此时机体中有足量的谷氨酰胺可供使用有关。但是,中等剂量泼尼松处理时健康人储存的谷氨酰胺也只有6 d左右即被耗尽[17],若没有及时补充谷氨酰胺,那么不良反应就可能开始出现。肌肉组织是谷氨酰胺的仓库,肌肉中谷氨酰胺水平为血液循环中的30倍。创伤、感染或GC处理等应激可引起炎性细胞释放大量炎性介质,导致肌肉蛋白质降解作用增强,谷氨酰胺合成酶活性增高,使其合成代偿性增加及原储备在肌肉细胞中游离谷氨酰胺大量释放入血,以满足其他组织细胞对其摄取和利用的需要。肌肉细胞谷氨酰胺水平迅速下降,肌肉蛋白质合成速率降低,即GC的“负氮平衡”,肌肉萎缩,伤口不能愈合等均与此相关[4-5],而谷氨酰胺补充可防止肌肉萎缩,还可能与抑制肌肉生长抑素表达有关[4]。对于胃肠上皮细胞而言,谷氨酰胺作为能源比葡萄糖更为重要,补充谷氨酰胺可显著降低胃肠道黏膜的通透性、 维持肠胃道黏膜结构,增强肠道免疫功能,减少细菌易位,避免肠源性败血症以及消化性溃疡的发生,因此也是目前谷氨酰胺颗粒的主要临床适应证之一。有研究[18]认为GD患者脑组织谷氨酰胺水平降低,与情感认知症状有关;GC治疗早期,肌肉合成释放谷氨酰胺增加,在谷氨酰胺水解酶作用下L-谷氨酰胺能生成兴奋性神经递质谷氨酸,可能出现神经兴奋等;反之谷氨酰胺下降后脑组织谷氨酸减少以及GC受体下调[19],抑制性神经递质如多巴胺等增多,患者又可能出现抑郁等障碍。
本研究中,补充谷氨酰胺的试验组胃肠道反应、负氮平衡、类Cushing综合征、精神症状等不良反应均未发现,推测与上述机制有关。谷氨酰胺无水盐代谢调节作用,因此两组血压均有所升高。另外,研究[19-20]报道,谷氨酰胺可以诱导感染性休克或严重创伤动物模型的多种细胞大量表达热休克蛋白并上调GC受体;谷氨酰胺可以降低氧自由基,增加线粒体内的还原型谷胱甘肽;这可能与GC产生抗炎反应的协同作用,缓解GO的炎性反应有关。上述机制可能解释本研究联合治疗后试验组CAS、眼睑挛缩的改善优于对照组的原因。
本研究初步表明131I治疗后使用起始约0.4 mg/kg、2个月的泼尼松,同时口服补充谷氨酰胺(2 g/d)能有效改善轻-中度GO,并且有效降低了GC的不良反应;但还需要延长随访时间评估是否能真正防止GO的恶化,并对中等以上剂量GC时谷氨酰胺的作用进一步研究。
[1]Stein JD,Childers D,Gupta S,et al.Risk factors for developing Thyroid-Associated ophthalmopathy among individuals with graves disease[J].JAMA Ophthalmol,2015,133(3):290-296.
[2]Shiber S,Stiebel-Kalish H,Shimon I,et al.Glucocorticoid regimens for prevention of Graves′ ophthalmopathy progression following radioiodine treatment:systematic review and Meta-Analysis[J].Thyroid,2014,24(10):1515-1523.
[3]Chen DY,Schneider PF,Zhang XS,et al.Changes in graves′ophthalmopathy after radioiodine and anti-thyroid drug treatment of Graves′disease from 2 prospective,randomized,open-label,blinded end point studies[J].Exp Clin Endocrinol Diabetes,2014,122(1):1-6.
[4]Salehian B,Mahabadi V,Bilas J,et al.The effect of glutamine on prevention of glucocorticoid-induced skeletal muscle atrophy is associated with myostatin suppression[J].Metabolism,2006,55(9):1239-1247.
[5]Boza JJ,Turini M,Moёnnoz D,et al.Effect of glutamine supplementation of the diet on tissue protein synthesis rate of glucocorticoid-treated rats[J].Nutrition,2001,17(1):35-40.
[6]Bartalena L,Baldeschi L,Dickinson A,et al.Consensus statement of the European Group on Graves′ or bitopathy(EUGOGO) on management of GO[J].Eur J Endocrinol,2008(158):273-285.
[7]张庆,张青,刘寄尘,等.131I联合分子吸附再循环系统治疗甲状腺功能亢进症合并重症肝损害[J].中华核医学与分子影像杂志,2012,32(4):298-299.
[8]Bartalena L.The dilemma of how to manage Graves′hyperthyroidism in patients with associated orbitopathy[J].J Clin Endocrinol Metab,2011,96(3):592-599.
[9]李素平,匡安仁.Graves甲亢多种治疗方法对Graves眼病影响的系统评价[J].中华核医学杂志,2008,28(4):83-94.
[10]中华医学会核医学分.131I治疗格雷夫斯甲亢指南(2013版)[J].中华核医学与分子影像杂志,2013,33(2):83-94.
[11]Lazarus JH,Bartalena L,Marcocci C,et al.Glucocorticoid administration for Graves′hyperthyroidism treated by radioiodine[J].J Endocrinol Invest,2010,33(6):409-413.
[12]段炼,陆克义,陈霞,等.131I治疗Graves病对甲状腺相关眼病转归的相关因素分析[J].国际放射医学核医学杂志,2011,35(4):230-234.
[13]林枫,史育红,董延武.预防性服用泼尼松对131I治疗后 Graves突眼预后及早发甲减的影响[J].中国现代医学杂志,2014,24(4):76-79.
[14]Watanabe N,Noh JY,Kozaki A,et al.Radioiodine-Associated exacerbation of Graves′ orbitopathy in the Japanese population:randomized prospective study[J].J Clin Endocrinol Metab,2015,100(7):2700-2708.
[15]李宁,赖万强.谷氨酰胺对免疫功能的影响[J].医学综述,2010,16(6):1006-2084.
[16]彭曦,尤忠义,黄显凯,等.谷氨酰胺颗粒对创伤患者免疫功能影响的多中心,随机,双盲对照研究[J].中华外科杂志,2005,43(17):1123-1126.
[17]Le BO,Mauras N,Welch S,et al.Acute depletion of plasma glutamine increases leucine oxidation in prednisone-treated humans[J].Clin Nutr,2007,26(2):231-238.
[18]Danielsen ER,Elberling TV,Rasmussen AK,et al.Reduced parietooccipital white matter glutamine measured by proton magnetic resonance Spectroscopy in treated Graves′ disease patients[J].J Clin Endocrinol Metab,2008,93(8):3192-3198.
[19]宋芬,景亮.谷氨酰胺对内毒素性休克大鼠糖皮质激素受体的保护作用[J].临床麻醉学杂志,2006,22(8):623-625.
[20]Oronsky BT,Oronsky N,Fanger GR,et al.Follow the ATP:tumor energy production:a perspective[J].Anticancer Agents Med Chem,2014,14(9):1187-1198.
Protective effects of standard dose prednisone combined with glutamine on Graves ophthalmopathy after131I treatment*
Zhang Qing1,Shao Yi2,Guan Yanxing1,Liu Shaozheng1,Chen Qingjie1,Zhang Qing1△
(1.Department of Nuclear Medicine;2.Department of Ophthalmology,First Affiliated Hospital of Nanchang University,Nanchang,Jiangxi 330006,China)
[Abstract] Objective To investigate the protective effect of standard dose prednisone(starting dose about 0.4 mg/kg bw) combined with glutamine(2 g/d) for Graves′ ophthalmopathy(GO) after131I treatment.Methods The prospective randomized controlled trial was performed and included 116 consecutive patients with mild-to-moderate GO or no active GO after131I treatment,but with high risk factors.The experimental group(59 cases) started to take oral prednisone(0.44±0.13)mg/kg at 2 d atter theatment,meanwhile replenishing glutamine,and prednisone was gradually decreased by 5mg per 2 weeks and stopped until 2 months;the control group(57 cases) received the initial dose prednisone(0.43±0.14)mg/kg without replenishing glutamine,and the rest was same as the experimental group.The GO change and prednisone adverse reactions in 2,4,6 months after treatment were evaluated in the two groups.Results The baseline characteristics had no significant difference between the two groups.In comparison of the experimental group and control group after 6-month treatment,the CAS score was (2.8±0.8vs. 3.5±0.9),exophthalmos degree was (19.6±8.1)mmvs.(21.7±3.0)mm,eyelid width was (11.3±2.9)mmvs.(13.8±3.1)mm,the improvement degree in the experimental group except for degree was superior to the control group (P<0.01).No new onset GO or deterioation occurred in the two groups;the experimental group had 42 cases(71.2%) of GO improvement and 17 cases(28.8%) of stability,while the control group had 39 cases(68.4%) of GO improvement and 18 cases(31.6%) of stability,and the curative effects had no sttistical difference between the two groups(P>0.05).The side effects in the control group were more than those in the experimental group(63.1%vs. 30.5%,P<0.05).the body mass increase was more obvious [(3.8±1.8) kgvs. (1.4±1.2)kg,P<0.01],and SBP and DBP in the two groups were slightly increased[ (10±4)mm Hgvs.(9±5)mm HgP>0.05].Conclusion Using the initial dose of oral prednisone(about 0.4 mg/kg) for 2 months and simultaneously replenishing glutamine (2 g/d)can effectively improve mild-moderate GO,and effectively reduce the adverse reactions of GC.However it is needed to extend the follow-up time to assess whether it can truly prevent the deterioration of GO,and to conduct a further study for the role of glutamine.
graves ophthalmopathy;prednisone;glutamine;iodine radioisotopes
10.3969/j.issn.1671-8348.2017.13.016
江西省卫生和计划生育委员会基金(20141023)。 作者简介:张庆(1979-),硕士,副主任医师,主要从事核素内照射治疗及靶向分子影像方面的研究。△
,E-mail:simonchin1@gmail.com。
R77
A
1671-8348(2017)13-1775-04
2016-12-06
2017-01-24)

